Method Article
Beurteilung der Eisenablagerung im Gehirn von 5xFAD-Mäusen durch Perls'/DAB-Färbung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt Methoden zur Beurteilung der Verteilung und Menge der Eisenablagerung in Geweben, insbesondere im Gehirn, vor. Das Protokoll beschreibt die Verfahren für die Probenvorbereitung, die Perls/DAB-Färbung, die Bildaufnahme und die Datenanalyse.
Zusammenfassung
Die Alzheimer-Krankheit (AD), eine häufige neurodegenerative Erkrankung, ist die Hauptursache für Demenz bei älteren Menschen. Die Eisenablagerung ist eng mit der Pathogenese der Alzheimer-Krankheit verbunden. Im AD-Gehirn korrelieren erhöhte Eisenspiegel stark mit charakteristischen AD-Pathologien, einschließlich β-Amyloid-Plaques, Tau-Neurofibrillentangles und Apoptose. Es gibt immer mehr Hinweise darauf, dass oxidativer Stress aufgrund eines fehlregulierten Eisenstoffwechsels eine wichtige Rolle in der Pathophysiologie der Alzheimer-Krankheit spielt. Das Verständnis der Rolle der Eisenakkumulation in der Pathologie der AD ist daher entscheidend für die Behandlung von AD. Ein umfassendes Eisenfärbeprotokoll ist unerlässlich, um die Eisenexpression und -verteilung im Gehirn zu erkennen. Ziel dieses Protokolls ist es, eine Methode zur Beurteilung der Menge und Verteilung der Eisenablagerung im Gehirn zu beschreiben. Wir beschreiben die Prozesse bei der Reagenzienvorbereitung, der Mausbehandlung und der Vorbereitung von Hirnschnitten. Darüber hinaus präsentieren wir ein detailliertes Schritt-für-Schritt-Protokoll für den histochemischen Eisennachweis in zerebralen Gewebeschnitten, begleitet von einem systematischen analytischen Rahmen, der sowohl die quantitative als auch die morphologische Bewertung integriert, um eine umfassende Interpretation der Färbeergebnisse zu gewährleisten. Dieses experimentelle Protokoll wird den Forschern helfen, Eisenablagerungen im Gehirn zu verstehen und die Alzheimer-Forschung zu unterstützen.
Einleitung
Die Alzheimer-Krankheit (AD) ist die häufigste neurodegenerative Erkrankung und hat sich zu einem ernsthaften Problem für die Gesellschaft entwickelt. Die Prävalenz von AD nimmt mit dem Altervon 1,2,3,4 Jahren dramatisch zu. Zu den primären pathologischen Kennzeichen der Alzheimer-Krankheit (AD) gehören die Ablagerung von β-Amyloid (Aβ)-Plaques und neurofibrillären Tangles (NFTs) aufgrund einer aberranten Phosphorylierung von Tau-Proteinen. Aβ wird durch die sequentielle Spaltung des Amyloid-Vorläuferproteins (APP) durch β-Sekretase und γ-Sekretase-Enzyme erzeugt. Eine Dysregulation der Aβ-Produktion oder -Clearance führt zu einer Akkumulation im Gehirn und zur Bildung von Amyloid-Plaques, die als einer der frühesten pathologischen Marker der Alzheimer-Krankheit gelten. Diese Plaques verursachen nicht nur direkte neuronale Schäden, sondern lösen auch eine Kaskade schädlicher Effekte aus, darunter Neuroinflammation, oxidativer Stress und synaptische Dysfunktion. Zusammengenommen tragen diese Prozesse zum neuronalen Tod und dem fortschreitenden kognitiven Verfall bei, der in5 n. Chr. beobachtet wurde. Trotz jahrzehntelanger Forschung, die sich hauptsächlich auf die pathologischen Kennzeichen der Alzheimer-Krankheit (AD) konzentriert, einschließlich der Ablagerung von Amyloid-β-Plaques und der hyperphosphorylierten Tau-Proteinaggregation, sind klinisch bedeutsame therapeutische Durchbrüche nach wie vor schwer fassbar, da bestehende Interventionen eine begrenzte Wirksamkeit bei der Modifizierung des Krankheitsverlaufs zeigen6.
Eisen ist ein wichtiges Metall für die Aufrechterhaltung der Gehirnfunktion und ist am Sauerstofftransport, der DNA-Synthese, der mitochondrialen Atmung, der Myelinsynthese, der Neurotransmittersynthese und dem Stoffwechsel beteiligt. Eisen wird jedoch schädlich, wenn die Konzentrationen die Kapazität der zellulären Sequestrierung überschreiten 6,7,8. Eine erhöhte Eisenablagerung, die in der Regel mit Aβ-Plaques kolokalisiert ist, wurde sowohl in kortikalen als auch in hippokampalen Regionen des Gehirns bei Patienten mitAD 9,10 beobachtet. Durch die Fenton-Reaktion11 kann intrazelluläres freies Eisen sowohl Hydroxylradikale (•OH) als auch reaktive Sauerstoffspezies erzeugen. Diese Schadstoffe induzieren nicht nur Neuroinflammation, indem sie Gliazellen aktivieren, sondern greifen auch die Biomoleküle der Zelle durch oxidativen Stress an, stören die normale Zellfunktion und führen zu synaptischer Dysfunktion 8,12. Darüber hinaus ist ein erhöhter Eisenspiegel direkt an der Entwicklung pathologischer Symptome der Alzheimer-Krankheit beteiligt: Eisen trägt zur Aβ-Produktion bei12 und erhöht auch die Dysfunktion des Tau-Proteins, was zu neurofibrillären Verwicklungen führt13.
Um den Eisengehalt im Gehirn zu bestimmen, wurden verschiedene Techniken entwickelt, darunter die Magnetresonanztomographie (MRT) sowie chemische und histochemische Methoden14. Die In-vivo-Quantifizierung des intrazerebralen Eisenspiegels mittels MRT ist klinisch wichtig für Patienten mit Alterung und Neurodegeneration15. Die MRT hat den Vorteil, dass sie nicht-invasiv und hochempfindlich ist: Sie kann Eisenablagerungen in den frühen Stadien der Erkrankung nachweisen. Insbesondere kann mit der feldabhängigen R2-Erhöhungstechnik (FDRI) zwischen verschiedenen Formen von Eisen unterschieden werden, wie z. B. Ferritineisen und Häm-Eisen16. Die MRT kann jedoch keine Eisenakkumulation auf zellulärer Ebene nachweisen und ist teuer, weshalb sie hauptsächlich in klinischen Untersuchungen eingesetzt wird17.
Die kolorimetrische Messung ist ein chemisches Verfahren, das die Konzentration einer Substanz (z. B. Eisen) bestimmt, indem die Intensität der Farbe gemessen wird, die durch die Reaktion der Substanz in Lösung mit einem chromogenen Mittel18 erzeugt wird. Diese Methode ist einfach durchzuführen und verwendet kostengünstige Reagenzien und Instrumente, wodurch sie für Labore mit begrenztem Budget geeignet ist18. Die Genauigkeit und Empfindlichkeit dieser Methode sind jedoch sehr begrenzt, da die Ergebnisse von Umweltfaktoren, der Farbentwicklungszeit und dem subjektiven Urteil des Bedieners beeinflusst werden. Die Flammenatomabsorptionsspektrometrie (FAAS) ist eine weitere Methode, mit der der Eisengehalt19 bestimmt werden kann. Bei diesem Verfahren wird eine geklärte Probenlösung erhalten, indem das interessierende Gewebe in einem Hochtemperaturofen verbrannt wird. Die Probe wird dann mit Salzsäure aufgelöst und die Eisenkonzentration in der Lösung mittels Atomabsorptionsspektrometrie bestimmt. Diese Methode ist hochempfindlich und für alle Arten von biologischen Proben geeignet19. Das Verfahren ist jedoch zeitaufwändig und erfordert teure Geräte, so dass seine Verwendung begrenzt ist.
Die Perls'/DAB-Färbung zum Nachweis von Nicht-Häm-Eisen ist aufgrund ihrer hohen Spezifität und einfachen Implementierung im Vergleich zu anderen histochemischen Methoden die am häufigsten verwendete Eisennachweismethode14. Im Gegensatz zur kolorimetrischen Analyse handelt es sich bei der Perls-Färbung um eine qualitative histochemische Färbemethode, die auf der Reaktion zwischen Eisenionen und Kaliumferrocyanid beruht, um einen blauen Niederschlag zu erzeugen. Es wird verwendet, um das Vorhandensein und die Verteilung von Eisen im Gewebe mikroskopisch sichtbar zu machen. Darüber hinaus ermöglicht uns diese Methode, die Eisenablagerung in verschiedenen Zelltypen zu unterscheiden und die subzelluläre Verteilung der Eisenablagerung zu beobachten, was eine Methode zur Untersuchung von20 n. Chr. darstellt. Die Perls-Färbung weist in erster Linie Nicht-Häm-Eisen nach und hängt von der Bildung des Preußisch-Blau-Komplexes ab:

(Preußisch blau)
Die traditionelle Perls-Färbung ist jedoch unwirksam, um die Eisenlokalisation bei niedrigen Eisengehalten zu erkennen. Wenn Diaminobenzidin (DAB) zugesetzt wird, reagiert es mit Eisenhexacyanoferrat unter Bildung einer braunen Verbindung, wodurch die Spezifität des Assayserhöht wird 21.
Das Ziel dieses Protokolls ist es, zu beschreiben, wie die Menge und Verteilung der Eisenablagerung im Gehirn eines AD-Mausmodells zu beurteilen ist. In diesem Protokoll wurden 8 Monate alte 5×FAD (C57BL/6J) transgene Mäuse als AD-Mausmodell verwendet und mit Wildtyp-Mäusen gleichen Alters verglichen. Einzelheiten zu den Verfahren zur Herstellung des chemischen Reagenzes, zum Schneiden des Gehirns, zur Durchführung der Perls/DAB-Färbung und zur Analyse von Bildern, die nach der Färbung aufgenommen wurden, werden hier vorgestellt.
Protokoll
Alle Verfahren wurden in Übereinstimmung mit den Richtlinien des Institutional Animal Care and Use Committee der Xuzhou Medical University und den Vorschriften der chinesischen Regierung für die Pflege und Verwendung von Labortieren durchgeführt.
1. Perfusion von Tieren
- Bereiten Sie das Fixiermittel vor: Lösen Sie 4 % Paraformaldehyd (PFA) in 1× phosphatgepufferter Kochsalzlösung (PBS) (siehe Tabelle 1).
- Betäuben Sie die Maus durch intraperitoneale Injektion mit Ketamin (100 mg/kg) und Xylazin (15 mg/kg). Sobald die Maus betäubt ist, befestigen Sie sie mit vier Stiften auf dem Tablett für die Perfusionschirurgie, um die Gliedmaßen zu sichern.
VORSICHT: Um eine ordnungsgemäße Anästhesie zu gewährleisten, überprüfen Sie, ob die Reaktionen auf das Einklemmen der Zehen, die Entspannung der Gliedmaßenmuskulatur und der tiefe, langsame und gleichmäßige Atem verloren gehen. - Schneide die Brust mit einer Schere auf, um das Herz freizulegen, und schneide den rechten Vorhof auf. Injizieren Sie 20 ml 1× PBS mit einer Spritze in den linken Ventrikel, um das Blut zu spülen. Injizieren Sie dann 20 ml 4% PFA zur Fixierung.
HINWEIS: Kontrollieren Sie die Tiefe und Richtung der Nadel, um ein Durchstechen des interventrikulären Septums zu vermeiden. Denken Sie daran, dass eine optimale Perfusion eine blasse Leber und steife Gliedmaßen nach dem anfänglichen Tremor aufweist. - Enthaupte die durchblutete Maus, schneide mit einer feinen Schere den Knochen um den Schädel herum, hebe den Schädel vorsichtig mit einer stumpfen Pinzette an und entferne das Gehirn. Weichen Sie dann das Gehirn über Nacht in 4 % PFA bei 4 °C ein.
ACHTUNG: Seien Sie vorsichtig mit 4% PFA, einem starken Reizstoff für die Atemwege. Tragen Sie eine geeignete Maske und führen Sie diesen Schritt in einem Abzug durch.
HINWEIS: Die Methode der Euthanasie wurde von der IACUC des Tierpflege- und Gebrauchsprogramms der Xuzhou Medical University für Euthanasie-Richtlinien genehmigt: Mäuse / Ratten.
2. Kryosektion des Gehirns
- Dehydrieren Sie das Gehirn mit abgestuften Saccharoselösungen (15 % und 30 %) bei 4 °C für 24 Stunden für jeden Schritt. Das Gehirn sollte schließlich auf den Boden der Saccharoselösung sinken.
- Hemisect des Gehirns entlang der interhemisphärischen Fissur mit einem Skalpell. Geben Sie die linke Hälfte in ein 5-ml-Mikrozentrifugenröhrchen, das mit 1 ml 30%iger Saccharoselösung und einem gleichen Volumen der Verbindung mit optimaler Schneidtemperatur (OCT) gefüllt ist, um den Kontakt zwischen dem OCT und dem Gehirn zu verbessern.
- Schneiden Sie mit einer Rasierklinge Fremdgewebe aus der linken Hemisphäre ab und bringen Sie es auf die OCT-Plattform.
- Betten Sie das Gewebe in OCT mit Unterstützung einer kreisförmigen Wand aus Aluminiumfolie ein.
- Frieren Sie das Gewebe in einem Kryostat-Mikrotom bei -22 °C für mindestens 1 h ein und stellen Sie die Temperatur des Schneidkopfes auf -19 °C ein.
HINWEIS: Denken Sie daran, das Anti-Roll-Glas und die Bürsten im Kryostaten zusammen mit der Probe vorzukühlen. - Montieren Sie den gefrorenen Gewebeblock. Schneiden Sie den Gewebeblock je nach interessierendem Bereich wieder in eine geeignete Position und beginnen Sie dann, das Gehirn in 20 μm dicke sagittale Schnitte zu schneiden.
HINWEIS: Wenn die Abschnitte gefaltet sind, verwenden Sie weiche Bürsten, um die Abschnitte zu entfalten. - Sammeln Sie jeden Abschnitt auf den mit Gelatine überzogenen Objektträgern und schmieren Sie einen Tropfen 1× PBS darauf. Drehen Sie den Gehirnteil mit einer feinen Bürste um und montieren Sie den Abschnitt dann schnell auf die Rutsche.
- Trocknen Sie die gesammelten Abschnitte über Nacht bei Raumtemperatur und lagern Sie sie bei -20 °C.
HINWEIS: Das Protokoll kann hier für bis zu 2 Wochen pausiert werden. Eine längere Lagerzeit kann die Gewebequalität beeinträchtigen und somit das Ergebnis des Versuchs beeinflussen.
3. Perls/DAB-Färbung
- Die folgenden Lösungen werden hergestellt: 2%iges Kaliumferrocyanid (K4[Fe(CN)6]·3H2O), 2%ige Salzsäure (HCI) und 20× DAB-Lösung (siehe Tabelle 1).
- Legen Sie einen Objektträger mit Abschnitten in ein mit 1× PBS gefülltes Färbeglas und stellen Sie das Glas für 5 Minuten auf einen Orbitalschüttler, um das OCT aus dem Gewebe zu waschen.
HINWEIS: Stellen Sie die Drehzahl des Orbitalschüttlers sorgfältig ein (empfohlene Drehzahl: 20 U/min), um zu vermeiden, dass Gewebe bei hohen Geschwindigkeiten vom Objektträger fällt. - Mischen Sie 20 ml 2%ige Kaliumferrocyanidlösung und ein gleiches Volumen 2%ige Salzsäure in einem 50-ml-Zentrifugenröhrchen.
- Übertragen Sie den Objektträger mit einer Kunststoffzange auf das 50 mL Röhrchen und erhitzen Sie das Röhrchen dann in einem Wasserbad bei 60 °C für 30 min.
- Spülen Sie den Objektträger mit 1× PBS ab und tupfen Sie überschüssige Lösung mit Seidenpapier ab.
- Geben Sie mit einer Pipette 50 μl DAB-Lösung in jeden Gehirnabschnitt und inkubieren Sie 10 Minuten lang bei Raumtemperatur.
- Aspirieren Sie die überschüssige DAB-Lösung mit einer Pipette und waschen Sie den Objektträger dann 3 Mal in PBS.
- Dehydrieren Sie die Schnitte mit abgestuften Alkohollösungen (50 %, 70 %, 95 %, 100 %) und Xylol (100 %, 100 %). Inkubieren Sie die Objektträger jeweils 3 Minuten lang.
- Versiegeln Sie die Abschnitte mit neutralem Gummi22 und legen Sie dann das Deckglas auf.
- Trocknen Sie die Objektträger 24 Stunden lang in einem Abzug, bevor Sie sie in einer Objektträgerbox aufbewahren.
4. Bildgebung
- Schalten Sie das Mikroskop ein, stellen Sie die Helligkeit der Lichtquelle ein und fokussieren Sie auf den Gehirnausschnitt unter einem Objektiv mit 4× Vergrößerung.
- Nehmen Sie das Bild mit der Kamerasteuerungssoftware auf und passen Sie die Parametereinstellungen an, um eine Überbelichtung zu vermeiden. Die spezifischen Einstellungen (10×, 40× Ziel) sind in Abbildung 1 dargestellt.
HINWEIS: Vermeiden Sie den automatischen Weißabgleich, um für jedes Bild die gleiche Belichtungszeit zu gewährleisten. - Wechseln Sie zu einem Objektiv mit 10× Vergrößerung, bewegen Sie den Mikroskoptisch, um auf die Bereiche mit hohen Perls/DAB-Färbesignalen zu fokussieren, insbesondere den Hippocampus und die Großhirnrinde, und nehmen Sie Bilder auf (Abbildung 1A).
- Wechseln Sie zu einem Objektiv mit 40-facher Vergrößerung, um Bilder mit klaren Färbesignalen aufzunehmen.
- Speichern Sie jedes Bild als 8-Bit-TIFF und exportieren Sie die Bilder zur weiteren Analyse.
5. Bildanalyse
- Wählen Sie in ImageJ/Fiji im Menü Plugins > Stitching > Grid/Collection-Stitching aus und wählen Sie dann Unbekannte Position , um die Bilder auszuwählen, die zusammengefügt werden sollen (Abbildung 2A).
- Wählen Sie File > Save As > Tiff , um das fertige Bild als TIFF zu speichern (Abbildung 2B).
- Verwenden Sie ImageJ/Fiji, um ein Bild zu öffnen, und stellen Sie sicher, dass das Bildformat RGB-Farbe ist (Abbildung 2C).
- Wählen Sie im Menü Plugins > IHC Profiler Image und dann Mode > Cytoplasmic Stained Image und den Color Deconvolution default H DAB (Abbildung 2D). Konvertieren Sie dann das Bildformat in 8-Bit-Graustufen.
- Konvertieren Sie die Grauwerte des Bildes in OD-Werte, indem Sie Analysieren > Kalibrieren > nicht kalibrierten OD auswählen (Abbildung 2E).
- Verwenden Sie die Threshold-Funktion , um den Bereich der positiven Perls/DAB-Färbung auszuwählen, und passen Sie dann die horizontalen Bildlaufbalken an, bis alle braunen Signalflecken rot bedeckt sind (Abbildung 2F).
- Klicken Sie auf Analysieren > Messwerte festlegen und wählen Sie dann die Optionen Fläche, Mittlerer Grauwert, Integrierte Dichte und vor allem Grenzwert begrenzen , um Hintergrundgeräusche auszuschließen (Abbildung 2G).
- Wählen Sie Analyze > Measure aus, um die Ergebnistabelle zu erhalten (Abbildung 2H).
- Gruppieren Sie die Ergebnisse und verwenden Sie Statistiksoftware, um statistische Analysen durchzuführen. In unserem Fall verglichen wir die Eisenakkumulation im Hippocampus und in der Hirnrinde von 5xFAD-transgenen Mäusen mit der in der Negativkontrolle (Wildtyp-Mäuse). Für Dreigruppenvergleiche wurde die unidirektionale Varianzanalyse (ANOVA) für Daten aus der Gaußschen Verteilung mit gleicher Standardabweichung verwendet.
Ergebnisse
Um die Verteilung und Akkumulation von Eisen in einem Mausmodell der Alzheimer-Krankheit zu untersuchen, führten wir eine Perls/DAB-Färbung in sagittalen Schnitten von 8 Monate alten 5xFAD-Mäusen durch. Wie in Abbildung 3 gezeigt, wurden Perls/DAB-Färbesignale bei 8 Monate alten 5xFAD- und Wildtyp-Mäusen sowie bei 2 Monate alten Wildtyp-Mäusen beobachtet. In 5xFAD-Mäusen wurden hohe Perls'/DAB-Färbesignale im Hippocampus und im Kortex beobachtet, insbesondere im Subiculum des Hippocampus. Wildtyp-Mäuse dienten als validierte Negativkontrollen; Sowohl 2 als auch 8 Monate alte Kohorten zeigten signifikant abgeschwächte Eisenablagerungssignale (Abbildung 3A), mit nachweisbaren, aber nicht signifikanten altersprogressiven Akkumulationstrends. Unter 40× Vergrößerung wurden die Signale in 5xFAD-Mäusen in Aβ-Plaque-ähnlichen Strukturen beobachtet, was mit früheren Studienübereinstimmt 9,10 (Abbildung 3B). Die Bilder mit 4× Vergrößerung wurden zusammengefügt, um die Verteilung der Eisenfärbung in den Gehirnen von 5xFAD-Mäusen zu untersuchen. Die Perls/DAB-Färbesignale waren im Kortex, im Hippocampus und im Kleinhirn deutlich stärker als in anderen Regionen. (Abbildung 3C). Drei Abschnitte der Großhirnrinde und drei Hippocampus von jeder der drei Mäuse in jeder Erkrankung und Altersgruppe wurden für die Quantifizierung ausgewählt. Die Eisenablagerung bei 8 Monate alten 5xFAD-Mäusen war signifikant höher als bei Wildtyp-Kontrollen gleichen Alters. Beim Vergleich der Signaldichte in 2 Monate alten und 8 Monate alten Wildtyp-Mäusen fanden wir keinen signifikanten Unterschied in der Eisenakkumulation zwischen diesen beiden Altersgruppen (Abbildung 3D). Diese Ergebnisse zeigen die Wirksamkeit der Perls/DAB-Färbung als histochemische Technik zur Eisendetektion. Abbildung 4 zeigt zwei Fälle, in denen eine Färbung fehlgeschlagen ist. Eine übermäßige Hintergrundfärbung tritt auf, wenn die Gehirnabschnitte zu lange in der DAB-Lösung belassen werden (Abbildung 4A). Unsachgemäße Dehydrierung führt zu gefalteten Abschnitten (Abbildung 4B).
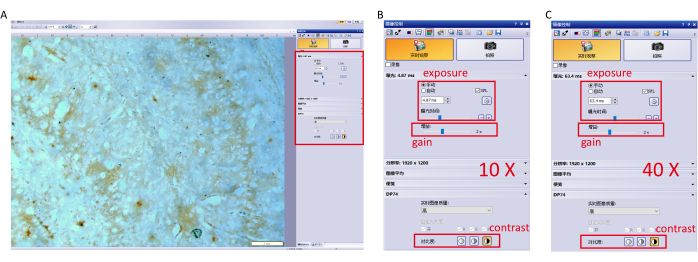
Abbildung 1: Parametereinstellungen für die Bildgebungssoftware. (A) Passen Sie die Parametereinstellungen der Software (Belichtung, Verstärkung und Kontrast) bei 10× Objektiv an und fokussieren Sie sich auf den Hippocampus. (B) Detaillierte Parametereinstellungen für ein 10×Ziel. (C) Detaillierte Parametereinstellungen für ein 40×Ziel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Datenverarbeitung der Perls/DAB-Färbeergebnisse. (A) Wählen Sie in ImageJ/Fiji im Menü Plugins > Stitching > Grid/Collection Stitching und dann Unbekannte Position , um die Bilder auszuwählen, die zusammengefügt werden sollen. (B) Wählen Sie Datei > Speichern unter> Tiff , um das fertige Bild als TIFF zu speichern. (C) Verwenden Sie ImageJ/Fiji, um ein Bild zu öffnen, und stellen Sie sicher, dass das Bildformat RGB-Farbe ist. (D) Wählen Sie Plugins > IHC Profiler Image und dann Modus > Cytoplasmic Stained Image und die Color Deconvolution default H DAB aus. (E) Konvertieren Sie die Grauwerte des Bildes in OD-Werte, indem Sie "Analysieren > > nicht kalibrierten OD" auswählen. (F) Verwenden Sie die Threshold-Funktion , um den positiven Bereich von Perls auszuwählen, und passen Sie dann die horizontalen Scrollbalken an, bis alle Signalpunkte abgedeckt sind. (G) Klicken Sie auf Analysieren > Messungen festlegen, wählen Sie die Optionen für Fläche, Mittlerer Grauwert, Integrierte Dichte und Grenzwert bis Schwellenwert aus, um Hintergrundgeräusche auszuschließen. (Integrierte Dichte = Fläche × Mittelwert). (H) Wählen Sie Analysieren > Messen , um die Ergebnistabelle zu erhalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
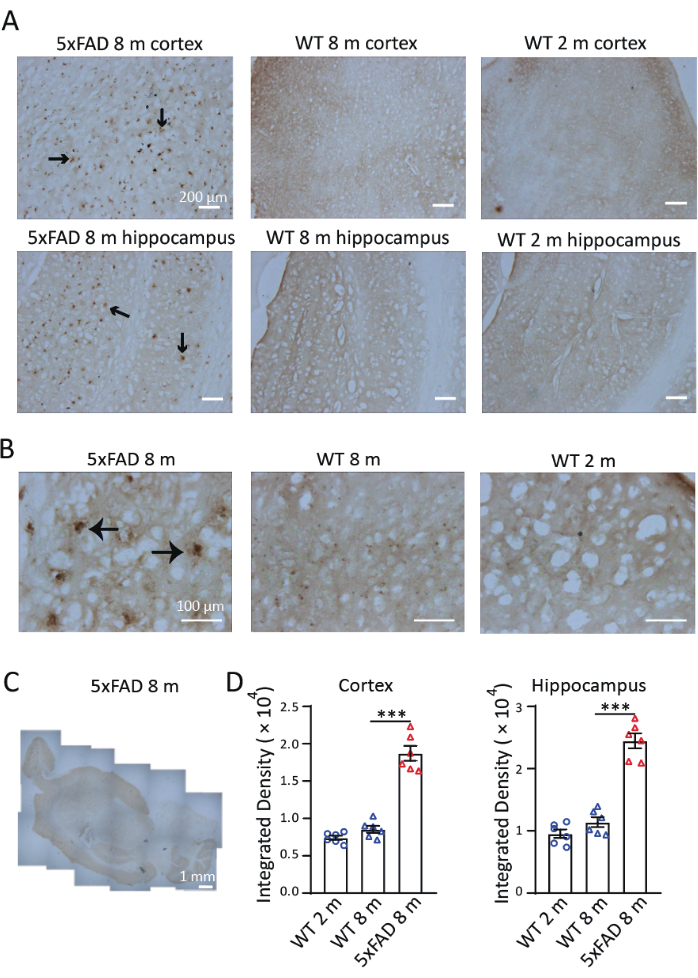
Abbildung 3: Repräsentative Perls'/DAB-Färbung in den Gehirnen von 5xFAD-Mäusen und Wildtyp-Mäusen (WT). (A) Starke Perls'/DAB-Signale in Längsschnitten des Hippocampus und des Kortex von 8 Monate alten 5xFAD-Mäusen im Vergleich zur Färbung bei 2 Monate alten und 8 Monate alten Wildtyp-Mäusen. (B) Die Perls/DAB-Signale waren um Aβ-Plaques gruppiert, insbesondere im Hippocampus. (C) Ein zusammengesetztes Längsbild, das die Verteilung von Perls/DAB-Signalen in einem 5xFAD-Mausgehirn zeigt. (D) Statistische Analyse des Perls/DAB-Signals im Kortex oder Hippocampus von 2 Monate alten WT-, 8 Monate alten WT- und 8 Monate alten 5xFAD-Mäusen. Einfache ANOVA, ***, P < 0,001. Maßstabsleisten werden in den Bildern angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Zwei Fälle von erfolgloser Perls/DAB-Färbung. (A) Eine überfärbte Perls/DAB-Färbung aufgrund einer übermäßigen DAB-Intensivierung. (B) Der Rand des Gehirnabschnitts ist aufgrund einer unangemessenen Dehydrierung gekrümmt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Eisenablagerung ist eng mit der Alzheimer-Krankheit verbunden. Einerseits kann es durch mehrere Mechanismen zur Aβ-Produktion führen, einschließlich einer erhöhten Expression des Amyloid-Vorläuferproteins{NOTE:20}23, und auch einer erhöhten γ-Sekretase-Aktivität, die zu einer beschleunigten Aβ-Produktion führen kann24; Auf der anderen Seite kann die durch erhöhtes Eisen induzierte Lipidperoxidation die Tau-Polymerisation fördern, was auch zu einer erhöhten abnormalen Phosphorylierung des Tau-Proteins in Neuronen führen kann25. Die Preußisch-Blau-Färbung von Perls ist eine etablierte histochemische Technik zur selektiven Visualisierung von Eisenablagerungen (Fe3+) in biologischen Proben. Das EisenEisen reagiert mit Ferrocyanid unter Bildung von blauem Eisen(III)-Ferrocyanid (Preußischblau)14. Die Perls/DAB-Färbung ist eine Modifikation der traditionellen Perl-Färbung. Die reagierenden Proben werden in eine Lösung überführt, die DAB (Diaminobenzolamin) enthält, woraufhin das Preußischblau eine braun gefärbte Verbindung bildet. Mit dieser Methode beobachteten wir die räumliche Verteilung der Eisenakkumulation im Gehirn von 5xFAD-Mäusen und verglichen quantitativ die Eisenakkumulation in AD-Modellmäusen und Wildtyp-Mäusen.
In diesem Protokoll zeigen wir, dass die Perls/DAB-Färbung für die Beurteilung pathologischer Eisenablagerung machbar und effektiv ist. Für ein ideales Ergebnis sollten einige Tipps beachtet werden. Erstens sollten eisenfreie Reagenzien und Werkzeuge, insbesondere eisenfreie Salzsäure, verwendet werden, um die Hintergrundfärbung zu reduzieren. Das Kaliumferrocyanid und die Salzsäure sollten frisch zubereitet werden. Die überschüssige Lösung, die auf dem Objektträger verbleibt, sollte entfernt werden, und es sollten reiner Alkohol und Xylol verwendet werden, um eine gründliche Dehydrierung zu gewährleisten. Während der Bildgebung führt der Einsatz des automatischen Weißabgleichs zu ungenauen Analysen. Denken Sie daran, die Grauwerte des Bildes in OD-Werte umzuwandeln, die der Dichte der histochemischen Signale entsprechen.
Das hier beschriebene Verfahren erhöht die Spezifität der Färbung und ist besonders nützlich in Geweben mit niedrigem Eisengehalt. Die DAB-Färbung erzeugt ein kontrastreiches Signal, das für die Mikroskopie und Bildanalyse wichtig ist. Zusammenfassend lässt sich sagen, dass die Perls/DAB-Färbung ein stärkeres Signal und einen besseren Hintergrundkontrast bietet als die herkömmliche Perls-Färbung, wodurch die Empfindlichkeit und Genauigkeit der Eisendetektion erhöht wird. Darüber hinaus weist die Perls-Färbung das Eisen nur in locker gebundenen Proteinkomplexen (wie in Hämosiderin) nach.21. Eisen, das wie im Hämoglobin stark gebunden ist, reagiert nicht. Dadurch werden die unerwünschten Signale, die durch Eisen in den roten Blutkörperchen und im Hämoglobin verursacht werden, stark reduziert.
Die Perls/DAB-Färbung hat jedoch einige Einschränkungen. Zum Beispiel führt die DAB-Färbung zu einer unspezifischen Hintergrundfärbung, die die Beobachtung positiver Ergebnisse beeinträchtigen kann. Darüber hinaus erfordert der Färbeprozess eine präzise Kontrolle sowohl der Zeit als auch der Konzentration; Andernfalls kann die Färbung ungleichmäßig sein oder eine unzureichende Signalintensität aufweisen. Es wurde auch berichtet, dass die Färbereaktion überwiegend in Oligodendrozyten und nicht in Neuronen erfolgt26.
Die Perls-/DAB-Färbung eignet sich für Studien der Pathologie, die Medienspezifität und Sensitivität erfordern. Diese Methode bietet Forschern eine weniger zeitaufwändige und kostengünstigere Möglichkeit, die Eisenakkumulation zu visualisieren und zu quantifizieren als MRT oder FAAS. Um die Verteilung der Eisenakkumulation in verschiedenen Zelltypen und subzellulären Strukturen weiter zu untersuchen, ist eine Co-Färbung mit Markern für Neuronen und Gliazellen erforderlich. Insgesamt wird die Perls/DAB-Färbung die Erforschung der Alzheimer-Pathologie beschleunigen und die Erforschung von Therapeutika im Zusammenhang mit dem Eisenstoffwechsel erleichtern.
Offenlegungen
Diese Forschung wurde durch ein allgemeines Projekt der Natural Science Foundation of China (Fördernummer: 32271010) unterstützt.
Danksagungen
Bei der Erstellung dieser Arbeit haben die Autoren DeepSeek verwendet, um die Sprache und Lesbarkeit zu verbessern. Nach der Nutzung dieses Tools/Dienstes haben die Autoren den Inhalt nach Bedarf überprüft und bearbeitet und übernehmen die volle Verantwortung für den Inhalt der Publikation.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.1 M PBS | biosharp | BL601A | Add deionized water to make solution |
| 4% PFA | Beyotime | P0099 | Restore at 4 °C for use |
| 20X DAB solution | Bioss | C-0003 | Mix 10 μl solution A, 10 μl solution B and 180 μl PBS |
| Alcohol | Supelco | 107017 | |
| HCL | Sigma | 7647-01-0 | Add distilled water to 50 ml |
| ketamine | China National Medicines | H20193336 | 100 mg/kg for anesthetizing |
| Microscope | Olympus | CX43 | |
| Optimal cutting temperature compound (OCT) | Sakura Finetek | 4583 | |
| potassium ferrocynide solution | Sigma | 14038-43-8 | Add distilled water to 50 ml |
| Sucrose | Sigma | 57-50-1 | |
| xylazine | Y-S Biotechnology | YS-(BC)-2842 | 15 mg/kg for anesthetizing |
| Xylenes | Sigma | 1330-20-7 |
Referenzen
- Karlawish, J., Jack, C. R., Rocca, W. A., Snyder, H. M., Carrillo, M. C. Alzheimer's disease: The next frontier-special report 2017. Alzheimer's Dement. 13 (4), 374-380 (2017).
- Praticò, D. Oxidative stress hypothesis in Alzheimer's disease: A reappraisal. Trends in Pharmacol Sci. 29 (12), 609-615 (2008).
- Sayre, L. M., et al. In situ oxidative catalysis by neurofibrillary tangles and senile plaques in alzheimer's disease. J. Neurochem. 74 (1), 270-279 (2001).
- Urrutia, P., et al. Inflammation alters the expression of dmt1, fpn1 and hepcidin, and it causes iron accumulation in central nervous system cells. J. Neurochem. 126 (4), 541-549 (2013).
- Hardy, J., Selkoe, D. J. The amyloid hypothesis of Alzheimer's disease: Progress and problems on the road to therapeutics. Science. 297 (5580), 353-356 (2002).
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Ficiarà, E., Munir, Z., Boschi, S., Caligiuri, M. E., Guiot, C. Alteration of iron concentration in alzheimer's disease as a possible diagnostic biomarker unveiling ferroptosis. Int J Mol Sci. 22 (9), 4479(2021).
- Yang, W. S., Stockwell, B. R. Ferroptosis: Death by lipid peroxidation. Trends in Cell Biol. 26 (3), 165-176 (2016).
- Lane, D. J. R., et al. Iron and Alzheimer's disease: An update on emerging mechanisms. J Alzheimers Dis. 64 (s1), S379-S395 (2018).
- Meadowcroft, M. D., Connor, J. R., Smith, M. B., Yang, Q. X. Mri and histological analysis of beta-amyloid plaques in both human Alzheimer's disease and app/ps1 transgenic mice. J Magn Reson Imaging. 29 (5), 997-1007 (2009).
- Winterbourn, C. C. Toxicity of iron and hydrogen peroxide: The Fenton reaction. Toxicol Lett. 82-83, 969-974 (1995).
- Silvestri, L., Camaschella, C. A potential pathogenetic role of iron in Alzheimer's disease. J Cell Mol Med. 12 (5a), 1548-1550 (2008).
- Gamblin, T. C., King, M. E., Kuret, J., Berry, R. W., Binder, L. I. Oxidative regulation of fatty acid-induced tau polymerization. Biochemistry. 39 (46), 14203-14210 (2000).
- Meguro, R., et al. Nonheme-iron histochemistry for light and electron microscopy: A historical, theoretical and technical review. Arch Histol Cytol. 70 (1), 1-19 (2007).
- Lehéricy, S., Roze, E., Goizet, C., Mochel, F. Mri of neurodegeneration with brain iron accumulation. Curr Opin Neurol. 33 (4), 462-473 (2020).
- Nabuurs, R. J. A., et al. High-field MRI of single histological slices using an inductively coupled, self-resonant microcoil: Application to ex vivo samples of patients with Alzheimer's disease. NMR Biomed. 24 (4), 351-357 (2010).
- Perl, D. P., Good, P. F. Comparative techniques for determining cellular iron distribution in brain tissues. Ann Neurol. 32 (S1), S76-S81 (1992).
- Riemer, J., Hoepken, H. H., Czerwinska, H., Robinson, S. R., Dringen, R. Colorimetric ferrozine-based assay for the quantitation of iron in cultured cells. Anal Biochem. 331 (2), 370-375 (2004).
- Luterotti, S., Kordić, T., Dodig, S. Simultaneous determination of iron and copper in children's sera by FAAS. Acta Pharm. 61 (1), 93-102 (2011).
- Hill, J. M., Switzer, R. C. The regional distribution and cellular localization of iron in the rat brain. Neuroscience. 11 (3), 595-603 (1984).
- Meguro, R., Asano, Y., Iwatsuki, H., Shoumura, K. Perfusion-perls and -turnbull methods supplemented by dab intensification for nonheme iron histochemistry: Demonstration of the superior sensitivity of the methods in the liver, spleen, and stomach of the rat. Histochem Cell Biol. 120 (1), 73-82 (2003).
- Liu, C., et al. S-nitrosylation of divalent metal transporter 1 enhances iron uptake to mediate loss of dopaminergic neurons and motoric deficit. J Neurosci. 38 (39), 8364-8377 (2018).
- Guillemot, J., Canuel, M., Essalmani, R., Prat, A., Seidah, N. G. Implication of the proprotein convertases in iron homeostasis: Proprotein convertase 7 sheds human transferrin receptor 1 and furin activates hepcidin. Hepatology. 57 (6), 2514-2524 (2013).
- Li, X., et al. Ferritin light chain interacts with pen-2 and affects γ-secretase activity. Neurosci Lett. 548, 90-94 (2013).
- Jin Jung, K., et al. Oxidative stress induces inactivation of protein phosphatase 2a, promoting proinflammatory nf-κb in aged rat kidney. Free Radic Biol Med. 61, 206-217 (2013).
- Connor, J. R., Menzies, S. L., Martin, S. M. S., Mufson, E. J. Cellular distribution of transferrin, ferritin, and iron in normal and aged human brains. J Neurosci Res. 27 (4), 595-611 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten