Method Article
Perls/DAB 염색에 의한 5xFAD 마우스의 뇌 내 철 침착 평가
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 조직, 특히 뇌에 침착되는 철의 분포와 양을 평가하는 방법을 제시합니다. 이 프로토콜은 시료 전처리, Perls/DAB 염색, 이미지 캡처 및 데이터 분석 절차를 자세히 설명합니다.
초록
알츠하이머병(Alzheimer's disease, AD)은 흔한 신경퇴행성 질환으로, 노인 치매의 주요 원인입니다. 철 침착은 알츠하이머병의 발병기전과 밀접한 관련이 있습니다. 알츠하이머병 뇌에서 철분 수치 상승은 β-아밀로이드 플라크(-amyloid plaque), 타우 신경섬유다발(tau neurofibrillary tangles), 세포사멸(apoptosis)을 포함한 특징적인 알츠하이머병 병리와 밀접한 관련이 있습니다. 철분 대사 조절 장애로 인한 산화 스트레스가 알츠하이머병 병태생리학에서 중요한 역할을 한다는 증거가 늘어나고 있습니다. 따라서 알츠하이머병의 병리학에서 철분 축적의 역할을 이해하는 것은 알츠하이머병 치료에 매우 중요합니다. 포괄적인 철 염색 프로토콜은 뇌에서 철의 발현과 분포를 감지하는 데 필수적입니다. 이 프로토콜은 뇌에 침착되는 철의 양과 분포를 평가하는 방법을 설명하는 것을 목표로 합니다. 우리는 시약 준비, 마우스 치료 및 뇌 절편 준비와 관련된 과정을 설명합니다. 또한, 대뇌 조직 절편에서 조직화학적 철 검출을 위한 상세한 단계별 프로토콜을 제시하며, 염색 결과에 대한 포괄적인 해석을 보장하기 위해 정량적 평가와 형태학적 평가를 모두 통합하는 체계적인 분석 프레임워크를 제공합니다. 이 실험 프로토콜은 연구자들이 뇌의 철 침착을 이해하고 알츠하이머병 연구를 지원하는 데 도움이 될 것입니다.
서문
알츠하이머병(Alzheimer's disease, AD)은 가장 흔한 신경퇴행성 질환으로 사회에서 심각한 문제가 되고 있습니다. 알츠하이머병의 유병률은 1,2,3,4세에 따라 급격히 증가합니다. 알츠하이머병(AD)의 주요 병리학적 특징으로는 타우 단백질의 비정상적인 인산화로 인한 β-아밀로이드(Aβ) 플라크와 신경섬유다발(NFT)의 침착이 있습니다. Aβ는 β-세크레타제와 γ-세크레타제 효소에 의한 아밀로이드 전구 단백질(APP)의 순차적 절단을 통해 생성됩니다. Aβ 생성 또는 제거의 조절 장애는 뇌에 축적되어 아밀로이드 플라크를 형성하며, 이는 AD의 가장 초기 병리학적 지표 중 하나로 인식됩니다. 이러한 플라크는 직접적인 신경 손상을 유발할 뿐만 아니라 신경 염증, 산화 스트레스 및 시냅스 기능 장애를 포함한 일련의 해로운 영향을 시작합니다. 총체적으로, 이러한 과정은 뉴런 사멸과 AD5에서 관찰된 점진적인 인지 기능 저하에 기여합니다. 아밀로이드-β 플라크 침착 및 과인산화 타우 단백질 응집을 포함하여 알츠하이머병(AD)의 병리학적 특징을 주로 표적으로 하는 수십 년간의 연구에도 불구하고, 질병 진행을 수정하는 데 제한된 효능을 입증한 기존 중재로 인해 임상적으로 의미 있는 치료법의 돌파구는 여전히 파악하기 어렵습니다6.
철분은 뇌 기능을 유지하는 데 중요한 금속으로 산소 운반, DNA 합성, 미토콘드리아 호흡, 미엘린 합성, 신경 전달 물질 합성 및 신진대사에 관여합니다. 그러나 철분은 농도가 세포 격리 능력을 초과하면 해로워집니다 6,7,8. 일반적으로 Aβ 플라크와 함께 국한되는 증가된 철 침착은 AD 9,10 환자의 뇌의 피질 및 해마 영역 모두에서 관찰되었습니다. Fenton 반응11을 통해 세포 내 유리 철은 활성산소종뿐만 아니라 하이드록실 라디칼(•OH)을 생성할 수 있습니다. 이러한 유해 물질은 신경교세포를 활성화하여 신경염증을 유발할 뿐만 아니라 산화 스트레스를 통해 세포의 생체 분자를 공격하여 정상적인 세포 기능을 방해하고 시냅스 기능 장애를 유발합니다 8,12. 더욱이, 철분 증가는 알츠하이머병의 병리학적 징후 발병에 직접적으로 관여합니다: 철분은 Aβ 생성에 기여하고12 타우 단백질 기능 장애를 증가시켜 신경섬유다발(neurofibrillary tangles)을 유발합니다13.
뇌의 철분 함량을 평가하기 위해 자기공명영상(MRI)과 화학적 및 조직화학적 방법 등 여러 기법이 개발되었다14. MRI를 이용한 뇌내 철분 수치의 생체 내 정량화는 노화 및 신경퇴행 환자에게 임상적으로 중요하다15. MRI는 비침습적이고 매우 민감하다는 장점이 있습니다: 질병의 초기 단계에서 철 침착을 감지할 수 있습니다. 특히, FDRI(Field-dependent R2 Increase) 기술은 페리틴철 및 헴-철16과 같은 다양한 형태의 철을 구별할 수 있습니다. 그러나 MRI는 세포 수준에서 철분 축적을 감지할 수 없고 비용이 많이 들기 때문에 주로 임상 조사에 사용됩니다17.
비색 측정은 용액 내 물질과 발색제(18)의 반응에 의해 생성된 색의 강도를 측정하여 물질(예: 철)의 농도를 결정하는 화학적 방법입니다. 이 방법은 수행하기 쉽고 저가의 시약과 기기를 사용하므로 예산이 제한된 실험실에 적합합니다18. 그러나 이 방법의 정확도와 감도는 결과가 환경 요인, 발색 시간 및 작업자의 주관적인 판단의 영향을 받기 때문에 매우 제한적입니다. 화염 원자 흡수 분광법(FAAS)은 철 수치를 평가하는 데 사용할 수 있는 또 다른 방법입니다19. 이 방법에서는 관심 조직을 고온로에서 연소시켜 정화된 샘플 용액을 얻습니다. 그런 다음 염산을 사용하여 샘플을 용해시키고 용액 내 철 농도는 원자 흡수 분광법을 통해 측정합니다. 이 방법은 매우 민감하며 모든 유형의 생물학적 샘플에 적합합니다19. 그러나 이 프로세스는 시간이 많이 걸리고 값비싼 장비가 필요하므로 사용이 제한됩니다.
비헴 철을 검출하기 위한 Perls'/DAB 염색은 다른 조직화학적 방법에 비해 특이성이 높고 구현이 용이하기 때문에 가장 일반적으로 사용되는 철 검출 방법입니다14. 비색 분석과 달리 Perls의 염색은 철 이온과 페로시아나이드 칼륨 사이의 반응에 의존하여 파란색 침전물을 생성하는 정성적 조직화학적 염색 방법입니다. 조직에서 철의 존재와 분포를 현미경으로 시각화하는 데 사용됩니다. 또한, 이 방법을 사용하면 다양한 세포 유형에서 철 침착을 구별하고 철 침착의 세포 내 분포를 관찰할 수 있어 AD20 연구를 위한 방법을 제공할 수 있습니다. Perls의 염색은 주로 비헴 철을 검출하며 프러시안 블루 복합체의 형성에 따라 다릅니다.

(프러시안 블루)
그러나 전통적인 Perls의 염색은 낮은 철분 수치에서 철의 국소화를 감지하는 데 효과적이지 않습니다. 디아미노벤지딘(DAB)을 첨가하면 헥사시아노페레이트와 반응하여 갈색 화합물을 형성하여 분석의 특이성을 높입니다21.
이 프로토콜의 목표는 AD 마우스 모델의 뇌에서 철 침착의 양과 분포를 평가하는 방법을 설명하는 것입니다. 이 프로토콜에서는 8개월 된 5×FAD(C57BL/6J) 형질전환 마우스를 AD 마우스 모델로 사용하고 동일한 연령의 야생형 마우스와 비교했습니다. 화학 시약을 준비하고, 뇌를 절편화하고, Perls/DAB 염색을 수행하고, 염색 후 촬영한 이미지를 분석하는 절차에 대한 세부 정보가 여기에 나와 있습니다.
프로토콜
모든 절차는 쉬저우 의과대학 기관 동물 관리 및 사용 위원회의 지침과 실험실 동물의 관리 및 사용에 대한 중국 정부 규정에 따라 수행되었습니다.
1. 동물의 관류
- 정착액 준비: 4% 파라포름알데히드(PFA)를 1× 인산염 완충 식염수(PBS)에 용해시킵니다( 표 1 참조).
- 케타민(100mg/kg)과 자일라진(15mg/kg)을 복강내 주사하여 마우스를 마취합니다. 마우스가 마취되면 4개의 핀으로 관류 수술 트레이에 고정하여 팔다리를 고정합니다.
주의 : 적절한 마취를 위해 발가락 끼임, 사지 근육의 이완, 깊고 느리고 꾸준한 호흡에 대한 반응 상실을 확인하십시오. - 가위로 가슴을 잘라 심장을 드러내고 오른쪽 심방을 자릅니다. 주사기로 1× PBS 20mL를 좌심실에 주사하여 혈액을 씻어냅니다. 그런 다음 고정을 위해 20mL의 4% PFA를 주입합니다.
참고: 심실 중격에 구멍이 나지 않도록 바늘의 깊이와 방향을 조절하십시오. 최적의 관류는 초기 떨림 후 창백한 간과 뻣뻣한 팔다리를 특징으로 한다는 것을 기억하십시오. - 관류된 쥐의 목을 베고, 가위 한 쌍으로 두개골 주위의 뼈를 자르고, 뭉툭한 집게를 사용하여 두개골을 조심스럽게 들어 올려 뇌를 추출합니다. 그런 다음 4°C에서 4% PFA에 뇌를 하룻밤 동안 담가둡니다.
주의: 강한 호흡기 자극제인 4% PFA에 주의하십시오. 적절한 마스크를 착용하고 흄 후드에서 이 단계를 수행하십시오.
참고: 안락사 방법은 Xuzhou Medical University Animal Care and Use Program 안락사 지침: 생쥐/쥐의 IACUC에 의해 승인되었습니다.
2. 뇌 동결절편
- 각 단계마다 4°C에서 24시간 동안 등급이 매겨진 자당 용액(15% 및 30%)으로 뇌를 탈수합니다. 뇌는 마침내 자당 용액의 바닥으로 가라앉아야 합니다.
- 메스로 반구 간 균열을 따라 뇌를 반구 균열을 따라 반구를 반구 해부합니다. 왼쪽 절반을 1mL의 30% 자당 용액과 동일한 부피의 최적 절단 온도(OCT) 화합물로 채워진 5mL 미세 원심분리 튜브에 넣어 OCT와 뇌 간의 접촉을 향상시킵니다.
- 면도날로 좌반구의 외부 조직을 잘라내고 OCT 플랫폼으로 옮깁니다.
- 알루미늄 호일로 만든 원형 벽의 지지를 사용하여 OCT에 조직을 삽입합니다.
- -22°C의 저온 유지 장치 마이크로톰에서 조직을 최소 1시간 동안 동결하고 절단 헤드 온도를 -19°C로 설정합니다.
알림: 롤 방지 유리와 브러시를 저온 유지 장치에서 샘플과 함께 사전 냉각하는 것을 잊지 마십시오. - 얼어붙은 조직 블록을 장착합니다. 관심 영역에 따라 조직 블록을 다시 적절한 위치로 잘라낸 다음 뇌를 20μm 두께의 시상 절편으로 절단하기 시작합니다.
참고: 섹션이 접히면 부드러운 브러시를 사용하여 섹션을 펼칩니다. - 젤라틴으로 코팅된 슬라이드의 각 섹션을 수집하고 1×PBS 한 방울을 바르십시오. 가는 브러시를 사용하여 뇌 섹션을 뒤집은 다음 슬라이드에 섹션을 빠르게 장착합니다.
- 수집된 절편을 실온에서 하룻밤 동안 건조시키고 -20°C에서 보관하십시오.
참고: 프로토콜은 여기에서 최대 2주 동안 일시 중지할 수 있습니다. 보관 시간이 길면 조직의 품질을 방해하여 실험 결과에 영향을 미칠 수 있습니다.
3. Perls'/DAB 염색
- 2% 페로시아나이드 칼륨(K4[Fe(CN)6]·3H2O), 2% 염산(HCI) 및 20× DAB 용액을 준비합니다( 표 1 참조).
- 절편이 들어있는 슬라이드를 1×PBS로 채워진 염색 용기에 넣고 용기를 오비탈 셰이커에 5분 동안 올려 조직에서 OCT를 씻어냅니다.
알림: 조직이 고속으로 슬라이드에서 떨어지지 않도록 오비탈 셰이커의 속도를 조심스럽게 조정하십시오(권장 속도: 20rpm). - 20mL의 2% 페로시안화칼륨 용액과 동일한 부피의 2% 염산을 50mL 원심분리 튜브에 혼합합니다.
- 플라스틱 집게를 사용하여 슬라이드를 50mL 튜브로 옮긴 다음 60°C의 수조에서 30분 동안 튜브를 가열합니다.
- 슬라이드를 1×PBS로 헹구고 여분의 용액을 티슈 페이퍼로 닦아냅니다.
- 피펫을 사용하여 각 뇌 절편에 50μL의 DAB 용액을 추가하고 실온에서 10분 동안 배양합니다.
- 피펫으로 여분의 DAB 용액을 흡입한 다음 PBS에서 슬라이드를 3회 세척합니다.
- 등급이 매겨진 알코올 용액(50%, 70%, 95%, 100%)과 자일렌(100%, 100%)으로 섹션을 탈수합니다. 슬라이드를 각각 3분 동안 배양합니다.
- 중성 껌22 로 섹션을 밀봉한 다음 커버슬립을 놓습니다.
- 현미경 슬라이드 상자에 보관하기 전에 흄 후드에서 슬라이드를 24시간 동안 건조시킵니다.
4. 이미징
- 현미경을 켜고 광원의 밝기를 조정한 다음 4× 배율 대물렌즈 아래의 뇌 부분에 초점을 맞춥니다.
- 카메라 제어 소프트웨어로 이미지를 캡처하고 매개변수 설정을 조정하여 과다 노출을 방지합니다. 특정 설정(10×, 40× 목표)은 그림 1에 나와 있습니다.
참고: 각 이미지에 대해 동일한 노출 시간을 보장하기 위해 자동 화이트 밸런스를 사용하지 마십시오. - 10× 배율 대물렌즈로 전환하고, 현미경 스테이지를 이동하여 Perls/DAB 염색 신호가 높은 영역, 특히 해마와 대뇌 피질에 초점을 맞추고 이미지를 캡처합니다(그림 1A).
- 40x 배율 대물렌즈로 전환하여 선명한 염색 신호가 있는 이미지를 캡처할 수 있습니다.
- 각 이미지를 8비트 TIFF로 저장하고 추가 분석을 위해 이미지를 내보냅니다.
5. 이미지 분석
- ImageJ/Fiji의 메뉴에서 Plugins > stitching > Grid/Collection stitching 을 선택한 다음 Unknown position 을 선택하여 스티칭할 이미지를 선택합니다(그림 2A).
- File > Save As > Tiff를 선택하여 완성된 이미지를 TIFF로 저장합니다(그림 2B).
- ImageJ/Fiji를 사용하여 이미지를 열고 이미지 형식이 RGB 색상인지 확인합니다(그림 2C).
- 메뉴에서 Plugins > IHC Profiler Image 를 선택한 다음 Mode > Cytoplasmic Stained Image 와 Color Deconvolution default H DAB 를 선택합니다(그림 2D). 그런 다음 이미지 형식을 8비트 그레이 스케일로 변환합니다.
- Analyze > Calibrate > Uncalibrated OD를 선택하여 이미지의 회색 값을 OD 값으로 변환합니다(그림 2E).
- 임계값 기능을 사용하여 양성 Perls/DAB 염색 영역을 선택한 다음 모든 갈색 신호 지점이 빨간색으로 덮일 때까지 수평 스크롤 막대를 조정합니다(그림 2F).
- Analyze(분석) > Set Measurements(측정 설정)를 클릭한 다음 Area(영역), Mean gray value(평균 회색 값), Integrated density(통합 밀도) 옵션을 선택하고 가장 중요한 Limit to threshold(임계값 제한) 옵션을 선택하여 배경 노이즈를 제외합니다(그림 2G).
- Analyze > Measure(분석 측정)를 선택하여 결과 테이블을 얻습니다(그림 2H).
- 결과를 그룹화하고 통계 소프트웨어를 사용하여 통계 분석을 수행합니다. 우리의 경우, 5xFAD 형질전환 마우스의 해마와 피질의 철분 축적을 음성 대조군(야생형 마우스)의 철분 축적과 비교했습니다. 3개 그룹 비교의 경우, 표준 편차가 동일한 가우스 분포의 데이터에 대해 일원 분산 분석(ANOVA)이 사용되었습니다.
결과
AD의 마우스 모델에서 철의 분포 및 축적을 조사하기 위해 8개월 된 5xFAD 마우스의 시상 절편에서 Perls'/DAB 염색을 수행했습니다. 그림 3에서 볼 수 있듯이, Perls'/DAB 염색 신호는 8개월 된 5xFAD 및 야생형 마우스와 2개월 된 야생형 마우스에서 관찰되었습니다. 5xFAD 마우스에서 높은 Perls'/DAB 염색 신호가 해마와 피질, 특히 해마의 하부에서 관찰되었습니다. 야생형 마우스는 검증된 음성 대조군으로 작용했습니다. 2개월 및 8개월 된 코호트 모두 유의하게 약화된 철 증착 신호를 보였으며(그림 3A), 검출 가능하지만 유의하지 않은 연령 진행 축적 추세를 보였습니다. 40× 배율 하에서 5xFAD 마우스의 신호는 이전 연구 9,10과 일치하는 Aβ 플라크와 같은 구조에서 관찰되었습니다(그림 3B). 4× 배율 이미지는 5xFAD 마우스의 뇌에서 철 염색의 분포를 조사하기 위해 스티칭되었습니다. Perls/DAB 염색 신호는 다른 영역보다 피질, 해마 및 소뇌에서 분명히 더 강했습니다. (그림 3C). 각 상태 및 연령 그룹에 있는 3마리의 마우스 각각에서 대뇌 피질의 3개 섹션과 3개의 해마를 정량화를 위해 선택했습니다. 8개월 된 5xFAD 마우스의 철 침착은 같은 나이의 야생형 대조군보다 유의하게 높았습니다. 생후 2개월과 8개월 된 야생형 마우스의 신호 밀도를 비교했을 때, 이 두 연령 사이에 철 축적에 큰 차이가 없음을 발견했습니다(그림 3D). 이러한 결과는 철 검출을 위한 조직화학적 기법으로서 Perls/DAB 염색의 효과를 보여줍니다. 그림 4는 염색에 실패한 두 가지 사례를 보여줍니다. 뇌 절편을 DAB 용액에 너무 오래 방치하면 과도한 배경색이 발생합니다(그림 4A). 부적절한 탈수로 인해 섹션이 접히게 됩니다(그림 4B).
그림 1: 이미징 소프트웨어의 매개변수 설정. (A) 소프트웨어의 매개변수 설정(노출, 게인 및 대비)을 10× 대물렌즈에서 조정하고 해마에 초점을 맞춥니다. (B) 10× 목표에 대한 자세한 매개변수 설정. (C) 40× 목표에 대한 자세한 매개변수 설정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: Perls/DAB 염색 결과의 데이터 처리. (A) ImageJ/Fiji의 메뉴에서 Plugins > stitching > Grid/Collection stitching을 선택한 다음 Unknown position을 선택하여 스티칭할 이미지를 선택합니다. (B) 파일 > 다른 이름으로 저장을 선택합니다> Tiff를 선택하여 완성된 이미지를 TIFF로 저장합니다. (C) ImageJ/Fiji를 사용하여 이미지를 열고 이미지 형식이 RGB 색상인지 확인합니다. (D) Plugins > IHC Profiler Image를 선택한 다음 Mode > Cytoplasmic Stained Image 및 Color Deconvolution default H DAB를 선택합니다. (E) Analyze > Calibrate > Uncalibrated OD를 선택하여 이미지의 회색 값을 OD 값으로 변환합니다. (F) 임계값 기능을 사용하여 Perls의 양수 영역을 선택한 다음 모든 신호 지점이 덮일 때까지 수평 스크롤 막대를 조정합니다. (G) Analyze(분석) > Set Measurements(측정 설정)를 클릭하고 Area(영역), Mean gray value(평균 회색 값), Integrated density(통합 밀도) 및 Limit to threshold(임계값 제한)에 대한 옵션을 선택하여 배경 소음을 제외합니다. (통합 밀도 = 면적 × 평균). (H) Analyze > Measure를 선택하여 결과 테이블을 얻습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
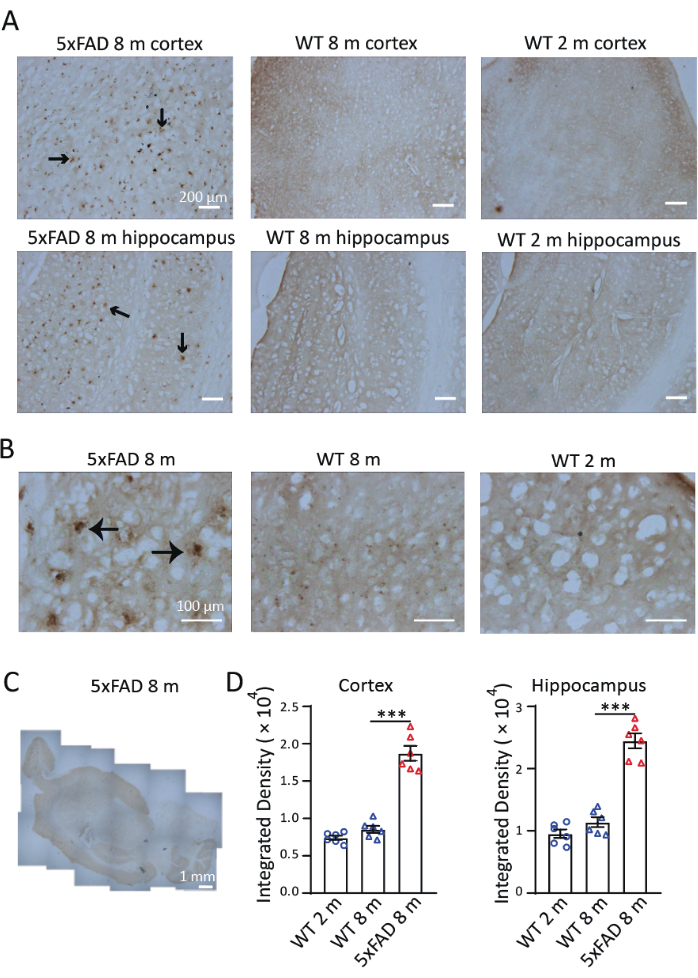
그림 3: 5xFAD 마우스와 야생형(WT) 마우스의 뇌에서 대표적인 Perls'/DAB 염색. (A) 생후 8개월 된 5xFAD 마우스의 해마 및 피질의 종방향 부분에서 강력한 Perls'/DAB 신호와 비교하여 2개월 및 8개월 된 야생형 마우스의 염색과 비교. (B) Perls'/DAB 신호는 Aβ 플라크 주위, 특히 해마에서 밀집되어 있었습니다. (C) 5xFAD 마우스 뇌에서 Perls'/DAB 신호의 분포를 보여주는 스티칭된 세로 이미지. (D) 2개월 된 WT, 8개월 된 WT 및 8개월 된 5xFAD 마우스의 피질 또는 해마에서 Perls'/DAB 신호의 통계적 분석. 일원 분산 분석, ***, P < 0.001. 배율 막대가 이미지에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: Perls'/DAB 염색에 실패한 두 가지 사례. (A) 과도한 DAB 강화로 인해 과도하게 착색된 Perls'/DAB 염색. (B) 부적절한 탈수로 인해 뇌 부분의 가장자리가 말려 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
철분 침착은 알츠하이머병과 밀접한 관련이 있습니다. 한편으로는, 아밀로이드 전구체 단백질의 발현 증가를 포함한 여러 메커니즘을 통해 Aβ 생성을 유도할 수 있으며[참고:20}23], Aβ 생성을 가속화할 수 있는 향상된 γ-세크레타제 활성을 유발할 수 있습니다24; 다른 한편으로는, 철분 증가에 의해 유도된 지질 과산화는 타우 중합을 촉진할 수 있으며, 이는 또한 뉴런에서 타우 단백질의 비정상적인 인산화를 증가시킬 수 있습니다25. Perls의 프러시안 블루 염색은 생물학적 표본에서 철(Fe3+) 침전물을 선택적으로 시각화하기 위한 잘 정립된 조직화학적 기술입니다. 철은 페로시아나이드와 반응하여 청색 페로시아나이드(프러시안 블루)를 생성합니다14. Perls'/DAB staining은 전통적인 Perls의 staining을 변형한 것입니다. 반응하는 샘플은 DAB(디아미노 벤제나민)를 함유한 용액으로 옮겨져 프러시안 블루가 갈색 화합물을 형성합니다. 이 방법을 사용하여 5xFAD 마우스의 뇌 내 철 축적의 공간적 분포를 관찰하고 AD 모델 마우스와 야생형 마우스의 철 축적을 정량적으로 비교했습니다.
이 프로토콜에서는 Perls/DAB 염색이 병리학적 철 침착을 평가하는 데 실현 가능하고 효과적임을 입증합니다. 이상적인 결과를 얻으려면 몇 가지 팁에 유의해야 합니다. 첫째, 무철분 시약과 도구, 특히 무철 염산을 사용하여 배경 염색을 줄여야 합니다. 칼륨 페로시안화물과 염산은 새로 준비해야 합니다. 슬라이드에 남아 있는 여분의 용액은 제거해야 하며, 순수한 알코올과 자일렌을 사용하여 철저한 탈수를 보장해야 합니다. 이미징 중에 자동 화이트 밸런스를 사용하면 분석이 부정확해질 수 있습니다. 영상의 회색 값을 조직화학적 신호의 밀도에 해당하는 OD 값으로 변환해야 한다는 점을 기억하십시오.
여기에 설명된 방법은 염색의 특이성을 향상시키고 철분 수치가 낮은 조직에서 특히 유용합니다. DAB 염색은 현미경 검사 및 이미지 분석에 중요한 고대비 신호를 생성합니다. 요약하면, Perls/DAB 염색은 기존 Perls의 염색보다 더 강한 신호와 더 나은 배경 대비를 제공하여 철 검출의 감도와 정확도를 높입니다. 또한, Perls의 염색은 느슨하게 결합된 단백질 복합체(헤모시데린에서와 같이)에서만 철을 검출합니다21. 헤모글로빈과 같이 강하게 결합된 철은 반응하지 않습니다. 이렇게 하면 적혈구의 철분과 헤모글로빈으로 인해 발생하는 원치 않는 신호가 크게 줄어듭니다.
그러나 Perls/DAB 염색에는 몇 가지 제한 사항이 있습니다. 예를 들어, DAB 염색은 긍정적인 결과의 관찰을 방해할 수 있는 일부 비특이적 배경 염색을 초래합니다. 또한 염색 공정에는 시간과 농도를 모두 정밀하게 제어해야 합니다. 그렇지 않으면 염색이 고르지 않거나 신호 강도가 충분하지 않을 수 있습니다. 또한 염색 반응은 뉴런(neuron)보다는 희소돌기아교세포(oligodendrocyte)에서 주로 나타나는 것으로 보고되었다26.
Perls'/DAB 염색은 중간 특이성과 민감도가 필요한 병리학 연구에 적합합니다. 이 방법은 MRI 또는 FAAS보다 철분 축적을 시각화하고 정량화하는 데 시간과 비용이 적게 드는 방법을 연구자에게 제공합니다. 다양한 세포 유형과 세포 내 구조에서 철 축적의 분포를 추가로 조사하려면 뉴런 및 신경교세포에 대한 마커와 함께 공동 염색해야 합니다. 전반적으로 Perls/DAB 염색은 AD 병리학의 탐구를 가속화하고 철 대사와 관련된 치료제 연구를 촉진할 것입니다.
공개
이 연구는 중국 자연과학재단(Natural Science Foundation of China)의 일반 프로젝트(보조금 번호: 32271010)의 지원을 받았습니다.
감사의 말
이 작업을 준비하는 동안 저자는 언어와 가독성을 향상시키기 위해 DeepSeek를 사용했습니다. 이 도구/서비스를 사용한 후 저자는 필요에 따라 콘텐츠를 검토 및 편집했으며 출판물 콘텐츠에 대한 전적인 책임을 집니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.1 M PBS | biosharp | BL601A | Add deionized water to make solution |
| 4% PFA | Beyotime | P0099 | Restore at 4 °C for use |
| 20X DAB solution | Bioss | C-0003 | Mix 10 μl solution A, 10 μl solution B and 180 μl PBS |
| Alcohol | Supelco | 107017 | |
| HCL | Sigma | 7647-01-0 | Add distilled water to 50 ml |
| ketamine | China National Medicines | H20193336 | 100 mg/kg for anesthetizing |
| Microscope | Olympus | CX43 | |
| Optimal cutting temperature compound (OCT) | Sakura Finetek | 4583 | |
| potassium ferrocynide solution | Sigma | 14038-43-8 | Add distilled water to 50 ml |
| Sucrose | Sigma | 57-50-1 | |
| xylazine | Y-S Biotechnology | YS-(BC)-2842 | 15 mg/kg for anesthetizing |
| Xylenes | Sigma | 1330-20-7 |
참고문헌
- Karlawish, J., Jack, C. R., Rocca, W. A., Snyder, H. M., Carrillo, M. C. Alzheimer's disease: The next frontier-special report 2017. Alzheimer's Dement. 13 (4), 374-380 (2017).
- Praticò, D. Oxidative stress hypothesis in Alzheimer's disease: A reappraisal. Trends in Pharmacol Sci. 29 (12), 609-615 (2008).
- Sayre, L. M., et al. In situ oxidative catalysis by neurofibrillary tangles and senile plaques in alzheimer's disease. J. Neurochem. 74 (1), 270-279 (2001).
- Urrutia, P., et al. Inflammation alters the expression of dmt1, fpn1 and hepcidin, and it causes iron accumulation in central nervous system cells. J. Neurochem. 126 (4), 541-549 (2013).
- Hardy, J., Selkoe, D. J. The amyloid hypothesis of Alzheimer's disease: Progress and problems on the road to therapeutics. Science. 297 (5580), 353-356 (2002).
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Ficiarà, E., Munir, Z., Boschi, S., Caligiuri, M. E., Guiot, C. Alteration of iron concentration in alzheimer's disease as a possible diagnostic biomarker unveiling ferroptosis. Int J Mol Sci. 22 (9), 4479(2021).
- Yang, W. S., Stockwell, B. R. Ferroptosis: Death by lipid peroxidation. Trends in Cell Biol. 26 (3), 165-176 (2016).
- Lane, D. J. R., et al. Iron and Alzheimer's disease: An update on emerging mechanisms. J Alzheimers Dis. 64 (s1), S379-S395 (2018).
- Meadowcroft, M. D., Connor, J. R., Smith, M. B., Yang, Q. X. Mri and histological analysis of beta-amyloid plaques in both human Alzheimer's disease and app/ps1 transgenic mice. J Magn Reson Imaging. 29 (5), 997-1007 (2009).
- Winterbourn, C. C. Toxicity of iron and hydrogen peroxide: The Fenton reaction. Toxicol Lett. 82-83, 969-974 (1995).
- Silvestri, L., Camaschella, C. A potential pathogenetic role of iron in Alzheimer's disease. J Cell Mol Med. 12 (5a), 1548-1550 (2008).
- Gamblin, T. C., King, M. E., Kuret, J., Berry, R. W., Binder, L. I. Oxidative regulation of fatty acid-induced tau polymerization. Biochemistry. 39 (46), 14203-14210 (2000).
- Meguro, R., et al. Nonheme-iron histochemistry for light and electron microscopy: A historical, theoretical and technical review. Arch Histol Cytol. 70 (1), 1-19 (2007).
- Lehéricy, S., Roze, E., Goizet, C., Mochel, F. Mri of neurodegeneration with brain iron accumulation. Curr Opin Neurol. 33 (4), 462-473 (2020).
- Nabuurs, R. J. A., et al. High-field MRI of single histological slices using an inductively coupled, self-resonant microcoil: Application to ex vivo samples of patients with Alzheimer's disease. NMR Biomed. 24 (4), 351-357 (2010).
- Perl, D. P., Good, P. F. Comparative techniques for determining cellular iron distribution in brain tissues. Ann Neurol. 32 (S1), S76-S81 (1992).
- Riemer, J., Hoepken, H. H., Czerwinska, H., Robinson, S. R., Dringen, R. Colorimetric ferrozine-based assay for the quantitation of iron in cultured cells. Anal Biochem. 331 (2), 370-375 (2004).
- Luterotti, S., Kordić, T., Dodig, S. Simultaneous determination of iron and copper in children's sera by FAAS. Acta Pharm. 61 (1), 93-102 (2011).
- Hill, J. M., Switzer, R. C. The regional distribution and cellular localization of iron in the rat brain. Neuroscience. 11 (3), 595-603 (1984).
- Meguro, R., Asano, Y., Iwatsuki, H., Shoumura, K. Perfusion-perls and -turnbull methods supplemented by dab intensification for nonheme iron histochemistry: Demonstration of the superior sensitivity of the methods in the liver, spleen, and stomach of the rat. Histochem Cell Biol. 120 (1), 73-82 (2003).
- Liu, C., et al. S-nitrosylation of divalent metal transporter 1 enhances iron uptake to mediate loss of dopaminergic neurons and motoric deficit. J Neurosci. 38 (39), 8364-8377 (2018).
- Guillemot, J., Canuel, M., Essalmani, R., Prat, A., Seidah, N. G. Implication of the proprotein convertases in iron homeostasis: Proprotein convertase 7 sheds human transferrin receptor 1 and furin activates hepcidin. Hepatology. 57 (6), 2514-2524 (2013).
- Li, X., et al. Ferritin light chain interacts with pen-2 and affects γ-secretase activity. Neurosci Lett. 548, 90-94 (2013).
- Jin Jung, K., et al. Oxidative stress induces inactivation of protein phosphatase 2a, promoting proinflammatory nf-κb in aged rat kidney. Free Radic Biol Med. 61, 206-217 (2013).
- Connor, J. R., Menzies, S. L., Martin, S. M. S., Mufson, E. J. Cellular distribution of transferrin, ferritin, and iron in normal and aged human brains. J Neurosci Res. 27 (4), 595-611 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유