Method Article
Évaluation du dépôt de fer dans le cerveau de souris 5xFAD par coloration Perls/DAB
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole présente des méthodes permettant d’évaluer la distribution et la quantité des dépôts de fer dans les tissus, en particulier le cerveau. Le protocole détaille les procédures de préparation des échantillons, de coloration Perls/DAB, de capture d’images et d’analyse des données.
Résumé
La maladie d’Alzheimer (MA), une maladie neurodégénérative courante, est la principale cause de démence chez les personnes âgées. Les dépôts de fer sont étroitement liés à la pathogenèse de la maladie d’Alzheimer. Dans le cerveau de la MA, des niveaux élevés de fer sont fortement corrélés avec des pathologies caractéristiques de la MA, notamment les plaques β-amyloïdes, les enchevêtrements neurofibrillaires tau et l’apoptose. De plus en plus de preuves suggèrent que le stress oxydatif, dû à un métabolisme du fer dérégulé, joue un rôle important dans la physiopathologie de la MA. Comprendre le rôle de l’accumulation de fer dans la pathologie de la MA est donc essentiel pour traiter la MA. Un protocole complet de coloration du fer est essentiel pour détecter l’expression et la distribution du fer dans le cerveau. Ce protocole vise à décrire une méthode permettant d’évaluer la quantité et la distribution des dépôts de fer dans le cerveau. Nous décrivons les processus impliqués dans la préparation des réactifs, le traitement des souris et la préparation des coupes cérébrales. De plus, nous présentons un protocole détaillé étape par étape pour la détection histochimique du fer dans les coupes de tissus cérébraux, accompagné d’un cadre analytique systématique intégrant à la fois l’évaluation quantitative et l’évaluation morphologique pour assurer une interprétation complète des résultats de la coloration. Ce protocole expérimental aidera les chercheurs à comprendre les dépôts de fer dans le cerveau et soutiendra la recherche sur la MA.
Introduction
La maladie d’Alzheimer (MA) est la maladie neurodégénérative la plus courante et est devenue un problème grave pour la société. La prévalence de la MA augmente considérablement avec l’âge de1, 2, 3 et 4 ans. Les principales caractéristiques pathologiques de la maladie d’Alzheimer (MA) comprennent le dépôt de plaques β-amyloïdes (Aβ) et d’enchevêtrements neurofibrillaires (NFT) dus à la phosphorylation aberrante des protéines tau. Aβ est généré par le clivage séquentiel de la protéine précurseur de l’amyloïde (APP) par les enzymes β-sécrétase et γ-sécrétase. La dérégulation de la production ou de l’élimination d’Aβ conduit à son accumulation dans le cerveau, formant des plaques amyloïdes, qui sont reconnues comme l’un des premiers marqueurs pathologiques de la MA. Ces plaques causent non seulement des dommages neuronaux directs, mais déclenchent également une cascade d’effets néfastes, notamment la neuroinflammation, le stress oxydatif et le dysfonctionnement synaptique. Collectivement, ces processus contribuent à la mort neuronale et au déclin cognitif progressif observé dans AD5. Malgré des décennies de recherche ciblant principalement les caractéristiques pathologiques de la maladie d’Alzheimer (MA), notamment le dépôt de plaques β amyloïde et l’agrégation hyperphosphorylée de la protéine tau, les percées thérapeutiques cliniquement significatives restent insaisissables, les interventions existantes démontrant une efficacité limitée pour modifier la progression de la maladie6.
Le fer est un métal important pour le maintien de la fonction cérébrale et est impliqué dans le transport de l’oxygène, la synthèse de l’ADN, la respiration mitochondriale, la synthèse de la myéline, la synthèse des neurotransmetteurs et le métabolisme. Cependant, le fer devient nocif lorsque les concentrations dépassent la capacité de séquestration cellulaire 6,7,8. Une augmentation des dépôts de fer, généralement co-localisée avec les plaques Aβ, a été observée dans les régions corticales et hippocampiques du cerveau chez les patients atteints de la MA 9,10. Grâce à la réaction de Fenton11, le fer libre intracellulaire peut générer des radicaux hydroxyles (•OH) ainsi que des espèces réactives de l’oxygène. Ces substances nocives induisent non seulement une neuroinflammation en activant les cellules gliales, mais attaquent également les biomolécules de la cellule par le biais du stress oxydatif, perturbant la fonction cellulaire normale et entraînant un dysfonctionnement synaptique 8,12. De plus, l’augmentation du fer est directement impliquée dans le développement des signes pathologiques de la MA : le fer contribue à la production de Aβ12 et augmente également le dysfonctionnement de la protéine tau, entraînant des enchevêtrements neurofibrillaires13.
Plusieurs techniques ont été développées pour évaluer la teneur en fer dans le cerveau, notamment l’imagerie par résonance magnétique (IRM), ainsi que des méthodes chimiques et histochimiques14. La quantification in vivo des taux de fer intracérébral à l’aide de l’IRM est cliniquement importante pour les patients vieillissants et atteints de neurodégénérescence15. L’IRM a l’avantage d’être non invasive et très sensible : elle permet de détecter les dépôts de fer dès les premiers stades de la maladie. En particulier, la technique d’augmentation R2 dépendante du champ (FDRI) permet de distinguer différentes formes de fer, telles que la ferritine et l’hème-fer16. Cependant, l’IRM ne peut pas détecter l’accumulation de fer au niveau cellulaire, et elle est coûteuse, elle est donc principalement utilisée dans les investigations cliniques17.
La mesure colorimétrique est une méthode chimique qui détermine la concentration d’une substance (comme le fer) en mesurant l’intensité de la couleur produite par la réaction de la substance en solution avec un agent chromogène18. Cette méthode est facile à mettre en œuvre et utilise des réactifs et des instruments peu coûteux, ce qui la rend adaptée aux laboratoires disposant de budgets limités18. Cependant, la précision et la sensibilité de cette méthode sont très limitées, car les résultats sont soumis à l’influence de facteurs environnementaux, du temps de développement des couleurs et du jugement subjectif de l’opérateur. La spectrométrie d’absorption atomique de flamme (FAAS) est une autre méthode qui peut être utilisée pour évaluer les niveaux de fer19. Dans cette méthode, une solution d’échantillon clarifiée est obtenue en brûlant le tissu d’intérêt dans un four à haute température. L’échantillon est ensuite dissous à l’aide d’acide chlorhydrique, et la concentration de fer dans la solution est déterminée par spectrométrie d’absorption atomique. Cette méthode est très sensible et convient à tous les types d’échantillons biologiques19. Cependant, le processus prend du temps et nécessite un équipement coûteux, de sorte que son utilisation est limitée.
La coloration Perls/DAB pour détecter la fonte ferrique non héminique est la méthode de détection du fer la plus couramment utilisée en raison de sa grande spécificité et de sa facilité de mise en œuvre par rapport à d’autres méthodes histochimiques14. Contrairement à l’analyse colorimétrique, la coloration de Perls est une méthode de coloration histochimique qualitative qui repose sur la réaction entre les ions fer et le ferrocyanure de potassium pour générer un précipité bleu. Il est utilisé pour visualiser au microscope la présence et la distribution du fer dans les tissus. De plus, cette méthode nous permet de distinguer les dépôts de fer dans différents types de cellules et d’observer la distribution subcellulaire des dépôts de fer, fournissant une méthode pour l’étude de20 après JC. La coloration de Perls détecte principalement la fonte ferrique non héminique et dépend de la formation du complexe du bleu de Prusse :

(Bleu de Prusse)
Cependant, la coloration traditionnelle de Perls est inefficace pour détecter la localisation du fer à de faibles niveaux de fer. Lorsque la diaminobenzidine (DAB) est ajoutée, elle réagit avec l’hexacyanoferrate ferrique pour former un composé brun, augmentant ainsi la spécificité du test21.
L’objectif de ce protocole est de décrire comment évaluer la quantité et la distribution des dépôts de fer dans le cerveau d’un modèle murin de MA. Dans ce protocole, des souris transgéniques 5×FAD (C57BL/6J) âgées de 8 mois ont été utilisées comme modèle de souris MA et ont été comparées à des souris de type sauvage du même âge. Les détails des procédures de préparation du réactif chimique, de section du cerveau, d’exécution de la coloration Perls/DAB et d’analyse des images prises après la coloration sont présentés ici.
Protocole
Toutes les procédures ont été effectuées conformément aux directives du Comité institutionnel de soin et d’utilisation des animaux de l’Université de médecine de Xuzhou et aux réglementations gouvernementales chinoises pour le soin et l’utilisation des animaux de laboratoire.
1. Perfusion d’animaux
- Préparez le fixateur : Dissoudre 4 % de paraformaldéhyde (PFA) dans une solution saline tamponnée au phosphate (PBS) à 1× (voir tableau 1).
- Anesthésier la souris par injection intrapéritonéale de kétamine (100 mg/kg) et de xylazine (15 mg/kg). Une fois la souris anesthésiée, fixez-la au plateau de chirurgie de perfusion à l’aide de quatre broches pour fixer les membres.
ATTENTION : Pour assurer une anesthésie appropriée, vérifiez la perte de réponses au pincement des orteils, la relaxation des muscles des membres et la respiration profonde, lente et régulière. - Ouvrez la poitrine avec des ciseaux pour exposer le cœur et coupez l’oreillette droite. Injecter 20 ml de PBS 1× dans le ventricule gauche à l’aide d’une seringue pour évacuer le sang. Ensuite, injectez 20 mL de PFA à 4 % pour la fixation.
REMARQUE : Contrôlez la profondeur et la direction de l’aiguille pour éviter de percer le septum interventriculaire. N’oubliez pas qu’une perfusion optimale se caractérise par un foie pâle et des membres raides après le tremblement initial. - Décapitez la souris perfusée, coupez l’os autour du crâne avec une paire de ciseaux fins, soulevez le crâne avec précaution à l’aide d’une pince émoussée et extrayez le cerveau. Ensuite, faites tremper le cerveau dans du PFA à 4 % à 4 °C pendant la nuit.
ATTENTION : Soyez prudent avec 4 % de PFA, qui est un puissant irritant respiratoire. Portez un masque approprié et effectuez cette étape dans une hotte.
REMARQUE : La méthode d’euthanasie a été approuvée par l’IACUC du programme de soins et d’utilisation des animaux de l’Université médicale de Xuzhou Directives d’euthanasie : souris / rats.
2. Cryosection cérébrale
- Déshydrater le cerveau avec des solutions de saccharose graduées (15 % et 30 %) à 4 °C pendant 24 h pour chaque étape. Le cerveau devrait finalement couler au fond de la solution de saccharose.
- Hemisectez le cerveau le long de la fissure interhémisphérique avec un scalpel. Placez la moitié gauche dans un tube de microcentrifugation de 5 mL rempli de 1 mL de solution de saccharose à 30 % et d’un volume égal de composé à température de coupe optimale (OCT) pour améliorer le contact entre l’OCT et le cerveau.
- Coupez les tissus étrangers de l’hémisphère gauche à l’aide d’une lame de rasoir et déplacez-les vers la plate-forme OCT.
- Encastrez le tissu dans l’OCT à l’aide d’une paroi circulaire en feuille d’aluminium.
- Congelez le tissu dans un microtome cryostatique à −22 °C pendant au moins 1 h et réglez la température de la tête de coupe à −19 °C.
REMARQUE : N’oubliez pas de prérefroidir le verre anti-roulis et les brosses dans le cryostat avec l’échantillon. - Montez le bloc de tissu congelé. Coupez à nouveau le bloc de tissu à une position appropriée en fonction de la zone d’intérêt, puis commencez à sectionner le cerveau en sections sagittales de 20 μm d’épaisseur.
REMARQUE : Si les sections se plient, utilisez des brosses douces pour déplier les sections. - Prélevez chaque section sur les lames recouvertes de gélatine et étalez une goutte de 1× PBS dessus. Retournez la section du cerveau à l’aide d’un pinceau fin, puis montez rapidement la section sur la diapositive.
- Séchez les sections collectées à température ambiante pendant la nuit et conservez-les à −20 °C.
REMARQUE : Le protocole peut être mis en pause ici jusqu’à 2 semaines. Une durée de stockage plus longue peut interférer avec la qualité des tissus et ainsi influencer le résultat de l’expérience.
3. Coloration Perls/DAB
- Préparez les solutions suivantes : du ferrocyanure de potassium à 2 % (K4[Fe(CN)6]·3H2O), de l’acide chlorhydrique (HCI) à 2 % et une solution de DAB à 20 × (voir le tableau 1).
- Placez une lame contenant des sections dans un bocal de coloration rempli de PBS 1× et placez le bocal sur un agitateur orbital pendant 5 minutes pour éliminer l’OCT du tissu.
REMARQUE : Ajustez soigneusement la vitesse de l’agitateur orbital (vitesse recommandée : 20 tr/min) pour éviter que les tissus ne tombent de la glissière à grande vitesse. - Mélanger 20 mL de solution de ferrocyanure de potassium à 2 % et un volume égal d’acide chlorhydrique à 2 % dans un tube à centrifuger de 50 mL.
- À l’aide d’une pince en plastique, transférez la lame dans le tube de 50 ml, puis chauffez le tube dans un bain-marie à 60 °C pendant 30 min.
- Rincez la lame avec 1× de PBS et épongez tout excès de solution avec du papier de soie.
- À l’aide d’une pipette, ajoutez 50 μL de solution de DAB dans chaque section de cerveau et incubez pendant 10 min à température ambiante.
- Aspirez l’excès de solution DAB à l’aide d’une pipette puis lavez la lame 3 fois dans du PBS.
- Déshydratez les sections avec des solutions d’alcool graduées (50 %, 70 %, 95 %, 100 %) et du xylène (100 %, 100 %). Incuber les lames pendant 3 min chacune.
- Scellez les sections avec de la gomme neutre22 , puis placez la lamelle.
- Faites sécher les lames dans une hotte pendant 24 h avant de les ranger dans une boîte à lames de microscope.
4. Imagerie
- Allumez le microscope, ajustez la luminosité de la source lumineuse et faites la mise au point sur la section du cerveau sous un objectif de grossissement de 4×.
- Capturez l’image avec le logiciel de contrôle de l’appareil photo et ajustez les paramètres pour éviter la surexposition. Les réglages spécifiques (objectif 10×, 40×) sont illustrés à la figure 1.
REMARQUE : Évitez d’utiliser la balance des blancs automatique pour garantir le même temps d’exposition pour chaque image. - Passez à un objectif à grossissement de 10×, déplacez la platine du microscope pour faire la mise au point sur les zones présentant des signaux de coloration Perls/DAB élevés, en particulier l’hippocampe et le cortex cérébral, et capturez des images (Figure 1A).
- Passez à un objectif de grossissement 40x pour capturer des images avec des signaux de coloration clairs.
- Enregistrez chaque image au format TIFF 8 bits et exportez-les pour une analyse plus approfondie.
5. Analyse d’images
- Dans ImageJ/Fiji, sélectionnez Plugins > l’assemblage > l’assemblage Grid/Collection dans le menu, puis sélectionnez Position inconnue pour choisir les images à assembler (Figure 2A).
- Choisissez Fichier > Enregistrer sous > Tiff pour enregistrer l’image finale au format TIFF (Figure 2B).
- Utilisez ImageJ/Fiji pour ouvrir une image et assurez-vous que le format d’image est RVB Couleur (Figure 2C).
- Sélectionnez Plugins > IHC Profiler Image dans le menu, puis choisissez Mode > Image colorée cytoplasmique et la valeur par défaut de déconvolution des couleurs H DAB (Figure 2D). Convertissez ensuite le format d’image en niveaux de gris 8 bits.
- Convertissez les valeurs de gris de l’image en valeurs de diamètre extérieur en sélectionnant Analyser > Calibrer > Diamètre extérieur non calibré (Figure 2E).
- Utilisez la fonction Threshold pour sélectionner la zone de coloration Perls/DAB positive, puis ajustez les barres de défilement horizontales jusqu’à ce que tous les points de signal bruns soient recouverts de rouge (Figure 2F).
- Cliquez sur Analyser > Définir les mesures, puis sélectionnez les options Surface, Valeur de gris moyenne, Densité intégrée et, surtout, Limiter au seuil pour exclure le bruit de fond (Figure 2G).
- Sélectionnez Analyser > Mesure pour obtenir le tableau des résultats (Figure 2H).
- Regroupez les résultats et utilisez un logiciel statistique pour effectuer des analyses statistiques. Dans notre cas, nous avons comparé l’accumulation de fer dans l’hippocampe et le cortex de souris transgéniques 5xFAD avec celle du contrôle négatif (souris de type sauvage). Pour les comparaisons à trois groupes, l’analyse de variance à un facteur (ANOVA) a été utilisée pour les données de la distribution gaussienne avec le même écart-type.
Résultats
Pour étudier la distribution et l’accumulation du fer dans un modèle murin de MA, nous avons effectué une coloration Perls/DAB dans des tranches sagittales de souris 5xFAD âgées de 8 mois. Comme le montre la figure 3, des signaux de coloration Perls/DAB ont été observés chez des souris 5xFAD et de type sauvage âgées de 8 mois et chez des souris de type sauvage âgées de 2 mois. Chez les souris 5xFAD, des signaux de coloration Perls/DAB élevés ont été observés dans l’hippocampe et le cortex, en particulier dans le subiculum de l’hippocampe. Des souris de type sauvage ont servi de contrôles négatifs validés ; Les cohortes de 2 et de 8 mois présentaient des signaux de dépôt de fer significativement atténués (figure 3A), avec des tendances d’accumulation progressives selon l’âge, détectables mais non significatives. Sous un grossissement de 40×, les signaux chez les souris 5xFAD ont été observés dans des structures Aβ ressemblant à des plaques, conformément aux études précédentes 9,10 (Figure 3B). Les images d’agrandissement de 4× ont été assemblées pour examiner la distribution de la coloration du fer dans le cerveau des souris 5xFAD. Les signaux de coloration Perls/DAB étaient clairement plus forts dans le cortex, l’hippocampe et le cervelet que dans d’autres régions. (Figure 3C). Trois sections du cortex cérébral et trois de l’hippocampe de chacune des trois souris de chaque condition et groupe d’âge ont été sélectionnées pour la quantification. Les dépôts de fer chez les souris 5xFAD âgées de 8 mois étaient significativement plus élevés que chez les témoins de type sauvage du même âge. En comparant la densité du signal chez des souris de type sauvage âgées de 2 mois et de 8 mois, nous n’avons trouvé aucune différence significative dans l’accumulation de fer entre ces deux âges (Figure 3D). Ces résultats démontrent l’efficacité de la coloration Perls/DAB en tant que technique histochimique pour la détection du fer. La figure 4 montre deux cas d’échec de la coloration. Une coloration de fond excessive se produira si les sections du cerveau sont laissées trop longtemps dans la solution DAB (Figure 4A). Une déshydratation inappropriée entraînera des sections pliées (figure 4B).
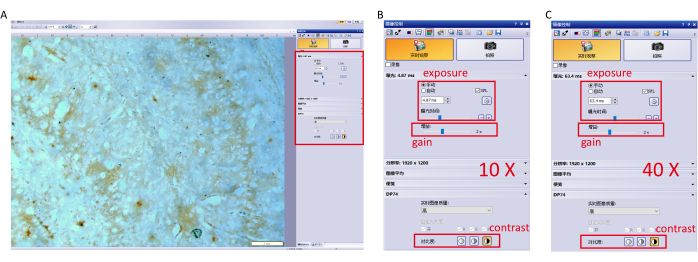
Figure 1 : Réglage des paramètres du logiciel d’imagerie. (A) Ajustez les paramètres du logiciel (exposition, gain et contraste) à 10×objectif et mise au point sur l’hippocampe. (B) Réglages détaillés des paramètres pour un objectif de 10×. (C) Réglages détaillés des paramètres pour un objectif de 40×. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Traitement des données des résultats de coloration Perls/DAB. (A) Dans ImageJ/Fiji, sélectionnez Plugins > l’assemblage > l’assemblage Grid/Collection dans le menu, puis sélectionnez Position inconnue pour choisir les images à assembler. (B) Choisissez Fichier > Enregistrer sous> Tiff pour enregistrer l’image finie au format TIFF. (C) Utilisez ImageJ/Fiji pour ouvrir une image et assurez-vous que le format de l’image est RVB Color. (D) Sélectionnez Plugins > IHC Profiler Image, puis choisissez le mode > Image colorée cytoplasmique et la déconvolution des couleurs par défaut H DAB. (E) Convertissez les valeurs de gris de l’image en valeurs OD en sélectionnant Analyser > Calibrer > OD non calibré. (F) Utilisez la fonction Seuil pour sélectionner la zone positive de Perls, puis ajustez les barres de défilement horizontales jusqu’à ce que tous les points de signal soient couverts. (G) Cliquez sur Analyser > Définir les mesures, sélectionnez les options Surface, Valeur de gris moyenne, Densité intégrée et Limiter au seuil pour exclure le bruit de fond. (Densité intégrée = aire × moyenne). (H) Sélectionnez Analyser > Mesure pour obtenir le tableau des résultats. Veuillez cliquer ici pour voir une version agrandie de cette figure.
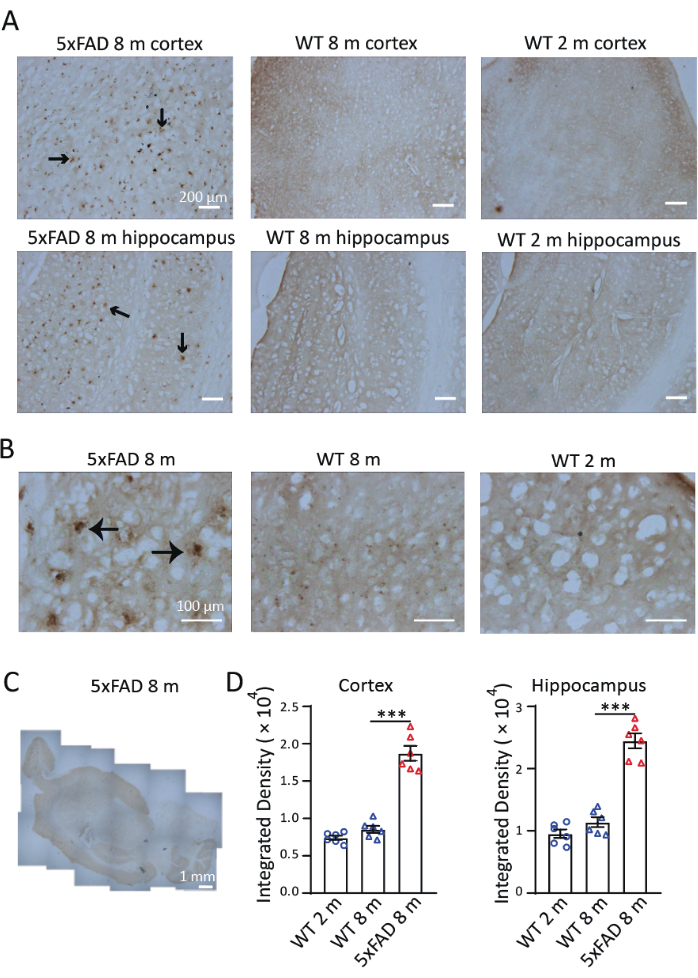
Figure 3 : Coloration représentative de Perls/DAB dans le cerveau de souris 5xFAD et de souris de type sauvage (WT). (A) Signaux Perls/DAB forts dans des sections longitudinales de l’hippocampe et du cortex de souris 5xFAD âgées de 8 mois, comparées à la coloration chez des souris de type sauvage âgées de 2 mois et de 8 mois. (B) Les signaux Perls/DAB ont été regroupés autour des plaques Aβ, en particulier dans l’hippocampe. (C) Une image longitudinale assemblée montrant la distribution des signaux Perls/DAB dans le cerveau d’une souris 5xFAD. (D) Analyse statistique du signal Perls/DAB dans le cortex ou l’hippocampe de souris WT de 2 mois, WT de 8 mois et 5xFAD de 8 mois. ANOVA à un facteur, ***, P < 0,001. Des barres d’échelle sont affichées dans les images. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Deux cas d’échec de la coloration Perls/DAB. (A) Une coloration Perls/DAB surcolorée due à une intensification excessive du DAB. (B) Le bord de la section cérébrale est courbé en raison d’une déshydratation inappropriée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le dépôt de fer est étroitement associé à la maladie d’Alzheimer. D’une part, elle peut conduire à la production d’Aβ par de multiples mécanismes, notamment l’expression accrue de la protéine précurseur de l’amyloïde{NOTE :20}23, et également l’augmentation de l’activité de la γ-sécrétase, qui peut conduire à une production accélérée d’Aβ24 ; D’autre part, la peroxydation lipidique induite par l’augmentation du fer peut favoriser la polymérisation de la protéine tau, ce qui peut également entraîner une augmentation de la phosphorylation anormale de la protéine tau dans les neurones25. La coloration au bleu de Prusse de Perls est une technique histochimique bien établie pour la visualisation sélective des dépôts de fer ferrique (Fe3+) dans les échantillons biologiques. La fonte ferrique réagit avec le ferrocyanure pour produire du ferrocyanure ferrique bleu (bleu de Prusse)14. La coloration Perls/DAB est une modification de la coloration traditionnelle de Perls. Les échantillons réactifs sont transférés dans une solution contenant du DAB (diamino benzénamine), après quoi le bleu de Prusse forme un composé de couleur brune. À l’aide de cette méthode, nous avons observé la distribution spatiale de l’accumulation de fer dans le cerveau de souris 5xFAD et comparé quantitativement l’accumulation de fer chez des souris modèles de la MA et des souris de type sauvage.
Dans ce protocole, nous démontrons que la coloration Perls/DAB est réalisable et efficace pour évaluer les dépôts pathologiques de fer. Pour un résultat idéal, quelques conseils sont à noter. Tout d’abord, des réactifs et des outils sans fer, en particulier de l’acide chlorhydrique sans fer, doivent être utilisés pour réduire les taches de fond. Le ferrocyanure de potassium et l’acide chlorhydrique doivent être fraîchement préparés. La solution supplémentaire laissée sur la lame doit être retirée, et de l’alcool pur et du xylène doivent être utilisés pour assurer une déshydratation complète. Lors de l’imagerie, l’utilisation de la balance des blancs automatique entraînera des analyses imprécises. N’oubliez pas de convertir les valeurs de gris de l’image en valeurs OD, qui correspondent à la densité des signaux histochimiques.
La méthode décrite ici améliore la spécificité de la coloration et est particulièrement utile dans les tissus à faible teneur en fer. La coloration DAB produit un signal de contraste élevé, ce qui est important pour la microscopie et l’analyse d’images. En résumé, la coloration Perls/DAB fournit un signal plus fort et un meilleur contraste d’arrière-plan que la coloration Perls conventionnelle, augmentant la sensibilité et la précision de la détection du fer. De plus, la coloration de Perls ne détecte le fer ferrique que dans les complexes protéiques faiblement liés (comme dans l’hémosidérine)21. Le fer qui est fortement lié, comme dans l’hémoglobine, ne réagit pas. Cela réduit considérablement les signaux indésirables causés par le fer dans les globules rouges et l’hémoglobine.
Cependant, la coloration Perls/DAB présente certaines limitations. Par exemple, la coloration DAB entraîne une coloration de fond non spécifique qui peut interférer avec l’observation de résultats positifs. De plus, le processus de coloration nécessite un contrôle précis du temps et de la concentration ; Sinon, la coloration peut être inégale ou avoir une intensité de signal insuffisante. Il a également été rapporté que la réponse de coloration se situe principalement dans les oligodendrocytes plutôt que dans les neurones26.
La coloration Perls/DAB est appropriée pour les études de pathologie qui nécessitent une spécificité et une sensibilité du milieu. Cette méthode offre aux chercheurs un moyen moins long et moins coûteux de visualiser et de quantifier l’accumulation de fer que l’IRM ou le FAAS. Pour étudier plus en détail la distribution de l’accumulation de fer dans différents types de cellules et de structures subcellulaires, il est nécessaire de procéder à une co-coloration avec des marqueurs pour les neurones et les cellules gliales. Dans l’ensemble, la coloration Perls/DAB accélérera l’exploration de la pathologie de la MA et facilitera la recherche sur les thérapies liées au métabolisme du fer.
Déclarations de divulgation
Cette recherche a été soutenue par un projet général de la Fondation des sciences naturelles de Chine (numéro de subvention : 32271010).
Remerciements
Au cours de la préparation de ce travail, les auteurs ont utilisé DeepSeek afin d’améliorer le langage et la lisibilité. Après avoir utilisé cet outil/service, les auteurs ont révisé et modifié le contenu au besoin et assument l’entière responsabilité du contenu de la publication.
matériels
| Name | Company | Catalog Number | Comments |
| 0.1 M PBS | biosharp | BL601A | Add deionized water to make solution |
| 4% PFA | Beyotime | P0099 | Restore at 4 °C for use |
| 20X DAB solution | Bioss | C-0003 | Mix 10 μl solution A, 10 μl solution B and 180 μl PBS |
| Alcohol | Supelco | 107017 | |
| HCL | Sigma | 7647-01-0 | Add distilled water to 50 ml |
| ketamine | China National Medicines | H20193336 | 100 mg/kg for anesthetizing |
| Microscope | Olympus | CX43 | |
| Optimal cutting temperature compound (OCT) | Sakura Finetek | 4583 | |
| potassium ferrocynide solution | Sigma | 14038-43-8 | Add distilled water to 50 ml |
| Sucrose | Sigma | 57-50-1 | |
| xylazine | Y-S Biotechnology | YS-(BC)-2842 | 15 mg/kg for anesthetizing |
| Xylenes | Sigma | 1330-20-7 |
Références
- Karlawish, J., Jack, C. R., Rocca, W. A., Snyder, H. M., Carrillo, M. C. Alzheimer's disease: The next frontier-special report 2017. Alzheimer's Dement. 13 (4), 374-380 (2017).
- Praticò, D. Oxidative stress hypothesis in Alzheimer's disease: A reappraisal. Trends in Pharmacol Sci. 29 (12), 609-615 (2008).
- Sayre, L. M., et al. In situ oxidative catalysis by neurofibrillary tangles and senile plaques in alzheimer's disease. J. Neurochem. 74 (1), 270-279 (2001).
- Urrutia, P., et al. Inflammation alters the expression of dmt1, fpn1 and hepcidin, and it causes iron accumulation in central nervous system cells. J. Neurochem. 126 (4), 541-549 (2013).
- Hardy, J., Selkoe, D. J. The amyloid hypothesis of Alzheimer's disease: Progress and problems on the road to therapeutics. Science. 297 (5580), 353-356 (2002).
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Ficiarà, E., Munir, Z., Boschi, S., Caligiuri, M. E., Guiot, C. Alteration of iron concentration in alzheimer's disease as a possible diagnostic biomarker unveiling ferroptosis. Int J Mol Sci. 22 (9), 4479(2021).
- Yang, W. S., Stockwell, B. R. Ferroptosis: Death by lipid peroxidation. Trends in Cell Biol. 26 (3), 165-176 (2016).
- Lane, D. J. R., et al. Iron and Alzheimer's disease: An update on emerging mechanisms. J Alzheimers Dis. 64 (s1), S379-S395 (2018).
- Meadowcroft, M. D., Connor, J. R., Smith, M. B., Yang, Q. X. Mri and histological analysis of beta-amyloid plaques in both human Alzheimer's disease and app/ps1 transgenic mice. J Magn Reson Imaging. 29 (5), 997-1007 (2009).
- Winterbourn, C. C. Toxicity of iron and hydrogen peroxide: The Fenton reaction. Toxicol Lett. 82-83, 969-974 (1995).
- Silvestri, L., Camaschella, C. A potential pathogenetic role of iron in Alzheimer's disease. J Cell Mol Med. 12 (5a), 1548-1550 (2008).
- Gamblin, T. C., King, M. E., Kuret, J., Berry, R. W., Binder, L. I. Oxidative regulation of fatty acid-induced tau polymerization. Biochemistry. 39 (46), 14203-14210 (2000).
- Meguro, R., et al. Nonheme-iron histochemistry for light and electron microscopy: A historical, theoretical and technical review. Arch Histol Cytol. 70 (1), 1-19 (2007).
- Lehéricy, S., Roze, E., Goizet, C., Mochel, F. Mri of neurodegeneration with brain iron accumulation. Curr Opin Neurol. 33 (4), 462-473 (2020).
- Nabuurs, R. J. A., et al. High-field MRI of single histological slices using an inductively coupled, self-resonant microcoil: Application to ex vivo samples of patients with Alzheimer's disease. NMR Biomed. 24 (4), 351-357 (2010).
- Perl, D. P., Good, P. F. Comparative techniques for determining cellular iron distribution in brain tissues. Ann Neurol. 32 (S1), S76-S81 (1992).
- Riemer, J., Hoepken, H. H., Czerwinska, H., Robinson, S. R., Dringen, R. Colorimetric ferrozine-based assay for the quantitation of iron in cultured cells. Anal Biochem. 331 (2), 370-375 (2004).
- Luterotti, S., Kordić, T., Dodig, S. Simultaneous determination of iron and copper in children's sera by FAAS. Acta Pharm. 61 (1), 93-102 (2011).
- Hill, J. M., Switzer, R. C. The regional distribution and cellular localization of iron in the rat brain. Neuroscience. 11 (3), 595-603 (1984).
- Meguro, R., Asano, Y., Iwatsuki, H., Shoumura, K. Perfusion-perls and -turnbull methods supplemented by dab intensification for nonheme iron histochemistry: Demonstration of the superior sensitivity of the methods in the liver, spleen, and stomach of the rat. Histochem Cell Biol. 120 (1), 73-82 (2003).
- Liu, C., et al. S-nitrosylation of divalent metal transporter 1 enhances iron uptake to mediate loss of dopaminergic neurons and motoric deficit. J Neurosci. 38 (39), 8364-8377 (2018).
- Guillemot, J., Canuel, M., Essalmani, R., Prat, A., Seidah, N. G. Implication of the proprotein convertases in iron homeostasis: Proprotein convertase 7 sheds human transferrin receptor 1 and furin activates hepcidin. Hepatology. 57 (6), 2514-2524 (2013).
- Li, X., et al. Ferritin light chain interacts with pen-2 and affects γ-secretase activity. Neurosci Lett. 548, 90-94 (2013).
- Jin Jung, K., et al. Oxidative stress induces inactivation of protein phosphatase 2a, promoting proinflammatory nf-κb in aged rat kidney. Free Radic Biol Med. 61, 206-217 (2013).
- Connor, J. R., Menzies, S. L., Martin, S. M. S., Mufson, E. J. Cellular distribution of transferrin, ferritin, and iron in normal and aged human brains. J Neurosci Res. 27 (4), 595-611 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon