Method Article
Evaluación de la deposición de hierro en el cerebro de ratones 5xFAD mediante tinción de Perls/DAB
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo presenta métodos para evaluar la distribución y cantidad de deposición de hierro en los tejidos, especialmente en el cerebro. El protocolo detalla los procedimientos para la preparación de muestras, la tinción de Perls/DAB, la captura de imágenes y el análisis de datos.
Resumen
La enfermedad de Alzheimer (EA), una enfermedad neurodegenerativa común, es la principal causa de demencia en las personas mayores. La deposición de hierro está estrechamente relacionada con la patogénesis de la EA. En el cerebro de la EA, los niveles elevados de hierro están fuertemente correlacionados con las patologías características de la EA, incluidas las placas β-amiloides, los ovillos neurofibrilares tau y la apoptosis. Cada vez hay más pruebas que sugieren que el estrés oxidativo, debido a la desregulación del metabolismo del hierro, desempeña un papel importante en la fisiopatología de la EA. Por lo tanto, comprender el papel de la acumulación de hierro en la patología de la EA es fundamental para el tratamiento de la EA. Un protocolo completo de tinción de hierro es esencial para detectar la expresión y distribución del hierro en el cerebro. Este protocolo tiene como objetivo describir un método para evaluar la cantidad y distribución de la deposición de hierro en el cerebro. Describimos los procesos involucrados en la preparación de reactivos, el tratamiento con ratones y la preparación de secciones cerebrales. Además, presentamos un protocolo detallado paso a paso para la detección histoquímica de hierro en secciones de tejido cerebral, acompañado de un marco analítico sistemático que integra tanto la evaluación cuantitativa como la evaluación morfológica para garantizar una interpretación completa de los resultados de la tinción. Este protocolo experimental ayudará a los investigadores a comprender las deposiciones de hierro en el cerebro y respaldar la investigación de la EA.
Introducción
La enfermedad de Alzheimer (EA) es la enfermedad neurodegenerativa más común y se ha convertido en un grave problema para la sociedad. La prevalencia de la EA aumenta drásticamente con la edad 1,2,3,4. Las principales características patológicas de la enfermedad de Alzheimer (EA) incluyen la deposición de placas de β-amiloide (Aβ) y ovillos neurofibrilares (NFT) debido a la fosforilación aberrante de las proteínas tau. Aβ se genera a través de la escisión secuencial de la proteína precursora de amiloide (APP) por las enzimas β-secretasa y γ-secretasa. La desregulación en la producción o eliminación de Aβ conduce a su acumulación en el cerebro, formando placas amiloides, que se reconocen como uno de los marcadores patológicos más tempranos de la EA. Estas placas no solo causan daño neuronal directo, sino que también inician una cascada de efectos perjudiciales, como la neuroinflamación, el estrés oxidativo y la disfunción sináptica. En conjunto, estos procesos contribuyen a la muerte neuronal y al deterioro cognitivo progresivo observado en la EA5. A pesar de décadas de investigación dirigida principalmente a las características patológicas de la enfermedad de Alzheimer (EA), incluida la deposición de placa de β amiloide y la agregación de proteína tau hiperfosforilada, los avances terapéuticos clínicamente significativos siguen siendo difíciles de alcanzar, y las intervenciones existentes demuestran una eficacia limitada para modificar la progresión de la enfermedad6.
El hierro es un metal importante para mantener la función cerebral y está involucrado en el transporte de oxígeno, la síntesis de ADN, la respiración mitocondrial, la síntesis de mielina, la síntesis de neurotransmisores y el metabolismo. Sin embargo, el hierro se vuelve dañino cuando las concentraciones exceden la capacidad de secuestro celular 6,7,8. Se ha observado un aumento de la deposición de hierro, generalmente colocalizada con placas Aβ, tanto en las regiones cortical como en el hipocampo del cerebro en pacientes con EA 9,10. A través de la reacción de Fenton11, el hierro libre intracelular puede generar radicales hidroxilo (-OH), así como especies reactivas de oxígeno. Estas sustancias nocivas no solo inducen neuroinflamación al activar las células gliales, sino que también atacan las biomoléculas de la célula a través del estrés oxidativo, interrumpiendo la función celular normal y provocando disfunción sináptica 8,12. Además, el aumento del hierro está directamente implicado en el desarrollo de signos patológicos de la EA: el hierro contribuye a la producción de Aβ12 y también aumenta la disfunción de la proteína tau, lo que conduce a ovillos neurofibrilares13.
Se han desarrollado varias técnicas para evaluar el contenido de hierro en el cerebro, incluyendo la resonancia magnética (RM), así como métodos químicos e histoquímicos14. La cuantificación in vivo de los niveles de hierro intracerebral mediante resonancia magnética es clínicamente importante para los pacientes con envejecimiento y neurodegeneración15. La resonancia magnética tiene la ventaja de ser no invasiva y muy sensible: puede detectar la deposición de hierro en las primeras etapas de la enfermedad. En particular, la técnica de aumento de R2 dependiente del campo (FDRI) puede distinguir entre diferentes formas de hierro, como el hierro ferritina y el hierro hemo16. Sin embargo, la resonancia magnética no puede detectar la acumulación de hierro a nivel celular y es costosa, por lo que se utiliza principalmente en investigaciones clínicas17.
La medición colorimétrica es un método químico que determina la concentración de una sustancia (como el hierro) midiendo la intensidad del color producido por la reacción de la sustancia en solución con un agente cromogénico18. Este método es fácil de realizar y utiliza reactivos e instrumentación de bajo costo, lo que lo hace adecuado para laboratorios con presupuestos limitados18. Sin embargo, la precisión y la sensibilidad de este método son muy limitadas, ya que los resultados están sujetos a la influencia de factores ambientales, el tiempo de desarrollo del color y el juicio subjetivo del operador. La espectrometría de absorción atómica de llama (FAAS) es otro método que se puede utilizar para evaluar los niveles de hierro19. En este método, se obtiene una solución de muestra clarificada quemando el tejido de interés en un horno de alta temperatura. A continuación, la muestra se disuelve utilizando ácido clorhídrico y la concentración de hierro en la solución se determina mediante espectrometría de absorción atómica. Este método es altamente sensible y adecuado para todo tipo de muestras biológicas19. Sin embargo, el proceso lleva mucho tiempo y requiere equipos costosos, por lo que su uso es limitado.
La tinción de Perls/DAB para detectar hierro férrico no hemo es el método de detección de hierro más utilizado debido a su alta especificidad y facilidad de implementación en comparación con otros métodos histoquímicos14. A diferencia del análisis colorimétrico, la tinción de Perls es un método de tinción histoquímica cualitativa que se basa en la reacción entre los iones de hierro y el ferrocianuro de potasio para generar un precipitado azul. Se utiliza para visualizar microscópicamente la presencia y distribución de hierro en los tejidos. Además, este método nos permite distinguir la deposición de hierro en diferentes tipos de células y observar la distribución subcelular de la deposición de hierro, proporcionando un método para el estudio de la AD20. La tinción de Perls detecta principalmente el hierro férrico no hemo y depende de la formación del complejo azul de Prusia:

(Azul de Prusia)
Sin embargo, la tinción tradicional de Perls es ineficaz para detectar la localización del hierro a niveles bajos de hierro. Cuando se añade diaminobenzidina (DAB), reacciona con el hexacianoferrato férrico para formar un compuesto marrón, aumentando la especificidad del ensayo21.
El objetivo de este protocolo es describir cómo evaluar la cantidad y distribución de la deposición de hierro en el cerebro de un modelo de ratón con EA. En este protocolo, se utilizaron ratones transgénicos 5×FAD (C57BL/6J) de 8 meses de edad como modelo de ratón AD y se compararon con ratones de tipo salvaje de la misma edad. Aquí se presentan los detalles de los procedimientos para preparar el reactivo químico, seccionar el cerebro, realizar la tinción de Perls/DAB y analizar las imágenes tomadas después de la tinción.
Protocolo
Todos los procedimientos se realizaron de acuerdo con las pautas del Comité Institucional de Cuidado y Uso de Animales de la Universidad Médica de Xuzhou y las regulaciones gubernamentales chinas para el Cuidado y Uso de Animales de Laboratorio.
1. Perfusión de animales
- Prepare el fijador: Disuelva el paraformaldehído (PFA) al 4% en solución salina tamponada con fosfato (PBS) al 1× (consulte la Tabla 1).
- Anestesiar al ratón mediante inyección intraperitoneal con ketamina (100 mg/kg) y xilacina (15 mg/kg). Una vez que el ratón esté anestesiado, fíjelo a la bandeja de cirugía de perfusión con cuatro clavos para asegurar las extremidades.
PRECAUCIÓN: Para garantizar una anestesia adecuada, verifique la pérdida de respuestas al pellizco de los dedos de los pies, la relajación de los músculos de las extremidades y la respiración profunda, lenta y constante. - Corta el pecho con unas tijeras para exponer el corazón y corta la aurícula derecha. Inyecte 20 ml de PBS 1× en el ventrículo izquierdo con una jeringa para enjuagar la sangre. A continuación, inyecte 20 ml de PFA al 4% para la fijación.
NOTA: Controle la profundidad y la dirección de la aguja para evitar perforar el tabique interventricular. Recuerde que una perfusión óptima presenta un hígado pálido y extremidades rígidas después del temblor inicial. - Decapita al ratón perfundido, corta el hueso alrededor del cráneo con unas tijeras finas, levanta el cráneo con cuidado con pinzas romas y extrae el cerebro. A continuación, remoje el cerebro en PFA al 4% a 4 °C durante la noche.
PRECAUCIÓN: Tenga cuidado con el 4% de PFA, que es un fuerte irritante respiratorio. Use una mascarilla adecuada y realice este paso con una campana extractora.
NOTA: El método de eutanasia fue aprobado por IACUC de la Universidad Médica de Xuzhou Programa de Cuidado y Uso de Animales Pautas de Eutanasia: Ratones / Ratas.
2. Criosección cerebral
- Deshidratar el cerebro con soluciones graduadas de sacarosa (15% y 30%) a 4 °C durante 24 h para cada paso. El cerebro finalmente debe hundirse hasta el fondo de la solución de sacarosa.
- Hemisectar el cerebro a lo largo de la fisura interhemisférica con un bisturí. Coloque la mitad izquierda en un tubo de microcentrífuga de 5 mL lleno con 1 mL de solución de sacarosa al 30% y un volumen igual de compuesto de temperatura óptima de corte (OCT) para mejorar el contacto entre la OCT y el cerebro.
- Recorte el tejido extraño del hemisferio izquierdo con una cuchilla de afeitar y muévalo a la plataforma OCT.
- Incruste el tejido en OCT con el soporte de una pared circular hecha de papel de aluminio.
- Congele el tejido en un micrótomo de criostato a -22 °C durante al menos 1 h y ajuste la temperatura del cabezal de corte a -19 °C.
NOTA: Recuerde preenfriar el vidrio estabilizador y los cepillos en el criostato junto con la muestra. - Monta el bloque de tejido congelado. Recorte el bloque de tejido nuevamente a una posición apropiada según el área de interés y luego comience a seccionar el cerebro en secciones sagitales de 20 μm de grosor.
NOTA: Si las secciones se pliegan, use pinceles suaves para desplegar las secciones. - Recoja cada sección en los portaobjetos recubiertos de gelatina y unte una gota de 1× PBS sobre ella. Dale la vuelta a la sección del cerebro con un pincel fino y luego monta rápidamente la sección en la guía.
- Seque las secciones recogidas a temperatura ambiente durante la noche y guárdelas a -20 °C.
NOTA: El protocolo se puede pausar aquí hasta por 2 semanas. Un tiempo de almacenamiento más largo puede interferir con la calidad del tejido y, por lo tanto, influir en el resultado del experimento.
3. Tinción de Perls/DAB
- Prepare las siguientes soluciones: ferrocianuro de potasio al 2% (K4[Fe(CN)6]·3H2O), ácido clorhídrico (HCI) al 2% y solución de DAB al 20× (ver Tabla 1).
- Coloque un portaobjetos que contenga secciones en un frasco de tinción lleno de 1× PBS y coloque el frasco en un agitador orbital durante 5 minutos para lavar la OCT del tejido.
NOTA: Ajuste cuidadosamente la velocidad del agitador orbital (velocidad recomendada: 20 rpm) para evitar que el tejido se caiga del portaobjetos a altas velocidades. - Mezcle 20 mL de solución de ferrocianuro de potasio al 2% y un volumen igual de ácido clorhídrico al 2% en un tubo de centrífuga de 50 mL.
- Utilice pinzas de plástico para transferir el portaobjetos al tubo de 50 ml y luego caliente el tubo en un baño de agua a 60 °C durante 30 minutos.
- Enjuague el portaobjetos con 1× PBS y seque el exceso de solución con papel de seda.
- Utilice una pipeta para añadir 50 μL de solución de DAB a cada sección del cerebro e incube durante 10 minutos a temperatura ambiente.
- Aspire el exceso de solución DAB con una pipeta y luego lave el portaobjetos 3 veces en PBS.
- Deshidratar las secciones con soluciones de alcohol graduadas (50%, 70%, 95%, 100%) y xileno (100%, 100%). Incuba los portaobjetos durante 3 minutos cada uno.
- Selle las secciones con goma neutra22 y luego coloque el cubreobjetos.
- Seque los portaobjetos en una campana extractora durante 24 horas antes de guardarlos en una caja de portaobjetos de microscopio.
4. Imágenes
- Encienda el microscopio, ajuste el brillo de la fuente de luz y concéntrese en la sección del cerebro con un objetivo de aumento de 4×.
- Capture la imagen con el software de control de la cámara y ajuste la configuración de los parámetros para evitar la sobreexposición. Los ajustes específicos (10×, 40× objetivo) se muestran en la Figura 1.
NOTA: Evite utilizar el balance de blancos automático para garantizar el mismo tiempo de exposición para cada imagen. - Cambie a un objetivo de aumento de 10×, mueva la platina del microscopio para centrarse en las áreas con altas señales de tinción de Perls/DAB, especialmente el hipocampo y la corteza cerebral, y capture imágenes (Figura 1A).
- Cambie a un objetivo de aumento de 40x para capturar imágenes con señales de tinción claras.
- Guarde cada imagen como un TIFF de 8 bits y exporte las imágenes para su posterior análisis.
5. Análisis de imágenes
- En ImageJ/Fiji, seleccione Complementos > costura > Costura de cuadrícula/colección en el menú y, a continuación, seleccione Posición desconocida para elegir las imágenes que se van a unir (Figura 2A).
- Elija Archivo > Guardar como > Tiff para guardar la imagen terminada como TIFF (Figura 2B).
- Utilice ImageJ/Fiji para abrir una imagen y asegurarse de que el formato de la imagen sea en color RGB (Figura 2C).
- Seleccione Plugins > IHC Profiler Image en el menú y, a continuación, elija Mode > Cytoplasmic Stained Image y el valor predeterminado de Deconvolución de color H DAB (Figura 2D). A continuación, convierta el formato de imagen a escala de grises de 8 bits.
- Convierta los valores de gris de la imagen en valores OD seleccionando Analizar > Calibrar > OD sin calibrar (Figura 2E).
- Utilice la función Umbral para seleccionar el área de tinción positiva de Perls/DAB, luego ajuste las barras de desplazamiento horizontales hasta que todos los puntos de señal marrones estén cubiertos de rojo (Figura 2F).
- Haga clic en Analizar > Establecer mediciones, luego seleccione las opciones Área, Valor medio de gris, Densidad integrada y, lo que es más importante, Limitar al umbral para excluir el ruido de fondo (Figura 2G).
- Seleccione Analizar > medir para obtener la tabla de resultados (Figura 2H).
- Agrupe los resultados y utilice software estadístico para realizar análisis estadísticos. En nuestro caso, comparamos la acumulación de hierro en el hipocampo y la corteza de ratones transgénicos 5xFAD con la del control negativo (ratones de tipo salvaje). Para las comparaciones de tres grupos, se utilizó el análisis de varianza de un factor (ANOVA) para los datos de la distribución gaussiana con la misma desviación estándar.
Resultados
Para investigar la distribución y acumulación de hierro en un modelo de ratón de EA, realizamos la tinción de Perls/DAB en cortes sagitales de ratones 5xFAD de 8 meses de edad. Como se muestra en la Figura 3, se observaron señales de tinción de Perls/DAB en ratones 5xFAD y de tipo salvaje de 8 meses de edad y en ratones de tipo salvaje de 2 meses de edad. En ratones 5xFAD, se observaron señales de tinción de Perls/DAB altas en el hipocampo y la corteza, especialmente en el subículo del hipocampo. Los ratones de tipo salvaje sirvieron como controles negativos validados; tanto las cohortes de 2 como las de 8 meses de edad mostraron señales de deposición de hierro significativamente atenuadas (Figura 3A), con tendencias de acumulación progresivas por edad detectables pero no significativas. Con un aumento del 40×, las señales en ratones 5xFAD se observaron en estructuras similares a placas Aβ, lo que concuerda con estudios previos 9,10 (Figura 3B). Las imágenes de 4× aumento se unieron para examinar la distribución de las tinciones de hierro en los cerebros de los ratones 5xFAD. Las señales de tinción de Perls/DAB fueron claramente más fuertes en la corteza, el hipocampo y el cerebelo que en otras regiones. (Figura 3C). Se seleccionaron tres secciones de la corteza cerebral y tres del hipocampo de cada uno de los tres ratones en cada condición y grupo de edad para la cuantificación. La deposición de hierro en ratones 5xFAD de 8 meses de edad fue significativamente mayor que en los controles de tipo salvaje de la misma edad. Al comparar la densidad de la señal en ratones salvajes de 2 y 8 meses de edad, no encontramos diferencias significativas en la acumulación de hierro entre estas dos edades (Figura 3D). Estos resultados demuestran la efectividad de la tinción de Perls/DAB como técnica histoquímica para la detección de hierro. La Figura 4 muestra dos casos de tinción fallida. Se producirá una coloración de fondo excesiva si las secciones del cerebro se dejan en la solución DAB durante demasiado tiempo (Figura 4A). La deshidratación inapropiada dará lugar a secciones dobladas (Figura 4B).
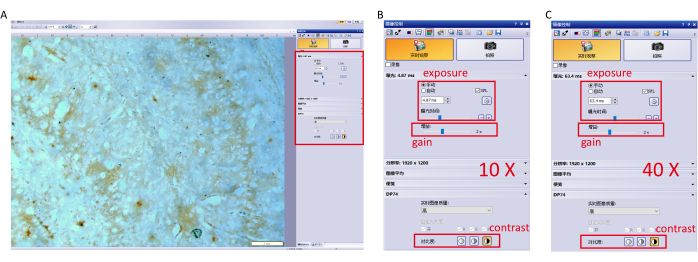
Figura 1: Configuración de parámetros para el software de imágenes. (A) Ajuste la configuración de parámetros del software (exposición, ganancia y contraste) al 10× objetivo y enfoque en el hipocampo. (B) Ajustes detallados de los parámetros para un objetivo de 10×. (C) Ajustes detallados de parámetros para un objetivo de 40×. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Procesamiento de datos de los resultados de tinción de Perls/DAB. (A) En ImageJ/Fiji, seleccione Plugins > costura > Grid/Collection stitching en el menú, luego seleccione Posición desconocida para elegir las imágenes que se van a coser. (B) Elija Archivo > Guardar como> Tiff para guardar la imagen terminada como TIFF. (C) Utilice ImageJ/Fiji para abrir una imagen y asegurarse de que el formato de la imagen sea color RGB. (D) Seleccione Complementos > Imagen del generador de perfiles IHC y, a continuación, elija Modo > Imagen teñida citoplasmática y el valor predeterminado de Deconvolución de color H DAB. (E) Convierta los valores de gris de la imagen en valores OD seleccionando Analizar > Calibrar > OD sin calibrar. (F) Utilice la función Umbral para seleccionar el área positiva de Perls, luego ajuste las barras de desplazamiento horizontales hasta que se cubran todos los puntos de señal. (G) Haga clic en Analizar > Establecer mediciones, seleccione las opciones de Área, Valor medio de gris, Densidad integrada y Limitar al umbral para excluir el ruido de fondo. (densidad integrada = área × media). (H) Seleccione Analizar > medir para obtener la tabla de resultados. Haga clic aquí para ver una versión más grande de esta figura.
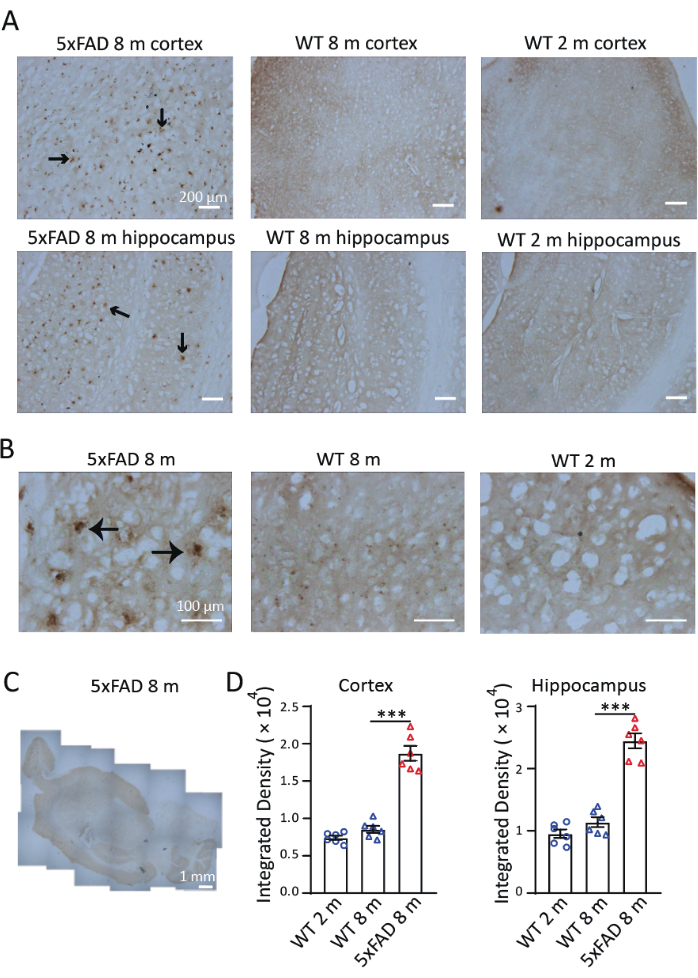
Figura 3: Tinción representativa de Perls/DAB en el cerebro de ratones 5xFAD y ratones de tipo salvaje (WT). (A) Fuertes señales de Perls/DAB en secciones longitudinales del hipocampo y la corteza de ratones 5xFAD de 8 meses de edad, en comparación con la tinción en ratones de tipo salvaje de 2 y 8 meses de edad. (B) Las señales de Perls/DAB se agruparon alrededor de las placas Aβ, especialmente en el hipocampo. (C) Una imagen longitudinal cosida que muestra la distribución de las señales de Perls/DAB en un cerebro de ratón 5xFAD. (D) Análisis estadístico de la señal de Perls/DAB en la corteza o el hipocampo de ratones WT de 2 meses, WT de 8 meses y 5xFAD de 8 meses de edad. ANOVA de un factor, ***, P < 0,001. Las barras de escala se muestran en las imágenes. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Dos casos de tinción fallida de Perls/DAB. (A) Una tinción de Perls/DAB sobrecoloreada debido a una intensificación excesiva de DAB. (B) El borde de la sección del cerebro está curvado debido a una deshidratación inapropiada. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La deposición de hierro está estrechamente asociada con la enfermedad de Alzheimer. Por un lado, puede conducir a la producción de Aβ a través de múltiples mecanismos, incluido el aumento de la expresión de la proteína precursora amiloide{NOTA:20}23, y también una mayor actividad de la γ-secretasa, que puede conducir a una producción acelerada de Aβ24; Por otro lado, la peroxidación lipídica inducida por el aumento del hierro puede promover la polimerización de tau, lo que también puede conducir a un aumento de la fosforilación anormal de la proteína tau en las neuronas25. La tinción con azul de Prusia de Perls es una técnica histoquímica bien establecida para la visualización selectiva de depósitos de hierro férrico (Fe3+) en muestras biológicas. El hierro férrico reacciona con el ferrocianuro para producir ferrocianuro férrico azul (azul de Prusia)14. La tinción de Perls/DAB es una modificación de la tinción tradicional de Perls. Las muestras que reaccionan se transfieren a una solución que contiene DAB (diamino benzenamina), tras lo cual el azul de Prusia forma un compuesto de color marrón. Usando este método, observamos la distribución espacial de la acumulación de hierro en los cerebros de ratones 5xFAD y comparamos cuantitativamente la acumulación de hierro en ratones modelo de EA y ratones de tipo salvaje.
En este protocolo, demostramos que la tinción de Perls/DAB es factible y eficaz para evaluar la deposición patológica de hierro. Para obtener resultados ideales, se deben tener en cuenta algunos consejos. En primer lugar, se deben utilizar reactivos y herramientas sin hierro, en particular ácido clorhídrico sin hierro, para reducir las manchas de fondo. El ferrocianuro de potasio y el ácido clorhídrico deben estar recién preparados. Se debe eliminar la solución adicional que queda en el portaobjetos y se debe usar alcohol puro y xileno para garantizar una deshidratación completa. Durante la obtención de imágenes, el uso del balance de blancos automático dará lugar a análisis inexactos. Recuerde convertir los valores de gris de la imagen en valores OD, que corresponden a la densidad de las señales histoquímicas.
El método descrito aquí mejora la especificidad de la tinción y es particularmente útil en tejidos con bajos niveles de hierro. La tinción DAB produce una señal de alto contraste, que es importante para la microscopía y el análisis de imágenes. En resumen, la tinción de Perls/DAB proporciona una señal más fuerte y un mejor contraste de fondo que la tinción convencional de Perls, lo que aumenta la sensibilidad y la precisión de la detección de hierro. Además, la tinción de Perls detecta el hierro férrico solo en complejos proteicos débilmente unidos (como en la hemosiderina)21. El hierro que está fuertemente unido, como en la hemoglobina, no reaccionará. Esto reduce en gran medida las señales no deseadas causadas por el hierro en los glóbulos rojos y la hemoglobina.
Sin embargo, la tinción de Perls/DAB tiene algunas limitaciones. Por ejemplo, la tinción de DAB da lugar a algunas tinciones de fondo inespecíficas que pueden interferir con la observación de resultados positivos. Además, el proceso de tinción requiere un control preciso tanto del tiempo como de la concentración; De lo contrario, la tinción puede ser desigual o tener una intensidad de señal insuficiente. También se ha reportado que la respuesta de tinción es predominantemente en oligodendrocitos en lugar de neuronas26.
La tinción de Perls/DAB es apropiada para estudios de patología que requieren una especificidad y sensibilidad medias. Este método proporciona a los investigadores una forma menos costosa y que requiere menos tiempo para visualizar y cuantificar la acumulación de hierro que la resonancia magnética o la FAAS. Para investigar más a fondo la distribución de la acumulación de hierro en diferentes tipos de células y estructuras subcelulares, se necesita la tinción conjunta con marcadores de neuronas y células gliales. En general, la tinción de Perls/DAB acelerará la exploración de la patología de la EA y facilitará la investigación de terapias relacionadas con el metabolismo del hierro.
Divulgaciones
Esta investigación fue apoyada por un proyecto general de la Fundación de Ciencias Naturales de China (número de subvención: 32271010).
Agradecimientos
Durante la preparación de este trabajo, los autores utilizaron DeepSeek con el fin de mejorar el lenguaje y la legibilidad. Después de utilizar esta herramienta/servicio, los autores revisan y editan el contenido según sea necesario y asumen toda la responsabilidad del contenido de la publicación.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.1 M PBS | biosharp | BL601A | Add deionized water to make solution |
| 4% PFA | Beyotime | P0099 | Restore at 4 °C for use |
| 20X DAB solution | Bioss | C-0003 | Mix 10 μl solution A, 10 μl solution B and 180 μl PBS |
| Alcohol | Supelco | 107017 | |
| HCL | Sigma | 7647-01-0 | Add distilled water to 50 ml |
| ketamine | China National Medicines | H20193336 | 100 mg/kg for anesthetizing |
| Microscope | Olympus | CX43 | |
| Optimal cutting temperature compound (OCT) | Sakura Finetek | 4583 | |
| potassium ferrocynide solution | Sigma | 14038-43-8 | Add distilled water to 50 ml |
| Sucrose | Sigma | 57-50-1 | |
| xylazine | Y-S Biotechnology | YS-(BC)-2842 | 15 mg/kg for anesthetizing |
| Xylenes | Sigma | 1330-20-7 |
Referencias
- Karlawish, J., Jack, C. R., Rocca, W. A., Snyder, H. M., Carrillo, M. C. Alzheimer's disease: The next frontier-special report 2017. Alzheimer's Dement. 13 (4), 374-380 (2017).
- Praticò, D. Oxidative stress hypothesis in Alzheimer's disease: A reappraisal. Trends in Pharmacol Sci. 29 (12), 609-615 (2008).
- Sayre, L. M., et al. In situ oxidative catalysis by neurofibrillary tangles and senile plaques in alzheimer's disease. J. Neurochem. 74 (1), 270-279 (2001).
- Urrutia, P., et al. Inflammation alters the expression of dmt1, fpn1 and hepcidin, and it causes iron accumulation in central nervous system cells. J. Neurochem. 126 (4), 541-549 (2013).
- Hardy, J., Selkoe, D. J. The amyloid hypothesis of Alzheimer's disease: Progress and problems on the road to therapeutics. Science. 297 (5580), 353-356 (2002).
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Ficiarà, E., Munir, Z., Boschi, S., Caligiuri, M. E., Guiot, C. Alteration of iron concentration in alzheimer's disease as a possible diagnostic biomarker unveiling ferroptosis. Int J Mol Sci. 22 (9), 4479(2021).
- Yang, W. S., Stockwell, B. R. Ferroptosis: Death by lipid peroxidation. Trends in Cell Biol. 26 (3), 165-176 (2016).
- Lane, D. J. R., et al. Iron and Alzheimer's disease: An update on emerging mechanisms. J Alzheimers Dis. 64 (s1), S379-S395 (2018).
- Meadowcroft, M. D., Connor, J. R., Smith, M. B., Yang, Q. X. Mri and histological analysis of beta-amyloid plaques in both human Alzheimer's disease and app/ps1 transgenic mice. J Magn Reson Imaging. 29 (5), 997-1007 (2009).
- Winterbourn, C. C. Toxicity of iron and hydrogen peroxide: The Fenton reaction. Toxicol Lett. 82-83, 969-974 (1995).
- Silvestri, L., Camaschella, C. A potential pathogenetic role of iron in Alzheimer's disease. J Cell Mol Med. 12 (5a), 1548-1550 (2008).
- Gamblin, T. C., King, M. E., Kuret, J., Berry, R. W., Binder, L. I. Oxidative regulation of fatty acid-induced tau polymerization. Biochemistry. 39 (46), 14203-14210 (2000).
- Meguro, R., et al. Nonheme-iron histochemistry for light and electron microscopy: A historical, theoretical and technical review. Arch Histol Cytol. 70 (1), 1-19 (2007).
- Lehéricy, S., Roze, E., Goizet, C., Mochel, F. Mri of neurodegeneration with brain iron accumulation. Curr Opin Neurol. 33 (4), 462-473 (2020).
- Nabuurs, R. J. A., et al. High-field MRI of single histological slices using an inductively coupled, self-resonant microcoil: Application to ex vivo samples of patients with Alzheimer's disease. NMR Biomed. 24 (4), 351-357 (2010).
- Perl, D. P., Good, P. F. Comparative techniques for determining cellular iron distribution in brain tissues. Ann Neurol. 32 (S1), S76-S81 (1992).
- Riemer, J., Hoepken, H. H., Czerwinska, H., Robinson, S. R., Dringen, R. Colorimetric ferrozine-based assay for the quantitation of iron in cultured cells. Anal Biochem. 331 (2), 370-375 (2004).
- Luterotti, S., Kordić, T., Dodig, S. Simultaneous determination of iron and copper in children's sera by FAAS. Acta Pharm. 61 (1), 93-102 (2011).
- Hill, J. M., Switzer, R. C. The regional distribution and cellular localization of iron in the rat brain. Neuroscience. 11 (3), 595-603 (1984).
- Meguro, R., Asano, Y., Iwatsuki, H., Shoumura, K. Perfusion-perls and -turnbull methods supplemented by dab intensification for nonheme iron histochemistry: Demonstration of the superior sensitivity of the methods in the liver, spleen, and stomach of the rat. Histochem Cell Biol. 120 (1), 73-82 (2003).
- Liu, C., et al. S-nitrosylation of divalent metal transporter 1 enhances iron uptake to mediate loss of dopaminergic neurons and motoric deficit. J Neurosci. 38 (39), 8364-8377 (2018).
- Guillemot, J., Canuel, M., Essalmani, R., Prat, A., Seidah, N. G. Implication of the proprotein convertases in iron homeostasis: Proprotein convertase 7 sheds human transferrin receptor 1 and furin activates hepcidin. Hepatology. 57 (6), 2514-2524 (2013).
- Li, X., et al. Ferritin light chain interacts with pen-2 and affects γ-secretase activity. Neurosci Lett. 548, 90-94 (2013).
- Jin Jung, K., et al. Oxidative stress induces inactivation of protein phosphatase 2a, promoting proinflammatory nf-κb in aged rat kidney. Free Radic Biol Med. 61, 206-217 (2013).
- Connor, J. R., Menzies, S. L., Martin, S. M. S., Mufson, E. J. Cellular distribution of transferrin, ferritin, and iron in normal and aged human brains. J Neurosci Res. 27 (4), 595-611 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados