Method Article
Murin Oküler ve Non-Oküler Dokularda Diyetle Alınan Vitamin A Metabolitlerinin Yüksek Performanslı Sıvı Kromatografisi Kullanılarak Kantitatif Analizi
Bu Makalede
Özet
Burada, temel ışığa duyarlı rodopsin kromoforu 11-cis-retinal'i oluşturmak için sistemik A vitamini kaynağı bağlamında, hem oküler hem de sistemik dokuda görme fonksiyonunun kolaylaştırılmasında rol oynayan kritik retinoidleri tespit etmek ve miktarını belirlemek için normal fazlı, yüksek performanslı bir sıvı kromatografisi yöntemi açıklanmaktadır.
Özet
G proteinine bağlı reseptörler (GPCR'ler), ligandı ile birleştikten sonra G proteininin aktivasyonu yoluyla sinyal kaskadlarını başlatan bir transmembran protein üst ailesidir. Tüm memeli görüşünde, rodopsin, fototransdüksiyon kaskadının başlatılmasından sorumlu olan GPCR'dir. Fotoreseptörler içinde, rodopsin kromoforu 11-cis-retinal'e bağlanır ve 11-cis-retinal'in all-trans-retinal'e ışığa duyarlı izomerizasyonu yoluyla aktive edilir, bu da transdüsin G proteinini aktive eder ve fototransdüksiyon kaskadı ile sonuçlanır.
Fototransdüksiyon iyi anlaşılmış olsa da, gözde 11-cis-retinal nesil için diyetle alınan A vitamini öncüllerinin temininde yer alan süreçler ve bu tedarikin bozulmasına neden olan hastalıklar henüz tam olarak anlaşılamamıştır. A vitamini öncüleri bağırsağa emildikten sonra, karaciğerde retinil esterler olarak depolanır ve retinol bağlayıcı protein 4'e (RBP4) bağlı all-trans-retinol olarak kan dolaşımına salınır. Bu dolaşım RBP4-retinol, karaciğer, akciğerler, böbrek ve göz gibi sistemik organlar tarafından emilecektir. Bu nedenle, göz ve sistemik organlarda diyetle alınan A vitamininin çeşitli metabolitlerinin miktar tayini için bir yöntem, uygun rodopsin GPCR fonksiyonunun incelenmesi için kritik öneme sahiptir.
Bu yöntemde, murin dokusunda A vitamini analizi için kapsamlı bir ekstraksiyon ve analitik yöntem sunuyoruz. Normal fazlı, yüksek performanslı sıvı kromatografisi analizi sayesinde, retinaldehitlerin, retinollerin ve retinil esterlerin ilgili tüm izomerleri tek bir çalışmayla aynı anda tespit edilebilir, bu da deneysel numunelerin verimli kullanımına olanak tanır ve aynı numune içindeki farklı A vitamini metabolitleri arasında dahili güvenilirliği artırır. Bu kapsamlı yöntemle, araştırmacılar rodopsin GPCR fonksiyonunda sistemik A vitamini tedarikini daha iyi değerlendirebileceklerdir.
Giriş
G proteinine bağlı reseptörler (GPCR'ler), bilinen en çok çalışılan ve karakterize edilen protein süper ailelerinden biridir. En iyi bilinen işlevinde, GPCR'ler, sinyal iletiminde bir hücre yüzeyi reseptörü olarak görev yapar ve belirli bir ligandla bağlandıktan sonra hücre içi yanıtları başlatır. GPCR'ler, yedi transmembran (TM) sarmal alan ve toplam altı döngü alanı ile karakterize edilir. Altı halkadan, üç ilmek, ligand bağlanmasını kolaylaştırmak için hücre dışı olarak yönlendirilirken, diğer üç hücre içi ilmek, Gα, Gβ ve Gγ alt birimlerinden 1,2 oluşan heterotrimerik bir G proteinine bağlanır.
GPCR'ler, A Sınıfı Rodopsin Benzeri, B Sınıfı Sekretin Reseptör ailesi, C Sınıfı Glutamat, D Sınıfı Mantar Çiftleşme Feromon Reseptörleri, E Sınıfı Siklik AMP reseptörleri ve F Sınıfı Kıvırcık/Düzleştirilmiş 3,4 dahil olmak üzere çeşitli sınıflara ayrılır. Adından da anlaşılacağı gibi, GPCR rodopsin benzeri Sınıf A alt sınıfı, fototransdüksiyon ve görsel işlevden sorumlu kritik GPCR olan rodopsin içerir. Rodopsin, daha önce bahsedilen yedi TM sarmal alanı, altı hücre dışı ve hücre içi döngü ve fotoreseptörlerde transdüsin (Gt) olarak da bilinen heterotrimerik bir G proteini ile ilişki dahil olmak üzere, GPCR'lerin kanonik modelinde bulunan tüm ilgili temel özellikleri ve yapısal unsurları içerir 1,5,6,7. Rodopsinin bağlanma cebi içinde, ışığa duyarlı kromofor ligandı olan 11-cis-retinal, bir kovalent Schiff baz bağı yoluyla lizin 296 üzerindeki rodopsine bağlanır ve böylece 11-cis-retinylidene 1,8 oluşturur. Bir fotonun emilmesi üzerine, 11-cis-retinyliden fotoizomerleri, rodopsin içinde konformasyonel bir değişikliğe neden olarak all-trans-retinyliden'e dönüşür. Bu nedenle, 11-cis-retinal ligand, rodopsin GPCR'nin işlevi için kritik öneme sahiptir ve fotoreseptörler içindeki yüksek devir hızının üstesinden gelmek için sağlam ve verimli bir 11-cis-retinal kaynağı sürekli olarak sürdürülmelidir.
11-cis-retinal gibi retinaldehitler, topluca retinoidler olarak adlandırılan bir molekül grubuna aittir ve biyolojik olarak ilgili retinoidler daha yaygın olarak A vitamini olarak adlandırılır. A vitamininin retinaldehitleri ve ilişkili vitamerleri, siklik uç grup olarak β-iyonon halkasını, bir diterpen polien zincirini ve vitamere bağlı olarak farklı bir polar uç grubunu, yani retinaldehitler için aldehit grubunu, retinoller için hidroksil grubunu, retinoik asitler için karboksil grubunu, retinil esterler için ester bağını içeren bu karakterizasyonun bir istisnası değildir. vb (Şekil 1)9,10.
Memeliler A de novo vitaminini sentezleyemezler, ancak bitkiler sentezleyebilir; Bu nedenle, memeli sistemlerindeki tüm retinoidler, bitki bazlı üreticilerin diyetinden besin zincirindeki tüketicilere kadar kaynaklanmalıdır. A vitamini metabolizmasının kanonik modelinde, arketipsel bitki provitamin A olan β-karoten, çöpçü reseptör sınıfı B, üye 1 (SCARB1) yoluyla bağırsak enterositine emilir, β-karoten oksijenaz 1 (BCO1/BCMO1) tarafından iki all-trans-retinal molekülüne bölünür, bu da retinalit bağlayıcı protein 2'ye (RBP2) bağlanır ve all-trans-retinol dehidrojenazlar (RDH) ile retinol, lesitin retinol asiltransferaz (LRAT) tarafından retinil esterlere dönüştürülür ve daha sonra şilomikronlarda kan dolaşımına gönderilir 11,12,13,14. Öte yandan, retinil palmitat gibi retinil esterler, hayvansal kaynaklardan elde edilen baskın provitamin A görevi görür. Bağırsak lümeninden gelen retinil palmitat, karboksilestaz 1 (CES1) ile all-trans-retinole hidrolize edilir ve bağırsak enterositine15 yayılır. Karaciğer, retinil ester hidrolazları tarafından hücresel retinol bağlayıcı protein 1'e (CRBP1) bağlanan all-trans-retinol içine hidrolize edilen bu şilomikronların içindeki retinil esterleri emen A vitamini homeostazı için birincil depolama ve homeostatik organdır, hepatik yıldız hücrelerine girer ve depolama için LRAT tarafından tekrar retinil esterlere dönüştürülür 13,16, 17. Organizmada homeostatik bir A vitamini seviyesini korumak için karaciğer, retinol bağlayıcı protein 4 (RBP4) ve transtiretinden (TTR) oluşan bir serum taşıma kompleksine bağlı all-trans-retinol formunda A vitamini salgılar15,18,19. Bu kompleks, bu el yazmasında holo-RBP4 olarak anılacaktır.
Kandaki bu sistemik A vitamini kaynağını kullanmak için, sağlam bir A vitamini kaynağının korunduğu oküler doku da dahil olmak üzere sistemik dokuların, holo-RBP4'ü dokuya emmek için bir yönteme sahip olması gerekir. Oküler dokudaki fotoreseptörden zengin retina içinde, retinoik asit 6 (STRA6) tarafından uyarılan membran reseptörü bu fonksiyonda rol oynayan taşıyıcıdır. Mekanik çalışmalarda, STRA6'nın holo-RBP4'ten RPE20'ye hücre dışı all-trans-retinol alımını kolaylaştırabildiği gösterilmiştir. Bu ithal edilen all-trans-retinol daha sonra görsel döngüye girecektir, bu da all-trans-retinolün RPE ve fotoreseptör dış segmenti içinde 11-cis-retinal'e dönüştürüldüğü ve böylece rodopsin 9,21'e bağlandığında görsel işlevi kolaylaştırdığı süreçtir.
Dolaşım holo-RBP4'ten gelen all-trans-retinol, kan-retina bariyerini STRA6 yoluyla oküler doku içindeki RPE'ye geçtiğinde, RPE'deki all-trans-retinol önce LRAT ile retinil esterlere esterleştirilir, daha sonra retinal pigment epiteline özgü 65 kDa proteini (RPE65) ile 11-cis-retinol'e hidrolize edilir. 11-cis-retinol daha sonra retinol dehidrojenaz 5 tarafından 11-cis-retinal'e dönüştürülür. Bu 11-cis-retinal daha sonra interfotoreseptör retinoid bağlayıcı protein (IRBP) tarafından fotoreseptörün dış segmentine (OS) taşınır9,21. Dış nükleer tabaka (ONL) içindeki fotoreseptör çekirdeğini çevreleyen endoplazmik retikulum içinde, opsin GPCR'ler sentezlenir ve bağlantı silyumu (CC) boyunca taşınır. CC boyunca bu taşımada yer alan motor proteinler tartışmalıdır, ancak mevcut hipotezler, kinesin ve dynein bazlı intraflagellar taşıma (IFT) veya miyozin bazlı taşımayı bu sürecin olası kolaylaştırıcıları olarak göstermektedir 14,22,23,24,25,26. Bu iki bileşen, işletim sistemi içindeki membranöz diskler içinde buluştuğunda, 11-cis-retinal ve opsin, fototransdüksiyon8 için hazır olan rodopsin üzerindeki lizin 196'da bir Schiff baz kovalent bağı yoluyla 11-cis-retinyliden oluşturur.
Retinanın RPE'si içinde STRA6'nın ekspresyonu, holo-RBP4'ten all-trans-retinol alımını kolaylaştırmaya yardımcı olurken, STRA6'nın A vitamini için ana homeostatik organ olarak rolüne ve holo-RBP4'ten all-trans-retinol alımında yetenekler sergilemesine rağmen karaciğerde eksprese edildiği bulunmadı 15,19,27,28, 29,30,31. Sonunda, retinol bağlayıcı protein 4 reseptörü 2 (RBPR2) adı verilen benzer bir reseptör keşfedildi ve STRA6'ya çok benzeyen holo-RBP4'ten all-trans-retinol alma kabiliyetini sergiledi, ancak hepatik doku32'de eksprese edildi.
Bu nedenle, rodopsinin görsel işlevdeki rolünün tam olarak anlaşılması, görsel pigmentin yenilenmesiyle sonuçlanan biyolojik süreçlerin anlaşılmasını gerektirir. Bu da, provitamin A öncüllerinin metabolizması, karaciğer içinde depolama, holo-RBP4'ün karaciğer tarafından salınması ve nihai olarak holo-RBP4'ün STRA6 ve RBPR2 membran reseptörleri yoluyla alınması dahil olmak üzere daha önce açıklanan süreçlerle yakından ilişkilidir. Yukarıda bahsedildiği gibi, fareler gibi hayvan modelleri, bu tür süreçlerin incelenmesinde önde gelen modellerden biri olmaya devam etmektedir. Bu nedenle, murin dokusundaki retinoidler için bir ekstraksiyon yönteminin yanı sıra bu retinoidleri tespit edebilen ve miktarını belirleyebilen normal fazlı yüksek performanslı bir sıvı kromatografisi (HPLC) yöntemi sunmak istiyoruz. Bu yöntemler kullanılarak, 11-cis-retinal rodopsin ligandı veya ana taşıma retinoid all-trans-retinol gibi yukarıda tarif edilen önemli retinoidler oküler, hepatik ve sistemik organlarda analiz edilebilir. Fare dokusundaki retinoid arzını değerlendirerek, retinoidlerin lojistik tedariki ile ilgili hastalık durumları ve patolojileri hakkındaki anlayışımız daha da geliştirilebilir.
Retinoidler, opsin GPCR'leri ile ilişki yoluyla görsel işlevde bir kromofor olarak işlev görmenin yanı sıra, doğrudan DNA'ya bağlanan ve gen transkripsiyonunu düzenleyen iki nükleer reseptör ailesi, retinoik asit reseptörleri (RAR'lar) ve retinoid X reseptörleri (RXR'ler) tarafından kolaylaştırılan retinoik asit sinyali yoluyla memeli hücre sinyallemesinde de önemli bir rol oynar33. Bu iki aile veya reseptörün her ikisi de ligand olarak retinoik asitler şeklinde retinoidler kullanır. RAR'ların hem all-trans-retinoik asit hem de 9-cis-retinoik asit için afiniteye sahip olduğu gösterilmiştir, oysa RXR'ler sadece 9-cis-retinoik asit için afinite ifade eder 34,35. Kontrolsüz miktarlardaki retinoik asitler teratojeniktir ve retinoik asit sinyalizasyonu son derece sıkı bir şekilde kontrol edilmelidir36. Sinyalleme için retinoik asitlerin üretimi, arka beyin ve uzuv gelişimi gibi dokuların düzgün gelişimi için yerel olarak ve çok belirli zaman noktalarında gerçekleşmelidir, ancak sayısız başka örnek retinoik asit sinyalini kullanır37,38. Retinoik asit sinyalizasyonuna katılan hücreler içinde, retinoik asitler, STRA6 veya RBPR2 tarafından alınan retinollerin retinaldehitlere oksidasyonunu kolaylaştıran alkol/retinol dehidrojenazlar (ADH'ler/RDH'ler) ve retinaldehitlerin retinoik asitlere oksidasyonunu kolaylaştıran retinaldehit dehidrojenazlar (RALDH'ler) olmak üzere iki enzim grubu tarafından sentezlenir39. Retinoik asitler, kendi başına GPCR sinyalizasyonuna katılmamakla birlikte, yine de sinyal reseptörleri için bir ligand olarak işlev gören çok önemli bir retinoid olarak bulunur.
Burada ayrıntılı olarak açıklanmasa da, gıda araştırmaları ve mikrobiyal rodopsin çalışmaları gibi çeşitli bağlamlarda HPLC kullanarak retinoid tespiti için önceden belirlenmiş yöntemleri kabul etmek isteriz. Bu yöntemler, daha az uçucu ve tehlikeli mobil fazlar40,41,42, retinoik asitlerin ve bunlarla ilişkili izomerlerin40,41 tespiti ve farklı biyolojik kaynaklardan saflaştırma ve ekstraksiyon gerektiren ters faz tekniklerinin kullanılması dahil olmak üzere retinoid tespiti için farklı hedefler ve yaklaşımlar kullanır43. Yöntemimiz özellikle memeli dokusundan retinil palmitat, retinaldehit izomerleri ve retinol izomerlerinin tespitine odaklanmaktadır. Amaçlanan kullanım durumu bu özel uygulamadan farklıysa farklı protokoller dikkate alınmalıdır.
Protokol
NOT: Tüm hayvan deneyleri, Minnesota Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) (protokol # 2312-41637A) tarafından onaylanmıştır ve Oftalmik ve Görme Araştırmalarında Hayvanların Kullanımına İlişkin ARVO Beyanına uygun olarak gerçekleştirilmiştir. Tüm ekstraksiyon işlemlerini karanlıkta, aydınlatma için loş kırmızı ışık altında gerçekleştirin. Gösterge ekranları ve aksesuar LED'leri tarafından yayılan artık ışığın farkında olun.
1. Spektrofotometrik retinoid standart üretimi ve harici standart eğri üretimi
NOT: HPLC ile analizden önce retinoidlerin geçici olarak depolanması için kuru bir buz kabı hazırlayın.
- Rastgele ancak uygun miktarda retinoid tartın ve bunları spektrofotometri yoluyla miktar tayini için uygun bir çözücü içinde çözün.
NOT: Bu çalışmada kullanılan çözücü etanoldür ve etanol içinde çözünen retinoidlerin molar absorptivite değerleri Tablo 1'de detaylandırılmıştır. Standartları ve numuneleri çözmek için susuz, HPLC dereceli etanol kullanılmalıdır. Sadece damıtma yoluyla saflaştırılan etanol, hacimce yaklaşık% 4 su içeren su ile azeotropik bir karışım oluşturur. Su, heksanoik mobil faz ile karışmaz ve silika sabit fazın hidrasyonuna neden olarak kolonun nihai olarak bozulmasına yol açar. - Beer-Lambert Yasasını ve ilgili retinoidin molar absorptivitesini kullanarak, oluşturulan standardın konsantrasyonunu ölçün (Tablo 1).
Absorbans = Molar Absorbtivite (ε) × Molar Konsantrasyon × Yol Uzunluğu - İstenen doku için kantitasyon aralığında standart bir eğri oluşturabilen konsantrasyonlar oluşturmak için seri seyreltmeler gerçekleştirin.
NOT: Beer-Lambert Yasasının, yüksek konsantrasyonlarda analit ile geçerliliğinin olmaması gibi temel sınırlamalarının farkında olun. Bu sorunu önlemek için, seyreltilmiş retinoid standartları, 1'den büyük absorbans değerleri üretmekten kaçınmalıdır. Fare organlarında retinol ve retinaldehit miktar tayini uygulamalarımız için, 1-10 ng aralığındaki bir kalibrasyon eğrisinin bulunan tipik miktarları kapsayabildiğini gördük. Fare karaciğerinden retinil palmitat miktar tayini için, 20-80 μg aralığındaki bir kalibrasyon eğrisinin bulunan tipik miktarları kapsayabildiğini bulduk. - Enjeksiyon hacmini daha önce oluşturulan stok çözeltisinden kademeli olarak değiştirerek, böylece enjekte edilen retinoid miktarını kademeli olarak değiştirerek, pik entegrasyonunun enjekte edilen retinoid miktarıyla doğru orantılı olduğu retinoid kantifikasyonu için uygun bir harici standart eğri oluşturmak için pikleri entegre edin.
2. Doku hasadı ve numune toplama
NOT: Doku homojenizasyonu ve retinoid ekstraksiyonundan önce dokunun geçici olarak saklanması için kuru bir buz kabı hazırlayın. Önerilen doku toplama miktarları Tablo 2'de detaylandırılmıştır. Her doku için kan içeriğindeki değişikliklere bağlı retinoid varyasyonlarını hesaba katmak için, doku ekstraksiyonu tamamen perfüze farelerde yapılmalı ve kan ekstraksiyonu ayrı farelerde tamamlanmalıdır.
- Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından belirlenen protokolü (burada CO2 boğulması) belirlenen yönergeleri izleyerek farelere ötenazi yapın.
- Kan: Ötenazinin hemen ardından, farelerin başını bir makasla kesin ve kanı farelerin ana gövdesinden 1.5 mL'lik bir tüpe boşaltın.
- Göz: Bir çift forseps kullanarak, gözleri kesilmiş kafadan çıkarın.
- Beyin: Bir çift küçük makas kullanarak, kafası kesilmiş kafayı kesin ve bir çift forseps kullanarak beyni çıkarın.
- Böbrek, karaciğer, dalak, kalp ve akciğer: Küçük bir makas kullanarak karın içine bir kesi yapın, orta hat boyunca üst yönde kesin ve sternum ve göğüs kafesini kesin. Bir çift forseps kullanarak maruz kalan dokuyu çıkarın.
3. Doku homojenizasyonu
NOT: Daha büyük organlarda (örneğin karaciğer veya akciğer dokusu) olduğu gibi daha küçük organ bölümlerinin analizi isteniyorsa, dokunun farklı bölgelerindeki retinoid içeriğindeki farklılıkları önlemek için tüm organ homojenize edilmelidir. Bunun yerine, daha küçük miktarlarda doku isteniyorsa homojenatı bölün. Protokol için bir şema Şekil 2'de detaylandırılmıştır. Bu değiştirilmiş protokol, Kane ve Napoli44'ten uyarlandı.
- Dokuyu %50 buz gibi tuzlu su (%0,9) ve %50 metanol ile birlikte doku öğütücü tüpüne yerleştirin. Her doku tipi için kullanılan hacim için Tablo 2'ye bakınız.
- Havaneli öğütücü borusuna yerleştirin, homojen bir ürün elde etmek için havaneli ile yavaşça ve nazikçe beş tam tur gerçekleştirin.
- Homojenizasyondan hemen sonra numuneleri 15 mL'lik tüplere aktarın.
- 2 mL metanol ekleyin ve oda sıcaklığında 15 dakika bekletin.
NOT: Retinaldehit oksim türevlerinin analizi isteniyorsa, 0,1 M HEPES (pH 6,5) içinde 1 mL 0,1 M hidroksilamin hidroklorür ekleyin (Şekil 1).
4. Retinoid ekstraksiyonu
DİKKAT: Hekzan son derece yanıcı, oldukça uçucu ve oldukça toksiktir. Hekzan ile çalışırken Ulusal Mesleki Güvenlik ve Sağlık Enstitüsü (NIOSH) onaylı solunum maskeleri, göz koruması, bütil eldivenler ve çeker ocak kullanılmalıdır. Numunelerden hekzan buharlaştırılırken, solvent dumanı birikmesini önlemek için bir tür gelişmiş hava sirkülasyon aparatı, örneğin bir şnorkel emme aparatı önerilir.
- Homojenata 10 mL heksan ekleyin ve tüpü en az 10 saniye boyunca yatay olarak karıştırın.
NOT: Fazların tamamen karışması çok önemlidir. - Faz ayrımını kolaylaştırmak için homojenat/heksan karışımını 1.000 × g'da 3 dakika santrifüjleyin.
- Homojenattan retinoidlerin toplam ekstraksiyonunu sağlamak için ekstraksiyonu 2x gerçekleştirin. 4.1 ve 4.2 adımlarını tekrarlayın.
- Bir pipet kullanarak heksan tabakasını çekin ve heksan tabakasını vakumla buharlaştırma için ayrı bir cam 15 mL tüp setine yerleştirin.
NOT: Buharlaşma için, retinoidlerin tüpün duvarlarına yapışmasını önlemek için GLASS 15 mL tüpler kullanın. - Bir vakum santrifüjü kullanarak, heksanı tamamen buharlaştırın.
5. Yeniden süspansiyon ve HPLC analizi
NOT: Bu el yazmasında kullanılan HPLC sistemi bir ikili pompa sistemi olduğundan, dört bileşenli mobil faz, çalıştırmadan önce tekil bir şişeye önceden karıştırılmıştır.
DİKKAT: Bu yöntemde kullanılan dört organik çözücünün tümü son derece yanıcı, oldukça uçucu ve oldukça toksiktir. 1,4-dioksan, oksijene maruz kaldığında patlayıcı peroksit oluşumuna karşı hassastır. Kullanılmadığı zaman 1,4-dioksan içeren tüm kapları kapalı tutun. Bu çözücülerle çalışırken Ulusal Mesleki Güvenlik ve Sağlık Enstitüsü (NIOSH) onaylı solunum maskeleri, göz koruması, bütil eldivenler ve çeker ocak kullanılmalıdır. Bu çözücüleri bir HPLC'de çalıştırırken, çözücü dumanı birikmesini önlemek için bir tür gelişmiş hava sirkülasyon aparatı, örneğin bir şnorkel emme aparatı önerilir.
- Kurutulmuş 15 mL'lik tüpü 100 μL hekzan ile tekrar süspanse edin; Tüm retinoidlerin çözüldüğünden emin olmak için iyice girdaplayın.
- HPLC analizi için 100 μL'lik hekzanın tamamını tek bir cam parçaya pipetleyin.
- HPLC çalışmasını ayarlayın (Landers ve Olson45'ten uyarlanmıştır): mobil faz: %85,4 heksan (h/v), %11,2 etil asetat (h/v), %2 dioksan (h/v), %1,4 1-oktanol (h/v); sütun: iki adet 4,6 mm ID x 250 nm, 5 μm sütun, seri bağlı; çok sütunlu bir Termostat Sıcaklığı: 25 °C; enjeksiyon hacmi: 100 μL; akış hızı: 1 mL/dak; Süre: 40 dk. UV spektrumu absorbans algılamasını kullanın; 200 nm'den 400 nm'ye kadar UV spektrumu elde etmek için seçeneği işaretli tutun.
6. Tepe Tanımlama ve Entegrasyon
- Retinoid standartlarının analizinden gözlemlendiği gibi, ilgilenilen her bir retinoidin tutma süresini ve UV spektrumlarını kullanarak zirveleri belirleyin (Şekil 3, Tablo 3 ve Tablo 4).
- Seçilen HPLC sisteminin kromatografik veri sistemini kullanarak, tanımlanan tepe noktalarını entegre edin. Entegrasyon veya eğrinin altındaki alan, analit miktarı ile doğru orantılıdır. Analiti ölçmek için 1. adımda oluşturulan harici standart eğriye başvurun.
- Biyolojik dokudan üretilen kromatogramların analizi için, tipik kromatografik veri sistemleri tarafından sunulan otomatik entegrasyon yerine manuel entegrasyon kullanın, çünkü bu tür numunelerde alıkonma süresi gibi parametrelerdeki değişkenlikler sıklıkla gözlenir.
- Kromatogramların, gürültülü taban çizgileri veya Gauss olmayan tepeler gibi çalışma sırasında sorunlara işaret edebilecek düzensizlikler sergilemediğinden emin olun. Bu sorunlar, HPLC'deki kirleticileri veya kolonlardaki aşınmayı gösterir ve geçerli analiz için düzeltilmelidir.
Sonuçlar
Burada, murin oküler ve sistemik dokudaki retinoidleri tespit etmek ve miktarını belirlemek için yukarıda açıklanan yöntemi kullandık ve temsili kromatogramlar oluşturduk. Ek olarak, bu dokularda tespit edilebilecek tipik retinoidlerin bir özetini vereceğiz.
6 aylıkken, farelere CO2 asfiksiasyonu yoluyla ötenazi yapıldı. Oküler retinoid içeriğini korumak için, fareler ötenazi ve ekstraksiyondan önce 2 gün boyunca karanlığa adapte edildi. Retinoid ekstraksiyonu ve ardından HPLC analizi için iki göz, 0.2 g karaciğer ve 75 μL kan alındı. Oküler doku için bir göz hidroksilamin ilavesi yapılmadan çıkarılırken, diğer göze hidroksilamin tedavisi uygulandı. Karaciğer ve kan için, retinaldehitler tipik olarak bu dokularda tespit edilmediğinden hidroksilamin tedavisine gerek yoktu.
Hidroksilamin ile muamele edilmeyen fare gözünün kromatogramında, kanonik olmayan iki retinalit izomerinden biri olan 13-cis-retinal tanımlandı. Ek olarak, iki kanonik retinalit izomeri olan hem 11-cis-retinal hem de all-trans-retinal tanımlandı. Her iki kromatogramda da, görsel döngü ara maddesi 11-cis-retinol ve ayrıca ana A vitamini taşıma formu all-trans-retinolün her ikisi de tanımlanmıştır (Şekil 4A).
Hidroksilamin ile muamele edilen fare gözünün kromatogramında, daha önce bahsedilen tüm retinaldehit izomerleri hala mevcuttu. Bununla birlikte, bu izomerler için alıkonma süreleri önemli ölçüde artmıştır. Ayrıca, bu retinaldehit izomerleri artık hem syn hem de anti izomerler olarak mevcuttur. Tepe entegrasyonu yoluyla niceleme sırasında, doğru bir entegrasyon değeri elde etmek için hem syn hem de anti tepe noktaları toplanmalıdır. Hem 11-cis-retinol hem de all-trans-retinol hala mevcuttu (Şekil 4B).
Fare hepatik dokusunun kromatogramında, bu dokular içinde retinil palmitat ve all-trans-retinol tanımlandı. Bir retinil ester olan retinil palmitat, memelilerde A vitamininin ana depolama formu olarak görev yapar ve memeli karaciğer dokusunda önemli miktarlarda bulunabilir. Karaciğer, A vitaminini sistemik dokulara holo-RBP4 olarak salgılar ve RBP4-transthryetin kompleksi içinde all-trans-retinol içerir. Daha sonra, bu kromatogram içinde büyük bir all-trans-retinol zirvesi tanımlanabilir (Şekil 4C).
Fare kanının kromatogramında, büyük bir all-trans-retinol zirvesi tanımlandı. Karaciğerden holo-RBP4'ün dolaşım sistemi yoluyla sistemik dokulara salındığı göz önüne alındığında, bu beklendiği gibidir (Şekil 4D). Zamana bağlı çözülmüş HPLC pikleri üzerindeki retinoid izoformlarının karakteristik UV spektrumu absorbansı (~ 250-400 nm), belirli bir ilgili pikte izoform varlığının kalitesini ilk çapraz doğrulamada yardımcı olabilir (Şekil 5).

Şekil 1: Retinoidlerin kimyasal yapıları. (A) Bu retinoidler tipik olarak ekstrakte edilmiş murin dokusunda bulunur. Farklı polar uç gruplarının yanı sıra retinoid izomerlerindeki cis çift bağlarının farklı konumlarına dikkat edin. (B) Retinaldehitlerin retinal oksimlere dönüştürülmesi, ekstraksiyon verimliliğini arttırır, piklerin retinil palmitat ile ko-elüsyonunu ve ayrıca retinaldehit izomerleri içinde ko-elüsyonunu önler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Doku toplama, homojenizasyon, retinoid ekstraksiyonu ve analizi için iş akışı. Karanlığa adapte olmuş farelerden alınan retinalar ve doku örnekleri homojenize edildi ve ekstrakte edildi. 1 Adım: Fareleri yönergelere göre ötenazi yaptıktan sonra kan ve çeşitli dokular toplanır. Adım 2-4: Doku homojenizasyonu daha sonra kantitatif analizler için salin ve metanol ile hidroksilamin hidroklorür ile yapılır. Adım 5-7: Retinoidler heksan kullanılarak muamele edilir, ardından buharlaştırma yapılır. Adım 8,9: Tüm retinoidlerin çözündüğünden emin olmak için 100 μL hekzan ile yeniden süspanse edilir. 10 Adım: Son olarak, numuneler HPLC kullanılarak analiz edilir. Kısaltma: HPLC = Yüksek Performanslı Sıvı Kromatografisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Retinoid standartlarının kromatogramı ve hidroksilamin ile muamele edilmiş retinoid standartları. (A) Bu kromatogram, retinil palmitat, 13-cis-retinal, 11-cis-retinal, all-trans-retinal, 11-cis-retinol, 13-cis-retinol ve all-trans-retinol standartlarını içerir. (B) Bu kromatogram, retinil palmitat, 13-cis-retinal, 11-cis-retinal, all-trans-retinal, 11-cis-retinol, 13-cis-retinol ve all-trans-retinol standartlarını içerir. Bu kromatogram, retinol izomerlerine ek olarak syn ve anti oksim retinaldehit izomerlerini içerir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Temsili kromatogramlar. (A) Fare oküler dokusunun temsili kromatogramı. Bu kromatogram, retinol izomerlerine ek olarak, retinaldehit izomerleri de dahil olmak üzere tipik olarak murin oküler dokusunda bulunan retinoidleri içerir. (B) Hidroksilamin ile tedavi edilmiş fare oküler dokusunun temsili kromatogramı. Önceki kromatogramlarda (Şekil 4A) bulunan kimyasal olarak modifiye edilmemiş retinaldehitlerin yerine, bu kromatogramın retinol izomerlerine ek olarak syn ve anti oksim retinaldeyde izomerlerini içerdiğine dikkat edin. (C) Fare karaciğer dokusunun temsili kromatogramı. Bu kromatogram, tipik olarak retinil palmitat ve all-trans-retinol dahil olmak üzere murin karaciğer dokusunda bulunan retinoidleri içerir. (D) Fare kanının temsili kromatogramı. Bu kromatogram, all-trans-retinol dahil olmak üzere tipik olarak murin kanında bulunan retinoidleri içerir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
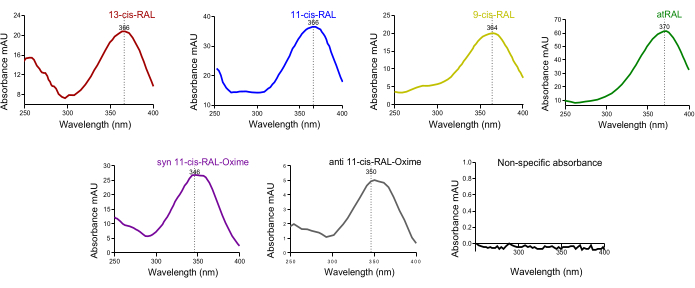
Şekil 5: Murin oküler dokusundan retinaldehit izomerlerinin UV absorbans spektrumu. (A) 13-cis-retinal, (B) 11-cis-retinal, (C) 9-cis-retinal, (D) all-trans-retinal, (E) syn 11-cis-retinal oksim, (F) anti 11-cis-retinal oksim absorbans spektrumları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: HPLC modüllerine, mobil faz akışına ve diğer enstrümantasyona genel bakış. Mobil faz akışı, hazırlanan solvent şişelerinden başlar ve ikili pompa tarafından yüksek basınçta otomatik numune alma cihazına pompalanır ve burada analit, solvent akışına dahil edilir. Mobil faz ve analit, sıcaklık ayarlı kolon bölmesine ve son olarak ölçüm için diyot dizisi dedektörüne ulaşır. (A) Retinoidlerin fotoizomerizasyonunu en aza indiren kırmızı renkli monitör ekranı. (B) İkili pompa. (C) Flakon örnekleyici. (D) Çok sütunlu termostat. (E) Diyot dizisi dedektörü. (F) Analitik fraksiyon toplayıcı. (G) Yüksek yoğunluklu poli atık konteyneri. (H) Soldan sağa, alüminyum kıvrımlı kapak, polimer ayaklı 250 μL kesici uç, kehribar renkli kıvrımlı üst şişe, enjeksiyon şişesinin son montajı. (I) Sol, soğutmalı santrifüj. Doğru, santrifüj yoğunlaştırıcı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Bileşik | Molar Absorptivite (ε) | Çözücü | Referans |
| Retinil Palmitat | 49260 | Etanol | Hubbard ve ark.49 |
| 13-cis-Retinal | 35500 | Etanol | Hubbard ve ark.49 |
| 11-cis-Retinal | 24935 | Etanol | Hubbard ve ark.49 |
| 9-cis-Retinal | 36100 | Etanol | Robeson ve ark.51 |
| All-trans-Retinal | 42880 | Etanol | Hubbard ve ark.49 |
| 11-cis-retinol | 34890 | Etanol | Hubbard ve ark.49 |
| 13-cis-Retinol | 48305 | Etanol | Robeson ve ark.50 ve Robeson ve ark.51 |
| All-trans-Retinol | 52770 | Etanol | Hubbard ve ark.49 |
Tablo 1: Etanoldeki retinoidlerin molar absorptivitesi. Retinoidlerin molar absorptivite değerleri Kane ve Napoli44, Hubbard ve ark.46, Robeson ve ark.47 ve Robeson ve ark.48'den toplanmıştır. Molar absorptivite çözücüye bağlıdır. Burada listelenen değerler etanol içinde çözünen retinoidlere özgüdür.
| Doku | Doku Toplama Miktarı | Homojenizasyon için hacim |
| Kan | 75 μL | YOK |
| Karaciğer | 0.2 gr | 2 mL |
| Böbrek | 2 Bütün Böbrek | 2 mL |
| Cilt | 0.2 gr | 1 mL – 1.5 mL arası |
| Dalak | 1 bütün dalak | 1 mL |
| Göz | Hem Retina, hem de havuz 4 Retina | 1 mL |
| Beyin | 1 Bütün Beyin | 2 mL |
| Kalp | 1 Bütün Kalp | 1 mL |
| Akciğer | 0.2 gr | 2 mL |
Tablo 2: Analiz başına önerilen doku miktarı. Kane ve Napoli44 tarafından önerildiği gibi, analiz başına doku miktarı ve doku homojenizasyonu için %50 buz gibi tuzlu su (%0.9) ve %50 metanol hacmi.
| Bileşik | Bekletme Süresi (dk) | UV Absorbans Maxima (nm) |
| Retinil Palmitat | 5.177 | 326 |
| 13-cis-Retinal | 7.268 | 366 |
| 11-cis-Retinal | 7.691 | 366 |
| 9-cis-Retinal | 7.931 | 364 |
| All-trans-Retinal | 8.993 | 370 |
| 11-cis-retinol | 17.003 | 318 |
| 13-cis-Retinol | 17.83 | 328 |
| All-trans-Retinol | 23.933 | 326 |
Tablo 3: Retinoidlerin alıkonma süreleri ve maksimum absorbans dalga boyları. Bu değerler, referans alınan diyot dizisi dedektörü ile tespit edildiği gibi, açıklanan yöntem ve mobil faz ile kullanıldığında gözlemlenmiştir.
| Bileşik | Bekletme Süresi (dk) | UV Absorbans Maxima (nm) |
| Syn 11-cis-Retinal Oksim | 9.59 | 346 |
| Syn All-trans-Retinal Oksim | 10.6 | 356 |
| Syn 13-cis-Retinal Oksim | 11.3 | 352 |
| Anti 13-cis-Retinal Oksim | 13 | 356 |
| Anti 11-cis-Retinal Oksim | 15.1 | 350 |
| Anti All-trans-Retinal Oksim | 19.7 | 360 |
Tablo 4: Hidroksilamin ile muamele edilmiş retinaldehitlerin alıkonma süreleri ve maksimum absorbans dalga boyları, her bir retinaldehitin syn ve anti oksim izomerleri ile sonuçlanır. Bu değerler, referans alınan diyot dizisi dedektörü ile tespit edildiği gibi, açıklanan yöntem ve mobil faz ile kullanıldığında gözlemlenmiştir.
Tartışmalar
Bu yöntemde, retinil esterler, retinaldehitler ve retinoller dahil olmak üzere ilgili retinoidleri tespit etmek ve miktarını belirlemek için normal fazlı HPLC kullanılır. Rodopsin GPCR'nin aktivasyonunda kritik kromofor olarak 11-cis-retinal'in önemi göz önüne alındığında, 11-cis-retinal üretimi ile ilgili metabolitleri tespit edebilen bir yöntem, genel görsel fonksiyonun incelenmesi için kritik öneme sahiptir. Bu yöntemin temel avantajı, hem retinaldehitlerin hem de retinollerin ilgili tüm izomerlerinin tek bir işlemle aynı anda tespit edilebilmesi ve miktarının belirlenebilmesidir. Canlı deney dokularının ne kadar az olduğu göz önüne alındığında, bu yöntem retinoid tespitinde dokunun verimli bir şekilde kullanılmasına izin verir. Retinoidlerinayrılmasında hekzan ve etil asetat bazlı mobil fazların kullanımı bildirilmiş olsa da, 1,4-dioksan ve 1-oktanol ilavesi retinoid izomerlerinin çözünürlüğünü iyileştirir. 1,4-cis-retinol ve 13-cis-retinol50'nin çözünürlüğü için 50-dioksan gereklidir, 1-oktanol gibi uzun zincirli alkoller ise retinol izomerlerinin 45,51,52 ayrılmasını daha da iyileştirir.
Retainaldehit izomerlerinin miktar tayini için, reaktif aldehit grubu proteinler ve lipitler45,53,54 gibi diğer biyomoleküllerle reaksiyona girmeye eğilimli olduğundan, hidroksilamin ile karşılık gelen retinaldehit oksimlerine önceden dönüşüm gereklidir. Retinaldehit oksimler daha kolay ekstrakte edilir ve retinaldehit piklerinin daha sonra elüte olmasına neden olur, böylece bilinmeyen pik grubu ve biyolojik dokular için ~ 5-8 dakikada ortaya çıkan retinil palmitat zirvesi ile pik ko-elüsyonunu önler. Retinaldehitlerin hidroksilamin ile muamelesi, benzer elüsyon sürelerine sahip retinaldehitlerin ko-elüsyonunu da önler45. Retinaldehit oksimlerine dönüşüm, her retinaldehit izomeri için iki farklı tepe noktası ile iki farklı zamanda elüte olan hem syn hem de anti izomerleri üretir. Her bir retinaldehit izomerini uygun şekilde ölçmek için her iki tepe noktasının entegrasyonu toplanmalıdır. Tutma süresinin yanı sıra, UV spektrumları, tepe tanımlamasında kullanılabilecek başka bir ölçüm sağlar. Her retinoid, biraz farklı bir UV absorbansı maksimumu sergiler. Tutma süresi ile birlikte dikkate alındığında, bu iki metrik tepe noktalarının doğru bir şekilde tanımlanmasına olanak tanır (Tablo 3 ve Tablo 4).
Oküler dokuda 11-cis-retinal ve all-trans-retinal gibi kanonik retinalit izomerlerinin varlığı beklenirken, 11-cis-retinal kritik rodopsin ligandı kromoforu ve all-trans-retinal fotoizomerize liganddır, diğer kanonik olmayan retinaldehit izomerleri bu yöntemle tespit edilir. Özellikle, analizimiz sırasında murin oküler dokusunun HPLC çalışmalarında 13-cis-retinal kolayca tespit edildi (Şekil 4A-D). Bu kanonik olmayan retinaldehitlerin ortaya çıkması tamamen beklenmedik değildir, ancak hem 13-cis-retinal hem de 9-cis-retinal, retina üzerindeki ışığın neden olduğu stresten kaynaklanan bilinen yan ürünlerdir55,56. Bu retinaldehit izomerleri, bilinen kanonik fototransdüksiyon kaskad yoluna katılmazlar ve metabolik kaderleri nispeten bilinmemektedir. Bununla birlikte, 9-cis-retinalin, rodopsinin bağlanma cebine stabil bir şekilde bağlanarak isorhodopsin oluşturduğu gösterilmiştir. İsorhodopsinin rolü henüz tam olarak karakterize edilmemiştir, ancak çalışmalar isorhodopsinin 11-cis-retinal bazlı rodopsin 57,58 gibi ışığa duyarlı yetenekler sergilediğini göstermiştir. En azından, 9-cis-retinal'in kararlı bir şekilde isorhodopsin oluşturma ve tüm trans-retinal'e fotoizomerize olma yeteneği, HPLC analizimizde(56) yokluğu için makul bir açıklama sağlar. Öte yandan, 13-cis-retinal'in bilinen herhangi bir oküler biyokimyasal yola katıldığı gösterilmemiştir ve oküler doku içinde birikmesi, retina içinde oksidatif strese neden olabilir 55,59,60.
9-cis-retinal tipik olarak murin dokusunda bulunmasa da, hidroksilamin ile tedavi edilen yöntemin 9-cis-retinal'in ayrılması ve miktarının belirlenmesi için uygun bir yöntem olmadığı belirtilmelidir. Syn 9-cis-retinal ve syn 13-cis-retinal için pikler 11.2 dakikada coelute olacaktır. Eksojen olarak uygulandığında olduğu gibi, önemli miktarlarda 9-cis-retinal'in beklendiği durumlarda, sadece kombine 9-cis-retinal ve 13-cis-retinal'in miktar tayini mümkün olacaktır. Kalitatif tanımlama için, 13-cis-retinal ve 9-cis-retinal tepe noktalarının tamamen ayrılmasına izin verecek şekilde dokuyu hidroksilamin ile tedavi etmeden yöntemin gerçekleştirilmesi.
Bu yöntem oküler dokunun yanı sıra sistemik dokuya da kolaylıkla uygulanabilir. Çeşitli izomerik formlarındaki retinaldehitler tipik olarak sistemik dokuda bulunmazken, retinol bağlayıcı protein 4'e (holo-RBP4) bağlı all-trans-retinol, memeli organizmalarında A vitamininin ana taşıma şeklidir ve all-trans-retinol bu yöntem kullanılarak kanda kolayca tespit edilebilir. Kanın yanı sıra, all-trans-retinol tipik olarak tüm sistemik dokularda da tespit edilebilir. Bu nedenle, bu yöntem kullanılarak, bu yöntem kullanılarak tam bir sistemik doku çapında retinoid profili oluşturulabilir.
Retinaldehitler, özellikle kritik rodopsin ligandı 11-cis-retinal, fotoizomerizasyona karşı son derece hassas olduğundan, yukarıda açıklanan adımlardan herhangi biri sırasında kazara ışığa maruz kalmayı önlemek için önleyici tedbirlerin alınması kritik öneme sahiptir. Oda aydınlatması ve gösterge panellerinden gelen bariz kaynakların yanı sıra, HPLC'nin kendisi de dahil olmak üzere aletlerin arkasında bulunanlar gibi çeşitli cihazlardaki aksesuar LED'lerinden gelen hatalı ışığın, kazara ışığa maruz kalmanın ana kaynakları olduğunu bulduk (Şekil 6). Ek olarak, retinaldehit izomerlerinin ve deney dokularının uygun şekilde ele alınması için özel bir karanlık odanın hayati önem taşıdığını bulduk. Işık minimizasyonunun yanı sıra, retinaldehit izomerlerinin bozunması ışık yokluğunda bile meydana geldiğinden, ötenazi ve hasattan sonra dokunun hızlı ve hızlı bir şekilde işlenmesini öneririz. İdeal olarak, doku toplama, ekstraksiyon ve HPLC analizinin tümü aynı gün içinde tamamlanmalıdır.
Hemen işlem görmeyen doku karanlıkta -80 °C'de saklanmalı ve işlemden önce bir haftadan fazla saklanmamalıdır. Yukarıda bahsedildiği gibi, yukarıdaki yöntemde mobil fazda ve ekstraksiyon adımlarında kullanılan tüm çözücüler oldukça toksik, uçucu ve yanıcıdır. Bu tehlikeli çözücülerle çalışırken uygun prosedürler ve ekipman kullanılmalıdır. Bütil eldivenler, NIOSH onaylı solunum maskeleri ve göz koruması gibi uygun kişisel koruyucu ekipman (KKD), solvent kullanımından önce giyilmeli ve tüm solvent transferleri bir çeker ocak içinde yapılmalıdır. 1,4-dioksanın oksijene maruz kaldığında patlayıcı peroksit oluşumuna duyarlı olduğunu unutmayın ve 1,4-dioksan içeren tüm çözücü kaplarını havadan sıkıca kapalı tutun.
Yetersiz malzeme veya ekipman nedeniyle normal fazlı bir HPLC yöntemi uygulanamıyorsa, retinaldehitleri ve retinolleri tespit etmek ve miktarını belirlemek için asetonitril ve su gibi daha az uçucu çözücüler içeren daha tipik ters fazlı yöntemler mevcuttur. Bununla birlikte, bu yöntemler izomerleri ayıramaz ve yalnızca toplam retinaldehitleri veya toplam retinolleritespit edebilir 44,54.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma, NIH-NEI hibeleri (EY030889 ve 3R01EY030889-03S1) ve kısmen Minnesota Üniversitesi başlangıç fonları tarafından GPL'ye desteklenmiştir. Ayrıca, bu makalede kullanılan 11-cis-retinal standardını bize sağladığı için Ulusal Göz Enstitüsü'ne de teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| 1-Octanol, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 203-917-6 | |
| 1,4-Dioxane, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 204-661-8 | |
| 11-cis-retinal | National Eye Institute | N/A | |
| 11-cis-Retinol | Toronto Research Chemicals | TRC-R252105 | |
| 13-cis-retinal | Toronto Research Chemicals | TRC-R239900 | |
| 13-cis-retinol | Toronto Research Chemicals | TRC-R252110 | |
| All-trans-Retinal | Toronto Research Chemicals | TRC-R240000 | |
| All-trans-Retinol | Toronto Research Chemicals | TRC-R252002 | |
| Ethyl Acetate, suitable for HPLC, ≥99.7% | Sigma-Aldrich, Millipore Sigma | 205-500-4 | |
| Hexane, HPLC Grade | Fisher Scientific, Spectrum Chemical | 18-610-808 | |
| Methanol (HPLC) | Fisher Scienctific | A452SK-4 | |
| Retinyl Palmitate | Toronto Research Chemicals | TRC-R275450 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| Instruments | |||
| 1260 Infinity II Analytical Fraction Collector | Agilent | G1364F | |
| 1260 Infinity II Binary Pump | Agilent | G7112B | |
| 1260 Infinity II Diode Array Detector | Agilent | G7115A | |
| 1260 Infinity II Multicolumn Thermostat | Agilent | G7116A | |
| 1260 Infinity II Vialsampler | Agilent | G7129A | |
| ST40R Refrigerated Centrifuge | Thermo Scientific | TSST40R | |
| Vacufuge Plus Centrifuge Concentrator | Eppendorf | 22820168 | |
| Consumables | |||
| 2 mL Amber Screw Top Vials | Agilent | 5188-6535 | |
| Crimp Cap with PTFE/red rubber septa, 11 mm | Agilent | 5183-4498 | |
| Disposable Glass Conical Centrifuge Tubes | Millipore Sigma | CLS9950215 | |
| Screw cap tube, 15 mL | Sarstedt | 62.554.502 | |
| Vial insert, 150 µL, glass with polymer feet | Agilent | 5183-2088 |
Referanslar
- Palczewski, K., et al. Crystal structure of rhodopsin: A G protein-coupled receptor. Science. 289 (5480), 739-745 (2000).
- Rosenbaum, D. M., Rasmussen, S. G. F., Kobilka, B. K. The structure and function of G-protein-coupled receptors. Nature. 459 (7245), 356-363 (2009).
- Alhosaini, K., Azhar, A., Alonazi, A., Al-Zoghaibi, F. GPCRs: The most promiscuous druggable receptor of the mankind. Saudi Pharm J. 29 (6), 539-551 (2021).
- Hu, G. -M., Mai, T. -L., Chen, C. -M. Visualizing the GPCR network: Classification and evolution. Sci Rep. 7 (1), 15495(2017).
- Lerea, C. L., Somers, D. E., Hurley, J. B., Klock, I. B., Bunt-Milam, A. H. Identification of specific transducin α subunits in retinal rod and cone photoreceptors. Science. 234 (4772), 77-80 (1986).
- Gao, Y., Hu, H., Ramachandran, S., Erickson, J. W., Cerione, R. A., Skiniotis, G. Structures of the rhodopsin-transducin complex: Insights into G protein activation. Mol Cell. 75 (4), 781-790.e3 (2019).
- Zhou, X. E., Melcher, K., Xu, H. E. Structure and activation of rhodopsin. Acta Pharmacol Sin. 33 (3), 291-299 (2012).
- Robinson, P. R., Cohen, G. B., Zhukovsky, E. A., Oprian, D. D. Constitutively active mutants of rhodopsin. Neuron. 9 (4), 719-725 (1992).
- Kiser, P. D., Golczak, M., Palczewski, K. Chemistry of the retinoid (visual) cycle. Chem Rev. 114 (1), 194-232 (2014).
- Sani, B. P., Hill, D. L. [3] Structural characteristics of synthetic retinoids. Methods Enzymol. 189, 43-50 (1990).
- Lobo, G. P., Amengual, J., Palczewski, G., Babino, D., von Lintig, J. Carotenoid-oxygenases: Key players for carotenoid function and homeostasis in mammalian biology. Biochim Biophys Acta. 1821 (1), 78-87 (2012).
- Amengual, J., et al. Two carotenoid oxygenases contribute to mammalian provitamin A metabolism. J Biol Chem. 288 (47), 34081-34096 (2013).
- Harrison, E. H. Mechanisms involved in the intestinal absorption of dietary vitamin A and provitamin A carotenoids. Biochim Biophys Acta. 1821 (1), 70-77 (2012).
- Leung, M., et al. The logistical backbone of photoreceptor cell function: Complementary mechanisms of dietary vitamin A receptors and rhodopsin transporters. Int J Mol Sci. 25 (8), 4278(2024).
- Martin Ask, N., Leung, M., Radhakrishnan, R., Lobo, G. P. Vitamin A transporters in visual function: A mini review on membrane receptors for dietary vitamin A uptake, storage, and transport to the eye. Nutrients. 13 (11), 3987(2021).
- Harrison, E. H. Carotenoids, β-apocarotenoids, and retinoids: The long and the short of it. Nutrients. 14 (7), 1411(2022).
- Li, Y., Wongsiriroj, N., Blaner, W. S. The multifaceted nature of retinoid transport and metabolism. Hepatobiliary Surg Nutr. 3 (3), 126-139 (2014).
- D'Ambrosio, D. N., Clugston, R. D., Blaner, W. S. Vitamin A metabolism: An update. Nutrients. 3 (1), 63-103 (2011).
- Yamamoto, Y., et al. Interactions of transthyretin (TTR) and retinol-binding protein (RBP) in the uptake of retinol by primary rat hepatocytes. Exp Cell Res. 234 (2), 373-378 (1997).
- Kawaguchi, R., et al. A membrane receptor for retinol binding protein mediates cellular uptake of vitamin A. Science. 315 (5813), 820-825 (2007).
- Kiser, P. D., Golczak, M., Maeda, A., Palczewski, K. Key enzymes of the retinoid (visual) cycle in vertebrate retina. Biochim Biophys Acta. 1821 (1), 137-151 (2012).
- Radhakrishnan, R., et al. The role of motor proteins in photoreceptor protein transport and visual function. Ophthalmic Genet. 43 (3), 285-300 (2022).
- Solanki, A. K., et al. Loss of motor protein MYO1C causes rhodopsin mislocalization and results in impaired visual function. Cells. 10 (6), 1322(2021).
- Liu, X., Udovichenko, I. P., Brown, S. D. M., Steel, K. P., Williams, D. S. Myosin VIIa participates in opsin transport through the photoreceptor cilium. J Neurosci. 19 (15), 6267-6274 (1999).
- Insinna, C., Besharse, J. C. Intraflagellar transport and the sensory outer segment of vertebrate photoreceptors. Dev Dyn. 237 (8), 1982-1992 (2008).
- Krock, B. L., Mills-Henry, I., Perkins, B. D. Retrograde intraflagellar transport by cytoplasmic dynein-2 is required for outer segment extension in vertebrate photoreceptors but not arrestin translocation. Invest Ophthalmol Vis Sci. 50 (11), 5463-5471 (2009).
- Blaner, W. S. STRA6, a cell-surface receptor for retinol-binding protein: The plot thickens. Cell Metab. 5 (3), 164-166 (2007).
- Bouillet, P., et al. Developmental expression pattern of Stra6, a retinoic acid-responsive gene encoding a new type of membrane protein. Mech Dev. 63 (2), 173-186 (1997).
- Blomhoff, R., Norum, K. R., Berg, T. Hepatic uptake of [3H]retinol bound to the serum retinol binding protein involves both parenchymal and perisinusoidal stellate cells. J Biol Chem. 260 (25), 13571-13575 (1985).
- Kelly, M., von Lintig, J. STRA6: role in cellular retinol uptake and efflux. Hepatobiliary Surg Nutr. 4 (4), 229-242 (2015).
- Quadro, L., et al. The role of extrahepatic retinol binding protein in the mobilization of retinoid stores. J. Lipid Res. 45 (11), 1975-1982 (2004).
- Alapatt, P., et al. Liver retinol transporter and receptor for serum retinol-binding protein (RBP4). J Biol Chem. 288 (2), 1250-1265 (2013).
- Chawla, A., Repa, J. J., Evans, R. M., Mangelsdorf, D. J. Nuclear receptors and lipid physiology: Opening the X-files. Science. 294 (5548), 1866-1870 (2001).
- Heyman, R. A., et al. 9-cis retinoic acid is a high affinity ligand for the retinoid X receptor. Cell. 68 (2), 397-406 (1992).
- Allenby, G., et al. Retinoic acid receptors and retinoid X receptors: interactions with endogenous retinoic acids. Proc Natl Acad Sci USA. 90 (1), 30-34 (1993).
- Das, B. C., et al. Retinoic acid signaling pathways in development and diseases. Bioorg Med Chem. 22 (2), 673-683 (2014).
- Hernandez, R. E., Putzke, A. P., Myers, J. P., Margaretha, L., Moens, C. B. Cyp26 enzymes generate the retinoic acid response pattern necessary for hindbrain development. Development. 134 (1), 177-187 (2007).
- Yashiro, K., et al. Regulation of retinoic acid distribution is required for proximodistal patterning and outgrowth of the developing mouse limb. Dev Cell. 6 (3), 411-422 (2004).
- Duester, G. Families of retinoid dehydrogenases regulating vitamin A function. Eur J Biochem. 267 (14), 4315-4324 (2000).
- Tatum, V., Chow, C. K. Rapid measurement of retinol, retinal, 13-cis-retinoic acid and all-trans-retinoic acid by high performance liquid chromatography. J Food Drug Anal. 13 (3), (2020).
- Teerlink, T., Copper, M. P., Klaassen, I., Braakhuis, B. J. M. Simultaneous analysis of retinol, all-trans- and 13-cis-retinoic acid and 13-cis-4-oxoretinoic acid in plasma by liquid chromatography using on-column concentration after single-phase fluid extraction. J Chromatogr B. Biomed Sci App. 694 (1), 83-92 (1997).
- Egberg, D. C., Heroff, J. C., Potter, R. H. Determination of all-trans and 13-cis vitamin A in food products by high-pressure liquid chromatography. J Agric Food Chem. 25 (5), 1127-1132 (1977).
- Sudo, Y., et al. A microbial rhodopsin with a unique retinal composition shows both sensory rhodopsin II and bacteriorhodopsin-like properties. J Biol Chem. 286 (8), 5967-5976 (2011).
- Kane, M. A., Napoli, J. L. Quantification of endogenous retinoids. Methods Mol Biol. 652, 1-54 (2010).
- Landers, G. M., Olson, J. A. Rapid, simultaneous determination of isomers of retinal, retinal oxime and retinol by high-performance liquid chromatography. J Chromatogr A. 438, 383-392 (1988).
- Hubbard, R., Brown, P. K., Bownds, D. [243] Methodology of vitamin A and visual pigments. Methods Enzymol. 18, 615-653 (1971).
- Robeson, C. D., et al. Chemistry of vitamin A. XXIV. The synthesis of geometric isomers of vitamin A via methyl β-methylglutaconate1. J Am Chem Soc. 77 (15), 4111-4119 (1955).
- Robeson, C. D., Blum, W. P., Dieterle, J. M., Cawley, J. D., Baxter, J. G. Chemistry of vitamin A. XXV. Geometrical isomers of vitamin A aldehyde and an isomer of its α-ionone analog1. J Am Chem Soc. 77 (15), 4120-4125 (1955).
- Hubinger, J. C. Determination of retinol, retinyl palmitate, and retinoic acid in consumer cosmetic products. J Cosmet Sci. 60 (5), 485-500 (2009).
- Bhat, P. V., Co, H. T., Lacroix, A. Effect of 2-alkanols on the separation of geometric isomers of retinol in non-aqueous high-performance liquid chromatography. J Chromatogr A. 260, 129-136 (1983).
- Stancher, B., Zonta, F. Quantitative high-performance liquid chromatographic method for determining the isomer distribution of retinol (vitamin A1) and 3-dehydroretinol (vitamin A2) in fish oils. J Chromatogr. 312, 423-434 (1984).
- Zonta, F., Stancher, B. High-performance liquid chromatography of retinals, retinols (vitamin A1) and their dehydro homologues (vitamin A2): improvements in resolution and spectroscopic characterization of the stereoisomers. J Chromatogr A. 301, 65-75 (1984).
- van Kuijk, F. J., Handelman, G. J., Dratz, E. A. Rapid analysis of the major classes of retinoids by step gradient reversed-phase high-performance liquid chromatography using retinal (O-ethyl) oxime derivatives. J Chromatogr. 348 (1), 241-251 (1985).
- Kane, M. A., Folias, A. E., Napoli, J. L. HPLC/UV quantitation of retinal, retinol, and retinyl esters in serum and tissues. Anal Biochem. 378 (1), 71-79 (2008).
- Widjaja-Adhi, M. A. K., Ramkumar, S., von Lintig, J. Protective role of carotenoids in the visual cycle. FASEB J. 32 (11), 6305-6315 (2018).
- Ramkumar, S., Jastrzebska, B., Montenegro, D., Sparrow, J. R., von Lintig, J. Unraveling the mystery of ocular retinoid turnover: Insights from albino mice and the role of STRA6. J Biol Chem. 300 (3), 105781(2024).
- de Grip, W. J., Lugtenburg, J. Isorhodopsin: An undervalued visual pigment analog. Colorants. 1 (3), 256-279 (2022).
- Fan, J., Rohrer, B., Moiseyev, G., Ma, J., Crouch, R. K. Isorhodopsin rather than rhodopsin mediates rod function in RPE65 knock-out mice. Proc Natl Acad Sci USA. 100 (23), 13662-13667 (2003).
- Sparrow, J. R. Bisretinoids of RPE lipofuscin: Trigger for complement activation in age-related macular degeneration. Adv Exp Med Biol. 703, 63-74 (2010).
- Różanowska, M., Handzel, K., Boulton, M. E., Różanowski, B. Cytotoxicity of all-trans-retinal increases upon photodegradation. Photochem Photobiol. 88 (6), 1362-1372 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır