Method Article
Análisis cuantitativo de los metabolitos dietéticos de la vitamina A en tejidos oculares y no oculares murinos mediante cromatografía líquida de alta resolución
En este artículo
Resumen
Aquí, se describe un método de cromatografía líquida de alta resolución en fase normal para detectar y cuantificar los retinoides críticos involucrados en la facilitación de la función visual tanto en el tejido ocular como en el sistémico, en el contexto del suministro sistémico de vitamina A para generar el cromóforo de rodopsina 11-cis-retinal fotosensible esencial.
Resumen
Los receptores acoplados a proteínas G (GPCR) son una superfamilia de proteínas transmembrana que inician cascadas de señalización a través de la activación de su proteína G al asociarse con su ligando. En toda la visión de los mamíferos, la rodopsina es el GPCR responsable del inicio de la cascada de fototransducción. Dentro de los fotorreceptores, la rodopsina se une a su cromóforo 11-cis-retinal y se activa a través de la isomerización sensible a la luz de 11-cis-retinal a todo trans-retinal, que activa la proteína G de la transducina, lo que da lugar a la cascada de fototransducción.
Si bien la fototransducción se conoce bien, los procesos que están involucrados en el suministro de precursores de vitamina A en la dieta para la generación de 11-cis-retinal en el ojo, así como las enfermedades que resultan en la interrupción de este suministro, aún no se comprenden completamente. Una vez que los precursores de la vitamina A se absorben en el intestino, se almacenan en el hígado como ésteres de retinilo y se liberan en el torrente sanguíneo como todo trans-retinol unido a la proteína de unión al retinol 4 (RBP4). Este RBP4-retinol circulatorio será absorbido por los órganos sistémicos, como el hígado, los pulmones, el riñón y los ojos. Por lo tanto, un método para la cuantificación de los diversos metabolitos de la vitamina A dietética en los ojos y los órganos sistémicos es fundamental para el estudio de la función adecuada de la rodopsina GPCR.
En este método, presentamos un método analítico y de extracción integral para el análisis de vitamina A en tejido murino. A través del análisis de cromatografía líquida de alta resolución en fase normal, todos los isómeros relevantes de retinaldehídos, retinoles y ésteres de retinilo se pueden detectar simultáneamente a través de una sola ejecución, lo que permite el uso eficiente de muestras experimentales y aumenta la confiabilidad interna entre diferentes metabolitos de vitamina A dentro de la misma muestra. Con este método integral, los investigadores podrán evaluar mejor el suministro sistémico de vitamina A en la función de GPCR de rodopsina.
Introducción
Los receptores acoplados a proteínas G (GPCRs) son una de las superfamilias de proteínas más estudiadas y caracterizadas que se conocen. En su función más conocida, los GPCR sirven como un receptor de superficie celular en la transducción de señales, inicializando respuestas intracelulares al unirse con un ligando específico. Los GPCR se caracterizan por siete dominios helicoidales transmembrana (TM) y seis dominios de bucle total. De los seis bucles, tres están orientados extracelularmente para facilitar la unión del ligando, mientras que los otros tres bucles intracelulares están acoplados a una proteína G heterotrimérica que consta de las subunidades Gα, Gβ y Gγ 1,2.
Los GPCR se clasifican en varias clases, incluyendo Clase A similar a la rodopsina, familia de receptores de secretina de clase B, glutamato de clase C, receptores de feromonas de apareamiento fúngico de clase D, receptores de AMP cíclico de clase E y clase F Frizzled/Smoothened 3,4. Como su nombre indica, la subclase de clase A similar a la rodopsina GPCR incluye la rodopsina, el GPCR crítico responsable de la fototransducción y la función visual. La rodopsina contiene todas las características clave pertinentes y los elementos estructurales que se encuentran en el modelo canónico de GPCR, incluidos los siete dominios helicoidales TM mencionados anteriormente, los seis bucles extracelulares e intracelulares, y la asociación con una proteína G heterotrimérica, también conocida como transducina (Gt) en los fotorreceptores 1,5,6,7. Dentro del bolsillo de unión de la rodopsina, el 11-cis-retinal, el ligando cromóforo sensible a la luz, se une a la rodopsina en la lisina 296 a través de un enlace covalente de la base de Schiff, formando así 11-cis-retinilideno 1,8. Tras la absorción de un fotón, el 11-cis-retinilideno se fotoisomeriza en todo trans-retinilideno, induciendo un cambio conformacional dentro de la rodopsina. Por lo tanto, el ligando 11-cis-retinal es fundamental para la función de la rodopsina GPCR, y se debe mantener continuamente un suministro robusto y eficiente de 11-cis-retinal para superar la alta tasa de recambio dentro de los fotorreceptores.
Los retinaldehídos, como el 11-cis-retinal, pertenecen a un grupo de moléculas llamadas colectivamente retinoides, y los retinoides biológicamente relevantes se conocen más ampliamente como vitamina A. Los retinoides se caracterizan por un grupo extremo cíclico conectado a una cadena de polieno conjugada, con un grupo extremo polar en el otro extremo. Los retinaldehídos y las vitaminas asociadas a la vitamina A no son una excepción a esta caracterización, ya que contienen el anillo de β-ionona como grupo final cíclico, una cadena de polieno diterpénico y un grupo terminal polar diferente según el vitámero, es decir, grupo aldehído para los retinaldehídos, grupo hidroxilo para los retinoles, grupo carboxilo para los ácidos retinoicos, enlace éster para los ésteres de retinilo, etc (Figura 1)9,10.
Los mamíferos no pueden sintetizar vitamina A de novo, pero las plantas sí; Por lo tanto, todos los retinoides dentro de los sistemas de mamíferos deben originarse en la dieta de los productores de origen vegetal y llegar a los consumidores en la cadena alimentaria. En el modelo canónico del metabolismo de la vitamina A, el β-caroteno, la planta arquetípica provitamina A, se absorbe en el enterocito intestinal a través del receptor eliminador de clase B, miembro 1 (SCARB1), escindido en dos moléculas de todo trans-retinal por la β-caroteno oxigenasa 1 (BCO1/BCMO1), que se une a la proteína de unión al retinaldehído 2 (RBP2) y se reduce a todo trans-retinol por retinol deshidrogenasas (RDH), convertido en ésteres de retinilo por lecitina retinol aciltransferasa (LRAT), y luego enviado al torrente sanguíneo en quilomicrones 11,12,13,14. Los ésteres de retinilo, como el palmitato de retinilo, por otro lado, sirven como la provitamina A predominante de origen animal. El palmitato de retinol de la luz intestinal se hidroliza en todo trans-retinol por la carboxilésterasa 1 (CES1) y se difunde en el enterocito intestinal15. El hígado es el principal órgano de almacenamiento y homeostático para la homeostasis de la vitamina A, que absorbe los ésteres de retinilo dentro de estos quilomicrones, que se hidrolizan en todo trans-retinol unido a la proteína celular de unión al retinol 1 (CRBP1) por hidrolasas de éster de retinilo, ingresa a las células estrelladas hepáticas y LRAT lo convierte nuevamente en ésteres de retinilo para su almacenamiento 13,16, Artículo 17. Para mantener un nivel homeostático de vitamina A en el organismo, el hígado libera vitamina A en forma de trans-retinol unido a un complejo de transporte sérico, formado por la proteína 4 de unión al retinol (RBP4) y la transtiretina (TTR)15,18,19. Este complejo se denominará holo-RBP4 en este manuscrito.
Para utilizar este suministro sistémico de vitamina A en la sangre, los tejidos sistémicos, incluido el tejido ocular donde se mantiene una fuente robusta de vitamina A, deben tener un método para absorber holo-RBP4 en el tejido. Dentro de la retina rica en fotorreceptores en el tejido ocular, el receptor de membrana estimulado por el ácido retinoico 6 (STRA6) es el transportador implicado en esta función. En estudios mecanicistas, se ha demostrado que STRA6 es capaz de facilitar la ingesta de todo-trans-retinol extracelular de holo-RBP4 en el RPE20. Este todo-trans-retinol importado entrará entonces en el ciclo visual, que es el proceso por el cual el todo-trans-retinol se convierte en 11-cis-retinal dentro del EPR y el segmento externo del fotorreceptor, facilitando así la función visual cuando se une a la rodopsina 9,21.
Una vez que el trans-retinol circulatorio del holo-RBP4 circulatorio cruza la barrera hematorretiniana hacia el EPR dentro del tejido ocular a través de STRA6, el trans-retinol completo en el EPR se esterifica primero en ésteres de retinilo por LRAT, luego se hidroliza en 11-cis-retinol por la proteína de 65 kDa específica del epitelio pigmentario de la retina (RPE65). A continuación, el 11-cis-retinol se convierte en 11-cis-retinal por la retinol deshidrogenasa 5. Este 11-cis-retinal es transportado al segmento externo del fotorreceptor (OS) por la proteína de unión al retinoide interfotorreceptor (IRBP)9,21. Dentro del retículo endoplásmico que rodea el núcleo fotorreceptor dentro de la capa nuclear externa (ONL), los GPCR opsina se sintetizan y transportan a través del cilio de conexión (CC). Las proteínas motoras que están involucradas en este transporte a través del CC son polémicas, pero las hipótesis actuales implican el transporte intraflagelar (IFT) basado en kinesina y dineína o el transporte basado en miosina como probables facilitadores de este proceso 14,22,23,24,25,26. Una vez que estos dos componentes se encuentran dentro de los discos membranosos dentro del sistema operativo, el 11-cis-retinal y la opsina forman 11-cis-retinilideno a través de un enlace covalente de base Schiff en lisina 196 en rodopsina, listo para la fototransducción8.
Si bien la expresión de STRA6 dentro del EPR de la retina ayuda a facilitar la ingesta de todo el trans-retinol del holo-RBP4, no se encontró que STRA6 se expresara en el hígado, a pesar de su papel como el principal órgano homeostático de la vitamina A y de exhibir capacidades para la ingesta de todo el trans-retinol del holo-RBP4 15,19,27,28, 29,30,31. Eventualmente, se descubrió un receptor análogo llamado receptor 2 de la proteína 4 de unión al retinol (RBPR2), que exhibe la capacidad de ingerir todo el trans-retinol del holo-RBP4, al igual que el STRA6, pero se expresa en el tejido hepático32.
Por lo tanto, una comprensión completa del papel de la rodopsina en la función visual requiere una comprensión de los procesos biológicos que culminan en la regeneración del pigmento visual. Esto, a su vez, está íntimamente relacionado con los procesos descritos anteriormente, incluido el metabolismo de los precursores de la provitamina A, el almacenamiento dentro del hígado, la liberación de holo-RBP4 por el hígado y la eventual absorción de holo-RBP4 a través de los receptores de membrana STRA6 y RBPR2. Como se mencionó anteriormente, los modelos animales como los ratones siguen siendo uno de los principales modelos en el estudio de tales procesos. Por lo tanto, nos gustaría presentar un método de extracción de retinoides en tejido murino, así como un método de cromatografía líquida de alta resolución (HPLC) en fase normal que puede detectar y cuantificar estos retinoides. Con estos métodos, los retinoides importantes descritos anteriormente, como el ligando de rodopsina 11-cis-retinal o el retinoide de transporte principal, el todo-trans-retinol, pueden analizarse en órganos oculares, hepáticos y sistémicos. Al evaluar el suministro de retinoides en el tejido murino, se puede avanzar aún más en nuestra comprensión de los estados de enfermedad y las patologías relacionadas con el suministro logístico de retinoides.
Además de funcionar como un cromóforo en la función visual a través de la asociación con OPSINA GPCRs, los retinoides también juegan un papel importante en la señalización de las células de mamíferos a través de la señalización del ácido retinoico, facilitada por dos familias de receptores nucleares, los receptores de ácido retinoico (RARA) y los receptores X de retinoides (RXR), que se unen directamente al ADN y regulan la transcripción génica33. Estas dos familias o receptores utilizan retinoides en forma de ácidos retinoicos como ligando. Se ha demostrado que los RAR tienen afinidad tanto por el ácido trans-retinoico como por el ácido 9-cis-retinoico, mientras que los RXRs expresan afinidad solo por el ácido 9-cis-retinoico 34,35. Los ácidos retinoicos en cantidades no controladas son teratogénicos, y la señalización del ácido retinoico debe ser extremadamente controlada36. La producción de ácidos retinoicos para la señalización debe ocurrir localmente y en puntos de tiempo muy específicos para el desarrollo adecuado de los tejidos, como en el desarrollo del cerebro posterior y las extremidades, pero muchos otros ejemplos utilizan la señalización del ácido retinoico37,38. Dentro de las células que participan en la señalización del ácido retinoico, los ácidos retinoicos son sintetizados por dos grupos de enzimas, las alcohol/retinol deshidrogenasas (ADHs/RDHs) que facilitan la oxidación de los retinoles ingeridos por STRA6 o RBPR2 a los retinaldehídos, y las retinaldehído deshidrogenasas (RALDHs) que facilitan la oxidación de los retinaldehídos a ácidos retinoicos39. Si bien no participan en la señalización de GPCR per se, los ácidos retinoicos se presentan como un retinoide crucial que también funciona como ligando para los receptores de señalización.
Aunque no se describen en detalle aquí, nos gustaría reconocer los métodos previamente establecidos para la detección de retinoides mediante HPLC en diversos contextos, como en la investigación alimentaria y el estudio de la rodopsina microbiana. Estos métodos emplean diferentes objetivos y enfoques para la detección de retinoides, incluido el uso de técnicas de fase inversa que requieren fases móviles menos volátiles y peligrosas 40,41,42, la detección de ácidos retinoicos y sus isómeros asociados 40,41, y la purificación y extracción de diferentes fuentes biológicas43. Nuestro método se centra específicamente en la detección de palmitato de retinilo, isómeros de retinaldehído e isómeros de retinol en tejidos de mamíferos. Se deben considerar diferentes protocolos si el caso de uso previsto difiere de esta aplicación específica.
Protocolo
NOTA: Todos los experimentos con animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Minnesota (protocolo # 2312-41637A) y se realizaron de acuerdo con la Declaración de ARVO para el Uso de Animales en la Investigación Oftálmica y de la Visión. Realice todas las extracciones en la oscuridad, bajo una luz roja tenue para iluminar. Tenga en cuenta la luz residual emitida por las pantallas de los instrumentos y los LED de los accesorios.
1. Generación de patrones de retinoides espectrofotométricos y generación de curvas estándar externas
NOTA: Prepare un recipiente de hielo seco para el almacenamiento temporal de retinoides antes del análisis con la HPLC.
- Pesar una cantidad arbitraria pero apropiada de retinoides y disolverlos en un disolvente apropiado para su cuantificación mediante espectrofotometría.
NOTA: El solvente de elección utilizado en este estudio es el etanol, y los valores de absorción molar de los retinoides disueltos en etanol se detallan en la Tabla 1. Se debe utilizar etanol anhidro de grado HPLC para disolver patrones y muestras. El etanol purificado únicamente a través de la destilación forma una mezcla azeotrópica con agua, que contiene aproximadamente un 4% de agua por volumen. El agua es inmiscible con la fase móvil hexanoica y dará lugar a la hidratación de la fase estacionaria de sílice, lo que conducirá a la eventual degradación de la columna. - Utilizando la Ley de Beer-Lambert y la absortividad molar del retinoide pertinente, cuantificar la concentración del patrón generado (Tabla 1).
Absorbancia = absorbencia molar (ε) × concentración molar × longitud del trayecto - Realice diluciones en serie para crear concentraciones que puedan generar una curva estándar dentro del rango de cuantificación para el tejido deseado.
NOTA: Tenga en cuenta las limitaciones fundamentales de la Ley de Beer-Lambert, como su falta de validez con altas concentraciones de analito. Para evitar este problema, los patrones de retinoides diluidos deben evitar generar valores de absorbancia superiores a 1. Para nuestras aplicaciones en la cuantificación de retinol y retinaldehído en órganos murinos, encontramos que una curva de calibración con un rango de 1-10 ng era capaz de cubrir las cantidades típicas encontradas. Para la cuantificación del palmitato de retinilo en hígado murino, encontramos que una curva de calibración con un rango de 20-80 μg fue capaz de cubrir las cantidades típicas encontradas. - Al alterar gradualmente el volumen de inyección de la solución madre previamente creada, alterando así gradualmente la cantidad inyectada de retinoide, integre los picos para generar una curva estándar externa adecuada para la cuantificación de retinoides donde la integración de picos es directamente proporcional a la cantidad de retinoide inyectado.
2. Recolección de tejidos y recolección de muestras
NOTA: Prepare un recipiente de hielo seco para el almacenamiento temporal de tejido antes de la homogeneización del tejido y la extracción de retinoides. Las cantidades recomendadas de recolección de tejidos se detallan en la Tabla 2. Para tener en cuenta las variaciones de los retinoides debidas a las variaciones en el contenido sanguíneo de cada tejido, la extracción de tejido debe realizarse en ratones completamente perfundidos, y la extracción de sangre debe completarse en ratones separados.
- Sacrificar a los ratones siguiendo las pautas establecidas por el protocolo dictado por el Comité Institucional de Cuidado y Uso de Animales (IACUC) (asfixia por CO2 aquí).
- Sangre: Inmediatamente después de la eutanasia, decapitar a los ratones con unas tijeras y drenar la sangre del tronco principal de los ratones en un tubo de 1,5 ml.
- Ojo: Con un par de fórceps, retire los ojos de la cabeza decapitada.
- Cerebro: Con unas tijeras pequeñas, corte la cabeza decapitada y extraiga el cerebro con un par de pinzas.
- Riñón, hígado, bazo, corazón y pulmón: Con unas tijeras pequeñas, haga una incisión en el abdomen, corte en la dirección superior a lo largo de la línea media y corte a través del esternón y la caja torácica. Retire el tejido expuesto con un par de pinzas.
3. Homogeneización de tejidos
NOTA: Si se desea el análisis de particiones más pequeñas de órganos, como en órganos más grandes (por ejemplo, tejido hepático o pulmonar), se debe homogeneizar todo el órgano para evitar diferencias en el contenido de retinoides en diferentes partes del tejido. En su lugar, divida el homogeneizado si se desean cantidades más pequeñas de tejido. En la Figura 2 se detalla un esquema del protocolo. Este protocolo modificado fue adaptado de Kane y Napoli44.
- Coloque el pañuelo en el tubo triturador de pañuelos, junto con un 50% de solución salina helada (0,9%) y un 50% de metanol. Consulte la Tabla 2 para conocer el volumen utilizado para cada tipo de tejido.
- Coloque el mortero en el tubo del molinillo, realice lenta y suavemente cinco rotaciones completas con el mortero para obtener un homogeneizado.
- Transfiera las muestras a tubos de 15 ml inmediatamente después de la homogeneización.
- Añadir 2 mL de metanol y dejar reposar durante 15 min a temperatura ambiente.
NOTA: Si se desea el análisis de derivados de óxido de retinaldehído, agregue 1 mL de clorhidrato de hidroxilamina 0.1 M en HEPES 0.1 M (pH 6.5) (Figura 1).
4. Extracción de retinoides
PRECAUCIÓN: El hexano es altamente inflamable, altamente volátil y altamente tóxico. Se deben usar respiradores, protección para los ojos, guantes de butilo y una campana extractora aprobados por el Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) cuando se manipula hexano. Al evaporar el hexano de las muestras, se recomienda algún tipo de aparato de circulación de aire mejorado para evitar la acumulación de humo de solvente, por ejemplo, un aparato de succión de snorkel.
- Agregue 10 mL de hexano al homogeneizado y mezcle el tubo horizontalmente durante al menos 10 s.
NOTA: Es fundamental que las fases se mezclen completamente. - Centrifugar la mezcla de homogeneado/hexano durante 3 min a 1.000 × g para facilitar la separación de fases.
- Realice la extracción 2 veces para asegurar la extracción total de los retinoides del homogeneizado. Repita los pasos 4.1 y 4.2.
- Extraiga la capa de hexano con una pipeta y coloque la capa de hexano en un juego separado de tubos de vidrio de 15 ml para la evaporación al vacío.
NOTA: Para la evaporación, utilice tubos GLASS de 15 mL para evitar la adhesión de retinoides a las paredes del tubo. - Usando una centrífuga de vacío, evapore completamente el hexano.
5. Análisis de resuspensión y HPLC
NOTA: Dado que el sistema de HPLC utilizado en este manuscrito era un sistema de bomba binaria, la fase móvil de cuatro componentes se premezcló en una botella singular antes de su funcionamiento.
PRECAUCIÓN: Los cuatro solventes orgánicos utilizados en este método son altamente inflamables, altamente volátiles y altamente tóxicos. El 1,4-dioxano es susceptible a la formación explosiva de peróxido tras la exposición al oxígeno. Mantenga cerrados todos los recipientes que contengan 1,4-dioxano cuando no estén en uso. Se deben usar respiradores, protección para los ojos, guantes de butilo y una campana extractora aprobados por el Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) cuando se manipulan estos solventes. Mientras se ejecutan estos solventes en una HPLC, se recomienda algún tipo de aparato de circulación de aire mejorado para evitar la acumulación de humo de solvente, por ejemplo, un aparato de succión de snorkel.
- Vuelva a suspender el tubo seco de 15 ml con 100 μl de hexano; pozo de vórtice para asegurarse de que todos los retinoides se disuelvan.
- Pipetee los 100 μL de hexano en un solo inserto de vidrio para el análisis por HPLC.
- Configurar la ejecución de HPLC (adaptado de Landers y Olson45): fase móvil: 85,4% de hexano (v/v), 11,2% de acetato de etilo (v/v), 2% de dioxano (v/v), 1,4% de 1-octanol (v/v); columna: dos columnas de 4,6 mm de diámetro interno x 250 nm, 5 μm, conectadas en serie; un termostato multicolumna Temperatura: 25 °C; volumen de inyección: 100 μL; caudal: 1 mL/min; Duración: 40 min. Utilice la detección de absorbancia del espectro UV; mantenga la opción marcada para adquirir el espectro UV de 200 nm a 400 nm.
6. Identificación e integración de picos
- Identifique los picos utilizando el tiempo de retención y los espectros UV de cada retinoide de interés, según se observe a partir del análisis de los estándares de retinoides (Figura 3, Tabla 3 y Tabla 4).
- Utilizando el sistema de datos cromatográficos del sistema de HPLC elegido, integre los picos identificados. La integración, o área bajo la curva, es directamente proporcional a la cantidad de analito. Consulte la curva estándar externa generada en el paso 1 para cuantificar el analito.
- Para el análisis de cromatogramas generados a partir de tejido biológico, utilice la integración manual en lugar de la integración automática que ofrecen los sistemas de datos cromatográficos típicos, ya que a menudo se observan variabilidades en parámetros como el tiempo de retención en dichas muestras.
- Asegúrese de que los cromatogramas no presenten irregularidades que puedan indicar problemas durante la ejecución, como líneas de base ruidosas o picos no gaussianos. Estos problemas indican contaminantes en la HPLC o desgaste en las columnas y deben rectificarse para que el análisis sea válido.
Resultados
Aquí, utilizamos el método descrito anteriormente para detectar y cuantificar retinoides en tejido ocular y sistémico murino y generamos cromatogramas representativos. Además, daremos un resumen de los retinoides típicos que se pueden detectar en estos tejidos.
A los 6 meses de edad, los ratones fueron sacrificados mediante asfixia por CO2 . Para mantener el contenido de retinoides oculares, los ratones se adaptaron a la oscuridad durante 2 días antes de la eutanasia y la extracción. Se extrajeron dos ojos, 0,2 g de hígado y 75 μL de sangre para la extracción de retinoides y el posterior análisis por HPLC. Para el tejido ocular, se extrajo un ojo sin la adición de hidroxilamina, mientras que el otro se sometió a un tratamiento con hidroxilamina. Para el hígado y la sangre, no fue necesario el tratamiento con hidroxilamina, ya que los retinaldehídos no se detectan típicamente en estos tejidos.
En el cromatograma del ojo de ratón no tratado con hidroxilamina, se identificó 13-cis-retinal, uno de los dos isómeros de retinaldehído no canónicos. Además, se identificaron tanto el 11-cis-retinal como el all-trans-retinal, los dos isómeros canónicos del retinaldehído. En ambos cromatogramas, se identificó el ciclo visual intermedio 11-cis-retinol, así como el principal transporte de vitamina A de todo-trans-retinol (Figura 4A).
En el cromatograma del ojo de ratón tratado con hidroxilamina, todos los isómeros de retinaldehído mencionados anteriormente seguían presentes. Sin embargo, los tiempos de retención de estos isómeros aumentaron significativamente. Además, estos isómeros de retinaldehído ahora están presentes como isómeros syn y anti. Durante la cuantificación a través de la integración de picos, se deben sumar los picos syn y anti para obtener un valor de integración preciso. Tanto el 11-cis-retinol como el todo-trans-retinol seguían presentes (Figura 4B).
En el cromatograma de tejido hepático de ratón, se identificaron palmitato de retinol y all-trans-retinol dentro de estos tejidos. El palmitato de retinilo, un éster de retinilo, sirve como la principal forma de almacenamiento de vitamina A en los mamíferos y se puede encontrar en cantidades significativas dentro del tejido hepático de los mamíferos. El hígado libera vitamina A en los tejidos sistémicos como holo-RBP4, que contiene todo trans-retinol dentro del complejo RBP4-transtritina. Posteriormente, se puede identificar un gran pico de trans-retinol dentro de este cromatograma (Figura 4C).
En el cromatograma de sangre de ratones, se identificó un gran pico de trans-retinol. Dado que el holo-RBP4 del hígado se libera a los tejidos sistémicos a través del sistema circulatorio, esto es lo esperado (Figura 4D). La absorbancia característica del espectro UV (~250-400 nm) de las isoformas de retinoides en los picos de HPLC resueltos dependientes del tiempo puede ser útil en la confirmación cruzada inicial de la calidad de la presencia de la isoforma en un pico respectivo particular (Figura 5).

Figura 1: Estructuras químicas de los retinoides. (A) Estos retinoides se encuentran típicamente en el tejido murino extraído. Obsérvese los diferentes grupos de extremos polares, así como las diferentes ubicaciones de los dobles enlaces cis en los isómeros retinoides. (B) La conversión de retinaldehídos en oximas de retina aumenta la eficiencia de extracción, evita la coelución de picos con palmitato de retinilo, así como la coelución dentro de los isómeros de retinaldehído. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Flujo de trabajo para la recolección de tejidos, homogeneización, extracción y análisis de retinoides. Se homogeneizaron y extrajeron retinas y muestras de tejido de ratones adaptados a la oscuridad. Paso 1: Después de sacrificar a los ratones de acuerdo con las pautas, se recolecta sangre y varios tejidos. Pasos 2-4: A continuación, se realiza la homogeneización de los tejidos con solución salina y metanol, con clorhidrato de hidroxilamina para los análisis cuantitativos. Pasos 5-7: Los retinoides se tratan con hexano, seguido de evaporación. Pasos 8,9: Resuspendido con 100 μL de hexano para asegurarse de que todos los retinoides se disuelvan. Paso 10: Finalmente, las muestras se analizan mediante HPLC. Abreviatura: HPLC = Cromatografía líquida de alta resolución. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Cromatograma de patrones de retinoides y patrones de retinoides tratados con hidroxilamina. (A) Este cromatograma contiene palmitato de retinilo, 13-cis-retinal, 11-cis-retinal, all-trans-retinal, 11-cis-retinol, 13-cis-retinol y estándares all-trans-retinol. (B) Este cromatograma contiene palmitato de retinol, 13-cis-retinal, 11-cis-retinal, all-trans-retinal, 11-cis-retinol, 13-cis-retinol y todos los estándares de trans-retinol. Este cromatograma contiene los isómeros de retinaldehído syn y anti oxima, además de los isómeros de retinol. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Cromatogramas representativos. (A) Cromatograma representativo del tejido ocular de ratón. Este cromatograma contiene retinoides que se encuentran típicamente en el tejido ocular murino, incluidos los isómeros de retinaldehído, además de los isómeros de retinol. (B) Cromatograma representativo de tejido ocular de ratón tratado con hidroxilamina. Tenga en cuenta que en lugar de los retinaldehídos no modificados químicamente que se encuentran en los cromatogramas anteriores (Figura 4A), este cromatograma contiene los isómeros syn y anti oxima retinaldeyde, además de los isómeros de retinol. (C) Cromatograma representativo del tejido hepático de ratón. Este cromatograma contiene retinoides que se encuentran típicamente en el tejido hepático murino, incluyendo palmitato de retinol y all-trans-retinol. (D) Cromatograma representativo de la sangre de ratón. Este cromatograma contiene retinoides que se encuentran típicamente en la sangre murina, incluyendo el trans-retinol completo. Haga clic aquí para ver una versión más grande de esta figura.
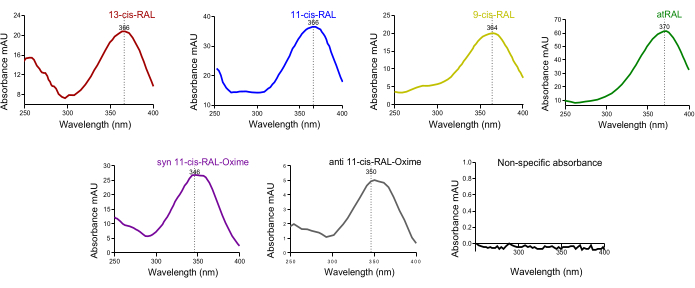
Figura 5: Espectro de absorbancia UV de isómeros de retinaldehído de tejido ocular murino. Espectros de absorbancia de (A) 13-cis-retinal, (B) 11-cis-retinal, (C) 9-cis-retinal, (D) all-trans-retinal, (E) oxima sin-11-cis-retinal, (F) oxima anti 11-cis-retinal. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Descripción general de los módulos de HPLC, flujo de fase móvil y otra instrumentación. El flujo de fase móvil comienza desde las botellas de disolvente preparadas y es bombeado a alta presión por la bomba binaria al muestreador automático, donde el analito se incorpora al flujo de disolvente. La fase móvil y el analito llegan al compartimento de la columna con temperatura regulada y, por último, al detector de matriz de diodos para su medición. (A) Pantalla de monitor teñida de rojo que minimiza la fotoisomerización de retinoides. (B) Bomba binaria. (C) Muestreador de viales. (D) Termostato multicolumna. (E) Detector de matriz de diodos. (F) Colector de fracciones analíticas. (G) Contenedor de residuos de polietileno de alta densidad. (H) De izquierda a derecha, tapa de engarce de aluminio, inserto de 250 μL con pies de polímero, vial superior de engarzado teñido de ámbar, ensamblaje final del vial de inyección. (I) Izquierda, centrífuga refrigerada. Derecha, concentrador centrífugo. Haga clic aquí para ver una versión más grande de esta figura.
| Compuesto | Absorción molar (ε) | Solvente | Referencia |
| Palmitato de retinilo | 49260 | Etanol | Hubbard et al.49 |
| 13-cis-Retinal | 35500 | Etanol | Hubbard et al.49 |
| 11-cis-Retinal | 24935 | Etanol | Hubbard et al.49 |
| 9-cis-Retinal | 36100 | Etanol | Robeson et al.51 |
| Totalmente trans-retiniano | 42880 | Etanol | Hubbard et al.49 |
| 11-cis-Retinol | 34890 | Etanol | Hubbard et al.49 |
| 13-cis-Retinol | 48305 | Etanol | Robeson et al.50 y Robeson et al.51 |
| All-trans-Retinol | 52770 | Etanol | Hubbard et al.49 |
Tabla 1: Absorción molar de retinoides en etanol. Los valores de absorción molar de los retinoides se obtuvieron de Kane y Napoli44, Hubbard et al.46, Robeson et al.47 y Robeson et al.48. La absorción molar depende del disolvente. Los valores enumerados aquí son específicos de los retinoides disueltos en etanol.
| Tejido | Cantidad de recolección de tejido | Volumen para homogeneización |
| Sangre | 75 μL | N/A |
| Hígado | 0,2 g | 2 mL |
| Riñón | 2 riñones enteros | 2 mL |
| Piel | 0,2 g | 1 mL – 1.5 mL |
| Bazo | 1 bazo entero | 1 mL |
| Ojo | Ambas Retina, piscina 4 Retina | 1 mL |
| Cerebro | 1 Cerebro entero | 2 mL |
| Corazón | 1 Corazón entero | 1 mL |
| Pulmón | 0,2 g | 2 mL |
Tabla 2: Cantidad de tejido recomendada por análisis. Cantidad de tejido por análisis y volumen de 50% de solución salina helada (0,9%) y 50% de metanol para la homogeneización de tejidos, según lo recomendado por Kane y Napoli44.
| Compuesto | Tiempo de retención (min) | Máximos de absorbancia UV (nm) |
| Palmitato de retinilo | 5.177 | 326 |
| 13-cis-Retinal | 7.268 | 366 |
| 11-cis-Retinal | 7.691 | 366 |
| 9-cis-Retinal | 7.931 | 364 |
| Totalmente trans-retiniano | 8.993 | 370 |
| 11-cis-Retinol | 17.003 | 318 |
| 13-cis-Retinol | 17.83 | 328 |
| All-trans-Retinol | 23.933 | 326 |
Tabla 3: Tiempos de retención y longitudes de onda máximas de absorbancia de los retinoides. Estos valores se observaron cuando se utilizaron con el método descrito y la fase móvil, tal como se detectaron con el detector de matriz de diodos de referencia.
| Compuesto | Tiempo de retención (min) | Máximos de absorbancia UV (nm) |
| Syn 11-cis-Oxima retiniana | 9.59 | 346 |
| Syn Oxima All-Trans-Retinal | 10.6 | 356 |
| Syn 13-cis-Oxima retiniana | 11.3 | 352 |
| Oxima retiniana anti 13-cis | 13 | 356 |
| Oxima retiniana anti 11-cis | 15.1 | 350 |
| Anti Oxima All-Trans-Retinal | 19.7 | 360 |
Tabla 4: Tiempos de retención y longitudes de onda de absorbancia máxima de los retinaldehídos tratados con hidroxilamina, lo que da lugar a isómeros syn y anti oxima de cada retinaldehído. Estos valores se observaron cuando se utilizaron con el método descrito y la fase móvil, tal como se detectaron con el detector de matriz de diodos de referencia.
Discusión
En este método, la HPLC de fase normal se utiliza para detectar y cuantificar los retinoides relevantes, incluidos los ésteres de retinilo, los retinaldehídos y los retinoles. Dada la importancia del 11-cis-retinal como cromóforo crítico en la activación de la rodopsina GPCR, un método que pueda detectar los metabolitos que están relacionados con la producción de 11-cis-retinal es fundamental para el estudio de la función visual general. La principal ventaja de este método es que todos los isómeros relevantes de los retinaldehídos y los retinoles se pueden detectar y cuantificar simultáneamente con una sola ejecución. Dado lo escasos que son los tejidos experimentales viables, este método permite un uso eficiente del tejido en la detección de retinoides. Si bien se ha informado del uso de fases móviles basadas en hexano y acetato de etilo en la separación de retinoides49, la adición de 1,4-dioxano y 1-octanol mejora la resolución de los isómeros de retinoides. El 1,4-dioxano es necesario para la resolución del 13-cis-retinol y el 11-cis-retinol50, mientras que los alcoholes de cadena larga como el 1-octanol mejoran aún más la separación de los isómeros del retinol 45,51,52.
Para la cuantificación de los isómeros de retinaldehído se requiere una conversión previa a las correspondientes oximas de retinaldehído con hidroxilamina, ya que el grupo aldehído reactivo es propenso a reaccionar con otras biomoléculas como proteínas y lípidos 45,53,54. Las oximas de retinaldehído se extraen más fácilmente y hacen que los picos de retinaldehído se eluyan más tarde en la carrera, evitando así la coelución máxima con el grupo desconocido de picos y el pico de palmitato de retinol que eluye a ~ 5-8 min para los tejidos biológicos. El tratamiento de los retinaldehídos con hidroxilamina también evita la coelución de retinaldehídos con tiempos de elución similares45. La conversión en oximas de retinaldehído genera isómeros syn y anti, que eluyen en dos momentos diferentes con dos picos diferentes para cada isómero de retinaldehído. La integración de ambos picos debe sumarse para cuantificar adecuadamente cada isómero de retinaldehído. Además del tiempo de retención, los espectros UV proporcionan otra métrica que se puede utilizar en la identificación de picos. Cada retinoide exhibe un máximo de absorbancia UV ligeramente diferente. Cuando se tienen en cuenta junto con el tiempo de retención, estas dos métricas permiten la identificación precisa de los picos (Tabla 3 y Tabla 4).
Si bien se espera la presencia de isómeros canónicos de retina como 11-cis-retinal y all-trans-retinal en el tejido ocular, siendo 11-cis-retinal el cromóforo crítico del ligando de rodopsina y all-trans-retinal el ligando fotoisomerizado, otros isómeros de retinaldehído no canónicos se detectan con este método. En particular, el 13-cis-retinal se detectó fácilmente en series de HPLC de tejido ocular murino durante nuestro análisis (Figura 4A-D). La aparición de estos retinaldehídos no canónicos no es completamente inesperada, sin embargo, tanto el 13-cis-retinal como el 9-cis-retinal son subproductos conocidos que resultan del estrés inducido por la luz sobre la retina 55,56. Estos isómeros de retinaldehído no participan en la conocida vía canónica de la cascada de fototransducción y sus destinos metabólicos siguen siendo relativamente desconocidos. Sin embargo, se ha demostrado que el 9-cis-retinal también se une de manera estable al bolsillo de unión de la rodopsina, formando isorodopsina. El papel de la isorodpsina aún no se ha caracterizado completamente, pero los estudios han demostrado que la isorodopsina exhibe capacidades fotosensibles muy parecidas a la rodopsina57,58 basada en 11-cis-retinal. Como mínimo, la capacidad del 9-cis-retinal para formar isorodopsina de manera estable y fotoisomerizarse en todo trans-retinal proporciona una explicación razonable para su ausencia en nuestro análisis de HPLC56. Por otro lado, no se ha demostrado que el 13-cis-retinal participe en ninguna vía bioquímica ocular conocida, y su acumulación dentro del tejido ocular podría resultar en estrés oxidativo dentro de la retina 55,59,60.
Aunque el 9-cis-retinal no se encuentra típicamente en el tejido murino, debe mencionarse que el método tratado con hidroxilamina no es un método viable para la separación y cuantificación del 9-cis-retinal. Los picos de syn 9-cis-retinal y syn 13-cis-retinal coeluyen a los 11,2 min. En los casos en los que se esperan cantidades significativas de 9-cis-retinal, como cuando se aplica exógenamente, solo será posible la cuantificación de la combinación de 9-cis-retinal y 13-cis-retinal. Para la identificación cualitativa, la realización del método sin tratar el tejido con hidroxilamina permite la separación completa de los picos 13-cis-retinales y 9-cis-retinales.
Además del tejido ocular, este método también se puede aplicar fácilmente al tejido sistémico. Si bien los retinaldehídos en sus diversas formas isoméricas generalmente no se encuentran en el tejido sistémico, el trans-retinol unido a la proteína 4 de unión al retinol (holo-RBP4) es la principal forma de transporte de vitamina A en los organismos mamíferos y el trans-retinol se puede detectar fácilmente en la sangre utilizando este método. Además de en la sangre, el trans-retinol también se puede detectar en todos los tejidos sistémicos. Por lo tanto, con este método, se puede crear un perfil retinoide sistémico completo de todo el tejido.
Dado que los retinaldehídos, especialmente el ligando crítico de rodopsina 11-cis-retinal, son extremadamente susceptibles a la fotoisomerización, es fundamental que se tomen medidas preventivas para evitar la exposición accidental a la luz durante cualquiera de los pasos descritos anteriormente. Además de las fuentes obvias de la iluminación de la habitación y los paneles de instrumentos, hemos descubierto que la luz errante de los LED accesorios en varios instrumentos, como los que se encuentran detrás de los instrumentos, incluido el propio HPLC, son fuentes importantes de exposición accidental a la luz (Figura 6). Además, hemos descubierto que una sala oscura dedicada era vital para el manejo adecuado de los isómeros de retinaldehído y los tejidos experimentales. Además de la minimización de la luz, recomendamos que el tejido se procese de forma rápida y oportuna después de la eutanasia y la recolección, ya que la degradación de los isómeros del retinaldehído se produce incluso en ausencia de luz. Lo ideal es que la recolección de tejidos, la extracción y el análisis por HPLC se completen el mismo día.
El tejido que no se procesa inmediatamente debe almacenarse en la oscuridad a -80 °C y no debe almacenarse durante más de una semana antes del procesamiento. Como se mencionó anteriormente, todos los solventes utilizados en la fase móvil y en los pasos de extracción en el método anterior son altamente tóxicos, volátiles e inflamables. Se deben utilizar procedimientos y equipos adecuados al manipular estos solventes peligrosos. El equipo de protección personal (EPP) adecuado, como guantes de butilo, respiradores aprobados por NIOSH y protección para los ojos, debe usarse antes de manipular solventes, y todas las transferencias de solventes deben realizarse dentro de una campana extractora. Tenga en cuenta que el 1,4-dioxano es susceptible a la formación explosiva de peróxido tras la exposición al oxígeno y mantenga todos los recipientes de solventes con 1,4-dioxano herméticamente sellados del aire.
Si un método de HPLC de fase normal es inviable debido a materiales o equipos inadecuados, existen métodos de fase inversa más típicos con disolventes menos volátiles como el acetonitrilo y el agua para detectar y cuantificar los retinaldehídos y los retinoles. Sin embargo, estos métodos no son capaces de separar los isómeros y solo son capaces de detectar retinaldehídos totales o retinoles totales44,54.
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Este trabajo fue apoyado por las subvenciones de los NIH-NEI (EY030889 y 3R01EY030889-03S1) y en parte por los fondos iniciales de la Universidad de Minnesota para G.P.L. También nos gustaría agradecer al Instituto Nacional del Ojo por proporcionarnos el estándar de retina 11 cis utilizado en este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| 1-Octanol, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 203-917-6 | |
| 1,4-Dioxane, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 204-661-8 | |
| 11-cis-retinal | National Eye Institute | N/A | |
| 11-cis-Retinol | Toronto Research Chemicals | TRC-R252105 | |
| 13-cis-retinal | Toronto Research Chemicals | TRC-R239900 | |
| 13-cis-retinol | Toronto Research Chemicals | TRC-R252110 | |
| All-trans-Retinal | Toronto Research Chemicals | TRC-R240000 | |
| All-trans-Retinol | Toronto Research Chemicals | TRC-R252002 | |
| Ethyl Acetate, suitable for HPLC, ≥99.7% | Sigma-Aldrich, Millipore Sigma | 205-500-4 | |
| Hexane, HPLC Grade | Fisher Scientific, Spectrum Chemical | 18-610-808 | |
| Methanol (HPLC) | Fisher Scienctific | A452SK-4 | |
| Retinyl Palmitate | Toronto Research Chemicals | TRC-R275450 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| Instruments | |||
| 1260 Infinity II Analytical Fraction Collector | Agilent | G1364F | |
| 1260 Infinity II Binary Pump | Agilent | G7112B | |
| 1260 Infinity II Diode Array Detector | Agilent | G7115A | |
| 1260 Infinity II Multicolumn Thermostat | Agilent | G7116A | |
| 1260 Infinity II Vialsampler | Agilent | G7129A | |
| ST40R Refrigerated Centrifuge | Thermo Scientific | TSST40R | |
| Vacufuge Plus Centrifuge Concentrator | Eppendorf | 22820168 | |
| Consumables | |||
| 2 mL Amber Screw Top Vials | Agilent | 5188-6535 | |
| Crimp Cap with PTFE/red rubber septa, 11 mm | Agilent | 5183-4498 | |
| Disposable Glass Conical Centrifuge Tubes | Millipore Sigma | CLS9950215 | |
| Screw cap tube, 15 mL | Sarstedt | 62.554.502 | |
| Vial insert, 150 µL, glass with polymer feet | Agilent | 5183-2088 |
Referencias
- Palczewski, K., et al. Crystal structure of rhodopsin: A G protein-coupled receptor. Science. 289 (5480), 739-745 (2000).
- Rosenbaum, D. M., Rasmussen, S. G. F., Kobilka, B. K. The structure and function of G-protein-coupled receptors. Nature. 459 (7245), 356-363 (2009).
- Alhosaini, K., Azhar, A., Alonazi, A., Al-Zoghaibi, F. GPCRs: The most promiscuous druggable receptor of the mankind. Saudi Pharm J. 29 (6), 539-551 (2021).
- Hu, G. -M., Mai, T. -L., Chen, C. -M. Visualizing the GPCR network: Classification and evolution. Sci Rep. 7 (1), 15495(2017).
- Lerea, C. L., Somers, D. E., Hurley, J. B., Klock, I. B., Bunt-Milam, A. H. Identification of specific transducin α subunits in retinal rod and cone photoreceptors. Science. 234 (4772), 77-80 (1986).
- Gao, Y., Hu, H., Ramachandran, S., Erickson, J. W., Cerione, R. A., Skiniotis, G. Structures of the rhodopsin-transducin complex: Insights into G protein activation. Mol Cell. 75 (4), 781-790.e3 (2019).
- Zhou, X. E., Melcher, K., Xu, H. E. Structure and activation of rhodopsin. Acta Pharmacol Sin. 33 (3), 291-299 (2012).
- Robinson, P. R., Cohen, G. B., Zhukovsky, E. A., Oprian, D. D. Constitutively active mutants of rhodopsin. Neuron. 9 (4), 719-725 (1992).
- Kiser, P. D., Golczak, M., Palczewski, K. Chemistry of the retinoid (visual) cycle. Chem Rev. 114 (1), 194-232 (2014).
- Sani, B. P., Hill, D. L. [3] Structural characteristics of synthetic retinoids. Methods Enzymol. 189, 43-50 (1990).
- Lobo, G. P., Amengual, J., Palczewski, G., Babino, D., von Lintig, J. Carotenoid-oxygenases: Key players for carotenoid function and homeostasis in mammalian biology. Biochim Biophys Acta. 1821 (1), 78-87 (2012).
- Amengual, J., et al. Two carotenoid oxygenases contribute to mammalian provitamin A metabolism. J Biol Chem. 288 (47), 34081-34096 (2013).
- Harrison, E. H. Mechanisms involved in the intestinal absorption of dietary vitamin A and provitamin A carotenoids. Biochim Biophys Acta. 1821 (1), 70-77 (2012).
- Leung, M., et al. The logistical backbone of photoreceptor cell function: Complementary mechanisms of dietary vitamin A receptors and rhodopsin transporters. Int J Mol Sci. 25 (8), 4278(2024).
- Martin Ask, N., Leung, M., Radhakrishnan, R., Lobo, G. P. Vitamin A transporters in visual function: A mini review on membrane receptors for dietary vitamin A uptake, storage, and transport to the eye. Nutrients. 13 (11), 3987(2021).
- Harrison, E. H. Carotenoids, β-apocarotenoids, and retinoids: The long and the short of it. Nutrients. 14 (7), 1411(2022).
- Li, Y., Wongsiriroj, N., Blaner, W. S. The multifaceted nature of retinoid transport and metabolism. Hepatobiliary Surg Nutr. 3 (3), 126-139 (2014).
- D'Ambrosio, D. N., Clugston, R. D., Blaner, W. S. Vitamin A metabolism: An update. Nutrients. 3 (1), 63-103 (2011).
- Yamamoto, Y., et al. Interactions of transthyretin (TTR) and retinol-binding protein (RBP) in the uptake of retinol by primary rat hepatocytes. Exp Cell Res. 234 (2), 373-378 (1997).
- Kawaguchi, R., et al. A membrane receptor for retinol binding protein mediates cellular uptake of vitamin A. Science. 315 (5813), 820-825 (2007).
- Kiser, P. D., Golczak, M., Maeda, A., Palczewski, K. Key enzymes of the retinoid (visual) cycle in vertebrate retina. Biochim Biophys Acta. 1821 (1), 137-151 (2012).
- Radhakrishnan, R., et al. The role of motor proteins in photoreceptor protein transport and visual function. Ophthalmic Genet. 43 (3), 285-300 (2022).
- Solanki, A. K., et al. Loss of motor protein MYO1C causes rhodopsin mislocalization and results in impaired visual function. Cells. 10 (6), 1322(2021).
- Liu, X., Udovichenko, I. P., Brown, S. D. M., Steel, K. P., Williams, D. S. Myosin VIIa participates in opsin transport through the photoreceptor cilium. J Neurosci. 19 (15), 6267-6274 (1999).
- Insinna, C., Besharse, J. C. Intraflagellar transport and the sensory outer segment of vertebrate photoreceptors. Dev Dyn. 237 (8), 1982-1992 (2008).
- Krock, B. L., Mills-Henry, I., Perkins, B. D. Retrograde intraflagellar transport by cytoplasmic dynein-2 is required for outer segment extension in vertebrate photoreceptors but not arrestin translocation. Invest Ophthalmol Vis Sci. 50 (11), 5463-5471 (2009).
- Blaner, W. S. STRA6, a cell-surface receptor for retinol-binding protein: The plot thickens. Cell Metab. 5 (3), 164-166 (2007).
- Bouillet, P., et al. Developmental expression pattern of Stra6, a retinoic acid-responsive gene encoding a new type of membrane protein. Mech Dev. 63 (2), 173-186 (1997).
- Blomhoff, R., Norum, K. R., Berg, T. Hepatic uptake of [3H]retinol bound to the serum retinol binding protein involves both parenchymal and perisinusoidal stellate cells. J Biol Chem. 260 (25), 13571-13575 (1985).
- Kelly, M., von Lintig, J. STRA6: role in cellular retinol uptake and efflux. Hepatobiliary Surg Nutr. 4 (4), 229-242 (2015).
- Quadro, L., et al. The role of extrahepatic retinol binding protein in the mobilization of retinoid stores. J. Lipid Res. 45 (11), 1975-1982 (2004).
- Alapatt, P., et al. Liver retinol transporter and receptor for serum retinol-binding protein (RBP4). J Biol Chem. 288 (2), 1250-1265 (2013).
- Chawla, A., Repa, J. J., Evans, R. M., Mangelsdorf, D. J. Nuclear receptors and lipid physiology: Opening the X-files. Science. 294 (5548), 1866-1870 (2001).
- Heyman, R. A., et al. 9-cis retinoic acid is a high affinity ligand for the retinoid X receptor. Cell. 68 (2), 397-406 (1992).
- Allenby, G., et al. Retinoic acid receptors and retinoid X receptors: interactions with endogenous retinoic acids. Proc Natl Acad Sci USA. 90 (1), 30-34 (1993).
- Das, B. C., et al. Retinoic acid signaling pathways in development and diseases. Bioorg Med Chem. 22 (2), 673-683 (2014).
- Hernandez, R. E., Putzke, A. P., Myers, J. P., Margaretha, L., Moens, C. B. Cyp26 enzymes generate the retinoic acid response pattern necessary for hindbrain development. Development. 134 (1), 177-187 (2007).
- Yashiro, K., et al. Regulation of retinoic acid distribution is required for proximodistal patterning and outgrowth of the developing mouse limb. Dev Cell. 6 (3), 411-422 (2004).
- Duester, G. Families of retinoid dehydrogenases regulating vitamin A function. Eur J Biochem. 267 (14), 4315-4324 (2000).
- Tatum, V., Chow, C. K. Rapid measurement of retinol, retinal, 13-cis-retinoic acid and all-trans-retinoic acid by high performance liquid chromatography. J Food Drug Anal. 13 (3), (2020).
- Teerlink, T., Copper, M. P., Klaassen, I., Braakhuis, B. J. M. Simultaneous analysis of retinol, all-trans- and 13-cis-retinoic acid and 13-cis-4-oxoretinoic acid in plasma by liquid chromatography using on-column concentration after single-phase fluid extraction. J Chromatogr B. Biomed Sci App. 694 (1), 83-92 (1997).
- Egberg, D. C., Heroff, J. C., Potter, R. H. Determination of all-trans and 13-cis vitamin A in food products by high-pressure liquid chromatography. J Agric Food Chem. 25 (5), 1127-1132 (1977).
- Sudo, Y., et al. A microbial rhodopsin with a unique retinal composition shows both sensory rhodopsin II and bacteriorhodopsin-like properties. J Biol Chem. 286 (8), 5967-5976 (2011).
- Kane, M. A., Napoli, J. L. Quantification of endogenous retinoids. Methods Mol Biol. 652, 1-54 (2010).
- Landers, G. M., Olson, J. A. Rapid, simultaneous determination of isomers of retinal, retinal oxime and retinol by high-performance liquid chromatography. J Chromatogr A. 438, 383-392 (1988).
- Hubbard, R., Brown, P. K., Bownds, D. [243] Methodology of vitamin A and visual pigments. Methods Enzymol. 18, 615-653 (1971).
- Robeson, C. D., et al. Chemistry of vitamin A. XXIV. The synthesis of geometric isomers of vitamin A via methyl β-methylglutaconate1. J Am Chem Soc. 77 (15), 4111-4119 (1955).
- Robeson, C. D., Blum, W. P., Dieterle, J. M., Cawley, J. D., Baxter, J. G. Chemistry of vitamin A. XXV. Geometrical isomers of vitamin A aldehyde and an isomer of its α-ionone analog1. J Am Chem Soc. 77 (15), 4120-4125 (1955).
- Hubinger, J. C. Determination of retinol, retinyl palmitate, and retinoic acid in consumer cosmetic products. J Cosmet Sci. 60 (5), 485-500 (2009).
- Bhat, P. V., Co, H. T., Lacroix, A. Effect of 2-alkanols on the separation of geometric isomers of retinol in non-aqueous high-performance liquid chromatography. J Chromatogr A. 260, 129-136 (1983).
- Stancher, B., Zonta, F. Quantitative high-performance liquid chromatographic method for determining the isomer distribution of retinol (vitamin A1) and 3-dehydroretinol (vitamin A2) in fish oils. J Chromatogr. 312, 423-434 (1984).
- Zonta, F., Stancher, B. High-performance liquid chromatography of retinals, retinols (vitamin A1) and their dehydro homologues (vitamin A2): improvements in resolution and spectroscopic characterization of the stereoisomers. J Chromatogr A. 301, 65-75 (1984).
- van Kuijk, F. J., Handelman, G. J., Dratz, E. A. Rapid analysis of the major classes of retinoids by step gradient reversed-phase high-performance liquid chromatography using retinal (O-ethyl) oxime derivatives. J Chromatogr. 348 (1), 241-251 (1985).
- Kane, M. A., Folias, A. E., Napoli, J. L. HPLC/UV quantitation of retinal, retinol, and retinyl esters in serum and tissues. Anal Biochem. 378 (1), 71-79 (2008).
- Widjaja-Adhi, M. A. K., Ramkumar, S., von Lintig, J. Protective role of carotenoids in the visual cycle. FASEB J. 32 (11), 6305-6315 (2018).
- Ramkumar, S., Jastrzebska, B., Montenegro, D., Sparrow, J. R., von Lintig, J. Unraveling the mystery of ocular retinoid turnover: Insights from albino mice and the role of STRA6. J Biol Chem. 300 (3), 105781(2024).
- de Grip, W. J., Lugtenburg, J. Isorhodopsin: An undervalued visual pigment analog. Colorants. 1 (3), 256-279 (2022).
- Fan, J., Rohrer, B., Moiseyev, G., Ma, J., Crouch, R. K. Isorhodopsin rather than rhodopsin mediates rod function in RPE65 knock-out mice. Proc Natl Acad Sci USA. 100 (23), 13662-13667 (2003).
- Sparrow, J. R. Bisretinoids of RPE lipofuscin: Trigger for complement activation in age-related macular degeneration. Adv Exp Med Biol. 703, 63-74 (2010).
- Różanowska, M., Handzel, K., Boulton, M. E., Różanowski, B. Cytotoxicity of all-trans-retinal increases upon photodegradation. Photochem Photobiol. 88 (6), 1362-1372 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados