Method Article
ניתוח כמותי של מטבוליטים תזונתיים של ויטמין A ברקמות עיניות ולא עיניות באמצעות כרומטוגרפיה נוזלית בעלת ביצועים גבוהים
In This Article
Summary
כאן, מתוארת שיטת כרומטוגרפיה נוזלית בשלב רגיל, בעלת ביצועים גבוהים כדי לזהות ולכמת רטינואידים קריטיים המעורבים בהקלה על תפקוד הראייה ברקמה עינית וסיסטמית כאחד, בהקשר של אספקת ויטמין A מערכתית ליצירת כרומופור רודופסין 11-cis-retinal רגיש לאור חיוני.
Abstract
קולטנים מצומדים לחלבון G (GPCRs) הם משפחת סופר-על של חלבונים טרנסממברנליים היוזמים מפל איתות באמצעות הפעלת חלבון G שלו עם הקשר עם הליגנד שלו. בכל ראיית יונקים, רודופסין הוא GPCR האחראי על התחלת מפל הפוטוטרנסדוקציה. בתוך פוטורצפטורים, רודופסין קשור לכרומופור 11-cis-retinal שלו ומופעל באמצעות איזומריזציה רגישה לאור של 11-cis-retinal ל-all-trans-retinal, אשר מפעילה את חלבון G המתמר, וכתוצאה מכך מפל הפוטוטרנסדוקציה.
בעוד phototransduction מובן היטב, התהליכים המעורבים באספקת מבשרי ויטמין A תזונתיים עבור 11-cis-retinal דור בעין, כמו גם מחלות וכתוצאה מכך שיבוש של אספקה זו, עדיין לא מובן במלואו. ברגע שמבשרי ויטמין A נספגים במעי, הם מאוחסנים בכבד כאסטרי רטיניל ומשוחררים לזרם הדם כטרנס-רטינול הקשור לחלבון קושר רטינול 4 (RBP4). רטינול RBP4-רטינול זה ייספג על ידי איברים מערכתיים, כגון הכבד, הריאות, הכליות והעין. לפיכך, שיטה לכימות המטבוליטים השונים של ויטמין A בעין ובאיברים מערכתיים היא קריטית לחקר תפקוד תקין של רודופסין GPCR.
בשיטה זו אנו מציגים מיצוי מקיף ושיטה אנליטית לניתוח ויטמין A ברקמת מורין. באמצעות ניתוח כרומטוגרפיה נוזלית בשלב רגיל ובעל ביצועים גבוהים, ניתן לזהות בו זמנית את כל האיזומרים הרלוונטיים של רטינאלדהידים, רטינולים ואסטרי רטיניל באמצעות ריצה אחת, המאפשרת שימוש יעיל בדגימות ניסיוניות ומגבירה את האמינות הפנימית בין מטבוליטים שונים של ויטמין A באותה דגימה. בעזרת שיטה מקיפה זו, החוקרים יוכלו להעריך טוב יותר את אספקת ויטמין A המערכתית בתפקוד רודופסין GPCR.
Introduction
קולטנים מצומדים לחלבון G (GPCRs) הם אחת ממשפחות החלבונים הנחקרות והמאופיינות ביותר הידועות. בתפקידם הידוע ביותר, GPCRs משמשים כקולטן פני התא בהעברת אותות, ומאתחלים תגובות תוך-תאיות בעת קשירה עם ליגנד מסוים. GPCRs מאופיינים בשבעה תחומים סליליים טרנסממברנליים (TM) ובשישה תחומי לולאה כוללת. מתוך שש הלולאות, שלוש לולאות מכוונות חוץ-תאיות כדי להקל על קשירת ליגנדים, בעוד ששלוש הלולאות התוך-תאיות האחרות מצומדות לחלבון G הטרוטרימרי המורכב מתת-היחידותGα, Gβ ו-Gγ 1,2.
GPCRs מסווגים למספר סוגים, כולל Class A דמוי רודופסין, משפחת קולטני Class B Secretin, Class C גלוטמט, קולטני פרומון הזדווגות פטרייתיים Class D, קולטני AMP מחזוריים Class E, ו- Class F מקורזל/מוחלק 3,4. כפי ששמה מרמז, תת-מחלקה מסוג A דמוית רודופסין GPCR כוללת רודופסין, ה-GPCR הקריטי האחראי על פוטוטרנסדוקציה ותפקוד חזותי. רודופסין מכיל את כל מאפייני המפתח הרלוונטיים והאלמנטים המבניים הנמצאים במודל הקנוני של GPCRs, כולל שבעת התחומים הסליליים של המדיטציה הטרנסנדנטלית שהוזכרו קודם לכן, שש הלולאות החוץ-תאיות והתוך-תאיות, והקשר עם חלבון G הטרוטרימרי, הידוע גם בשם טרנסדוקין (Gt) בפוטורצפטורים 1,5,6,7. בתוך כיס הקישור של רודופסין, 11-cis-retinal, ליגנד הכרומופורים הרגיש לאור, נקשר לרודופסין על ליזין 296 דרך קישור בסיס קוולנטי של שיף, וכך נוצר 11-cis-retinylidene 1,8. עם ספיגת פוטון, 11-cis-retinylidene photoisomerize לתוך all-trans-retinylidene, גרימת שינוי קונפורמציה בתוך רודופסין. לכן, ליגנד הרשתית 11-cis-retinal הוא קריטי לתפקוד של rhodopsin GPCR, ואספקה חזקה ויעילה של 11-cis-retinal חייבת להישמר ברציפות כדי להתגבר על קצב התחלופה הגבוה בתוך photoreceptors.
רטינאלדהידים כגון 11-cis-retinal שייכים לקבוצת מולקולות הנקראות רטינואידים, ורטינואידים רלוונטיים ביולוגית מכונים באופן נרחב יותר ויטמין A. רטינואידים מאופיינים בקבוצת קצה מחזורית המחוברת לשרשרת פוליאן מצומדת, עם קבוצת קצה קוטבית בקצה השני. רטינאלדהידים והוויטמינים הקשורים לוויטמין A אינם יוצאים מן הכלל לאפיון זה, המכילים את טבעת β-יונון כקבוצת הקצה המחזורית, שרשרת פוליאן דיטרפן, וקבוצת קצה קוטבית שונה בהתאם לוויטמר, כלומר, קבוצת אלדהיד עבור רטינלדהידים, קבוצת הידרוקסיל עבור רטינולים, קבוצת קרבוקסיל עבור חומצות רטינואיות, קשר אסטר עבור אסטרי רטיניל, וכו' (איור 1)9,10.
יונקים לא יכולים לסנתז ויטמין A דה נובו, אבל צמחים יכולים; לכן, כל הרטינואידים במערכות יונקים חייבים לנבוע מהתזונה של יצרנים צמחיים לצרכנים בשרשרת המזון. במודל הקנוני של מטבוליזם של ויטמין A, β-קרוטן, הצמח הארכיטיפי פרוביטמין A, נספג לתוך אנטרוציט המעי דרך קולטן נבלות סוג B, חבר 1 (SCARB1), נבקע לשתי מולקולות של all-trans-retinal על ידי β-carotene oxygenase 1 (BCO1/BCMO1), אשר נקשר לחלבון קושר רטינאלדהיד 2 (RBP2) ומופחת ל- all-trans-רטינול על ידי רטינול דהידרוגנאזות (RDH), מומר לאסטרי רטיניל על ידי לציטין רטינול אצילטרנספראז (LRAT), ולאחר מכן נשלח לזרם הדם בכילומיקרונים 11,12,13,14. אסטרי רטיניל, כגון רטיניל פלמיטט, לעומת זאת, משמשים כפרוביטמין A הדומיננטי ממקורות מן החי. רטיניל פלמיטט מלומן המעי עובר הידרוליזה לכל-טרנס-רטינול על ידי קרבוקסילאסטראז 1 (CES1) ומתפזר לתוך אנטרוציט המעי15. הכבד הוא האיבר ההומאוסטטי והאחסון העיקרי של ויטמין A הומיאוסטזיס, אשר סופג את אסטרי הרטיניל בתוך כילומיקרונים אלה, אשר עוברים הידרוליזה לכל-טרנס-רטינול הקשור לחלבון קושר רטינול תאי 1 (CRBP1) על ידי הידרולזות רטיניל אסטר, נכנס לתאי סטלט בכבד ומומר חזרה לאסטרי רטיניל על ידי LRAT לאחסון 13,16, 17. כדי לשמור על רמה הומיאוסטטית של ויטמין A באורגניזם, הכבד משחרר ויטמין A בצורה של כל טרנס-רטינול הקשור לקומפלקס הובלת סרום, המורכב מחלבון קושר רטינול 4 (RBP4) וטרנסתירטין (TTR)15,18,19. קומפלקס זה ייקרא holo-RBP4 בכתב יד זה.
כדי להשתמש באספקה מערכתית זו של ויטמין A בדם, רקמות מערכתיות, כולל רקמת העין שבה נשמר מקור איתן של ויטמין A, חייבות להיות בעלות שיטה לספוג הולו-RBP4 ברקמות. בתוך הרשתית העשירה בפוטורצפטורים ברקמת העין, קולטן הממברנה המגורה על ידי חומצה רטינואית 6 (STRA6) הוא הטרנספורטר המעורב בפונקציה זו. במחקרים מכניסטיים, הוכח כי STRA6 מסוגל להקל על צריכת כל טרנס-רטינול חוץ-תאי מ-holo-RBP4 לתוך RPE20. כל טרנס-רטינול מיובא זה ייכנס לאחר מכן למחזור הראייה, שהוא התהליך שבו כל טרנס-רטינול מומר ל-11-cis-retinal בתוך RPE והקטע החיצוני של קולטני האור, ובכך מקל על תפקוד הראייה כאשר הוא קשור לרודופסין 9,21.
ברגע ש-all-trans-retinol מ-circulatory holo-RBP4 חוצה את מחסום הדם-רשתית לתוך RPE בתוך רקמת העין דרך STRA6, all-trans-retinol ב-RPE עובר תחילה אסטרי רטיניל על ידי LRAT, ולאחר מכן עובר הידרוליזה ל-11-cis-retinol על ידי חלבון אפיתל פיגמנט ברשתית ספציפי ל-65 kDa (RPE65). 11-cis-retinol מומר לאחר מכן ל-11-cis-retinal על ידי retinol dehydrogenase 5. רשתית 11-cis-retinal זו נישאת לתוך המקטע החיצוני של הפוטורצפטור (OS) על ידי החלבון קושר הרטינואידים הבין-פוטורצפטור (IRBP)9,21. בתוך הרשתית האנדופלסמית המקיפה את גרעין הפוטורצפטור בתוך השכבה הגרעינית החיצונית (ONL), GPCRs אופסין מסונתזים ומועברים על פני הציליום המחבר (CC). החלבונים המוטוריים המעורבים בהובלה זו ברחבי CC שנויים במחלוקת, אך ההשערות הנוכחיות מרמזות על קינזין והובלה תוך-פלגלרית מבוססת דינאין (IFT) או הובלה מבוססת מיוזין כמסייעים אפשריים לתהליך זה 14,22,23,24,25,26. ברגע ששני רכיבים אלה נפגשים בתוך הדיסקים הממברניים בתוך מערכת ההפעלה, 11-cis-retinal ואופסין יוצרים 11-cis-retinylidene באמצעות קישור קוולנטי של בסיס Schiff בליזין 196 על רודופסין, מוכן לפוטוטרנסדוקציה8.
בעוד שהביטוי של STRA6 בתוך RPE של הרשתית מסייע להקל על צריכת all-trans-retinol מ- holo-RBP4, STRA6 לא נמצא מתבטא בכבד, למרות תפקידו כאיבר ההומיאוסטטי העיקרי לוויטמין A והפגין יכולות בצריכת all-trans-retinol מ- holo-RBP4 15,19,27,28, 29,30,31. בסופו של דבר, התגלה קולטן מקביל הנקרא חלבון קושר רטינול 4 קולטן 2 (RBPR2), המציג את היכולת לצרוך את כל טרנס-רטינול מ- Holo-RBP4, בדומה ל- STRA6, אך מתבטא ברקמת הכבד32.
לכן, הבנה מלאה של תפקיד הרודופסין בתפקוד הראייה מחייבת הבנה של התהליכים הביולוגיים ששיאם בהתחדשות הפיגמנט הראייתי. זה, בתורו, קשור קשר הדוק לתהליכים שתוארו לעיל, כולל חילוף החומרים של מבשרי פרוביטמין A, אחסון בתוך הכבד, שחרור של holo-RBP4 על ידי הכבד, ובסופו של דבר ספיגה של קולטני ממברנה holo-RBP4 דרך STRA6 ו- RBPR2. כאמור, מודלים של בעלי חיים כגון עכברים נותרו אחד המודלים המובילים בחקר תהליכים כאלה. לפיכך, ברצוננו להציג שיטת מיצוי עבור רטינואידים ברקמת מורין, כמו גם שיטת כרומטוגרפיה נוזלית בעלת ביצועים גבוהים בשלב רגיל (HPLC) שיכולה לזהות ולכמת רטינואידים אלה. באמצעות שיטות אלה, ניתן לנתח את הרטינואידים החשובים שתוארו לעיל, כגון ליגנד רודופסין ברשתית 11-cis-retinal או הרטינואיד הראשי המוביל all-trans-retinol, באיברים עיניים, כבדיים וסיסטמיים. על ידי הערכת אספקת רטינואידים ברקמת מורין, הבנתנו את מצבי המחלה והפתולוגיות הקשורות לאספקה הלוגיסטית של רטינואידים יכולה להיות מתקדמת עוד יותר.
מלבד תפקודם ככרומופור בתפקוד הראייה באמצעות קשר עם GPCRs אופסין, רטינואידים גם ממלאים תפקיד מרכזי באיתות תאי יונקים באמצעות איתות חומצה רטינואית, המתאפשר על ידי שתי משפחות של קולטנים גרעיניים, קולטני חומצה רטינואית (RARs) וקולטני X רטינואידים (RXR), הנקשרים ישירות לדנ"א ושעתוק גנים מוסדר33. שתי משפחות או קולטנים אלה משתמשים שניהם ברטינואידים בצורה של חומצות רטינואיות כמו ליגנד. נדירים הוכחו כבעלי זיקה הן לחומצה טרנס-רטינואית והן לחומצה רטינואית 9-cis-retinoic, בעוד ש-RXR מבטאים זיקה רק לחומצה 9-cis-retinoic 34,35. חומצות רטינואיות בכמויות בלתי מבוקרות הן טרטוגניות, ואיתות חומצה רטינואית חייב להיות מבוקר באופן הדוק ביותר36. ייצור חומצות רטינואיות לאיתות חייב להתרחש באופן מקומי ובנקודות זמן ספציפיות מאוד להתפתחות תקינה של רקמות, כגון בהתפתחות המוח האחורי והגפיים, אך אינספור דוגמאות אחרות משתמשות באיתות חומצה רטינואית37,38. בתוך תאים המשתתפים באיתות חומצה רטינואית, חומצות רטינואיות מסונתזות על ידי שתי קבוצות של אנזימים, אלכוהול/רטינול דהידרוגנאזות (ADHs/RDHs) המאפשרים חמצון של רטינולים הנלקחים על ידי STRA6 או RBPR2 לרטינאלדהידים, ורטינאלדהיד דהידרוגנאזות (RALDHs) המאפשרים חמצון של רטינאלדהידים לחומצות רטינואיות39. בעוד שהן אינן משתתפות באיתות GPCR כשלעצמו, חומצות רטינואיות בכל זאת נוכחות כרטינואיד חיוני המתפקד גם כליגנד לקולטני איתות.
אמנם לא מתואר בפירוט כאן, אך ברצוננו להכיר בשיטות שנקבעו בעבר לזיהוי רטינואידים באמצעות HPLC בהקשרים שונים, כגון במחקר מזון ובחקר רודופסין מיקרוביאלי. שיטות אלה משתמשות במטרות ובגישות שונות לזיהוי רטינואידים, כולל שימוש בטכניקות של פאזה הפוכה הדורשות שלבים ניידים פחות נדיפים ומסוכנים 40,41,42, זיהוי חומצות רטינואיות והאיזומרים הקשורים אליהן 40,41, וטיהור ומיצוי ממקורות ביולוגיים שונים43. השיטה שלנו מתמקדת באופן ספציפי בזיהוי של איזומרים של רטיניל פלמיטט, רטינאלדהיד ורטינול מרקמת יונקים. יש לשקול פרוטוקולים שונים אם מקרה השימוש המיועד שונה מיישום ספציפי זה.
Protocol
הערה: כל הניסויים בבעלי חיים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של אוניברסיטת מינסוטה (פרוטוקול # 2312-41637A) ובוצעו בהתאם להצהרת ARVO לשימוש בבעלי חיים במחקר עיניים וראייה. בצעו את כל החילוצים בחושך, תחת אור אדום עמום להארה. שימו לב לשאריות האור הנפלטות מתצוגות המכשירים ונורות ה-LED של האביזרים.
1. יצירת תקן רטינואיד ספקטרופוטומטרי ויצירת עקומה סטנדרטית חיצונית
הערה: הכן מיכל קרח יבש לאחסון זמני של רטינואידים לפני ניתוח עם HPLC.
- לשקול כמות שרירותית אך מתאימה של רטינואידים ולהמיס אותם בממס מתאים לכימות באמצעות ספקטרופוטומטריה.
הערה: הממס המועדף במחקר זה הוא אתנול, וערכי הספיגה המולרית של רטינואידים המומסים באתנול מפורטים בטבלה 1. אתנול נטול מים, ברמת HPLC חייב לשמש להמסת תקנים ודגימות. אתנול מטוהר אך ורק באמצעות זיקוק יוצר תערובת אזאוטרופית עם מים, המכילה כ -4% מים בנפח. מים אינם ניתנים לערבוב עם הפאזה ההקסנואית הניידת ויגרמו להידרציה של השלב הנייח של הסיליקה, מה שיוביל בסופו של דבר להתכלות של העמודה. - תוך שימוש בחוק באר-למברט ובספיגה המולרית של הרטינואיד הרלוונטי, מכמתים את ריכוז התקן שנוצר (טבלה 1).
ספיגה = ספיגה מולרית (ε) × ריכוז מולארי × אורך נתיב - בצע דילולים סדרתיים כדי ליצור ריכוזים שיכולים ליצור עקומה סטנדרטית בטווח הכימות של הרקמה הרצויה.
הערה: היו מודעים למגבלות היסוד של חוק באר-למברט, כגון חוסר תוקפו עם ריכוזים גבוהים של אנליטים. כדי להימנע מבעיה זו, תקני הרטינואידים המדוללים צריכים להימנע מיצירת ערכי ספיגה גדולים מ-1. עבור היישומים שלנו בכימות רטינול ורטינאלדהיד באיברי מורין, מצאנו שעקומת כיול עם טווח של 1-10 ננוגרם הצליחה לכסות את הכמויות האופייניות שנמצאו. עבור כימות רטיניל פלמיטט מכבד מורין, מצאנו כי עקומת כיול עם טווח של 20-80 מיקרוגרם הצליחה לכסות את הכמויות האופייניות שנמצאו. - על ידי שינוי הדרגתי של נפח ההזרקה מתמיסת המלאי שנוצרה בעבר, ובכך לשנות בהדרגה את כמות הרטינואיד המוזרקת, לשלב את הפסגות כדי ליצור עקומה סטנדרטית חיצונית המתאימה לכימות רטינואיד שבו שילוב השיא עומד ביחס ישר לכמות הרטינואיד המוזרקת.
2. קציר רקמות ואיסוף דגימות
הערה: הכינו מיכל קרח יבש לאחסון זמני של רקמה לפני הומוגניזציה של רקמות ומיצוי רטינואידים. כמויות קציר הרקמה המומלצות מפורטות בטבלה 2. כדי להסביר שינויים ברטינואידים עקב שינויים בתכולת הדם עבור כל רקמה, מיצוי רקמות צריך להיעשות על עכברים מחוררים לחלוטין, ומיצוי דם צריך להסתיים על עכברים נפרדים.
- יש להרדים את העכברים בהתאם להנחיות שנקבעו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) (חנק CO2 כאן).
- דם: מיד לאחר המתת חסד, ערפו את ראשיהם של העכברים עם זוג מספריים, ונקזו את הדם מהגזע הראשי של העכברים לתוך צינור של 1.5 מ"ל.
- עין: בעזרת זוג מלקחיים, הסירו את העיניים מהראש הערוף.
- מוח: בעזרת זוג מספריים קטנים, חותכים לתוך הראש הערוף ומוציאים את המוח באמצעות זוג מלקחיים.
- כליות, כבד, טחול, לב וריאות: באמצעות זוג מספריים קטנים, לבצע חתך לתוך הבטן, לחתוך בכיוון העליון לאורך קו האמצע, לחתוך דרך עצם החזה ואת כלוב הצלעות. הסר את הרקמה החשופה באמצעות זוג מלקחיים.
3. הומוגניזציה של רקמות
הערה: אם יש צורך בניתוח של מחיצות קטנות יותר של איברים, כגון באיברים גדולים יותר (למשל, רקמת כבד או ריאה), האיבר כולו צריך להיות הומוגני כדי למנוע הבדלים בתכולת רטינואיד בחלקים שונים של הרקמה. במקום זאת, לחלק את הומוגנט אם כמויות קטנות יותר של רקמה רצויים. סכמה לפרוטוקול מפורטת באיור 2. פרוטוקול שונה זה הותאם מקיין ונאפולי44.
- הניחו את הרקמה בצינור מטחנת הרקמות, יחד עם 50% מלוחים קרים כקרח (0.9%) ו-50% מתנול. ראה טבלה 2 עבור הנפח המשמש עבור כל סוג רקמה.
- מניחים את המזיק לתוך צינור המטחנה, לאט ובעדינות לבצע חמישה סיבובים מלאים עם pestle כדי לקבל הומוגנאט.
- העברת דגימות לתוך צינורות 15 מ"ל מיד לאחר הומוגניזציה.
- מוסיפים 2 מ"ל מתנול ומניחים למשך 15 דקות בטמפרטורת החדר.
הערה: אם יש צורך בניתוח של נגזרות רטינאלדהיד אוקסים, יש להוסיף 1 מ"ל של הידרוקסילאמין הידרוכלוריד 0.1 M ב-0.1 M HEPES (pH 6.5) (איור 1).
4. מיצוי רטינואידים
זהירות: הקסאן דליק מאוד, נדיף מאוד ורעיל מאוד. יש להשתמש במכונות הנשמה מאושרות על ידי המכון הלאומי לבטיחות ובריאות תעסוקתית (NIOSH), הגנה על העיניים, כפפות בוטיל ומכסה מנוע מנדף בעת הטיפול בהקסאן. בעת אידוי הקסאן מדגימות, מומלץ להשתמש בצורה כלשהי של מנגנון זרימת אוויר משופר כדי למנוע הצטברות אדי ממס, למשל, מנגנון יניקה של שנורקל.
- הוסף 10 מ"ל של הקסאן להומוגנט ומערבל את הצינור אופקית במשך 10 שניות לפחות.
הערה: קריטי שהשלבים יתערבבו במלואם. - צנטריפוגו את תערובת ההומוגנאט/הקסאן למשך 3 דקות ב-1,000 × גרם כדי להקל על הפרדת פאזות.
- בצע את המיצוי 2x כדי להבטיח מיצוי מלא של רטינואידים מן homogenate. חזור על שלבים 4.1 ו- 4.2.
- מוציאים את שכבת ההקסאן באמצעות פיפטה ומניחים את שכבת ההקסאן בסט נפרד של שפופרות זכוכית 15 מ"ל לאידוי ואקום.
הערה: לאידוי, השתמש בצינורות זכוכית 15 מ"ל כדי למנוע הידבקות של רטינואידים לדפנות הצינור. - באמצעות צנטריפוגת ואקום, לאדות לחלוטין את הקסאן.
5. ניתוח השעיה ו-HPLC
הערה: מכיוון שמערכת HPLC ששימשה בכתב יד זה הייתה מערכת משאבה בינארית, הפאזה הניידת בת ארבעת הרכיבים עורבבה מראש בבקבוק יחיד לפני הפעולה.
זהירות: כל ארבעת הממיסים האורגניים המשמשים בשיטה זו הם דליקים מאוד, נדיפים מאוד ורעילים מאוד. 1,4-דיוקסן רגיש להיווצרות חמצן נפיץ בחשיפה לחמצן. יש לשמור את כל הכלים המכילים 1,4-דיוקסן סגורים כאשר אינם בשימוש. בעת הטיפול בממסים אלה יש להשתמש במכונות הנשמה מאושרות על ידי המכון הלאומי לבטיחות ובריאות תעסוקתית (NIOSH), להגנה על העיניים, לכפפות בוטיל ולמכסה אדים. בעת הפעלת ממסים אלה ב- HPLC, מומלצת צורה כלשהי של מנגנון זרימת אוויר משופר כדי למנוע הצטברות אדי ממס, למשל, מנגנון יניקה של שנורקל.
- להשעות את צינור 15 מ"ל מיובש עם 100 μL של הקסאן; מערבלים היטב כדי לוודא שכל הרטינואידים מומסים.
- פיפטה את כל 100 μL של הקסאן לתוך תוספת זכוכית אחת עבור ניתוח HPLC.
- הגדר את ריצת HPLC (הותאמה מ- Landers ו- Olson45): שלב נייד: 85.4% הקסאן (v/v), 11.2% אתיל אצטט (v/v), 2% דיוקסן (v/v), 1.4% 1-אוקטאנול (v/v); עמודה: שתי עמודות ID, 4.6 מ"מ x 250 ננומטר, 5 מיקרומטר, מחוברות בסדרה; טמפרטורת תרמוסטט מרובת עמודות: 25 °C; נפח הזרקה: 100 μL; קצב זרימה: 1 מ"ל/דקה; זמן הפעלה: 40 דקות. השתמש בזיהוי ספיגת ספקטרום UV; השאר את האפשרות לרכישת ספקטרום UV מ 200 ננומטר עד 400 ננומטר.
6. שיא הזיהוי והאינטגרציה
- זהה שיאים באמצעות זמן שמירה וספקטרום UV של כל רטינואיד מעניין כפי שנצפה מניתוח תקני רטינואידים (איור 3, טבלה 3 וטבלה 4).
- באמצעות מערכת הנתונים הכרומטוגרפית של מערכת HPLC שנבחרה, שלב את הפסגות שזוהו. האינטגרציה, או השטח שמתחת לעקומה עומד ביחס ישר לכמות האנליט. הפנה לעקומת התקן החיצונית שנוצרה בשלב 1 כדי לכמת את האנליט.
- לניתוח כרומטוגרמות הנוצרות מרקמה ביולוגית, השתמש באינטגרציה ידנית על פני אינטגרציה אוטומטית המוצעת על ידי מערכות נתונים כרומטוגרפיות טיפוסיות, שכן שינויים בפרמטרים כגון זמן שמירה נצפים לעתים קרובות בדגימות כאלה.
- ודא שהכרומטוגרמות אינן מציגות אי סדרים שעשויים להצביע על בעיות במהלך הריצה, כגון קווי בסיס רועשים או פסגות שאינן גאוסיות. בעיות אלה מצביעות על מזהמים ב- HPLC או בלאי על עמודות ויש לתקן אותן לצורך ניתוח תקף.
תוצאות
כאן, השתמשנו בשיטה שתוארה לעיל כדי לזהות ולכמת רטינואידים ברקמה עינית וסיסטמית מורין ויצרנו כרומטוגרמות מייצגות. בנוסף, אנו נותנים סיכום של רטינואידים טיפוסיים שניתן לזהות ברקמות אלה.
בגיל 6 חודשים, עכברים הומתו באמצעות חנק CO2 . כדי לשמור על תכולת רטינואיד עיני, עכברים עברו התאמה כהה במשך יומיים לפני המתת חסד וחילוץ. שתי עיניים, 0.2 גרם כבד ו-75 מיקרוליטר דם נקצרו לצורך מיצוי רטינואיד וניתוח HPLC לאחר מכן. עבור רקמת העין, עין אחת חולצה ללא תוספת של hydroxylamine, בעוד השני היה נתון לטיפול hydroxylamine. עבור כבד ודם, טיפול הידרוקסילאמין לא היה נחוץ מאז retinaldehydes אינם מזוהים בדרך כלל ברקמות אלה.
בכרומטוגרמה של עין העכבר שלא טופלה בהידרוקסילאמין, זוהה 13-cis-retinal, אחד משני איזומרי רטינאלדהיד שאינם קנוניים. בנוסף, זוהו הן 11-cis-retinal והן all-trans-retinal, שני איזומרי רטינאלדהיד הקנוניים. בשני הכרומטוגרמות, מחזור הראייה 11-cis-retinol, כמו גם צורת ההובלה העיקרית של ויטמין A all-trans-retinol, זוהו שניהם (איור 4A).
בכרומטוגרמה של עין העכבר שטופלה בהידרוקסילאמין, כל איזומרי הרטינאלדהיד שהוזכרו קודם לכן עדיין היו נוכחים. עם זאת, זמני השמירה של איזומרים אלה הוגדלו באופן משמעותי. יתר על כן, איזומרים אלה של רטינאלדהיד קיימים כיום הן כאיזומרים סינים והן כאנטי איזומרים. במהלך הכימות באמצעות שילוב שיא, יש לסכם הן את שיא ה- syn והן את שיא האנטי כדי לקבל ערך אינטגרציה מדויק. גם 11-cis-retinol וגם all-trans-retinol עדיין היו נוכחים (איור 4B).
בכרומטוגרמה של רקמת הכבד של עכבר, רטיניל פלמיטט ו all-trans-retinol זוהו בתוך רקמות אלה. רטיניל פלמיטט, אסטר רטיניל, משמש כצורת האחסון העיקרית של ויטמין A ביונקים וניתן למצוא אותו בכמויות משמעותיות ברקמת הכבד של יונקים. הכבד משחרר ויטמין A לרקמות מערכתיות בשם holo-RBP4, המכיל all-trans-retinol בתוך קומפלקס RBP4-transthryetin. לאחר מכן, ניתן לזהות שיא גדול של טרנס-רטינול בתוך הכרומטוגרמה הזו (איור 4C).
בכרומטוגרמה של דם עכברים זוהה שיא גדול של כל טרנס-רטינול. בהתחשב בכך שהולו-RBP4 מהכבד משתחרר לרקמות מערכתיות דרך מערכת הדם, זה כצפוי (איור 4D). ספיגת ספקטרום UV אופיינית (~250-400 ננומטר) של איזופורמים רטינואידים על פסגות HPLC תלויות זמן יכולה להיות מועילה באישור ראשוני צולב של איכות נוכחות האיזופורמים בשיא מסוים בהתאמה (איור 5).

איור 1: מבנים כימיים של רטינואידים. (A) רטינואידים אלה נמצאים בדרך כלל ברקמת מורין שחולצה. שימו לב לקבוצות הקצה הקוטביות השונות, כמו גם למיקומים השונים של קשרים כפולים סיס באיזומרים רטינואידים. (B) המרה של רטינאלדהידים לאוקסימים ברשתית מגבירה את יעילות המיצוי, מונעת אלוציה משותפת של פסגות עם רטיניל פלמיטט, כמו גם קו-אלוציה בתוך איזומרים של רטינלדהיד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: זרימת עבודה עבור קצירת רקמות, הומוגניזציה, מיצוי רטינואידים וניתוחם. רשתיות ודגימות רקמה מעכברים בעלי התאמה כהה עברו הומוגניות והוצאו. שלב 1: לאחר המתת עכברים על פי ההנחיות, נאספים דם ורקמות שונות. שלבים 2-4: הומוגניזציה של רקמות נעשית לאחר מכן עם מלוחים ומתנול, עם הידרוקסילאמין הידרוכלוריד לניתוחים כמותיים. שלבים 5-7: רטינואידים מטופלים באמצעות הקסאן, ואחריו אידוי. שלבים 8,9: מושהה מחדש עם 100 μL של הקסאן כדי לוודא שכל הרטינואידים מומסים. שלב 10: לבסוף, דגימות מנותחות באמצעות HPLC. קיצור: HPLC = כרומטוגרפיה נוזלית בעלת ביצועים גבוהים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: כרומטוגרמה של תקני רטינואידים ותקני רטינואידים המטופלים בהידרוקסילאמין. (A) כרומטוגרמה זו מכילה רטיניל פלמיטט, 13-cis-retinal, 11-cis-retinal, all-trans-retinal, 11-cis-retinol, 13-cis-retinol, ו-all-trans-retinol. (B) כרומטוגרמה זו מכילה רטיניל פלמיטט, 13-cis-retinal, 11-cis-retinal, all-trans-retinal, 11-cis-retinol, 13-cis-retinol, ו-all-trans-retinol. כרומטוגרמה זו מכילה את איזומרי הרטינאלדהיד syn ואנטי אוקסימיים, בנוסף לאיזומרים של רטינול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: כרומטוגרמות מייצגות. (A) כרומטוגרמה מייצגת של רקמת העין של עכבר. כרומטוגרמה זו מכילה רטינואידים הנמצאים בדרך כלל ברקמת העין של מורין, כולל איזומרים של רטינאלדהיד, בנוסף לאיזומרים של רטינול. (B) כרומטוגרמה מייצגת של רקמת עין עכבר שטופלה בהידרוקסילאמין. שימו לב שבמקום רטינאלדהידים לא מהונדסים כימית שנמצאו בכרומטוגרמות הקודמות (איור 4A), הכרומטוגרמה הזו מכילה את איזומרי הרטינלדיד syn ואנטי אוקסיום, בנוסף לאיזומרים של רטינול. (C) כרומטוגרמה מייצגת של רקמת כבד עכבר. כרומטוגרמה זו מכילה רטינואידים הנמצאים בדרך כלל ברקמת הכבד המורין, כולל רטיניל פלמיטט ואול-טרנס-רטינול. (D) כרומטוגרמה מייצגת של דם עכבר. כרומטוגרמה זו מכילה רטינואידים הנמצאים בדרך כלל בדם מורין, כולל כל טרנס-רטינול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
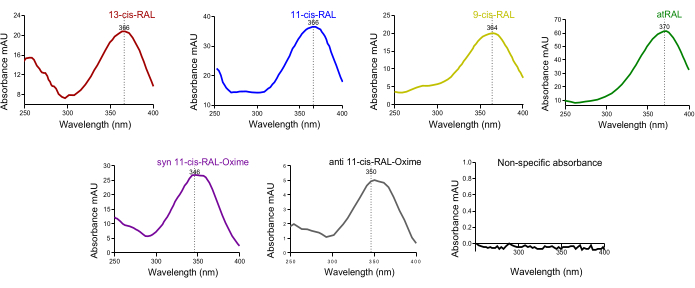
איור 5: ספקטרום ספיגת UV של איזומרים של רטינאלדהיד מרקמת העין של מורין. ספקטרום ספיגה של (A) 13-cis-retinal, (B) 11-cis-retinal, (C) 9-cis-retinal, (D) all-trans-retinal, (E) syn 11-cis-retinal oxime, (F) anti 11-cis-retinal oxime. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 6: סקירה כללית של מודולי HPLC, זרימת פאזה ניידת ומכשור אחר. זרימת הפאזה הניידת מתחילה מבקבוקי הממס המוכנים ונשאבת בלחץ גבוה על ידי המשאבה הבינארית לתוך הדוגם האוטומטי, שם משולב האנליט בזרימת הממס. הפאזה הניידת והאנליט מגיעים לתא העמודים המווסת בטמפרטורה, ולבסוף לגלאי מערך הדיודות לצורך מדידה. (A) מסך צג צבוע אדום הממזער פוטואיזומריזציה של רטינואידים. (B) משאבה בינארית. (ג) דוגם בקבוקון. (D) תרמוסטט רב-עמודתי. (E) גלאי מערך דיודות. (ו) אספן שברים אנליטי. (G) מיכל פסולת פולי בצפיפות גבוהה. (H) משמאל לימין, מכסה כיווץ אלומיניום, 250 μL הוספה עם רגלי פולימר, בקבוקון עליון בצבע ענבר, הרכבה סופית של בקבוקון הזרקה. (I) צנטריפוגה שמאלית, מקוררת. מימין, רכז צנטריפוגות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| תרכובת | ספיחה מולרית (ε) | הממס | הפניה |
| רטיניל פלמיטט | 49260 | אתנול | האברד ואחרים 49 |
| 13-cis-רשתית | 35500 | אתנול | האברד ואחרים 49 |
| 11-cis-רשתית | 24935 | אתנול | האברד ואחרים 49 |
| 9-cis-רשתית | 36100 | אתנול | רובסון ואחרים 51 |
| כל-טרנס-רטינל | 42880 | אתנול | האברד ואחרים 49 |
| 11-cis-רטינול | 34890 | אתנול | האברד ואחרים 49 |
| 13-cis-רטינול | 48305 | אתנול | Robeson et al.50 ו- Robeson et al.51 |
| כל-טרנס-רטינול | 52770 | אתנול | האברד ואחרים 49 |
טבלה 1: ספיגה מולארית של רטינואידים באתנול. ערכי ספיגה מולארית של רטינואידים נאספו מקיין ונפולי44, האברד ואחרים 46, רובסון ואחרים 47 ורובסון ואחרים 48. הספיגה המולרית תלויה בממס. הערכים המפורטים כאן ספציפיים לרטינואידים המומסים באתנול.
| טישו | כמות קציר רקמות | נפח להומוגניזציה |
| דם | 75 מיקרוליטר | לא ישים |
| כבד | 0.2 גרם | 2 מ"ל |
| כליה | 2 כליות שלמות | 2 מ"ל |
| עור | 0.2 גרם | 1 מ"ל – 1.5 מ"ל |
| טחול | 1 טחול שלם | 1 מ"ל |
| עין | שתיהן רשתית, בריכה 4 רשתית | 1 מ"ל |
| מוח | 1 מוח שלם | 2 מ"ל |
| לב | 1 לב שלם | 1 מ"ל |
| ריאה | 0.2 גרם | 2 מ"ל |
טבלה 2: כמות רקמה מומלצת לניתוח. כמות רקמה לאנליזה ונפח של 50% מלח קר כקרח (0.9%) ו-50% מתנול להומוגניזציה של רקמות, כפי שהומלץ על ידי קיין ונפולי44.
| תרכובת | זמן שמירה (מינימום) | ספיגת UV מקסימלית (ננומטר) |
| רטיניל פלמיטט | 5.177 | 326 |
| 13-cis-רשתית | 7.268 | 366 |
| 11-cis-רשתית | 7.691 | 366 |
| 9-cis-רשתית | 7.931 | 364 |
| כל-טרנס-רטינל | 8.993 | 370 |
| 11-cis-רטינול | 17.003 | 318 |
| 13-cis-רטינול | 17.83 | 328 |
| כל-טרנס-רטינול | 23.933 | 326 |
טבלה 3: זמני שמירה ואורכי גל בליעה מרביים של רטינואידים. ערכים אלה נצפו בעת שימוש בשיטה המתוארת ובפאזה הניידת, כפי שזוהו עם גלאי מערך הדיודות המוזכר.
| תרכובת | זמן שמירה (מינימום) | ספיגת UV מקסימלית (ננומטר) |
| Syn 11-cis-Retinal Oxime | 9.59 | 346 |
| Syn אוקסימיום All-trans-Retinal | 10.6 | 356 |
| Syn 13-cis-Retinal Oxime | 11.3 | 352 |
| אנטי 13-cis-Retinal Oxime | 13 | 356 |
| אנטי 11-cis-Retinal Oxime | 15.1 | 350 |
| אנטי אוקסימיום All-trans-Retinal | 19.7 | 360 |
טבלה 4: זמני שמירה ואורכי גל בליעה מרביים של רטינאלדהידים שטופלו בהידרוקסילאמין, וכתוצאה מכך איזומרים סינים ואנטי אוקסימים של כל רטינאלדהיד. ערכים אלה נצפו בעת שימוש בשיטה המתוארת ובפאזה הניידת, כפי שזוהו עם גלאי מערך הדיודות המוזכר.
Discussion
בשיטה זו, HPLC בשלב רגיל משמש לזיהוי וכימות רטינואידים רלוונטיים, כולל אסטרי רטיניל, רטינאלדהידים ורטינולים. בהתחשב בחשיבות של 11-cis-retinal ככרומופור קריטי בהפעלת rhodopsin GPCR, שיטה שיכולה לזהות את המטבוליטים הקשורים לייצור של 11-cis-retinal היא קריטית לחקר תפקוד הראייה הכולל. היתרון העיקרי של שיטה זו הוא שניתן לזהות ולכמת בו זמנית את כל האיזומרים הרלוונטיים הן של רטינאלדהידים והן של רטינולים בריצה אחת. בהתחשב במחסור ברקמות ניסיוניות, שיטה זו מאפשרת שימוש יעיל ברקמה בזיהוי רטינואידים. בעוד השימוש בפאזות ניידות מבוססות הקסאן ואתיל אצטט דווח בהפרדת רטינואידים49, תוספת של 1,4-דיוקסן ו-1-אוקטאנול משפרת את הרזולוציה של איזומרים רטינואידים. 1,4-דיוקסן נחוץ לרזולוציה של 13-cis-retinol ו-11-cis-retinol50, בעוד שאלכוהולים ארוכי שרשרת כגון 1-octanol משפרים עוד יותר את ההפרדה של איזומרי רטינול 45,51,52.
לצורך כימות איזומרים של רטינאלדהיד, נדרשת המרה מוקדמת לאוקסימים המתאימים של רטינאלדהיד עם הידרוקסילאמין, שכן קבוצת אלדהיד תגובתי נוטה להגיב עם ביומולקולות אחרות כגון חלבונים ושומנים 45,53,54. Retinaldehyde oximes מופקים בקלות רבה יותר וגורמים לפסגות רטינאלדהיד להיעלם מאוחר יותר בריצה, ובכך מונעים שיתוף פעולה שיא עם קבוצת הפסגות הלא ידועה ושיא רטיניל פלמיטט שפולט ב~5-8 דקות עבור רקמות ביולוגיות. טיפול של retinaldehydes עם hydroxylamine גם מונע co-elution של retinaldehydes עם elution דומה פעמים45. ההמרה לרטינאלדהיד אוקסימים מייצרת הן איזומרים סינים והן אנטי איזומרים, אשר פולטים בשני זמנים שונים עם שני שיאים שונים עבור כל איזומר רטינאלדהיד. יש לסכם את האינטגרציה עבור שתי הפסגות כדי לכמת כראוי כל איזומר רטינאלדהיד. מלבד זמן שמירה, ספקטרום UV מספק מדד נוסף שניתן להשתמש בו בזיהוי שיא. כל רטינואיד מציג ספיגת UV מקסימלית מעט שונה. כאשר מביאים בחשבון יחד עם זמן השמירה, שני מדדים אלה מאפשרים זיהוי מדויק של פסגות (טבלה 3 וטבלה 4).
בעוד נוכחות של איזומרים קנוניים של רטינאלדהיד כגון 11-cis-retinal ו- all-trans-retinal צפויים ברקמת העין, כאשר 11-cis-retinal הוא כרומופור ליגנד רודופסין קריטי ו- all-trans-retinal הוא ליגנד פוטואיזומרי, איזומרים אחרים שאינם קנוניים של רטינאלדהיד מזוהים בשיטה זו. בפרט, 13-cis-retinal זוהה בקלות בריצות HPLC של רקמת עין מורין במהלך הניתוח שלנו (איור 4A-D). הופעתם של רטינאלדהידים לא קנוניים אלה אינה בלתי צפויה לחלוטין, עם זאת, הן 13-cis-retinal והן 9-cis-retinal הם תוצרי לוואי ידועים הנובעים מלחץ המושרה על ידי אור על הרשתית55,56. איזומרים אלה של רטינאלדהיד אינם משתתפים במסלול מפל הפוטוטרנסדוקציה הקנוני הידוע וגורלם המטבולי נותר לא ידוע יחסית. עם זאת, הוכח כי 9-cis-retinal נקשר ביציבות גם לכיס הקישור של רודופסין, ויוצר איזורודופסין. תפקידו של isorhodopsin עדיין לא אופיין במלואו, אבל מחקרים הראו כי isorhodopsin מציג יכולות רגישות לאור בדומה 11-cis-retinal מבוסס rhodopsin57,58. לכל הפחות, היכולת של 9-cis-retinal ליצור יציב isorhodopsin ו photoisomerize לתוך all-trans-retinal מספק הסבר סביר להיעדרו בניתוח HPLC56 שלנו. 13-cis-retinal, לעומת זאת, לא הוכח כמשתתף בשום מסלול ביוכימי עיני ידוע, והצטברות שלו בתוך רקמת העין עלולה לגרום לעקה חמצונית בתוך הרשתית 55,59,60.
למרות ש-9-cis-retinal בדרך כלל לא נמצא ברקמת מורין, יש לציין כי השיטה המטופלת בהידרוקסילאמין אינה שיטה בת קיימא להפרדה וכימות של 9-cis-retinal. השיאים של syn 9-cis-retinal ו-syn 13-cis-retinal יתמזגו ב-11.2 דקות. במקרים בהם צפויות כמויות משמעותיות של 9-cis-retinal, כגון כאשר הוא מיושם באופן אקסוגני, רק כימות של 9-cis-retinal משולב ו-13-cis-retinal יהיה אפשרי. לצורך זיהוי איכותי, ביצוע השיטה ללא טיפול ברקמה עם הידרוקסילאמין עם מאפשר הפרדה מלאה של פסגות רשתית 13-cis-retinal ו-9-cis-retinal.
מלבד רקמת העין, שיטה זו יכולה להיות מיושמת בקלות גם על רקמה מערכתית. בעוד שרטינאלדהידים בצורותיהם האיזומריות השונות בדרך כלל אינם נמצאים ברקמה מערכתית, כל טרנס-רטינול הקשור לחלבון קושר רטינול 4 (Holo-RBP4) הוא צורת ההובלה העיקרית של ויטמין A באורגניזמים של יונקים, וניתן לזהות בקלות את כל הטרנס-רטינול בדם בשיטה זו. מלבד הדם, all-trans-retinol יכול גם להיות מזוהה בדרך כלל בכל הרקמות המערכתיות. לפיכך, באמצעות שיטה זו, ניתן ליצור פרופיל רטינואידי מערכתי שלם בכל הרקמה באמצעות שיטה זו.
מאחר שרטינאלדהידים, במיוחד ליגנד רודופסין 11-cis-retinal הקריטי, רגישים מאוד לפוטואיזומריזציה, חיוני שיינקטו אמצעי מניעה למניעת חשיפה מקרית לאור במהלך כל אחד מהשלבים המתוארים לעיל. מלבד המקורות הברורים מתאורת חדרים ומלוחות מחוונים, מצאנו שאור תועה מנורות LED נלוות במכשירים שונים, כמו אלה שנמצאים מאחורי מכשירים, כולל HPLC עצמו, הם מקורות עיקריים לחשיפה מקרית לאור (איור 6). בנוסף, מצאנו כי חדר חושך ייעודי היה חיוני לטיפול נכון באיזומרים של רטינאלדהיד וברקמות ניסוי. מלבד מזעור האור, אנו ממליצים לעבד את הרקמה במהירות ובמהירות לאחר המתת חסד וקציר, שכן פירוק איזומרים של רטינאלדהיד מתרחש גם בהיעדר אור. באופן אידיאלי, קצירת רקמות, מיצוי וניתוח HPLC צריכים להסתיים כולם באותו יום.
רקמות שאינן מעובדות באופן מיידי חייבות להיות מאוחסנות בחושך ב -80 מעלות צלזיוס ואין לאחסן אותן יותר משבוע לפני העיבוד. כפי שהוזכר לעיל, כל הממסים המשמשים בשלב הנייד ובשלבי המיצוי בשיטה הנ"ל הם רעילים ביותר, נדיפים ודליקים. יש להשתמש בנהלים ובציוד מתאימים בעת הטיפול בממיסים מסוכנים אלה. יש ללבוש ציוד מגן אישי מתאים (PPE) כגון כפפות בוטיל, מכונות הנשמה מאושרות NIOSH והגנה על העיניים לפני הטיפול בממס, וכל העברות הממס חייבות להיעשות בתוך מכסה אדים. שימו לב כי 1,4-דיוקסן רגיש להיווצרות חמצן נפיץ בעת חשיפה לחמצן ושמרו על כל מיכלי הממס עם 1,4-דיוקסן אטומים היטב מהאוויר.
אם שיטת HPLC בשלב רגיל אינה בת קיימא עקב מחסור בחומרים או בציוד, קיימות שיטות טיפוסיות יותר לשלב ההפוך עם ממיסים פחות נדיפים כגון אצטוניטריל ומים כדי לזהות ולכמת רטינאלדהידים ורטינולים. עם זאת, שיטות אלה אינן מסוגלות להפריד איזומרים והן מסוגלות לזהות רק רטינאלדהידים כולל או רטינולים סה"כ44,54.
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
עבודה זו נתמכה על ידי מענקי NIH-NEI (EY030889 ו- 3R01EY030889-03S1) ובחלקה על ידי קרנות הזנק של אוניברסיטת מינסוטה ל- G.P.L. ברצוננו גם להודות למכון העיניים הלאומי על שסיפק לנו את תקן הרשתית 11-cis-retinal המשמש בכתב יד זה.
Materials
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| 1-Octanol, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 203-917-6 | |
| 1,4-Dioxane, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 204-661-8 | |
| 11-cis-retinal | National Eye Institute | N/A | |
| 11-cis-Retinol | Toronto Research Chemicals | TRC-R252105 | |
| 13-cis-retinal | Toronto Research Chemicals | TRC-R239900 | |
| 13-cis-retinol | Toronto Research Chemicals | TRC-R252110 | |
| All-trans-Retinal | Toronto Research Chemicals | TRC-R240000 | |
| All-trans-Retinol | Toronto Research Chemicals | TRC-R252002 | |
| Ethyl Acetate, suitable for HPLC, ≥99.7% | Sigma-Aldrich, Millipore Sigma | 205-500-4 | |
| Hexane, HPLC Grade | Fisher Scientific, Spectrum Chemical | 18-610-808 | |
| Methanol (HPLC) | Fisher Scienctific | A452SK-4 | |
| Retinyl Palmitate | Toronto Research Chemicals | TRC-R275450 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| Instruments | |||
| 1260 Infinity II Analytical Fraction Collector | Agilent | G1364F | |
| 1260 Infinity II Binary Pump | Agilent | G7112B | |
| 1260 Infinity II Diode Array Detector | Agilent | G7115A | |
| 1260 Infinity II Multicolumn Thermostat | Agilent | G7116A | |
| 1260 Infinity II Vialsampler | Agilent | G7129A | |
| ST40R Refrigerated Centrifuge | Thermo Scientific | TSST40R | |
| Vacufuge Plus Centrifuge Concentrator | Eppendorf | 22820168 | |
| Consumables | |||
| 2 mL Amber Screw Top Vials | Agilent | 5188-6535 | |
| Crimp Cap with PTFE/red rubber septa, 11 mm | Agilent | 5183-4498 | |
| Disposable Glass Conical Centrifuge Tubes | Millipore Sigma | CLS9950215 | |
| Screw cap tube, 15 mL | Sarstedt | 62.554.502 | |
| Vial insert, 150 µL, glass with polymer feet | Agilent | 5183-2088 |
References
- Palczewski, K., et al. Crystal structure of rhodopsin: A G protein-coupled receptor. Science. 289 (5480), 739-745 (2000).
- Rosenbaum, D. M., Rasmussen, S. G. F., Kobilka, B. K. The structure and function of G-protein-coupled receptors. Nature. 459 (7245), 356-363 (2009).
- Alhosaini, K., Azhar, A., Alonazi, A., Al-Zoghaibi, F. GPCRs: The most promiscuous druggable receptor of the mankind. Saudi Pharm J. 29 (6), 539-551 (2021).
- Hu, G. -M., Mai, T. -L., Chen, C. -M. Visualizing the GPCR network: Classification and evolution. Sci Rep. 7 (1), 15495(2017).
- Lerea, C. L., Somers, D. E., Hurley, J. B., Klock, I. B., Bunt-Milam, A. H. Identification of specific transducin α subunits in retinal rod and cone photoreceptors. Science. 234 (4772), 77-80 (1986).
- Gao, Y., Hu, H., Ramachandran, S., Erickson, J. W., Cerione, R. A., Skiniotis, G. Structures of the rhodopsin-transducin complex: Insights into G protein activation. Mol Cell. 75 (4), 781-790.e3 (2019).
- Zhou, X. E., Melcher, K., Xu, H. E. Structure and activation of rhodopsin. Acta Pharmacol Sin. 33 (3), 291-299 (2012).
- Robinson, P. R., Cohen, G. B., Zhukovsky, E. A., Oprian, D. D. Constitutively active mutants of rhodopsin. Neuron. 9 (4), 719-725 (1992).
- Kiser, P. D., Golczak, M., Palczewski, K. Chemistry of the retinoid (visual) cycle. Chem Rev. 114 (1), 194-232 (2014).
- Sani, B. P., Hill, D. L. [3] Structural characteristics of synthetic retinoids. Methods Enzymol. 189, 43-50 (1990).
- Lobo, G. P., Amengual, J., Palczewski, G., Babino, D., von Lintig, J. Carotenoid-oxygenases: Key players for carotenoid function and homeostasis in mammalian biology. Biochim Biophys Acta. 1821 (1), 78-87 (2012).
- Amengual, J., et al. Two carotenoid oxygenases contribute to mammalian provitamin A metabolism. J Biol Chem. 288 (47), 34081-34096 (2013).
- Harrison, E. H. Mechanisms involved in the intestinal absorption of dietary vitamin A and provitamin A carotenoids. Biochim Biophys Acta. 1821 (1), 70-77 (2012).
- Leung, M., et al. The logistical backbone of photoreceptor cell function: Complementary mechanisms of dietary vitamin A receptors and rhodopsin transporters. Int J Mol Sci. 25 (8), 4278(2024).
- Martin Ask, N., Leung, M., Radhakrishnan, R., Lobo, G. P. Vitamin A transporters in visual function: A mini review on membrane receptors for dietary vitamin A uptake, storage, and transport to the eye. Nutrients. 13 (11), 3987(2021).
- Harrison, E. H. Carotenoids, β-apocarotenoids, and retinoids: The long and the short of it. Nutrients. 14 (7), 1411(2022).
- Li, Y., Wongsiriroj, N., Blaner, W. S. The multifaceted nature of retinoid transport and metabolism. Hepatobiliary Surg Nutr. 3 (3), 126-139 (2014).
- D'Ambrosio, D. N., Clugston, R. D., Blaner, W. S. Vitamin A metabolism: An update. Nutrients. 3 (1), 63-103 (2011).
- Yamamoto, Y., et al. Interactions of transthyretin (TTR) and retinol-binding protein (RBP) in the uptake of retinol by primary rat hepatocytes. Exp Cell Res. 234 (2), 373-378 (1997).
- Kawaguchi, R., et al. A membrane receptor for retinol binding protein mediates cellular uptake of vitamin A. Science. 315 (5813), 820-825 (2007).
- Kiser, P. D., Golczak, M., Maeda, A., Palczewski, K. Key enzymes of the retinoid (visual) cycle in vertebrate retina. Biochim Biophys Acta. 1821 (1), 137-151 (2012).
- Radhakrishnan, R., et al. The role of motor proteins in photoreceptor protein transport and visual function. Ophthalmic Genet. 43 (3), 285-300 (2022).
- Solanki, A. K., et al. Loss of motor protein MYO1C causes rhodopsin mislocalization and results in impaired visual function. Cells. 10 (6), 1322(2021).
- Liu, X., Udovichenko, I. P., Brown, S. D. M., Steel, K. P., Williams, D. S. Myosin VIIa participates in opsin transport through the photoreceptor cilium. J Neurosci. 19 (15), 6267-6274 (1999).
- Insinna, C., Besharse, J. C. Intraflagellar transport and the sensory outer segment of vertebrate photoreceptors. Dev Dyn. 237 (8), 1982-1992 (2008).
- Krock, B. L., Mills-Henry, I., Perkins, B. D. Retrograde intraflagellar transport by cytoplasmic dynein-2 is required for outer segment extension in vertebrate photoreceptors but not arrestin translocation. Invest Ophthalmol Vis Sci. 50 (11), 5463-5471 (2009).
- Blaner, W. S. STRA6, a cell-surface receptor for retinol-binding protein: The plot thickens. Cell Metab. 5 (3), 164-166 (2007).
- Bouillet, P., et al. Developmental expression pattern of Stra6, a retinoic acid-responsive gene encoding a new type of membrane protein. Mech Dev. 63 (2), 173-186 (1997).
- Blomhoff, R., Norum, K. R., Berg, T. Hepatic uptake of [3H]retinol bound to the serum retinol binding protein involves both parenchymal and perisinusoidal stellate cells. J Biol Chem. 260 (25), 13571-13575 (1985).
- Kelly, M., von Lintig, J. STRA6: role in cellular retinol uptake and efflux. Hepatobiliary Surg Nutr. 4 (4), 229-242 (2015).
- Quadro, L., et al. The role of extrahepatic retinol binding protein in the mobilization of retinoid stores. J. Lipid Res. 45 (11), 1975-1982 (2004).
- Alapatt, P., et al. Liver retinol transporter and receptor for serum retinol-binding protein (RBP4). J Biol Chem. 288 (2), 1250-1265 (2013).
- Chawla, A., Repa, J. J., Evans, R. M., Mangelsdorf, D. J. Nuclear receptors and lipid physiology: Opening the X-files. Science. 294 (5548), 1866-1870 (2001).
- Heyman, R. A., et al. 9-cis retinoic acid is a high affinity ligand for the retinoid X receptor. Cell. 68 (2), 397-406 (1992).
- Allenby, G., et al. Retinoic acid receptors and retinoid X receptors: interactions with endogenous retinoic acids. Proc Natl Acad Sci USA. 90 (1), 30-34 (1993).
- Das, B. C., et al. Retinoic acid signaling pathways in development and diseases. Bioorg Med Chem. 22 (2), 673-683 (2014).
- Hernandez, R. E., Putzke, A. P., Myers, J. P., Margaretha, L., Moens, C. B. Cyp26 enzymes generate the retinoic acid response pattern necessary for hindbrain development. Development. 134 (1), 177-187 (2007).
- Yashiro, K., et al. Regulation of retinoic acid distribution is required for proximodistal patterning and outgrowth of the developing mouse limb. Dev Cell. 6 (3), 411-422 (2004).
- Duester, G. Families of retinoid dehydrogenases regulating vitamin A function. Eur J Biochem. 267 (14), 4315-4324 (2000).
- Tatum, V., Chow, C. K. Rapid measurement of retinol, retinal, 13-cis-retinoic acid and all-trans-retinoic acid by high performance liquid chromatography. J Food Drug Anal. 13 (3), (2020).
- Teerlink, T., Copper, M. P., Klaassen, I., Braakhuis, B. J. M. Simultaneous analysis of retinol, all-trans- and 13-cis-retinoic acid and 13-cis-4-oxoretinoic acid in plasma by liquid chromatography using on-column concentration after single-phase fluid extraction. J Chromatogr B. Biomed Sci App. 694 (1), 83-92 (1997).
- Egberg, D. C., Heroff, J. C., Potter, R. H. Determination of all-trans and 13-cis vitamin A in food products by high-pressure liquid chromatography. J Agric Food Chem. 25 (5), 1127-1132 (1977).
- Sudo, Y., et al. A microbial rhodopsin with a unique retinal composition shows both sensory rhodopsin II and bacteriorhodopsin-like properties. J Biol Chem. 286 (8), 5967-5976 (2011).
- Kane, M. A., Napoli, J. L. Quantification of endogenous retinoids. Methods Mol Biol. 652, 1-54 (2010).
- Landers, G. M., Olson, J. A. Rapid, simultaneous determination of isomers of retinal, retinal oxime and retinol by high-performance liquid chromatography. J Chromatogr A. 438, 383-392 (1988).
- Hubbard, R., Brown, P. K., Bownds, D. [243] Methodology of vitamin A and visual pigments. Methods Enzymol. 18, 615-653 (1971).
- Robeson, C. D., et al. Chemistry of vitamin A. XXIV. The synthesis of geometric isomers of vitamin A via methyl β-methylglutaconate1. J Am Chem Soc. 77 (15), 4111-4119 (1955).
- Robeson, C. D., Blum, W. P., Dieterle, J. M., Cawley, J. D., Baxter, J. G. Chemistry of vitamin A. XXV. Geometrical isomers of vitamin A aldehyde and an isomer of its α-ionone analog1. J Am Chem Soc. 77 (15), 4120-4125 (1955).
- Hubinger, J. C. Determination of retinol, retinyl palmitate, and retinoic acid in consumer cosmetic products. J Cosmet Sci. 60 (5), 485-500 (2009).
- Bhat, P. V., Co, H. T., Lacroix, A. Effect of 2-alkanols on the separation of geometric isomers of retinol in non-aqueous high-performance liquid chromatography. J Chromatogr A. 260, 129-136 (1983).
- Stancher, B., Zonta, F. Quantitative high-performance liquid chromatographic method for determining the isomer distribution of retinol (vitamin A1) and 3-dehydroretinol (vitamin A2) in fish oils. J Chromatogr. 312, 423-434 (1984).
- Zonta, F., Stancher, B. High-performance liquid chromatography of retinals, retinols (vitamin A1) and their dehydro homologues (vitamin A2): improvements in resolution and spectroscopic characterization of the stereoisomers. J Chromatogr A. 301, 65-75 (1984).
- van Kuijk, F. J., Handelman, G. J., Dratz, E. A. Rapid analysis of the major classes of retinoids by step gradient reversed-phase high-performance liquid chromatography using retinal (O-ethyl) oxime derivatives. J Chromatogr. 348 (1), 241-251 (1985).
- Kane, M. A., Folias, A. E., Napoli, J. L. HPLC/UV quantitation of retinal, retinol, and retinyl esters in serum and tissues. Anal Biochem. 378 (1), 71-79 (2008).
- Widjaja-Adhi, M. A. K., Ramkumar, S., von Lintig, J. Protective role of carotenoids in the visual cycle. FASEB J. 32 (11), 6305-6315 (2018).
- Ramkumar, S., Jastrzebska, B., Montenegro, D., Sparrow, J. R., von Lintig, J. Unraveling the mystery of ocular retinoid turnover: Insights from albino mice and the role of STRA6. J Biol Chem. 300 (3), 105781(2024).
- de Grip, W. J., Lugtenburg, J. Isorhodopsin: An undervalued visual pigment analog. Colorants. 1 (3), 256-279 (2022).
- Fan, J., Rohrer, B., Moiseyev, G., Ma, J., Crouch, R. K. Isorhodopsin rather than rhodopsin mediates rod function in RPE65 knock-out mice. Proc Natl Acad Sci USA. 100 (23), 13662-13667 (2003).
- Sparrow, J. R. Bisretinoids of RPE lipofuscin: Trigger for complement activation in age-related macular degeneration. Adv Exp Med Biol. 703, 63-74 (2010).
- Różanowska, M., Handzel, K., Boulton, M. E., Różanowski, B. Cytotoxicity of all-trans-retinal increases upon photodegradation. Photochem Photobiol. 88 (6), 1362-1372 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved