Method Article
고성능 액체 크로마토그래피를 사용한 쥐 안구 및 비안구 조직의 식이 비타민 A 대사 산물의 정량 분석
요약
여기에서는 필수 감광성 로돕신 발색단 11-시스-레티날을 생성하기 위한 전신 비타민 A 공급의 맥락에서 안구 및 전신 조직의 시각 기능 촉진에 관여하는 중요한 레티노이드를 검출하고 정량화하는 순상 고성능 액체 크로마토그래피 방법에 대해 설명합니다.
초록
G 단백질 결합 수용체(GPCR)는 리간드와의 결합 시 G 단백질의 활성화를 통해 신호 캐스케이드를 시작하는 막관통 단백질의 슈퍼패밀리입니다. 모든 포유류의 시각에서 로돕신은 광전달 캐스케이드의 시작을 담당하는 GPCR입니다. 광수용체 내에서 로돕신은 발색단 11-시스-레티날에 결합되어 있으며 11-시스-레티널에서 모든 트랜스-레티널로의 빛에 민감한 이성질체를 통해 활성화되며, 이는 트랜스듀신 G 단백질을 활성화하여 광전달 캐스케이드를 일으킵니다.
광전달은 잘 알려져 있지만, 눈에서 11-시스-망막 생성을 위한 식이 비타민 A 전구체의 공급에 관여하는 과정과 이 공급의 중단을 초래하는 질병은 아직 완전히 이해되지 않았습니다. 비타민 A 전구체가 장으로 흡수되면 레티닐 에스테르로 간에 저장되고 레티놀 결합 단백질 4(RBP4)에 결합된 모든 트랜스 레티놀로 혈류로 방출됩니다. 이 순환 RBP4-레티놀은 간, 폐, 신장 및 눈과 같은 전신 장기에 흡수됩니다. 따라서 눈과 전신 장기에서 식이 비타민 A의 다양한 대사 산물을 정량화하는 방법은 적절한 로돕신 GPCR 기능을 연구하는 데 매우 중요합니다.
이 방법에서는 쥐 조직에서 비타민 A 분석을 위한 포괄적인 추출 및 분석 방법을 제시합니다. 순상, 고성능 액체 크로마토그래피 분석을 통해 레틴알데히드, 레티놀 및 레티닐 에스테르의 모든 관련 이성질체를 한 번의 실행으로 동시에 검출할 수 있으므로 실험 샘플을 효율적으로 사용할 수 있고 동일한 샘플 내의 다른 비타민 A 대사 산물에 대한 내부 신뢰성이 향상됩니다. 이 포괄적인 방법을 통해 조사관은 로돕신 GPCR 기능에서 전신 비타민 A 공급을 더 잘 평가할 수 있습니다.
서문
G 단백질 결합 수용체(GPCR)는 가장 많이 연구되고 특성화된 단백질 슈퍼패밀리 중 하나입니다. 가장 잘 알려진 기능에서 GPCR은 신호 전달에서 세포 표면 수용체 역할을 하여 특정 리간드와 결합할 때 세포 내 반응을 초기화합니다. GPCR은 7개의 막관통(TM) 나선형 영역과 6개의 총 루프 영역을 특징으로 합니다. 6개의 고리 중 3개의 고리는 리간드 결합을 용이하게 하기 위해 세포 밖으로 배향되며, 다른 3개의 세포내 고리는 Gα, Gβ 및 Gγ 소단위 1,2로 구성된 이종 삼합체 G 단백질에 결합됩니다.
GPCR은 Class A Rhodopsin-Like, Class B Secretin Receptor family, Class C Glutamate, Class D Fungal Mating Pheromone Receptor, Class E Cyclic AMP receptor 및 Class F Frizzled/Smoothened 3,4를 포함한 여러 클래스로 분류됩니다. 이름에서 알 수 있듯이 GPCR 로돕신과 같은 클래스 A 하위 클래스에는 광전달 및 시각 기능을 담당하는 중요한 GPCR인 로돕신이 포함됩니다. 로돕신은 앞서 언급한 7개의 TM 나선 영역, 6개의 세포외 및 세포내 루프, 광수용체 1,5,6,7에서 트랜스듀신(GT)으로도 알려진 이종삼합체 G 단백질과의 연관성을 포함하여 GPCR의 표준 모델에서 발견되는 모든 관련 주요 특성 및 구조적 요소를 포함합니다. 로돕신의 결합 포켓 내에서 빛에 민감한 발색단 리간드인 11-시스-레티날은 공유 Schiff 염기 결합을 통해 라이신 296의 로돕신에 결합하여 11-시스-레티닐리덴 1,8을 형성합니다. 광자가 흡수되면 11-cis-retinylidene 광이성질체가 all-trans-retinylidene으로 분해되어 로돕신 내에서 구조적 변화를 유도합니다. 따라서 11-시스-레티날 리간드는 로돕신 GPCR의 기능에 매우 중요하며, 광수용체 내의 높은 회전율을 극복하기 위해 11-시스-레티날의 견고하고 효율적인 공급을 지속적으로 유지해야 합니다.
11-시스-레티날과 같은 레틴알데히드는 레티노이드라고 통칭되는 분자 그룹에 속하며, 생물학적으로 관련성이 있는 레티노이드는 비타민 A로 더 널리 알려져 있습니다. 레티노이드는 공액 폴리엔 사슬에 연결된 고리형 말단기가 특징이며, 다른 쪽 끝에는 극성 말단기가 있습니다. 비타민 A의 레틴알데히드 및 관련 비타민체는 이러한 특성화에 예외가 아니며, 이들은 β-이오논 고리를 고리형 말단기, 디테르펜 폴리엔 사슬 및 비타머에 따라 다른 극성 말단기, 즉 레티알데히드에 대한 알데히드기, 레티놀에 대한 수산기, 레티노산에 대한 카르복실기, 레티닐 에스테르에 대한 에스테르 결합을 포함하고, 등(그림 1)9,10.
포유류는 비타민 A를 신생할 수 없지만 식물은 합성할 수 있습니다. 따라서 포유류 시스템 내의 모든 레티노이드는 식물 기반 생산자의 식단에서 먹이 사슬의 소비자에게 유래해야 합니다. 비타민 A 대사의 표준 모델에서, 전형적인 식물 프로비타민 A인 β-카로틴은 청소부 수용체 클래스 B, 구성원 1(SCARB1)을 통해 장내 장세포로 흡수되고, β-카로틴 산소효소 1(BCO1/BCMO1)에 의해 두 개의 모든 트랜스 망막 분자로 절단되며, 이는 레틴알데히드 결합 단백질 2(RBP2)에 결합하고 all-trans로 환원됩니다-레티놀 탈수소 효소 (RDH)에 의한 레티놀, 레시틴 레티놀 아실 전이 효소 (LRAT)에 의해 레티 닐 에스테르로 변환 된 다음 chylomicrons 11,12,13,14의 혈류로 보내집니다. 반면에 레티닐 팔미테이트와 같은 레티닐 에스테르는 동물성 원료에서 추출한 주요 프로비타민 A 역할을 합니다. 장 내강에서 나온 레티닐 팔미테이트는 카르복실에스테라아제 1(CES1)에 의해 올-트랜스-레티놀로 가수분해되어 장 장세포(15)로 확산된다. 간은 비타민 A 항상성의 주요 저장 및 항상성 기관으로, 이러한 chylomicrons 내의 레티닐 에스테르를 흡수하며, 이는 레티닐 에스테르 가수분해효소에 의해 세포 레티놀 결합 단백질 1(CRBP1)에 결합된 모든 트랜스 레티놀로 가수분해되고, 간 성상 세포로 들어가 LRAT에 의해 다시 레티닐 에스테르로 전환되어 저장됩니다13,16, 17. 유기체에서 비타민 A의 항상성 수준을 유지하기 위해 간은 레티놀 결합 단백질 4(RBP4)와 트랜스티레틴(TTR)으로 구성된 혈청 수송 복합체에 결합된 모든 트랜스 레티놀 형태로 비타민 A를 방출합니다15,18,19. 이 복합체는 이 원고에서 holo-RBP4로 지칭됩니다.
혈액 내 이러한 전신 비타민 A 공급을 이용하려면 비타민 A의 강력한 공급원이 유지되는 안구 조직을 포함한 전신 조직이 holo-RBP4를 조직 내로 흡수하는 방법을 가지고 있어야 합니다. 안구 조직의 광수용체가 풍부한 망막 내에서 레티노산 6(STRA6)에 의해 자극된 막 수용체는 이 기능과 관련된 수송체입니다. 기계론적 연구에서 STRA6는 holo-RBP4에서 RPE20으로의 세포외 all-trans-retinol의 섭취를 촉진할 수 있는 것으로 나타났습니다. 이렇게 수입된 all-trans-retinol은 모든 trans-retinol이 RPE와 광수용체 외부 세그먼트 내에서 11-cis-retinal로 전환되는 과정인 시각 주기에 진입하여 로돕신 9,21에 결합할 때 시각 기능을 촉진합니다.
순환성 holo-RBP4의 all-trans-retinol이 STRA6를 통해 혈액-망막 장벽을 통과하여 안구 조직 내의 RPE로 들어가면, RPE의 all-trans-retinol은 먼저 LRAT에 의해 레티닐 에스테르로 에스테르화된 다음 망막 색소 상피 특이적 65kDa 단백질(RPE65)에 의해 11-시스-레티놀로 가수분해됩니다. 11-시스-레티놀은 레티놀 탈수소효소 5에 의해 11-시스-레티날로 전환됩니다. 이 11-시스-레티널은 그런 다음 광수용체 간 레티노이드 결합 단백질(IRBP)9,21에 의해 광수용체의 바깥쪽 분절(OS)로 운반됩니다. 외부 핵층(ONL) 내의 광수용체 핵을 둘러싸고 있는 소포체 내에서 옵신 GPCR은 합성되어 연결된 섬모(CC)를 통해 운반됩니다. CC를 가로지르는 이러한 수송에 관여하는 운동 단백질은 논쟁의 여지가 있지만, 현재의 가설은 kinesin 및 dynein-based intraflagellar transport (IFT) 또는 myosin-based transport가 이 과정의 촉진자일 가능성이 있다고 주장합니다 14,22,23,24,25,26. 이 두 구성 요소가 OS 내의 막질 디스크 내에서 만나면 11-cis-retinal 및 opsin은 로돕신의 lysine 196에서 Schiff 염기 공유 결합을 통해 11-cis-retinylidene을 형성하여 phototransduction8을 준비합니다.
망막의 RPE 내에서 STRA6의 발현은 holo-RBP4로부터 all-trans-retinol의 섭취를 촉진하는 데 도움이 되지만, STRA6는 비타민 A의 주요 항상성 기관으로서의 역할과 holo-RBP4 15,19,27,28로부터 all-trans-retinol을 섭취하는 능력을 보임에도 불구하고 간에서 발현되지 않는 것으로 밝혀졌습니다. 29,30,31. 결국, 레티놀 결합 단백질 4 수용체 2(RBPR2)라는 유사한 수용체가 발견되었으며, STRA6와 마찬가지로 holo-RBP4에서 all-trans-retinol을 섭취할 수 있는 능력을 보이지만 간 조직32에서 발현됩니다.
따라서 시각 기능에서 로돕신의 역할을 완전히 이해하려면 시각 색소의 재생으로 절정에 이르는 생물학적 과정에 대한 이해가 필요합니다. 이는 프로비타민 A 전구체의 대사, 간 내 저장, 간에서 holo-RBP4 방출, STRA6 및 RBPR2 막 수용체를 통한 holo-RBP4의 최종 흡수를 포함하여 앞서 설명한 과정과 밀접한 관련이 있습니다. 위에서 언급했듯이 마우스와 같은 동물 모델은 이러한 과정 연구에서 최고의 모델 중 하나로 남아 있습니다. 따라서 쥐 조직에서 레티노이드를 추출하는 방법과 이러한 레티노이드를 검출하고 정량화할 수 있는 순상 고성능 액체 크로마토그래피(HPLC) 방법을 제시하고자 합니다. 이러한 방법을 사용하면 11-cis-retinal rhodopsin 리간드 또는 main transport retinoid all-trans-retinol과 같이 위에서 설명한 중요한 레티노이드를 안구, 간 및 전신 기관에서 분석할 수 있습니다. 쥐 조직에서의 레티노이드 공급을 평가함으로써, 레티노이드의 물류 공급과 관련된 질병 상태 및 병리학에 대한 우리의 이해는 더욱 발전될 수 있습니다.
레티노이드는 옵신 GPCR과의 연계를 통해 시각 기능에서 발색단으로 기능하는 것 외에도, DNA 및 조절된 유전자 전사에 직접 결합하는 핵 수용체의 두 가지 계열인 레티노산 수용체(RAR)와 레티노이드 X 수용체(RXR)에 의해 촉진되는 레티노산 신호 전달을 통한 포유류 세포 신호 전달에도 중요한 역할을 합니다33. 이 두 계열 또는 수용체는 모두 레티노산 형태의 레티노이드를 리간드로 사용합니다. RAR은 all-trans-retinoic acid와 9-cis-retinoic acid 모두에 대해 친화력을 갖는 것으로 나타났지만 RXR은 9-cis-retinoic acid34,35에 대해서만 친화력을 나타냅니다. 조절되지 않은 양의 레티노산은 기형을 유발하며, 레티노산 신호전달은 매우 엄격하게 제어되어야 한다36. 신호전달을 위한 레티노산의 생산은 후뇌 및 사지 발달과 같이 조직의 적절한 발달을 위해 국소적으로 그리고 매우 특정한 시점에 이루어져야 하지만, 수많은 다른 예들이 레티노산 신호전달을 이용한다37,38. 레티노산 신호전달에 관여하는 세포 내에서 레티노산은 STRA6 또는 RBPR2에 의해 흡수된 레티놀을 레틴알데히드로 산화시키는 알코올/레티놀 탈수소효소(ADH/RDHs)와 레틴알데히드가 레티노산으로 산화되는 것을 촉진하는 레틴알데히드 탈수소효소(RALDHs)의 두 가지 효소 그룹에 의해 합성된다39. 레티노산은 GPCR 신호전달 자체에 관여하지 않지만, 신호전달 수용체의 리간드로 기능하는 중요한 레티노이드로 존재합니다.
여기에서 자세히 설명하지는 않지만, 식품 연구 및 미생물 로돕신 연구와 같은 다양한 상황에서 HPLC를 사용하여 이전에 확립된 레티노이드 검출 방법을 인정하고자 합니다. 이러한 방법은 레티노이드 검출에 대한 다양한 목표와 접근법을 사용하는데, 여기에는 휘발성과 위험이 적은 이동상(40,41,42)을 필요로 하는 역상 기법의 사용, 레티노산 및 관련 이성질체(40,41)의 검출, 다양한 생물학적 공급원(43)으로부터의 정제 및 추출이 포함된다. 당사의 분석법은 특히 포유류 조직에서 레티닐 팔미테이트, 레틴알데히드 이성질체 및 레티놀 이성질체를 검출하는 데 중점을 둡니다. 의도된 사용 사례가 이 특정 애플리케이션과 다른 경우 다른 프로토콜을 고려해야 합니다.
프로토콜
참고: 모든 동물 실험은 미네소타 대학의 IACUC(Institutional Animal Care and Use Committee)의 승인을 받았으며 안과 및 시력 연구에서 동물 사용에 대한 ARVO 선언문에 따라 수행되었습니다. 조명을 위해 어두운 빨간색 조명 아래에서 모든 추출을 수행합니다. 기기 디스플레이와 액세서리 LED에서 방출되는 잔류광에 주의하십시오.
1. 분광광도계 레티노이드 표준 생성 및 외부 표준 곡선 생성
참고: HPLC로 분석하기 전에 레티노이드를 임시로 보관할 드라이아이스 용기를 준비하십시오.
- 임의적이지만 적절한 양의 레티노이드를 칭량하고 분광광도계를 통한 정량화를 위해 적절한 용매에 용해시킵니다.
참고: 이 연구에서 사용된 선택된 용매는 에탄올이며, 에탄올에 용해된 레티노이드의 몰 흡수율 값은 표 1에 자세히 설명되어 있습니다. 무수 HPLC 등급 에탄올을 사용하여 표준물질과 샘플을 용해해야 합니다. 증류를 통해서만 정제된 에탄올은 물과 공비 혼합물을 형성하여 부피로 약 4%의 물을 포함합니다. 물은 헥사노익 이동상과 혼합되지 않으며 실리카 고정상의 수화를 초래하여 결국 컬럼의 저하를 초래합니다. - Beer-Lambert 법칙과 관련 레티노이드의 몰 흡수율을 활용하여 생성된 표준물질의 농도를 정량화합니다(표 1).
흡광도 = 몰 흡수율(ε) × 몰 농도 × 경로 길이 - 연속 희석을 수행하여 원하는 조직에 대한 정량 범위 내에서 표준 곡선을 생성할 수 있는 농도를 생성합니다.
참고: Beer-Lambert 법칙의 근본적인 한계(예: 고농도의 분석물에 대한 유효성 부족)를 알고 있어야 합니다. 이 문제를 피하기 위해 희석된 레티노이드 표준물질은 1보다 큰 흡광도 값을 생성하지 않아야 합니다. 쥐 장기의 레티놀 및 레틴알데히드 정량 분석에 대한 응용 분야의 경우, 1-10ng 범위의 보정 곡선이 발견된 일반적인 양을 처리할 수 있음을 발견했습니다. 쥐 간에서 채취한 레티닐 팔미테이트 정량화의 경우, 20-80 μg 범위의 검량선이 발견된 일반적인 양을 커버할 수 있음을 발견했습니다. - 이전에 생성된 스톡 용액에서 주입량을 점진적으로 변경하여 주입된 레티노이드 양을 점진적으로 변경함으로써, 피크를 적분하여 피크 적분이 주입된 레티노이드의 양에 정비례하는 레티노이드 정량화에 적합한 외부 표준 곡선을 생성합니다.
2. 조직 채취 및 검체 채취
알림: 조직 균질화 및 레티노이드 추출 전에 조직을 임시로 보관할 드라이아이스 용기를 준비합니다. 권장되는 조직 수확량은 표 2에 자세히 설명되어 있습니다. 각 조직에 대한 혈액 함량의 변화로 인한 레티노이드 변이를 설명하기 위해, 조직 추출은 완전히 관류된 마우스에서 수행되어야 하며, 혈액 추출은 별도의 마우스에서 완료되어야 합니다.
- IACUC(Institutional Animal Care and Use Committee)에서 지시한 프로토콜(여기에서 CO2 질식)에 따라 마우스를 안락사시킵니다.
- 혈액 : 안락사 직후 가위로 쥐의 목을 자르고 쥐의 주요 줄기에서 혈액을 1.5mL 튜브로 배출합니다.
- 눈: 집게를 사용하여 목이 잘린 머리에서 눈을 제거합니다.
- 뇌: 작은 가위를 사용하여 목이 잘린 머리를 자르고 집게를 사용하여 뇌를 제거합니다.
- 신장, 간, 비장, 심장 및 폐: 작은 가위를 사용하여 복부를 절개하고 정중선을 따라 위쪽 방향으로 절단한 다음 흉골과 흉곽을 절단합니다. 한 쌍의 집게를 사용하여 노출된 조직을 제거합니다.
3. 조직 균질화
참고: 큰 장기(예: 간 또는 폐 조직)와 같이 장기의 더 작은 분할을 분석하려는 경우 조직의 다른 부분에서 레티노이드 함량의 차이를 피하기 위해 전체 장기를 균질화해야 합니다. 대신, 더 적은 양의 조직이 필요한 경우 균질화를 분할합니다. 프로토콜의 회로도는 그림 2에 자세히 설명되어 있습니다. 이 수정된 프로토콜은 케인과 나폴리44에서 채택되었습니다.
- 50% 얼음처럼 차가운 식염수(0.9%) 및 50% 메탄올과 함께 조직 분쇄기 튜브에 조직을 넣습니다. 각 조직 유형에 사용되는 부피에 대해서는 표 2 를 참조하십시오.
- 유봉을 그라인더 튜브에 넣고 유봉으로 천천히 부드럽게 5회전을 수행하여 균질액을 얻습니다.
- 균질화 직후 시료를 15mL 튜브로 이송합니다.
- 메탄올 2mL를 넣고 실온에서 15분 동안 그대로 둡니다.
참고: 레틴알데히드 옥심 유도체 분석이 필요한 경우 0.1M HEPES(pH 6.5)에 0.1M 하이드록실아민 하이드로클로라이드 1mL를 추가합니다(그림 1).
4. 레티노이드 추출
주의: 헥산은 가연성이 높고 휘발성이 높으며 독성이 강합니다. 헥산을 취급할 때는 NIOSH(National Institute for Occupational Safety and Health)에서 승인한 호흡기, 보안경, 부틸 장갑 및 흄 후드를 사용해야 합니다. 샘플에서 헥산을 증발시킬 때 용매 흄 축적을 방지하기 위해 향상된 공기 순환 장치(예: 스노클 흡입 장치)를 사용하는 것이 좋습니다.
- 균질액에 10mL의 헥산을 추가하고 소용돌이를 일으키고 튜브를 수평으로 10초 이상 혼합합니다.
알림: 위상이 완전히 혼합되는 것이 중요합니다. - 균질액/헥산 혼합물을 1,000× g 에서 3분 동안 원심분리하여 상 분리를 용이하게 합니다.
- 균질액에서 레티노이드를 완전히 추출하기 위해 추출을 2회 수행합니다. 4.1단계와 4.2단계를 반복합니다.
- 피펫을 사용하여 헥산 층을 제거하고 진공 증발을 위해 헥산 층을 별도의 유리 15mL 튜브 세트에 넣습니다.
참고: 증발을 위해 GLASS 15mL 튜브를 사용하여 레티노이드가 튜브 벽에 부착되지 않도록 하십시오. - 진공 원심분리기를 사용하여 헥산을 완전히 증발시킵니다.
5. 재현탁 및 HPLC 분석
참고: 이 원고에 사용된 HPLC 시스템은 2액 펌프 시스템이었기 때문에 4가지 성분으로 구성된 이동상을 작동 전에 단일 병에 미리 혼합했습니다.
주의: 이 방법에 사용된 4가지 유기 용제는 모두 가연성이 높고 휘발성이 높으며 독성이 높습니다. 1,4-디옥산은 산소에 노출되면 폭발성 과산화물 형성에 취약합니다. 사용하지 않을 때는 1,4-다이옥산이 들어 있는 모든 용기를 닫아 두십시오. NIOSH(National Institute for Occupational Safety and Health)에서 승인한 호흡기, 보안경, 부틸 장갑 및 흄 후드를 사용할 때는 이러한 용제를 취급해야 합니다. HPLC에서 이러한 용매를 실행하는 동안, 용매 흄 축적을 방지하기 위해 일부 형태의 향상된 공기 순환 장치(예: 스노클 흡입 장치)를 사용하는 것이 권장됩니다.
- 건조된 15mL 튜브에 100μL의 헥산을 재현탁합니다. 모든 레티노이드가 용해되도록 잘 소용돌이칩니다.
- HPLC 분석을 위해 100μL의 헥산을 모두 단일 유리 인서트에 피펫팅합니다.
- HPLC 실행 설정(Landers 및 Olson45에서 조정): 이동상: 85.4% 헥산(v/v), 11.2% 에틸 아세테이트(v/v), 2% 디옥산(v/v), 1.4% 1-옥탄올(v/v); 컬럼: 4.6mm ID x 250nm, 5μm 컬럼 2개, 직렬로 연결됨; 다중 열 온도 조절기 온도: 25°C; 주입량: 100μL; 유속: 1mL/분; 상영 시간 : 40 분. UV 스펙트럼 흡광도 감지를 사용하십시오. 200nm에서 400nm까지의 UV 스펙트럼을 획득하려면 옵션을 선택한 상태로 유지합니다.
6. 피크 식별 및 적분
- 레티노이드 표준물질 분석에서 관찰된 관심 각 레티노이드의 머무름 시간 및 UV 스펙트럼을 사용하여 피크를 식별합니다(그림 3, 표 3 및 표 4).
- 선택한 HPLC 시스템의 크로마토그래피 데이터 시스템을 사용하여 식별된 피크를 적분합니다. 적분 또는 곡선 아래 면적은 분석물의 양에 정비례합니다. 1단계에서 생성된 외부 표준물질 곡선을 참조하여 분석물을 정량화합니다.
- 생물학적 조직에서 생성된 크로마토그램을 분석하려면 머무름 시간과 같은 파라미터의 변동성이 샘플에서 자주 관찰되기 때문에 일반적인 크로마토그래피 데이터 시스템에서 제공하는 자동 통합보다 수동 통합을 사용하십시오.
- 크로마토그램이 실행 중 문제를 나타낼 수 있는 불규칙성(예: 노이즈가 있는 기준선 또는 비가우스 피크)을 나타내지 않는지 확인합니다. 이러한 문제는 HPLC의 오염 물질 또는 컬럼의 마모를 나타내며 유효한 분석을 위해 수정해야 합니다.
결과
여기에서는 위에서 설명한 방법을 활용하여 쥐 안구 및 전신 조직에서 레티노이드를 검출 및 정량화하고 대표적인 크로마토그램을 생성했습니다. 또한 이러한 조직에서 검출될 수 있는 일반적인 레티노이드에 대한 요약을 제공할 것입니다.
생후 6개월이 되었을 때, 생쥐는CO2 질식을 통해 안락사시켰다. 안구 레티노이드 함량을 유지하기 위해, 마우스는 안락사 및 추출 전에 2일 동안 어두운 적응을 하였다. 레티노이드 추출 및 후속 HPLC 분석을 위해 두 개의 눈, 0.2g의 간, 75μL의 혈액을 채취했습니다. 안구 조직의 경우, 히드록실아민을 첨가하지 않고 한쪽 눈을 발치하고, 다른 쪽 눈은 히드록실아민 처리를 실시했습니다. 간과 혈액의 경우, 레틴알데히드는 일반적으로 이러한 조직에서 검출되지 않기 때문에 하이드록실아민 치료가 필요하지 않았습니다.
하이드록실아민으로 처리하지 않은 쥐 눈의 크로마토그램에서 두 개의 비표준 레틴알데히드 이성질체 중 하나인 13-시스-레티날이 확인되었습니다. 또한, 두 개의 표준 레틴알데히드 이성질체인 11-cis-retinal 및 all-trans-retinal이 모두 확인되었습니다. 두 크로마토그램 모두에서 시각 주기 중간체 11-시스-레티놀과 주요 비타민 A 수송 형태인 all-trans-레티놀을 모두 확인했습니다(그림 4A).
하이드록실아민으로 처리한 쥐 눈의 크로마토그램에서는 앞서 언급한 모든 레틴알데히드 이성질체가 여전히 존재했습니다. 그러나 이러한 이성질체의 머무름 시간은 크게 증가했습니다. 더욱이, 이러한 레틴알데히드 이성질체는 현재 syn 및 anti 이성질체로 존재합니다. peak integration을 통한 정량화 중에는 정확한 integration 값을 얻기 위해 syn 및 anti peaks를 모두 합산해야 합니다. 11-시스-레티놀과 올-트랜스-레티놀 모두 여전히 존재했다(그림 4B).
생쥐 간 조직의 크로마토그램에서 레티닐 팔미테이트(retinyl palmitate)와 올-트랜스-레티놀(all-trans-retinol)이 이들 조직 내에서 확인되었습니다. 레티닐 에스테르인 레티닐 팔미테이트는 포유류에서 비타민 A의 주요 저장 형태 역할을 하며 포유류의 간 조직에서 상당한 양으로 발견될 수 있습니다. 간은 비타민 A를 홀로-RBP4로 전신 조직으로 방출하며, 이 세포는 RBP4-트랜스트리에틴 복합체 내에 모든 트랜스-레티놀을 함유하고 있습니다. 그 후, 이 크로마토그램 내에서 큰 all-trans-retinol 피크를 식별할 수 있습니다(그림 4C).
생쥐 혈액의 크로마토그램에서 큰 all-trans-retinol 피크가 확인되었습니다. 간에서 홀로-RBP4가 순환계를 통해 전신 조직으로 방출된다는 점을 감안할 때 이는 예상된 결과입니다(그림 4D). 시간 종속 분해 HPLC 피크에서 레티노이드 동형의 특징적인 UV 스펙트럼 흡광도(~250-400nm)는 특정 각 피크에서 동형의 존재를 초기에 교차 확인하는 데 도움이 될 수 있습니다 (그림 5).

그림 1: 레티노이드의 화학 구조. (A) 이러한 레티노이드는 일반적으로 추출된 쥐 조직에서 발견됩니다. 레티노이드 이성질체에서 cis 이중 결합의 위치가 다르고 극성 말단 그룹이 다르다는 점에 유의하십시오. (B) 레틴알데히드를 레티날 옥시메로 전환하면 추출 효율이 증가하고, 레티닐 팔미테이트와의 피크 동시 용출 및 레틴알데히드 이성질체 내 동시 용리를 방지합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 조직 채취, 균질화, 레티노이드 추출 및 분석을 위한 워크플로우. 어둡게 적응된 마우스의 망막과 조직 샘플을 균질화하여 추출했습니다. 1 단계 : 지침에 따라 쥐를 안락사시킨 후 혈액과 다양한 조직을 채취합니다. 2-4단계: 그런 다음 식염수와 메탄올을 사용하여 조직 균질화를 수행하고 정량 분석을 위해 하이드록실아민 염산염을 사용합니다. 5-7단계: 레티노이드는 헥산을 사용하여 처리한 후 증발시킵니다. 8,9 단계 : 모든 레티노이드가 용해되도록 100μL의 헥산으로 재현탁합니다. 10 단계 : 마지막으로 HPLC를 사용하여 샘플을 분석합니다. 약어: HPLC = High-performance liquid chromatography. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 레티노이드 표준물질과 하이드록실아민 처리된 레티노이드 표준물질의 크로마토그램. (A) 이 크로마토그램에는 레티닐 팔미테이트, 13-시스-레티날, 11-시스-레티날, all-trans-retinal, 11-시스-레티놀, 13-시스-레티놀 및 all-trans-레티놀 표준물질이 포함되어 있습니다. (B) 이 크로마토그램에는 레티닐 팔미테이트, 13-시스-레티날, 11-시스-레티널, 올-트랜스-레티널, 11-시스-레티놀, 13-시스-레티놀 및 올-트랜스-레티놀 표준물질이 포함되어 있습니다. 이 크로마토그램에는 레티놀 이성질체 외에도 syn 및 anti oxime 레틴알데히드 이성질체가 포함되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 대표적인 크로마토그램. (A) 쥐 안구 조직의 대표 크로마토그램. 이 크로마토그램에는 레티놀 이성질체 외에도 레틴알데히드 이성질체를 포함하여 쥐 안구 조직에서 일반적으로 발견되는 레티노이드가 포함되어 있습니다. (B) 하이드록실아민 처리된 마우스 안구 조직의 대표 크로마토그램. 이전 크로마토그램(그림 4A)에서 발견된 화학적으로 변형되지 않은 레틴알데히드 대신, 이 크로마토그램에는 레티놀 이성질체 외에도 syn 및 anti oxime retinaldeyde 이성질체가 포함되어 있습니다. (C) 마우스 간 조직의 대표 크로마토그램. 이 크로마토그램에는 레티닐 팔미테이트(retinyl palmitate) 및 올-트랜스-레티놀(all-trans-retinol)을 포함하여 쥐 간 조직에서 일반적으로 발견되는 레티노이드가 포함되어 있습니다. (D) 쥐 혈액의 대표 크로마토그램. 이 크로마토그램에는 all-trans-retinol을 포함하여 쥐의 혈액에서 일반적으로 발견되는 레티노이드가 포함되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
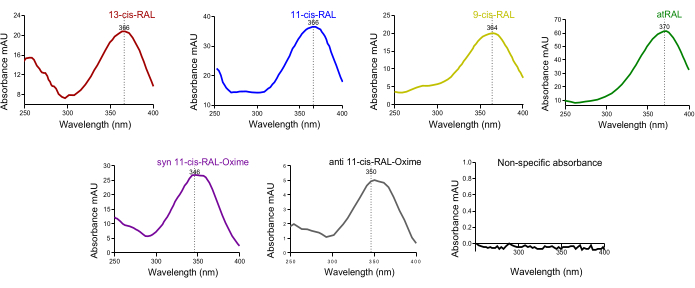
그림 5: 쥐 안구 조직에서 추출한 레틴알데히드 이성질체의 UV 흡광도 스펙트럼. (A) 13-시스-레티날, (B) 11-시스-레티날, (C) 9-시스-레티널, (D) 모든 트랜스-레티날, (E) syn 11-시스-레티날 옥심, (F) 안티 11-시스-레티날 옥심의 흡광도 스펙트럼. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: HPLC 모듈, 이동상 흐름 및 기타 기기의 개요. 이동상 흐름은 준비된 용매 병에서 시작하여 2액(binary) 펌프에 의해 고압으로 자동 시료 주입기로 펌핑되며, 여기서 분석물질은 용매 흐름에 통합됩니다. 이동상과 분석물질은 온도 조절이 가능한 컬럼 컴파트먼트에 도달하고, 최종적으로 측정을 위해 다이오드 어레이 검출기로 들어갑니다. (A) 레티노이드의 광이성질체화를 최소화하는 빨간색 모니터 화면. (B) 바이너리 펌프. (C) 바이알 샘플러. (D) 다중 열 온도 조절기. (E) 다이오드 어레이 검출기. (F) 분석 분획 분취기. (G) 고밀도 폴리 폐기물 용기. (H) 왼쪽에서 오른쪽으로, 알루미늄 크림프 캡, 폴리머 피트가 있는 250μL 인서트, 황색 크림프 상단 바이알, 주입 바이알의 최종 조립품. (I) 왼쪽, 냉장 원심분리기. 오른쪽, 원심분리기 농축기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 화합물 | 몰 흡수율 (ε) | 용매 | 참조 |
| 레티닐 팔미테이트 | 49260 | 에탄올 | 허버드 외.49 |
| 13-시스-망막 | 35500 | 에탄올 | 허버드 외.49 |
| 11-시스-망막 | 24935 | 에탄올 | 허버드 외.49 |
| 9-시스-망막 | 36100 | 에탄올 | Robeson 외 51 |
| 모든 트랜스 망막 | 42880 | 에탄올 | 허버드 외.49 |
| 11-시스-레티놀 | 34890 | 에탄올 | 허버드 외.49 |
| 13-시스-레티놀 | 48305 | 에탄올 | Robeson 외 50 및 Robeson 외 51 |
| 올-트랜스-레티놀 | 52770 | 에탄올 | 허버드 외.49 |
표 1: 에탄올에서 레티노이드의 몰 흡수율. 레티노이드의 몰 흡수율 값은 Kane 및 Napoli44, Hubbard et al.46, Robeson et al.47 및 Robeson et al.48로부터 수집하였다. 몰 흡수율은 용매에 따라 다릅니다. 여기에 나열된 값은 에탄올에 용해된 레티노이드에만 해당됩니다.
| 조직 | 조직 수확량 | 균질화를 위한 부피 |
| 피 | 75 마이크로리터 | 해당 없음 |
| 간 | 0.2 지 | 2mL |
| 신장 | 2 전체 신장 | 2mL |
| 피부 | 0.2 지 | 1mL – 1.5mL |
| 지라 | 1 전체 비장 | 1mL |
| 눈 | 양쪽 레티나, 풀 4 레티나 | 1mL |
| 뇌 | 1 전뇌 | 2mL |
| 심장 | 1 진심 | 1mL |
| 부아 | 0.2 지 | 2mL |
표 2: 분석당 권장되는 조직 양. Kane 및 Napoli44에서 권장하는 조직 균질화를 위한 50% 얼음-냉 식염수(0.9%) 및 50% 메탄올의 분석당 조직 양 및 부피.
| 화합물 | 머무름 시간(분) | UV 흡광도 최대값 (nm) |
| 레티닐 팔미테이트 | 5.177 | 326 |
| 13-시스-망막 | 7.268 | 366 |
| 11-시스-망막 | 7.691 | 366 |
| 9-시스-망막 | 7.931 | 364 |
| 모든 트랜스 망막 | 8.993 | 370 |
| 11-시스-레티놀 | 17.003 | 318 |
| 13-시스-레티놀 | 17.83 | 328 |
| 올-트랜스-레티놀 | 23.933 | 326 |
표 3: 레티노이드의 머무름 시간 및 최대 흡광도 파장. 이 값들은 참조된 다이오드 어레이 검출기로 검출된 바와 같이 설명된 방법 및 이동상과 함께 사용될 때 관찰되었습니다.
| 화합물 | 머무름 시간(분) | UV 흡광도 최대값 (nm) |
| Syn 11-cis-망막 산소 농도 | 9.59 | 346 |
| 신(Syn )모든 트랜스 망막 산소 농도 | 10.6 | 356 |
| Syn 13-cis-망막 옥심 | 11.3 | 352 |
| 안티 13-시스-망막 산소 농도 | 13 | 356 |
| 안티 11-시스-망막 산소 | 15.1 | 350 |
| 반 모든 트랜스 망막 산소 농도 | 19.7 | 360 |
표 4: 하이드록실아민 처리된 레틴알데히드의 머무름 시간 및 최대 흡광도 파장, 각 레틴알데히드의 syn 및 anti oxime 이성질체. 이 값들은 참조된 다이오드 어레이 검출기로 검출된 바와 같이 설명된 방법 및 이동상과 함께 사용될 때 관찰되었습니다.
토론
이 방법에서 순상 HPLC는 레티닐 에스테르, 레티닐알데히드 및 레티놀을 포함한 관련 레티노이드를 검출하고 정량화하는 데 사용됩니다. 로돕신 GPCR의 활성화에서 중요한 발색단으로서 11-시스-레티날의 중요성을 감안할 때, 11-시스-레티날의 생성과 관련된 대사 산물을 검출할 수 있는 방법은 전반적인 시각 기능 연구에 매우 중요합니다. 이 방법의 주요 장점은 레틴알데히드와 레티놀의 모든 관련 이성질체를 한 번의 실행으로 동시에 검출하고 정량화할 수 있다는 것입니다. 생존 가능한 실험 조직이 얼마나 부족한지를 감안할 때 이 방법을 사용하면 레티노이드 검출에서 조직을 효율적으로 사용할 수 있습니다. 헥산 및 에틸 아세테이트 기반 이동상의 사용이 레티노이드49의 분리에서 보고되었지만, 1,4-디옥산 및 1-옥탄올을 첨가하면 레티노이드 이성질체의 분리능이 향상됩니다. 1,4-디옥산은 13-시스-레티놀 및 11-시스-레티놀50의 분리에 필요하며, 1-옥탄올과 같은 장쇄 알코올은 레티놀 이성질체 45,51,52의 분리를 더욱 향상시킵니다.
레틴알데히드 이성질체의 정량화를 위해서는 반응성 알데히드 그룹이 단백질 및 지질과 같은 다른 생체 분자와 반응하기 쉽기 때문에 히드록실아민을 사용한 해당 레틴알데히드 옥시메로의 사전 전환이 필요합니다(45,53,54). 레틴알데히드 옥심은 더 쉽게 추출되고 레틴알데히드 피크가 실행 후반에 용리되도록 하여 생물학적 조직에 대해 5~8분에서 용리되는 미지의 피크 그룹 및 레티닐 팔미테이트 피크와의 피크 동시 용리를 방지합니다. 하이드록실아민으로 레틴알데히드를 처리하면 유사한 용출 시간을 가진 레틴알데히드의 동시 용출도 방지할 수 있다45. 레틴알데히드 옥심으로의 전환은 syn 및 anti 이성질체를 모두 생성하며, 이 이성질체는 각 레틴알데히드 이성질체에 대해 두 개의 다른 피크로 두 개의 다른 시간에 용리됩니다. 각 레틴알데히드 이성질체를 적절하게 정량화하기 위해 두 피크에 대한 적분을 합산해야 합니다. 머무름 시간 외에도 UV 스펙트럼은 피크 식별에 활용할 수 있는 또 다른 메트릭을 제공합니다. 각 레티노이드는 최대 UV 흡광도에 대해 약간씩 다른 효과를 보입니다. 머무름 시간과 함께 고려할 때 이 두 가지 메트릭을 통해 피크를 정확하게 식별할 수 있습니다(표 3 및 표 4).
안구 조직에서는 11-cis-retinal 및 all-trans-retinal과 같은 표준 레틴알데히드 이성질체의 존재가 예상되며, 11-cis-retinal은 중요한 로돕신 리간드 발색단이고 all-trans-retinal은 광이성질체화된 리간드이지만 다른 비표준 레틴알데히드 이성질체는 이 방법으로 검출됩니다. 특히, 분석 중 쥐 안구 조직의 HPLC 실행에서 13-cis-retinal이 쉽게 검출되었습니다(그림 4A-D). 이러한 비표준 레틴알데히드의 출현은 완전히 예상치 못한 것은 아니지만, 13-시스-레티날과 9-시스-레티날은 모두 망막에 대한 빛에 의한 스트레스로 인한 부산물로 알려져 있다(55,56). 이러한 레틴알데히드 이성질체는 알려진 표준 광전달 캐스케이드 경로에 참여하지 않으며 이들의 대사 운명은 상대적으로 알려지지 않았습니다. 그러나 9-cis-retinal은 로돕신의 결합 주머니에도 안정적으로 결합하여 이소로돕신을 형성하는 것으로 나타났습니다. 이소로돕신의 역할은 아직 완전히 규명되지 않았지만, 연구에 따르면 이소로돕신은 11-시스-레티날 기반 로돕신57,58과 매우 유사한 감광성을 나타냅니다. 적어도, 9-시스-레티날(9-cis-retinal)이 이소로돕신(isorhodopsin)을 안정적으로 형성하고 광이성질체(photoisomerize)를 모든 트랜스-레티널(all-trans-retinal)로 만들 수 있는 능력은 우리의 HPLC 분석에서 9-시스-레티날이 없는 것에 대한 합리적인 설명을 제공한다56. 반면에 13-cis-retinal은 알려진 안구 생화학적 경로에 관여하는 것으로 나타나지 않았으며, 안구 조직 내에 축적되면 망막 내에 산화 스트레스가 발생할 수 있습니다 55,59,60.
9-시스-레티날은 일반적으로 쥐 조직에서 발견되지 않지만, 하이드록실아민 처리 방법은 9-시스-레티날의 분리 및 정량화를 위한 실행 가능한 방법이 아니라는 점을 언급해야 합니다. syn 9-cis-retinal 및 syn 13-cis-retinal의 피크는 11.2분에 용리됩니다. 외인성으로 적용되는 경우와 같이 상당한 양의 9-cis-retinal이 예상되는 경우, 9-cis-retinal과 13-cis-retinal의 결합을 정량화하는 것만 가능합니다. 정성적 식별을 위해 조직을 하이드록실아민으로 처리하지 않고 이 방법을 수행하면 13-시스-레티날 및 9-시스-레티막 피크를 완전히 분리할 수 있습니다.
안구 조직 외에도 이 방법은 전신 조직에도 쉽게 적용할 수 있습니다. 다양한 이성질체 형태의 레틴알데히드는 일반적으로 전신 조직에서 발견되지 않지만, 레티놀 결합 단백질 4(holo-RBP4)에 결합된 all-trans-retinol은 포유류 유기체에서 비타민 A의 주요 수송 형태이며 all-trans-retinol은 이 방법을 사용하여 혈액에서 쉽게 검출할 수 있습니다. 혈액 외에도 모든 트랜스 레티놀은 일반적으로 모든 전신 조직에서 검출될 수 있습니다. 따라서 이 방법을 사용하면 이 방법을 사용하여 완전한 전신 조직 전체의 레티노이드 프로필을 생성할 수 있습니다.
레틴알데히드, 특히 중요한 로돕신 리간드 11-시스-레티날은 광이성질체화에 매우 취약하기 때문에 위에서 설명한 단계 중 하나라도 실수로 빛에 노출되는 것을 방지하기 위한 예방 조치를 취하는 것이 중요합니다. 실내 조명 및 계기판의 명백한 광원 외에도 HPLC 자체를 포함하여 기기 뒤에서 발견되는 것과 같은 다양한 기기의 액세서리 LED에서 나오는 잘못된 빛이 우발적인 빛 노출의 주요 원인이라는 것을 발견했습니다(그림 6). 또한 전용 암실이 레틴알데히드 이성질체와 실험 조직을 적절하게 취급하는 데 필수적이라는 것을 알게 되었습니다. 빛을 최소화하는 것 외에도 빛이 없는 경우에도 레틴알데히드 이성질체의 분해가 발생하기 때문에 안락사 및 채취 후 조직을 신속하고 신속하게 처리하는 것이 좋습니다. 이상적으로는 조직 채취, 추출 및 HPLC 분석이 모두 같은 날에 완료되어야 합니다.
즉시 처리되지 않은 조직은 -80 °C의 어두운 곳에 보관해야 하며 처리하기 전에 일주일 이상 보관해서는 안 됩니다. 위에서 언급했듯이 이동상 및 위 방법의 추출 단계에서 사용되는 모든 용매는 독성, 휘발성 및 가연성이 높습니다. 이러한 유해 용제를 취급할 때는 적절한 절차와 장비를 사용해야 합니다. 용매 취급 전에 부틸 장갑, NIOSH 승인 호흡보호구 및 눈 보호구와 같은 적절한 개인 보호 장비(PPE)를 착용해야 하며 모든 용제 이송은 흄 후드 내에서 이루어져야 합니다. 1,4-디옥산은 산소에 노출되면 폭발성 과산화물이 형성되기 쉽다는 점에 유의하고 1,4-디옥산이 포함된 모든 용매 용기는 공기로부터 단단히 밀봉된 상태로 유지하십시오.
부적절한 재료나 장비로 인해 순상 HPLC 분석법을 사용할 수 없는 경우, 레틴알데히드와 레티놀을 검출하고 정량화하기 위해 아세토니트릴 및 물과 같은 휘발성이 적은 용매를 사용하는 보다 일반적인 역상 분석법이 존재합니다. 그러나 이러한 방법은 이성질체를 분리할 수 없으며 총 레틴알데히드 또는 총 레티놀44,54만 검출할 수 있습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 NIH-NEI 보조금(EY030889 및 3R01EY030889-03S1)과 미네소타 대학의 G.P.L.에 대한 창업 자금의 지원을 받았습니다. 또한 이 원고에 사용된 11-cis-retinal 표준을 제공해 준 National Eye Institute에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| 1-Octanol, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 203-917-6 | |
| 1,4-Dioxane, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 204-661-8 | |
| 11-cis-retinal | National Eye Institute | N/A | |
| 11-cis-Retinol | Toronto Research Chemicals | TRC-R252105 | |
| 13-cis-retinal | Toronto Research Chemicals | TRC-R239900 | |
| 13-cis-retinol | Toronto Research Chemicals | TRC-R252110 | |
| All-trans-Retinal | Toronto Research Chemicals | TRC-R240000 | |
| All-trans-Retinol | Toronto Research Chemicals | TRC-R252002 | |
| Ethyl Acetate, suitable for HPLC, ≥99.7% | Sigma-Aldrich, Millipore Sigma | 205-500-4 | |
| Hexane, HPLC Grade | Fisher Scientific, Spectrum Chemical | 18-610-808 | |
| Methanol (HPLC) | Fisher Scienctific | A452SK-4 | |
| Retinyl Palmitate | Toronto Research Chemicals | TRC-R275450 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| Instruments | |||
| 1260 Infinity II Analytical Fraction Collector | Agilent | G1364F | |
| 1260 Infinity II Binary Pump | Agilent | G7112B | |
| 1260 Infinity II Diode Array Detector | Agilent | G7115A | |
| 1260 Infinity II Multicolumn Thermostat | Agilent | G7116A | |
| 1260 Infinity II Vialsampler | Agilent | G7129A | |
| ST40R Refrigerated Centrifuge | Thermo Scientific | TSST40R | |
| Vacufuge Plus Centrifuge Concentrator | Eppendorf | 22820168 | |
| Consumables | |||
| 2 mL Amber Screw Top Vials | Agilent | 5188-6535 | |
| Crimp Cap with PTFE/red rubber septa, 11 mm | Agilent | 5183-4498 | |
| Disposable Glass Conical Centrifuge Tubes | Millipore Sigma | CLS9950215 | |
| Screw cap tube, 15 mL | Sarstedt | 62.554.502 | |
| Vial insert, 150 µL, glass with polymer feet | Agilent | 5183-2088 |
참고문헌
- Palczewski, K., et al. Crystal structure of rhodopsin: A G protein-coupled receptor. Science. 289 (5480), 739-745 (2000).
- Rosenbaum, D. M., Rasmussen, S. G. F., Kobilka, B. K. The structure and function of G-protein-coupled receptors. Nature. 459 (7245), 356-363 (2009).
- Alhosaini, K., Azhar, A., Alonazi, A., Al-Zoghaibi, F. GPCRs: The most promiscuous druggable receptor of the mankind. Saudi Pharm J. 29 (6), 539-551 (2021).
- Hu, G. -. M., Mai, T. -. L., Chen, C. -. M. Visualizing the GPCR network: Classification and evolution. Sci Rep. 7 (1), 15495 (2017).
- Lerea, C. L., Somers, D. E., Hurley, J. B., Klock, I. B., Bunt-Milam, A. H. Identification of specific transducin α subunits in retinal rod and cone photoreceptors. Science. 234 (4772), 77-80 (1986).
- Gao, Y., Hu, H., Ramachandran, S., Erickson, J. W., Cerione, R. A., Skiniotis, G. Structures of the rhodopsin-transducin complex: Insights into G protein activation. Mol Cell. 75 (4), 781-790.e3 (2019).
- Zhou, X. E., Melcher, K., Xu, H. E. Structure and activation of rhodopsin. Acta Pharmacol Sin. 33 (3), 291-299 (2012).
- Robinson, P. R., Cohen, G. B., Zhukovsky, E. A., Oprian, D. D. Constitutively active mutants of rhodopsin. Neuron. 9 (4), 719-725 (1992).
- Kiser, P. D., Golczak, M., Palczewski, K. Chemistry of the retinoid (visual) cycle. Chem Rev. 114 (1), 194-232 (2014).
- Sani, B. P., Hill, D. L. [3] Structural characteristics of synthetic retinoids. Methods Enzymol. 189, 43-50 (1990).
- Lobo, G. P., Amengual, J., Palczewski, G., Babino, D., von Lintig, J. Carotenoid-oxygenases: Key players for carotenoid function and homeostasis in mammalian biology. Biochim Biophys Acta. 1821 (1), 78-87 (2012).
- Amengual, J., et al. Two carotenoid oxygenases contribute to mammalian provitamin A metabolism. J Biol Chem. 288 (47), 34081-34096 (2013).
- Harrison, E. H. Mechanisms involved in the intestinal absorption of dietary vitamin A and provitamin A carotenoids. Biochim Biophys Acta. 1821 (1), 70-77 (2012).
- Leung, M., et al. The logistical backbone of photoreceptor cell function: Complementary mechanisms of dietary vitamin A receptors and rhodopsin transporters. Int J Mol Sci. 25 (8), 4278 (2024).
- Martin Ask, N., Leung, M., Radhakrishnan, R., Lobo, G. P. Vitamin A transporters in visual function: A mini review on membrane receptors for dietary vitamin A uptake, storage, and transport to the eye. Nutrients. 13 (11), 3987 (2021).
- Harrison, E. H. Carotenoids, β-apocarotenoids, and retinoids: The long and the short of it. Nutrients. 14 (7), 1411 (2022).
- Li, Y., Wongsiriroj, N., Blaner, W. S. The multifaceted nature of retinoid transport and metabolism. Hepatobiliary Surg Nutr. 3 (3), 126-139 (2014).
- D'Ambrosio, D. N., Clugston, R. D., Blaner, W. S. Vitamin A metabolism: An update. Nutrients. 3 (1), 63-103 (2011).
- Yamamoto, Y., et al. Interactions of transthyretin (TTR) and retinol-binding protein (RBP) in the uptake of retinol by primary rat hepatocytes. Exp Cell Res. 234 (2), 373-378 (1997).
- Kawaguchi, R., et al. A membrane receptor for retinol binding protein mediates cellular uptake of vitamin A. Science. 315 (5813), 820-825 (2007).
- Kiser, P. D., Golczak, M., Maeda, A., Palczewski, K. Key enzymes of the retinoid (visual) cycle in vertebrate retina. Biochim Biophys Acta. 1821 (1), 137-151 (2012).
- Radhakrishnan, R., et al. The role of motor proteins in photoreceptor protein transport and visual function. Ophthalmic Genet. 43 (3), 285-300 (2022).
- Solanki, A. K., et al. Loss of motor protein MYO1C causes rhodopsin mislocalization and results in impaired visual function. Cells. 10 (6), 1322 (2021).
- Liu, X., Udovichenko, I. P., Brown, S. D. M., Steel, K. P., Williams, D. S. Myosin VIIa participates in opsin transport through the photoreceptor cilium. J Neurosci. 19 (15), 6267-6274 (1999).
- Insinna, C., Besharse, J. C. Intraflagellar transport and the sensory outer segment of vertebrate photoreceptors. Dev Dyn. 237 (8), 1982-1992 (2008).
- Krock, B. L., Mills-Henry, I., Perkins, B. D. Retrograde intraflagellar transport by cytoplasmic dynein-2 is required for outer segment extension in vertebrate photoreceptors but not arrestin translocation. Invest Ophthalmol Vis Sci. 50 (11), 5463-5471 (2009).
- Blaner, W. S. STRA6, a cell-surface receptor for retinol-binding protein: The plot thickens. Cell Metab. 5 (3), 164-166 (2007).
- Bouillet, P., et al. Developmental expression pattern of Stra6, a retinoic acid-responsive gene encoding a new type of membrane protein. Mech Dev. 63 (2), 173-186 (1997).
- Blomhoff, R., Norum, K. R., Berg, T. Hepatic uptake of [3H]retinol bound to the serum retinol binding protein involves both parenchymal and perisinusoidal stellate cells. J Biol Chem. 260 (25), 13571-13575 (1985).
- Kelly, M., von Lintig, J. STRA6: role in cellular retinol uptake and efflux. Hepatobiliary Surg Nutr. 4 (4), 229-242 (2015).
- Quadro, L., et al. The role of extrahepatic retinol binding protein in the mobilization of retinoid stores. J. Lipid Res. 45 (11), 1975-1982 (2004).
- Alapatt, P., et al. Liver retinol transporter and receptor for serum retinol-binding protein (RBP4). J Biol Chem. 288 (2), 1250-1265 (2013).
- Chawla, A., Repa, J. J., Evans, R. M., Mangelsdorf, D. J. Nuclear receptors and lipid physiology: Opening the X-files. Science. 294 (5548), 1866-1870 (2001).
- Heyman, R. A., et al. 9-cis retinoic acid is a high affinity ligand for the retinoid X receptor. Cell. 68 (2), 397-406 (1992).
- Allenby, G., et al. Retinoic acid receptors and retinoid X receptors: interactions with endogenous retinoic acids. Proc Natl Acad Sci USA. 90 (1), 30-34 (1993).
- Das, B. C., et al. Retinoic acid signaling pathways in development and diseases. Bioorg Med Chem. 22 (2), 673-683 (2014).
- Hernandez, R. E., Putzke, A. P., Myers, J. P., Margaretha, L., Moens, C. B. Cyp26 enzymes generate the retinoic acid response pattern necessary for hindbrain development. Development. 134 (1), 177-187 (2007).
- Yashiro, K., et al. Regulation of retinoic acid distribution is required for proximodistal patterning and outgrowth of the developing mouse limb. Dev Cell. 6 (3), 411-422 (2004).
- Duester, G. Families of retinoid dehydrogenases regulating vitamin A function. Eur J Biochem. 267 (14), 4315-4324 (2000).
- Tatum, V., Chow, C. K. Rapid measurement of retinol, retinal, 13-cis-retinoic acid and all-trans-retinoic acid by high performance liquid chromatography. J Food Drug Anal. 13 (3), (2020).
- Teerlink, T., Copper, M. P., Klaassen, I., Braakhuis, B. J. M. Simultaneous analysis of retinol, all-trans- and 13-cis-retinoic acid and 13-cis-4-oxoretinoic acid in plasma by liquid chromatography using on-column concentration after single-phase fluid extraction. J Chromatogr B. Biomed Sci App. 694 (1), 83-92 (1997).
- Egberg, D. C., Heroff, J. C., Potter, R. H. Determination of all-trans and 13-cis vitamin A in food products by high-pressure liquid chromatography. J Agric Food Chem. 25 (5), 1127-1132 (1977).
- Sudo, Y., et al. A microbial rhodopsin with a unique retinal composition shows both sensory rhodopsin II and bacteriorhodopsin-like properties. J Biol Chem. 286 (8), 5967-5976 (2011).
- Kane, M. A., Napoli, J. L. Quantification of endogenous retinoids. Methods Mol Biol. 652, 1-54 (2010).
- Landers, G. M., Olson, J. A. Rapid, simultaneous determination of isomers of retinal, retinal oxime and retinol by high-performance liquid chromatography. J Chromatogr A. 438, 383-392 (1988).
- Hubbard, R., Brown, P. K., Bownds, D. [243] Methodology of vitamin A and visual pigments. Methods Enzymol. 18, 615-653 (1971).
- Robeson, C. D., et al. Chemistry of vitamin A. XXIV. The synthesis of geometric isomers of vitamin A via methyl β-methylglutaconate1. J Am Chem Soc. 77 (15), 4111-4119 (1955).
- Robeson, C. D., Blum, W. P., Dieterle, J. M., Cawley, J. D., Baxter, J. G. Chemistry of vitamin A. XXV. Geometrical isomers of vitamin A aldehyde and an isomer of its α-ionone analog1. J Am Chem Soc. 77 (15), 4120-4125 (1955).
- Hubinger, J. C. Determination of retinol, retinyl palmitate, and retinoic acid in consumer cosmetic products. J Cosmet Sci. 60 (5), 485-500 (2009).
- Bhat, P. V., Co, H. T., Lacroix, A. Effect of 2-alkanols on the separation of geometric isomers of retinol in non-aqueous high-performance liquid chromatography. J Chromatogr A. 260, 129-136 (1983).
- Stancher, B., Zonta, F. Quantitative high-performance liquid chromatographic method for determining the isomer distribution of retinol (vitamin A1) and 3-dehydroretinol (vitamin A2) in fish oils. J Chromatogr. 312, 423-434 (1984).
- Zonta, F., Stancher, B. High-performance liquid chromatography of retinals, retinols (vitamin A1) and their dehydro homologues (vitamin A2): improvements in resolution and spectroscopic characterization of the stereoisomers. J Chromatogr A. 301, 65-75 (1984).
- van Kuijk, F. J., Handelman, G. J., Dratz, E. A. Rapid analysis of the major classes of retinoids by step gradient reversed-phase high-performance liquid chromatography using retinal (O-ethyl) oxime derivatives. J Chromatogr. 348 (1), 241-251 (1985).
- Kane, M. A., Folias, A. E., Napoli, J. L. HPLC/UV quantitation of retinal, retinol, and retinyl esters in serum and tissues. Anal Biochem. 378 (1), 71-79 (2008).
- Widjaja-Adhi, M. A. K., Ramkumar, S., von Lintig, J. Protective role of carotenoids in the visual cycle. FASEB J. 32 (11), 6305-6315 (2018).
- Ramkumar, S., Jastrzebska, B., Montenegro, D., Sparrow, J. R., von Lintig, J. Unraveling the mystery of ocular retinoid turnover: Insights from albino mice and the role of STRA6. J Biol Chem. 300 (3), 105781 (2024).
- de Grip, W. J., Lugtenburg, J. Isorhodopsin: An undervalued visual pigment analog. Colorants. 1 (3), 256-279 (2022).
- Fan, J., Rohrer, B., Moiseyev, G., Ma, J., Crouch, R. K. Isorhodopsin rather than rhodopsin mediates rod function in RPE65 knock-out mice. Proc Natl Acad Sci USA. 100 (23), 13662-13667 (2003).
- Sparrow, J. R. Bisretinoids of RPE lipofuscin: Trigger for complement activation in age-related macular degeneration. Adv Exp Med Biol. 703, 63-74 (2010).
- Różanowska, M., Handzel, K., Boulton, M. E., Różanowski, B. Cytotoxicity of all-trans-retinal increases upon photodegradation. Photochem Photobiol. 88 (6), 1362-1372 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유