Method Article
高速液体クロマトグラフィーを用いたマウス眼組織および非眼組織における食事性ビタミンA代謝物の定量分析
要約
ここでは、眼組織と全身組織の両方における視覚機能の促進に関与する重要なレチノイドを検出および定量するための順相高速液体クロマトグラフィー法について説明し、全身性ビタミンA供給の文脈で、必須の光感受性ロドプシン発色団11-シス-レチナールを生成します。
要約
Gタンパク質共役型受容体(GPCR)は、リガンドとの結合によりGタンパク質が活性化することでシグナル伝達カスケードを開始する膜貫通タンパク質のスーパーファミリーです。すべての哺乳類の視覚において、ロドプシンは光伝達カスケードの開始に関与するGPCRです。光受容体内では、ロドプシンはその発色団11-cis-レチナールに結合し、11-cis-レチナールからオールトランスレチナールへの光感受性異性化によって活性化され、トランスデューシンGタンパク質を活性化して光伝達カスケードを引き起こします。
光伝達はよく理解されていますが、眼での11-cis-レチナール生成のための食事性ビタミンA前駆体の供給に関与するプロセス、およびこの供給の中断をもたらす疾患はまだ完全には理解されていません。ビタミンA前駆体が腸に吸収されると、レチニルエステルとして肝臓に貯蔵され、レチノール結合タンパク質4(RBP4)に結合したオールトランスレチノールとして血流に放出されます。この循環性RBP4-レチノールは、肝臓、肺、腎臓、眼などの全身臓器に吸収されます。したがって、眼や全身臓器における食事性ビタミンAのさまざまな代謝物を定量化する方法は、ロドプシンGPCRの適切な機能の研究にとって重要です。
この方法では、マウス組織におけるビタミンA分析のための包括的な抽出および分析方法を紹介します。順相の高速液体クロマトグラフィー分析により、レチナールデヒド、レチノール、レチニルエステルの関連するすべての異性体を1回の分析で同時に検出できるため、実験サンプルを効率的に使用することができ、同じサンプル内の異なるビタミンA代謝物の内部信頼性が向上します。この包括的な方法により、研究者はロドプシンGPCR機能における全身性ビタミンAの供給をより適切に評価できるようになります。
概要
Gタンパク質共役受容体(GPCR)は、知られているタンパク質の中で最も研究され、特徴付けられたタンパク質のスーパーファミリーの1つです。GPCRは、シグナル伝達における細胞表面受容体として働き、特定のリガンドと結合すると細胞内応答を初期化する機能として最もよく知られています。GPCRは、7つの膜貫通型(TM)ヘリカルドメインと6つのトータルループドメインによって特徴付けられます。6つのループのうち、3つのループはリガンドの結合を促進するために細胞外に配向されており、他の3つの細胞内ループは、Gα、Gβ、およびGγサブユニットからなるヘテロ三量体Gタンパク質に結合しています1,2。
GPCRは、クラスAロドプシン様、クラスBセクレチン受容体ファミリー、クラスCグルタミン酸、クラスD真菌交配フェロモン受容体、クラスEサイクリックAMP受容体、クラスFフリズル/スムージング3,4など、いくつかのクラスに分類されます。GPCRのロドプシン様クラスAサブクラスには、光伝達と視覚機能を担う重要なGPCRであるロドプシンが含まれています。ロドプシンには、前述の7つのTMヘリックスドメイン、6つの細胞外および細胞内ループ、光受容体1,5,6,7のトランスデューシン(Gt)としても知られるヘテロ三量体Gタンパク質との関連など、GPCRの標準モデルに見られるすべての関連する主要な特性と構造要素が含まれています。ロドプシンの結合ポケット内では、光感受性発色団リガンドである11-シス-レチナールが、共有結合シッフ塩基結合を介してリジン296上のロドプシンに結合し、11-シス-レチニリデン1,8を形成します。光子を吸収すると、11-シス-レチニリデンは光異性体化して全-トランス-レチニリデンになり、ロドプシン内で立体配座変化を誘発します。したがって、11-cis-レチナールリガンドはロドプシンGPCRの機能にとって重要であり、光受容体内の高い代謝回転率を克服するためには、11-cis-レチナールの堅牢で効率的な供給を継続的に維持する必要があります。
11-cis-レチナールなどのレチナールデヒドは、まとめてレチノイドと呼ばれる分子のグループに属し、生物学的に関連性のあるレチノイドは、より広くビタミンAと呼ばれています。レチナルデヒドおよびビタミンAの関連ビタマーもこの特性評価に例外ではなく、環状末端基としてのβ-イオノン環、ジテルペンポリエン鎖、およびビタマーに応じて異なる極性末端基、すなわち、レチナールデヒドのアルデヒド基、レチノールのヒドロキシル基、レチノイン酸のカルボキシル基、レチニルエステルのエステル結合、 など(図1)9,10。
哺乳類はビタミンAを新規に合成することはできませんが、植物は合成できます。したがって、哺乳類のシステム内のすべてのレチノイドは、植物ベースの生産者の食事から食物連鎖の消費者に由来する必要があります。ビタミンA代謝の標準的なモデルでは、植物の原型であるβ-カロチンは、植物の原型であるプロビタミンAがスカベンジャー受容体クラスBのメンバー1(SCARB1)を介して腸腸細胞に吸収され、β-カロテンオキシゲナーゼ1(BCO1/BCMO1)によって2分子のオールトランスレチナールに切断され、レチナールデヒド結合タンパク質2(RBP2)に結合してオールトランスに還元されます-レチノールデヒドロゲナーゼ(RDH)によるレチノールは、レシチンレチノールアシルトランスフェラーゼ(LRAT)によってレチニルエステルに変換され、その後、カイロミクロン11,12,13,14で血流に送られます。一方、パルミチン酸レチニルなどのレチニルエステルは、動物由来の主要なプロビタミンAとして機能します。腸管腔からのパルミチン酸レチニルは、カルボキシルエステラーゼ1(CES1)によって全トランスレチノールに加水分解され、腸腸細胞15に拡散します。肝臓は、ビタミンA恒常性のための主要な貯蔵および恒常性器官であり、これらのカイロミクロン内のレチニルエステルを吸収し、レチニルエステル加水分解酵素によって細胞性レチノール結合タンパク質1(CRBP1)に結合した全トランスレチノールに加水分解され、肝臓の星状細胞に入り、貯蔵のためのLRATによってレチニルエステルに戻されます13,16、17.生体内のビタミンAの恒常性を維持するために、肝臓は、レチノール結合タンパク質4(RBP4)とトランスサイレチン(TTR)からなる血清輸送複合体に結合した全トランスレチノールの形でビタミンAを放出します15,18,19。この複合体は、この原稿ではholo-RBP4と呼ばれます。
この全身性ビタミンAの血液供給を利用するためには、ビタミンAの強固な供給源が維持されている眼組織を含む全身組織に、ホロRBP4を組織に吸収する方法が必要です。眼組織の視細胞に富む網膜内では、レチノイン酸6(STRA6)によって刺激される膜受容体がこの機能に関与するトランスポーターです。機構研究では、STRA6 は、holo-RBP4 から RPE20 への細胞外全トランスレチノールの摂取を促進することができることが示されています。この輸入された全トランスレチノールは、その後、全トランスレチノールがRPEおよび光受容体の外側セグメント内で11-シスレチナールに変換されるプロセスである視覚周期に入り、それによってロドプシン9,21に結合したときに視覚機能を促進します。
循環性ホロRBP4由来の全トランスレチノールが血液網膜関門を通過してSTRA6を介して眼組織内のRPEに入ると、RPE中の全トランスレチノールはまずLRATによってレチニルエステルにエステル化され、次に網膜色素上皮特異的65 kDaタンパク質(RPE65)によって11-シス-レチノールに加水分解されます。その後、11-CIS-レチノールは、レチノールデヒドロゲナーゼ5によって11-CIS-レチナールに変換されます。次いで、この11-cis-レチナールは、光受容体間レチノイド結合タンパク質(IRBP)9,21によって光受容体の外側セグメント(OS)に運ばれる。外核層(ONL)内の視細胞核を囲む小胞体内では、オプシンGPCRが合成され、接続繊毛(CC)を介して輸送されます。CCを横切るこの輸送に関与するモータータンパク質は論争の的となっているが、現在の仮説では、キネシンおよびダイニンベースの鞭毛内輸送(IFT)またはミオシンベースの輸送がこのプロセスの促進因子である可能性が高いとされている14,22,23,24,25,26。これら2つの成分がOS内の膜状円板内で出会うと、11-シス-レチナールとオプシンは、ロドプシン上のリジン196のシッフ塩基共有結合を介して11-シス-レチニリデンを形成し、光伝達の準備が整います8。
網膜のRPE内でのSTRA6の発現は、holo-RBP4からのオールトランスレチノールの摂取を促進するのに役立ちますが、STRA6は、ビタミンAの主要な恒常性器官としての役割とholo-RBP4からのオールトランスレチノールの摂取能力を示すにもかかわらず、肝臓で発現されることは見つかりませんでした15,19,27,28、29、30、31。最終的に、レチノール結合タンパク質4受容体2(RBPR2)と呼ばれる類似の受容体が発見され、STRA6と同様にホロRBP4から全トランスレチノールを摂取する能力を示すが、肝臓組織で発現する32。
したがって、視覚機能におけるロドプシンの役割を完全に理解するには、視覚色素の再生に至る生物学的プロセスを理解する必要があります。これは、プロビタミンA前駆体の代謝、肝臓内での貯蔵、肝臓によるホロRBP4の放出、STRA6およびRBPR2膜受容体を介したホロRBP4の最終的な取り込みなど、前述のプロセスと密接に関連しています。前述のように、マウスなどの動物モデルは、そのようなプロセスの研究における主要なモデルの1つであり続けています。そこで、マウス組織中のレチノイドの抽出法と、これらのレチノイドを検出・定量できる順相高速液体クロマトグラフィー(HPLC)法について紹介したい。これらの方法を使用すると、11-cis-レチナールロドプシンリガンドやメイントランスポートレチノイドのall-trans-レチノールなど、上述の重要なレチノイドを眼、肝臓、および全身の臓器で分析できます。マウス組織におけるレチノイドの供給を評価することにより、レチノイドの物流供給に関連する病状と病状の理解をさらに進めることができます。
レチノイドは、オプシンGPCRとの関連を通じて視覚機能における発色団として機能するだけでなく、レチノイン酸シグナル伝達を通じて哺乳類細胞のシグナル伝達においても主要な役割を果たしており、これは、DNAに直接結合し、遺伝子転写を制御するレチノイン酸受容体(RAR)とレチノイドX受容体(RXR)の2つのファミリーによって促進されます33.これら2つのファミリーまたは受容体はどちらも、リガンドとしてレチノイン酸の形でレチノイドを利用します。RARは、オールトランスレチノイン酸と9-シス-レチノイン酸の両方に対して親和性を有することが示されていますが、RXRは9-シス-レチノイン酸に対してのみ親和性を示します34,35。制御されていない量のレチノイン酸は催奇形性であり、レチノイン酸シグナル伝達は極めて厳密に制御されなければならない36。シグナル伝達のためのレチノイン酸の産生は、後脳や四肢の発達など、組織の適切な発達のために局所的かつ非常に特定の時点で行われなければならないが、他の無数の例がレチノイン酸シグナル伝達を利用している37,38。レチノイン酸シグナル伝達に関与する細胞内では、レチノイン酸は、STRA6またはRBPR2によって取り込まれたレチノールのレチノイルデヒドへの酸化を促進するアルコール/レチノールデヒドロゲナーゼ(ADH/RDH)と、レチノアルデヒドのレチノイン酸への酸化を促進するレチナールデヒドデヒドロゲナーゼ(RALDH)の2つの酵素群によって合成される39。それ自体はGPCRシグナル伝達に関与していませんが、それでもレチノイン酸は、シグナル伝達受容体のリガンドとしても機能する重要なレチノイドとして存在します。
ここでは詳しく説明しませんが、食品研究や微生物ロドプシンの研究など、さまざまな状況でHPLCを使用したレチノイド検出の以前に確立された方法に感謝したいと思います。これらの方法は、揮発性および危険性の低い移動相40,41,42を必要とする逆相技術の使用、レチノイン酸およびそれらに関連する異性体40,41の検出、および異なる生物学的源からの精製および抽出43を含む、レチノイド検出に対する異なる目標とアプローチを採用する.私たちの方法は、特に哺乳類組織からのパルミチン酸レチニル、レチナールデヒド異性体、およびレチノール異性体の検出に焦点を当てています。意図したユースケースがこの特定のアプリケーションと異なる場合は、異なるプロトコルを考慮する必要があります。
プロトコル
注:すべての動物実験は、ミネソタ大学の動物管理および使用委員会(IACUC)(プロトコル#2312-41637A)によって承認され、眼科および視覚研究における動物の使用に関するARVOステートメントに準拠して実施されました。すべての抽出は、照明用の薄暗い赤色のライトの下で、暗闇で実行します。計器のディスプレイやアクセサリのLEDから放出される残留光に注意してください。
1. 分光光度法レチノイド標準試料作製および外部標準曲線作製
注:HPLCで分析する前に、レチノイドを一時的に保存するためのドライアイス容器を準備してください。
- 任意だが適切な量のレチノイドを秤量し、分光光度法による定量のために適切な溶媒に溶解します。
注:この研究で使用される選択溶媒はエタノールであり、エタノールに溶解したレチノイドのモル吸収率の値は 表1に詳述されています。無水のHPLCグレードのエタノールを使用して、標準物質とサンプルを溶解する必要があります。蒸留のみによって精製されたエタノールは、水と共沸混合物を形成し、体積で約4%の水を含んでいます。水はヘキサン移動相と混和しないため、シリカ固定相が水和し、最終的にカラムが劣化します。 - ランベルトベールの法則と関連するレチノイドのモル吸収率を利用して、生成された標準の濃度を定量します(表1)。
吸光度=モル吸収性(ε)×モル濃度×パス長 - 段階希釈を行うことで、目的の組織の定量範囲内で標準曲線を形成できる濃度を算出します。
注:ランベルトベール法の基本的な制限、例えば高濃度の分析物では有効性がないことに注意してください。この問題を回避するには、希釈したレチノイド標準物質で 1 より大きい吸光度値が生成されないようにする必要があります。マウス臓器のレチノールおよびレチナールデヒド定量における当社のアプリケーションでは、1〜10 ngの範囲の検量線が、見つかった典型的な量をカバーできることがわかりました。マウス肝臓からのパルミチン酸レチニル定量では、20 〜 80 μg の範囲の検量線で、検出された一般的な量をカバーできることがわかりました。 - 以前に作成したストック溶液から注入量を段階的に変更することにより、レチノイドの注入量を段階的に変更することにより、ピークを積分して、ピーク積分が注入されたレチノイドの量に正比例するレチノイド定量に適した外部標準曲線を生成します。
2.組織の採取とサンプル収集
注:組織の均質化とレチノイド抽出の前に、組織を一時的に保存するためのドライアイス容器を準備します。推奨される組織採取量を 表2に詳述します。各組織の血液含有量の変動によるレチノイドの変動を考慮するために、組織抽出は完全に灌流されたマウスで行い、血液抽出は別々のマウスで完了する必要があります。
- Institutional Animal Care and Use Committee(IACUC)が定めたプロトコル(ここではCO2 窒息)によって定められたガイドラインに従って、マウスを安楽死させます。
- 血液:安楽死の直後に、ハサミでマウスの首を切り落とし、マウスの主幹から血液を1.5mLのチューブに排出します。
- 目:一対の鉗子を使用して、斬首された頭から目を取り除きます。
- 脳:小さなハサミを使用して、首を切った頭に切り込み、鉗子を使用して脳を取り除きます。
- 腎臓、肝臓、脾臓、心臓、肺:小さなハサミを使用して腹部を切開し、正中線に沿って上方向に切り込み、胸骨と胸郭を切開します。一対の鉗子を使用して露出した組織を取り除きます。
3. 組織の均質化
注:大きな臓器(肝臓や肺組織など)など、臓器の小さなパーティションの分析が必要な場合は、組織のさまざまな部分でのレチノイド含有量の違いを避けるために、臓器全体を均質化する必要があります。代わりに、少量の組織が必要な場合は、ホモジネートを分割します。このプロトコルの概略図を 図2に詳しく説明します。この修正されたプロトコルは、ケインとナポリ44から採用されました。
- ティッシュをティッシュグラインダーチューブに入れ、50%の氷冷生理食塩水(0.9%)と50%のメタノールを入れます。各組織タイプに使用した容量については、 表2 を参照してください。
- 乳棒をグラインダーチューブに入れ、乳棒でゆっくりとゆっくりと5回転させて均質化します。
- ホモジナイズ後すぐにサンプルを15 mLチューブに移します。
- メタノール2mLを加え、室温で15分間放置します。
注:レチナールデヒドオキシム誘導体の分析が必要な場合は、0.1 M HEPES(pH 6.5)に0.1 Mヒドロキシルアミン塩酸塩1 mLを添加します(図1)。
4.レチノイド抽出
注意:ヘキサンは引火性が高く、揮発性が高く、毒性が強いです。ヘキサンを取り扱う際には、国立労働安全衛生研究所(NIOSH)が承認したマスク、目の保護具、ブチル手袋、ヒュームフードを使用する必要があります。サンプルからヘキサンを蒸発させる場合は、溶媒ヒュームの蓄積を防ぐために、シュノーケル吸引装置など、何らかの形の強化空気循環装置が推奨されます。
- ホモジネートにヘキサン10 mLを加え、チューブを水平に少なくとも10秒間ボルテックス混合します。
注:相が完全に混合することが重要です。 - ホモジネート/ヘキサン混合物を1,000 × g で3分間遠心分離し、相分離を促進します。
- ホモジネートからのレチノイドの全抽出を確実にするために、抽出を2回行います。手順 4.1 と 4.2 を繰り返します。
- ピペットを使用してヘキサン層を引き出し、ヘキサン層を別のガラス15 mLチューブのセットに入れて真空蒸着します。
注:蒸発には、チューブの壁にレチノイドが付着しないように、GLASS 15 mLチューブを使用してください。 - 真空遠心分離機を使用して、ヘキサンを完全に蒸発させます。
5. 再懸濁およびHPLC分析
注:この原稿で使用したHPLCシステムはバイナリーポンプシステムであったため、4成分移動相は操作前に単一のボトルにあらかじめ混合されていました。
注意:この方法で使用される4つの有機溶剤はすべて、引火性が高く、揮発性が高く、毒性が強いです。1,4-ジオキサンは、酸素にさらされると爆発性の過酸化物形成を受けやすいです。使用しないときは、1,4-ジオキサンを含むすべての容器を閉じて保管してください。これらの溶剤を取り扱う際には、国立労働安全衛生研究所(NIOSH)が承認した人工呼吸器、目の保護具、ブチル手袋、およびヒュームフードを使用する必要があります。これらの溶媒をHPLCで泳動させる際には、溶媒のヒュームの蓄積を防ぐために、シュノーケル吸引装置など、何らかの形の強化空気循環装置が推奨されます。
- 乾燥させた15mLチューブを100μLのヘキサンで再懸濁します。すべてのレチノイドが溶解していることを確認するためによく渦を巻く。
- 100 μLのヘキサンを1つのガラスインサートにピペットで移し、HPLC分析を行います。
- HPLC ランのセットアップ(Landers および Olson45 から適合):移動相:85.4% ヘキサン(v/v)、11.2% 酢酸エチル(v/v)、2% ジオキサン(v/v)、1.4% 1-オクタノール(v/v)。カラム:2本の4.6 mm ID x 250 nm、5 μmカラム、直列に接続。マルチカラムサーモスタット温度:25°C;注入量:100μL;流速:1mL/分;上映時間:40分UVスペクトル吸光度検出を使用します。200 nmから400 nmまでのUVスペクトルを取得するには、オプションをチェックインしたままにします。
6. ピークの同定と波形解析
- レチノイド標準試料の分析から観察された、対象とする各レチノイドの保持時間と UV スペクトルを使用してピークを同定します(図 3、表 3、および表 4)。
- 選択したHPLCシステムのクロマトグラフィーデータシステムを使用して、同定したピークを波形解析します。積分、つまり曲線の下の面積は、分析対象物の量に正比例します。ステップ 1 で生成した外部標準曲線を参照して、分析対象物を定量します。
- 生体組織から生成されたクロマトグラムの分析では、保持時間などのパラメーターのばらつきが観察されることが多いため、一般的なクロマトグラフィーデータシステムが提供する自動波形解析ではなく、手動波形解析を使用します。
- クロマトグラムに、ノイズの多いベースラインや非ガウスピークなど、実行中の問題を示す可能性のある不規則性が見られないことを確認してください。これらの問題は、HPLC の汚染物質またはカラムの摩耗を示しており、有効な分析のためには修正する必要があります。
結果
ここでは、上記の方法を利用して、マウスの眼組織および全身組織中のレチノイドを検出および定量し、代表的なクロマトグラムを生成しました。さらに、これらの組織で検出できる典型的なレチノイドの概要を示します。
生後6か月で、マウスはCO2 窒息によって安楽死させられました。眼のレチノイド含有量を維持するために、マウスは安楽死と抽出の2日前に暗順応しました。2つの眼、0.2 gの肝臓、および75 μLの血液を採取し、レチノイド抽出とその後のHPLC分析を行いました。眼組織については、片方の眼をヒドロキシルアミンを添加せずに摘出し、もう片方の眼をヒドロキシラミン処理に供した。肝臓と血液の場合、レチナールデヒドは通常これらの組織で検出されないため、ヒドロキシルアミン治療は必要ありませんでした。.
ヒドロキシルアミンで処理していないマウスの眼のクロマトグラムでは、2つの非標準的なレチナールデヒド異性体のうちの1つである13-cis-レチナールが同定されました。さらに、11-cis-レチナールとオールトランス-レチナールの両方、2つの標準的なレチナールデヒド異性体が同定されました。両方のクロマトグラムで、視覚周期の中間体である 11-cis-レチノールと、主要なビタミン A 輸送形態であるオールトランスレチノールの両方が同定されました(図 4A)。
ヒドロキシルアミンで処理したマウスの眼のクロマトグラムでは、前述のすべてのレチナールデヒド異性体がまだ存在していました。しかし、これらの異性体の保持時間は大幅に増加しました。さらに、これらのレチナールデヒド異性体は、現在、 syn および 抗 異性体の両方として存在します。ピーク波形解析による定量では、正確な波形解析値を得るためには、 syn ピークと アンチ ピークの両方を合計する必要があります。11-シス-レチノールとオールトランス-レチノールの両方がまだ存在していました(図4B)。
マウス肝組織のクロマトグラムでは、これらの組織内でパルミチン酸レチニルとオールトランスレチノールが同定されました。レチニルエステルであるパルミチン酸レチニルは、哺乳類のビタミンAの主要な貯蔵形態として機能し、哺乳類の肝臓組織内にかなりの量で見つけることができます。肝臓は、ビタミンAをホロRBP4として全身組織に放出し、RBP4-トランススリエチン複合体内に全トランス-レチノールを含んでいます。その後、このクロマトグラム内で大きなオールトランスレチノールピークを同定できます(図 4C)。
マウスの血液のクロマトグラムでは、大きなオールトランスレチノールピークが同定されました。肝臓から採取されたholo-RBP4が循環器系を通じて全身組織に放出されることを考えると、これは予想通りです(図4D)。時間依存分離 HPLC ピーク上のレチノイドアイソフォームの特性 UV スペクトル吸光度(~250-400 nm)は、特定の各ピークにおけるアイソフォームの存在の品質を最初に交差確認するのに役立ちます(図 5)。

図1:レチノイドの化学構造。 (A)これらのレチノイドは、典型的には抽出されたマウス組織に見出される。極性末端基が異なること、およびレチノイド異性体中の シス 二重結合の位置が異なることに注意してください。(B)レチナルデヒドをレチナールオキシムに変換すると、抽出効率が向上し、パルミチン酸レチニルとのピークの共溶出、およびレチナールデヒド異性体内での共溶出が防止されます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:組織回収、均質化、レチノイド抽出、分析のワークフロー。 暗順応マウスの網膜および組織サンプルを均質化し、抽出した。 ステップ1: ガイドラインに従ってマウスを安楽死させた後、血液や各種組織を採取します。 ステップ2-4: 次に、生理食塩水とメタノールを用いて組織の均質化を行い、定量分析のために塩酸ヒドロキシルアミンを用いて行います。 ステップ5〜7: レチノイドはヘキサンを使用して処理され、続いて蒸発します。 ステップ 8、9: 100 μLのヘキサンで再懸濁し、すべてのレチノイドが溶解していることを確認します。 ステップ10: 最後に、サンプルをHPLCを使用して分析します。略語:HPLC=高速液体クロマトグラフィー。 この図の拡大版を表示するには、ここをクリックしてください。

図3:レチノイド標準試料およびヒドロキシルアミン処理レチノイド標準試料のクロマトグラム。 (A)このクロマトグラムには、パルミチン酸レチニル、13-シス-レチナール、11-シスレチナール、オールトランスレチナール、11-シス-レチノール、13-シス-レチノール、およびオールトランスレチノール標準物質が含まれています。(B)このクロマトグラムには、パルミチン酸レチニル、13-シス-レチナール、11-シス-レチナール、オールトランスレチナール、11-シス-レチノール、13-シス-レチノール、およびオールトランスレチノール標準が含まれています。このクロマトグラムには、レチノール異性体に加えて、 シン および 抗 オキシムレチナールデヒド異性体が含まれています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:代表的なクロマトグラム (A)マウスの眼組織の代表的なクロマトグラム。このクロマトグラムには、レチノール異性体に加えて、レチノール異性体に加えて、レチノール異性体など、マウスの眼組織に通常見られるレチノイドが含まれています。(B)ヒドロキシルアミン処理したマウス眼組織の代表的なクロマトグラム。前のクロマトグラム(図 4A)で見つかった非化学的修飾のレチナルデヒドの代わりに、このクロマトグラムには、レチノール異性体に加えて、syn および抗オキシムのレチナルデデ異性体が含まれていることに注意してください。(C)マウス肝臓組織の代表的なクロマトグラム。このクロマトグラムには、パルミチン酸レチニルやオールトランスレチノールなど、マウスの肝臓組織に一般的に見られるレチノイドが含まれています。 (D)マウス血液の代表的なクロマトグラム。このクロマトグラムには、マウスの血液中に通常見られるレチノイドが含まれており、これにはオールトランスレチノールが含まれています。この図の拡大版を表示するには、ここをクリックしてください。
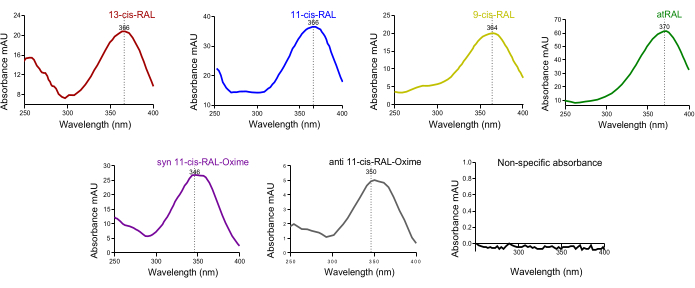
図5:マウス眼組織からのレチナールデヒド異性体のUV吸光度スペクトル。(A)13-cis-レチナール、(B)11-cis-レチナール、(C)9-cis-レチナール、(D)オールトランスレチナール、(E)syn 11-cis-レチナールオキシム、(F)抗11-cis-レチナールオキシムの吸光度スペクトル。この図の拡大版を表示するには、ここをクリックしてください。

図6:HPLCモジュール、移動相フロー、およびその他の装置の概要。 移動相の流れは、調製された溶媒ボトルから始まり、バイナリーポンプによって高圧でオートサンプラーにポンプで送られ、そこで分析物が溶媒の流れに取り込まれます。移動相と分析種は、温度調節されたカラムコンパートメントに到達し、最終的に測定のためにダイオードアレイ検出器に到達します。(A)レチノイドの光異性化を最小限に抑える赤みがかったモニター画面。(B)バイナリポンプ。(C)バイアルサンプラー。(D)マルチカラムサーモスタット。(E)ダイオードアレイ検出器。(F)分析フラクションコレクター。(G)高密度ポリ廃棄物容器。(H)左から右へ、アルミニウム製クリンプキャップ、ポリマー脚付き250μLインサート、琥珀色着色のクリンプトップバイアル、インジェクションバイアルの最終組み立て。(I)左、冷蔵遠心分離機。右、遠心分離機濃縮器。 この図の拡大版を表示するには、ここをクリックしてください。
| 化合物 | モル吸収率 (ε) | 溶媒 | 参考 |
| パルミチン酸レチニル | 49260 | エタノール | ハバード他49 |
| 13-シス-レチナール | 35500 | エタノール | ハバード他49 |
| 11-シス-レチナール | 24935 | エタノール | ハバード他49 |
| 9-シス-レチナール | 36100 | エタノール | ロブソン他51 |
| オールトランスレチナール | 42880 | エタノール | ハバード他49 |
| 11-シス-レチノール | 34890 | エタノール | ハバード他49 |
| 13-シス-レチノール | 48305 | エタノール | Robeson et al.50 および Robeson et al.51 |
| オールトランスレチノール | 52770 | エタノール | ハバード他49 |
表1:エタノール中のレチノイドのモル吸収率。 レチノイドのモル吸収率は、Kane and Napoli44、Hubbard et al.46、Robeson et al.47、および Robeson et al.48 から収集されました。モル吸収率は溶媒に依存します。ここにリストされている値は、エタノールに溶解したレチノイドに固有のものです。
| 組織 | ティッシュ収穫量 | 均質化のためのボリューム |
| 血 | 75 μL | 該当なし |
| 肝臓 | 0.2グラム | 2ミリリットル |
| 腎臓 | 2腎臓全体 | 2ミリリットル |
| 皮膚 | 0.2グラム | 1 mL – 1.5 mL |
| 脾臓 | 脾臓全体1個 | 1 mLの |
| 目 | 両方の網膜、プール4網膜 | 1 mLの |
| 脳 | 1 全脳 | 2ミリリットル |
| 心 | 1 ホールハート | 1 mLの |
| 肺 | 0.2グラム | 2ミリリットル |
表2:分析ごとの推奨組織量。 Kane と Napoli44 が推奨する、組織の均質化のための 50% 氷冷生理食塩水 (0.9%) と 50% メタノールの分析あたりの組織量。
| 化合物 | 保持時間 (分) | UV吸光度最大(nm) |
| パルミチン酸レチニル | 5.177 | 326 |
| 13-シス-レチナール | 7.268 | 366 |
| 11-シス-レチナール | 7.691 | 366 |
| 9-シス-レチナール | 7.931 | 364 |
| オールトランスレチナール | 8.993 | 370 |
| 11-シス-レチノール | 17.003 | 318 |
| 13-シス-レチノール | 17.83 | 328 |
| オールトランスレチノール | 23.933 | 326 |
表3:レチノイドの保持時間と最大吸光度波長。 これらの値は、記載されている方法および移動相とともに使用した場合に観察され、参照ダイオードアレイ検出器で検出されました。
| 化合物 | 保持時間 (分) | UV吸光度最大(nm) |
| Syn 11-cis-レチナールオキシム | 9.59 | 346 |
| シン オールトランスレチナールオキシム | 10.6 | 356 |
| Syn 13-cis-レチナールオキシム | 11.3 | 352 |
| 抗 13-シス-レチナールオキシム | 13 | 356 |
| 抗 11-シス-レチナールオキシム | 15.1 | 350 |
| 反 オールトランスレチナールオキシム | 19.7 | 360 |
表4:ヒドロキシルアミン処理されたレチナルデヒドの保持時間と最大吸光度波長により、各レチナルデヒドの シン および 抗 オキシム異性体が得られます。 これらの値は、記載されている方法および移動相とともに使用した場合に観察され、参照ダイオードアレイ検出器で検出されました。
ディスカッション
この分析法では、順相HPLCを使用して、レチニルエステル、レチナールデヒド、レチノールなどの関連するレチノイドを検出および定量します。ロドプシンGPCRの活性化における重要な発色団としての11-cis-レチナールの重要性を考えると、11-cis-レチナールの産生に関連する代謝物を検出できる方法は、全体的な視覚機能の研究にとって重要です。この方法の主な利点は、レチナールデヒドとレチノールの両方の関連するすべての異性体を 1 回の実行で同時に検出および定量できることです。生存可能な実験組織がいかに少ないかを考えると、この方法ではレチノイド検出に組織を効率的に使用することができます。レチノイドの分離では、ヘキサンおよび酢酸エチルベースの移動相の使用が報告されていますが49、1,4-ジオキサンと 1-オクタノールを添加すると、レチノイド異性体の分離が向上します。1,4-ジオキサンは、13-cis-レチノールおよび11-cis-レチノール50の分離に必要であり、一方、1-オクタノールなどの長鎖アルコールは、レチノール異性体45,51,52の分離をさらに改善する。
レチナルデヒド異性体の定量のためには、反応性アルデヒド基がタンパク質および脂質45,53,54などの他の生体分子と反応しやすいので、ヒドロキシルアミンによる対応するレチナールデヒドオキシムへの事前の変換が必要である。レチナルデヒドオキシムはより容易に抽出され、分析の後半でレチナールデヒドのピークが溶出するため、未知のピーク群や生体組織に対して 5 ~ 8 分で溶出するパルミチン酸レチニルピークとのピーク共溶出が防止されます。ヒドロキシルアミンによるレチナルデヒドの処理は、同様の溶出時間を持つレチナールデヒドの共溶出も防ぐ45。レチナルデヒドオキシムへの変換により、syn と反異性体の両方が生成され、これらは 2 つの異なる時間に溶出し、各レチナルデヒド異性体に対して 2 つの異なるピークがあります。各レチナルデヒド異性体を適切に定量するには、両方のピークの波形解析を合計する必要があります。保持時間以外にも、UVスペクトルはピーク同定に利用できる別の指標を提供します。各レチノイドは、わずかに異なるUV吸光度の最大値を示します。保持時間とともに考慮すると、これら 2 つの指標により、ピークを正確に特定できます(表 3 および表 4)。
眼組織には、11-cis-レチナールやオールトランスレチナールなどの標準的なレチノールデヒド異性体の存在が予想されますが、11-シスレチナールが重要なロドプシンリガンド発色団であり、オールトランスレチナールが光異性体化されたリガンドである一方で、他の非標準的なレチナールデヒド異性体はこの方法で検出されます。特に、13-cis-レチナールは、分析中にマウス眼組織のHPLCランで容易に検出されました(図4A-D)。これらの非標準的なレチナールデヒドの出現は完全に予想外ではないが、13-cis-レチナールと9-cis-レチナールの両方が、網膜55,56への光誘起ストレスに起因する副産物であることが知られている。これらのレチナールデヒド異性体は、既知の標準的な光伝達カスケード経路には関与せず、その代謝運命は比較的不明のままです。しかし、9-cis-レチナールは、ロドプシンの結合ポケットにも安定して結合し、イソロドプシンを形成することが示されています。イソロドプシンの役割はまだ完全には特徴付けられていませんが、研究によると、イソロドプシンは11-シス-レチナールベースのロドプシン57,58と非常によく似た感光性を示すことが示されています。少なくとも、9-cis-レチナールが安定してイソロドプシンを形成し、光異性体を全トランス-レチナール化する能力は、我々のHPLC分析56にそれが存在しないことの合理的な説明を提供する。一方、13-CIS-レチナールは、既知の眼の生化学的経路に関与していることが示されておらず、眼組織内でのその蓄積は網膜55,59,60内の酸化ストレスをもたらす可能性があります。
9-cis-レチナールは通常、マウス組織には見られませんが、ヒドロキシルアミン処理法は9-cis-レチナールの分離および定量化に有効な方法ではないことに言及する必要があります。syn 9-cis-retinal および syn 13-cis-retinal のピークは 11.2 分で共溶出します。外因的に適用する場合など、大量の9-cis-レチナールが予想される場合、9-cis-レチナールと13-cis-レチナールの組み合わせの定量化のみが可能です。定性的な同定のために、組織をヒドロキシルアミンで処理せずに分析法を実行すると、13-cis-レチナールピークと9-cis-レチナールピークを完全に分離できます。
眼組織以外にも、この方法は全身組織にも容易に適用できます。レチノールデヒドは、その様々な異性体形態のものは、通常、全身組織には見られませんが、レチノール結合タンパク質4(holo-RBP4)に結合した全トランスレチノールは、哺乳類の生物におけるビタミンAの主要な輸送形態であり、全トランスレチノールは、この方法を用いて血液中に容易に検出することができます。血液以外にも、オールトランスレチノールは通常、すべての全身組織で検出できます。したがって、この方法を使用すると、この方法を使用して完全な全身組織全体のレチノイドプロファイルを作成できます。
レチナールデヒド、特に重要なロドプシンリガンド11-シス-レチナールは光異性化に対して非常に感受性が高いため、上記のいずれかのステップで偶発的に光にさらされるのを防ぐための予防策を講じることが重要です。室内照明やインストルメントパネルからの明らかな発生源に加えて、HPLC自体を含む計器の後ろにあるものなど、さまざまな計器のアクセサリLEDからの誤った光が、偶発的な光曝露の主な原因であることがわかりました(図6)。さらに、レチナールデヒド異性体や実験組織を適切に取り扱うためには、専用の暗室が不可欠であることを発見しました。光の最小化に加えて、光がなくてもレチナールデヒド異性体の分解が起こるため、安楽死と採取後に組織を迅速かつ迅速に処理することをお勧めします。理想的には、組織の回収、抽出、およびHPLC分析はすべて同じ日に完了する必要があります。
すぐに処理しない組織は、-80°Cの暗所で保存する必要があり、処理前に1週間以上保存しないでください。前述したように、上記の方法の移動相および抽出ステップで使用されるすべての溶媒は、毒性が高く、揮発性で、可燃性です。これらの危険な溶剤を取り扱う際には、適切な手順と機器を使用する必要があります。溶剤の取り扱いには、ブチル手袋、NIOSH認定のマスク、目の保護具などの適切な個人用保護具(PPE)を着用し、すべての溶剤の移送はヒュームフード内で行う必要があります。1,4-ジオキサンは酸素にさらされると爆発性の過酸化物形成を受けやすいことに注意し、1,4-ジオキサンを含むすべての溶剤容器を空気からしっかりと密封してください。
材料や装置が不十分なために順相HPLC分析法が不可能な場合は、アセトニトリルや水などの揮発性の低い溶媒を使用したより一般的な逆相分析法が存在し、レチナールデヒドやレチノールを検出および定量できます。ただし、これらの方法では異性体を分離することはできず、総レチナールデヒドまたは総レチノール44,54しか検出できません。
開示事項
著者は、利益相反を宣言しません。
謝辞
この研究は、NIH-NEIの助成金(EY030889および3R01EY030889-03S1)と、ミネソタ大学のG.P.L.へのスタートアップ資金によって部分的に支援されました。また、この原稿で使用した11-cis-retinal標準を提供してくださったNational Eye Instituteにも感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| 1-Octanol, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 203-917-6 | |
| 1,4-Dioxane, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 204-661-8 | |
| 11-cis-retinal | National Eye Institute | N/A | |
| 11-cis-Retinol | Toronto Research Chemicals | TRC-R252105 | |
| 13-cis-retinal | Toronto Research Chemicals | TRC-R239900 | |
| 13-cis-retinol | Toronto Research Chemicals | TRC-R252110 | |
| All-trans-Retinal | Toronto Research Chemicals | TRC-R240000 | |
| All-trans-Retinol | Toronto Research Chemicals | TRC-R252002 | |
| Ethyl Acetate, suitable for HPLC, ≥99.7% | Sigma-Aldrich, Millipore Sigma | 205-500-4 | |
| Hexane, HPLC Grade | Fisher Scientific, Spectrum Chemical | 18-610-808 | |
| Methanol (HPLC) | Fisher Scienctific | A452SK-4 | |
| Retinyl Palmitate | Toronto Research Chemicals | TRC-R275450 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| Instruments | |||
| 1260 Infinity II Analytical Fraction Collector | Agilent | G1364F | |
| 1260 Infinity II Binary Pump | Agilent | G7112B | |
| 1260 Infinity II Diode Array Detector | Agilent | G7115A | |
| 1260 Infinity II Multicolumn Thermostat | Agilent | G7116A | |
| 1260 Infinity II Vialsampler | Agilent | G7129A | |
| ST40R Refrigerated Centrifuge | Thermo Scientific | TSST40R | |
| Vacufuge Plus Centrifuge Concentrator | Eppendorf | 22820168 | |
| Consumables | |||
| 2 mL Amber Screw Top Vials | Agilent | 5188-6535 | |
| Crimp Cap with PTFE/red rubber septa, 11 mm | Agilent | 5183-4498 | |
| Disposable Glass Conical Centrifuge Tubes | Millipore Sigma | CLS9950215 | |
| Screw cap tube, 15 mL | Sarstedt | 62.554.502 | |
| Vial insert, 150 µL, glass with polymer feet | Agilent | 5183-2088 |
参考文献
- Palczewski, K., et al. Crystal structure of rhodopsin: A G protein-coupled receptor. Science. 289 (5480), 739-745 (2000).
- Rosenbaum, D. M., Rasmussen, S. G. F., Kobilka, B. K. The structure and function of G-protein-coupled receptors. Nature. 459 (7245), 356-363 (2009).
- Alhosaini, K., Azhar, A., Alonazi, A., Al-Zoghaibi, F. GPCRs: The most promiscuous druggable receptor of the mankind. Saudi Pharm J. 29 (6), 539-551 (2021).
- Hu, G. -. M., Mai, T. -. L., Chen, C. -. M. Visualizing the GPCR network: Classification and evolution. Sci Rep. 7 (1), 15495 (2017).
- Lerea, C. L., Somers, D. E., Hurley, J. B., Klock, I. B., Bunt-Milam, A. H. Identification of specific transducin α subunits in retinal rod and cone photoreceptors. Science. 234 (4772), 77-80 (1986).
- Gao, Y., Hu, H., Ramachandran, S., Erickson, J. W., Cerione, R. A., Skiniotis, G. Structures of the rhodopsin-transducin complex: Insights into G protein activation. Mol Cell. 75 (4), 781-790.e3 (2019).
- Zhou, X. E., Melcher, K., Xu, H. E. Structure and activation of rhodopsin. Acta Pharmacol Sin. 33 (3), 291-299 (2012).
- Robinson, P. R., Cohen, G. B., Zhukovsky, E. A., Oprian, D. D. Constitutively active mutants of rhodopsin. Neuron. 9 (4), 719-725 (1992).
- Kiser, P. D., Golczak, M., Palczewski, K. Chemistry of the retinoid (visual) cycle. Chem Rev. 114 (1), 194-232 (2014).
- Sani, B. P., Hill, D. L. [3] Structural characteristics of synthetic retinoids. Methods Enzymol. 189, 43-50 (1990).
- Lobo, G. P., Amengual, J., Palczewski, G., Babino, D., von Lintig, J. Carotenoid-oxygenases: Key players for carotenoid function and homeostasis in mammalian biology. Biochim Biophys Acta. 1821 (1), 78-87 (2012).
- Amengual, J., et al. Two carotenoid oxygenases contribute to mammalian provitamin A metabolism. J Biol Chem. 288 (47), 34081-34096 (2013).
- Harrison, E. H. Mechanisms involved in the intestinal absorption of dietary vitamin A and provitamin A carotenoids. Biochim Biophys Acta. 1821 (1), 70-77 (2012).
- Leung, M., et al. The logistical backbone of photoreceptor cell function: Complementary mechanisms of dietary vitamin A receptors and rhodopsin transporters. Int J Mol Sci. 25 (8), 4278 (2024).
- Martin Ask, N., Leung, M., Radhakrishnan, R., Lobo, G. P. Vitamin A transporters in visual function: A mini review on membrane receptors for dietary vitamin A uptake, storage, and transport to the eye. Nutrients. 13 (11), 3987 (2021).
- Harrison, E. H. Carotenoids, β-apocarotenoids, and retinoids: The long and the short of it. Nutrients. 14 (7), 1411 (2022).
- Li, Y., Wongsiriroj, N., Blaner, W. S. The multifaceted nature of retinoid transport and metabolism. Hepatobiliary Surg Nutr. 3 (3), 126-139 (2014).
- D'Ambrosio, D. N., Clugston, R. D., Blaner, W. S. Vitamin A metabolism: An update. Nutrients. 3 (1), 63-103 (2011).
- Yamamoto, Y., et al. Interactions of transthyretin (TTR) and retinol-binding protein (RBP) in the uptake of retinol by primary rat hepatocytes. Exp Cell Res. 234 (2), 373-378 (1997).
- Kawaguchi, R., et al. A membrane receptor for retinol binding protein mediates cellular uptake of vitamin A. Science. 315 (5813), 820-825 (2007).
- Kiser, P. D., Golczak, M., Maeda, A., Palczewski, K. Key enzymes of the retinoid (visual) cycle in vertebrate retina. Biochim Biophys Acta. 1821 (1), 137-151 (2012).
- Radhakrishnan, R., et al. The role of motor proteins in photoreceptor protein transport and visual function. Ophthalmic Genet. 43 (3), 285-300 (2022).
- Solanki, A. K., et al. Loss of motor protein MYO1C causes rhodopsin mislocalization and results in impaired visual function. Cells. 10 (6), 1322 (2021).
- Liu, X., Udovichenko, I. P., Brown, S. D. M., Steel, K. P., Williams, D. S. Myosin VIIa participates in opsin transport through the photoreceptor cilium. J Neurosci. 19 (15), 6267-6274 (1999).
- Insinna, C., Besharse, J. C. Intraflagellar transport and the sensory outer segment of vertebrate photoreceptors. Dev Dyn. 237 (8), 1982-1992 (2008).
- Krock, B. L., Mills-Henry, I., Perkins, B. D. Retrograde intraflagellar transport by cytoplasmic dynein-2 is required for outer segment extension in vertebrate photoreceptors but not arrestin translocation. Invest Ophthalmol Vis Sci. 50 (11), 5463-5471 (2009).
- Blaner, W. S. STRA6, a cell-surface receptor for retinol-binding protein: The plot thickens. Cell Metab. 5 (3), 164-166 (2007).
- Bouillet, P., et al. Developmental expression pattern of Stra6, a retinoic acid-responsive gene encoding a new type of membrane protein. Mech Dev. 63 (2), 173-186 (1997).
- Blomhoff, R., Norum, K. R., Berg, T. Hepatic uptake of [3H]retinol bound to the serum retinol binding protein involves both parenchymal and perisinusoidal stellate cells. J Biol Chem. 260 (25), 13571-13575 (1985).
- Kelly, M., von Lintig, J. STRA6: role in cellular retinol uptake and efflux. Hepatobiliary Surg Nutr. 4 (4), 229-242 (2015).
- Quadro, L., et al. The role of extrahepatic retinol binding protein in the mobilization of retinoid stores. J. Lipid Res. 45 (11), 1975-1982 (2004).
- Alapatt, P., et al. Liver retinol transporter and receptor for serum retinol-binding protein (RBP4). J Biol Chem. 288 (2), 1250-1265 (2013).
- Chawla, A., Repa, J. J., Evans, R. M., Mangelsdorf, D. J. Nuclear receptors and lipid physiology: Opening the X-files. Science. 294 (5548), 1866-1870 (2001).
- Heyman, R. A., et al. 9-cis retinoic acid is a high affinity ligand for the retinoid X receptor. Cell. 68 (2), 397-406 (1992).
- Allenby, G., et al. Retinoic acid receptors and retinoid X receptors: interactions with endogenous retinoic acids. Proc Natl Acad Sci USA. 90 (1), 30-34 (1993).
- Das, B. C., et al. Retinoic acid signaling pathways in development and diseases. Bioorg Med Chem. 22 (2), 673-683 (2014).
- Hernandez, R. E., Putzke, A. P., Myers, J. P., Margaretha, L., Moens, C. B. Cyp26 enzymes generate the retinoic acid response pattern necessary for hindbrain development. Development. 134 (1), 177-187 (2007).
- Yashiro, K., et al. Regulation of retinoic acid distribution is required for proximodistal patterning and outgrowth of the developing mouse limb. Dev Cell. 6 (3), 411-422 (2004).
- Duester, G. Families of retinoid dehydrogenases regulating vitamin A function. Eur J Biochem. 267 (14), 4315-4324 (2000).
- Tatum, V., Chow, C. K. Rapid measurement of retinol, retinal, 13-cis-retinoic acid and all-trans-retinoic acid by high performance liquid chromatography. J Food Drug Anal. 13 (3), (2020).
- Teerlink, T., Copper, M. P., Klaassen, I., Braakhuis, B. J. M. Simultaneous analysis of retinol, all-trans- and 13-cis-retinoic acid and 13-cis-4-oxoretinoic acid in plasma by liquid chromatography using on-column concentration after single-phase fluid extraction. J Chromatogr B. Biomed Sci App. 694 (1), 83-92 (1997).
- Egberg, D. C., Heroff, J. C., Potter, R. H. Determination of all-trans and 13-cis vitamin A in food products by high-pressure liquid chromatography. J Agric Food Chem. 25 (5), 1127-1132 (1977).
- Sudo, Y., et al. A microbial rhodopsin with a unique retinal composition shows both sensory rhodopsin II and bacteriorhodopsin-like properties. J Biol Chem. 286 (8), 5967-5976 (2011).
- Kane, M. A., Napoli, J. L. Quantification of endogenous retinoids. Methods Mol Biol. 652, 1-54 (2010).
- Landers, G. M., Olson, J. A. Rapid, simultaneous determination of isomers of retinal, retinal oxime and retinol by high-performance liquid chromatography. J Chromatogr A. 438, 383-392 (1988).
- Hubbard, R., Brown, P. K., Bownds, D. [243] Methodology of vitamin A and visual pigments. Methods Enzymol. 18, 615-653 (1971).
- Robeson, C. D., et al. Chemistry of vitamin A. XXIV. The synthesis of geometric isomers of vitamin A via methyl β-methylglutaconate1. J Am Chem Soc. 77 (15), 4111-4119 (1955).
- Robeson, C. D., Blum, W. P., Dieterle, J. M., Cawley, J. D., Baxter, J. G. Chemistry of vitamin A. XXV. Geometrical isomers of vitamin A aldehyde and an isomer of its α-ionone analog1. J Am Chem Soc. 77 (15), 4120-4125 (1955).
- Hubinger, J. C. Determination of retinol, retinyl palmitate, and retinoic acid in consumer cosmetic products. J Cosmet Sci. 60 (5), 485-500 (2009).
- Bhat, P. V., Co, H. T., Lacroix, A. Effect of 2-alkanols on the separation of geometric isomers of retinol in non-aqueous high-performance liquid chromatography. J Chromatogr A. 260, 129-136 (1983).
- Stancher, B., Zonta, F. Quantitative high-performance liquid chromatographic method for determining the isomer distribution of retinol (vitamin A1) and 3-dehydroretinol (vitamin A2) in fish oils. J Chromatogr. 312, 423-434 (1984).
- Zonta, F., Stancher, B. High-performance liquid chromatography of retinals, retinols (vitamin A1) and their dehydro homologues (vitamin A2): improvements in resolution and spectroscopic characterization of the stereoisomers. J Chromatogr A. 301, 65-75 (1984).
- van Kuijk, F. J., Handelman, G. J., Dratz, E. A. Rapid analysis of the major classes of retinoids by step gradient reversed-phase high-performance liquid chromatography using retinal (O-ethyl) oxime derivatives. J Chromatogr. 348 (1), 241-251 (1985).
- Kane, M. A., Folias, A. E., Napoli, J. L. HPLC/UV quantitation of retinal, retinol, and retinyl esters in serum and tissues. Anal Biochem. 378 (1), 71-79 (2008).
- Widjaja-Adhi, M. A. K., Ramkumar, S., von Lintig, J. Protective role of carotenoids in the visual cycle. FASEB J. 32 (11), 6305-6315 (2018).
- Ramkumar, S., Jastrzebska, B., Montenegro, D., Sparrow, J. R., von Lintig, J. Unraveling the mystery of ocular retinoid turnover: Insights from albino mice and the role of STRA6. J Biol Chem. 300 (3), 105781 (2024).
- de Grip, W. J., Lugtenburg, J. Isorhodopsin: An undervalued visual pigment analog. Colorants. 1 (3), 256-279 (2022).
- Fan, J., Rohrer, B., Moiseyev, G., Ma, J., Crouch, R. K. Isorhodopsin rather than rhodopsin mediates rod function in RPE65 knock-out mice. Proc Natl Acad Sci USA. 100 (23), 13662-13667 (2003).
- Sparrow, J. R. Bisretinoids of RPE lipofuscin: Trigger for complement activation in age-related macular degeneration. Adv Exp Med Biol. 703, 63-74 (2010).
- Różanowska, M., Handzel, K., Boulton, M. E., Różanowski, B. Cytotoxicity of all-trans-retinal increases upon photodegradation. Photochem Photobiol. 88 (6), 1362-1372 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved