Method Article
Análise quantitativa de metabólitos dietéticos de vitamina A em tecidos oculares e não oculares murinos usando cromatografia líquida de alta eficiência
Neste Artigo
Resumo
Aqui, um método de cromatografia líquida de alta eficiência de fase normal é descrito para detectar e quantificar retinóides críticos envolvidos na facilitação da função visual no tecido ocular e sistêmico, no contexto do suprimento sistêmico de vitamina A para gerar o cromóforo de rodopsina fotossensível essencial 11-cis-retinal.
Resumo
Os receptores acoplados à proteína G (GPCRs) são uma superfamília de proteínas transmembranares que iniciam cascatas de sinalização por meio da ativação de sua proteína G após a associação com seu ligante. Em toda a visão de mamíferos, a rodopsina é o GPCR responsável pelo início da cascata de fototransdução. Dentro dos fotorreceptores, a rodopsina está ligada ao seu cromóforo 11-cis-retinal e é ativada através da isomerização sensível à luz de 11-cis-retinal para all-trans-retinal, que ativa a proteína G da transducina, resultando na cascata de fototransdução.
Embora a fototransdução seja bem compreendida, os processos envolvidos no fornecimento de precursores de vitamina A na dieta para a geração de 11-cis-retinal no olho, bem como doenças que resultam na interrupção desse fornecimento, ainda não são totalmente compreendidos. Uma vez que os precursores da vitamina A são absorvidos pelo intestino, eles são armazenados no fígado como ésteres de retinil e liberados na corrente sanguínea como all-trans-retinol ligado à proteína de ligação ao retinol 4 (RBP4). Este RBP4-retinol circulatório será absorvido por órgãos sistêmicos, como fígado, pulmões, rins e olhos. Portanto, um método para a quantificação dos vários metabólitos da vitamina A dietética no olho e nos órgãos sistêmicos é fundamental para o estudo da função adequada da rodopsina GPCR.
Neste método, apresentamos um método abrangente de extração e análise para análise de vitamina A em tecido murino. Por meio da análise de cromatografia líquida de alta eficiência em fase normal, todos os isômeros relevantes de retinaldeídos, retinóis e ésteres de retinil podem ser detectados simultaneamente por meio de uma única execução, o que permite o uso eficiente de amostras experimentais e aumenta a confiabilidade interna em diferentes metabólitos de vitamina A dentro da mesma amostra. Com este método abrangente, os investigadores poderão avaliar melhor o suprimento sistêmico de vitamina A na função GPCR da rodopsina.
Introdução
Os receptores acoplados à proteína G (GPCRs) são uma das superfamílias de proteínas mais estudadas e caracterizadas conhecidas. Em sua função mais conhecida, os GPCRs servem como um receptor de superfície celular na transdução de sinal, inicializando as respostas intracelulares ao se ligarem a um ligante específico. Os GPCRs são caracterizados por sete domínios helicoidais transmembrana (TM) e seis domínios de alça total. Das seis alças, três alças são orientadas extracelularmente para facilitar a ligação do ligante, enquanto as outras três alças intracelulares são acopladas a uma proteína G heterotrimérica que consiste nas subunidades Gα, Gβ e Gγ 1,2.
Os GPCRs são classificados em várias classes, incluindo Classe A Semelhante à Rodopsina, Família de Receptores de Secretina Classe B, Glutamato Classe C, Receptores de Feromônio de Acasalamento Fúngico Classe D, Receptores de AMP Cíclico Classe E e Classe F Frisado / Suavizado 3,4. Como o próprio nome sugere, a subclasse Classe A semelhante à rodopsina GPCR inclui a rodopsina, a GPCR crítica responsável pela fototransdução e função visual. A rodopsina contém todas as principais características e elementos estruturais pertinentes encontrados no modelo canônico de GPCRs, incluindo os sete domínios helicoidais da MT mencionados anteriormente, as seis alças extracelulares e intracelulares e a associação com uma proteína G heterotrimérica, também conhecida como transducina (Gt) em fotorreceptores 1,5,6,7. Dentro da bolsa de ligação da rodopsina, o 11-cis-retinal, o ligante cromóforo sensível à luz, liga-se à rodopsina na lisina 296 por meio de uma ligação covalente da base de Schiff, formando assim o 11-cis-retinilideno 1,8. Após a absorção de um fóton, o 11-cis-retinilideno fotoisomeriza em all-trans-retinilideno, induzindo uma mudança conformacional dentro da rodopsina. Portanto, o ligante 11-cis-retinal é crítico para a função do GPCR da rodopsina, e um suprimento robusto e eficiente de 11-cis-retinal deve ser mantido continuamente para superar a alta taxa de renovação dentro dos fotorreceptores.
Os retinaldeídos, como o 11-cis-retinal, pertencem a um grupo de moléculas chamadas coletivamente de retinóides, e os retinóides biologicamente relevantes são mais amplamente chamados de vitamina A. Os retinóides são caracterizados por um grupo final cíclico conectado a uma cadeia de polieno conjugada, com um grupo final polar na outra extremidade. Os retinaldeídos e os vitâmeros associados da vitamina A não são exceção a essa caracterização, que contêm o anel de β-ionona como o grupo final cíclico, uma cadeia de polieno diterpeno e um grupo final polar diferente dependendo do vitâmero, ou seja, grupo aldeído para retinaldeídos, grupo hidroxila para retinóis, grupo carboxila para ácidos retinóicos, ligação éster para ésteres de retinil, etc (Figura 1)9,10.
Os mamíferos não podem sintetizar vitamina A de novo, mas as plantas podem; Portanto, todos os retinóides dentro dos sistemas de mamíferos devem se originar da dieta de produtores à base de plantas para os consumidores da cadeia alimentar. No modelo canônico do metabolismo da vitamina A, o β-caroteno, a planta arquetípica da pró-vitamina A, é absorvido pelo enterócito intestinal através do receptor eliminador classe B, membro 1 (SCARB1), clivado em duas moléculas de all-trans-retinal pela β-caroteno oxigenase 1 (BCO1 / BCMO1), que se liga à proteína de ligação ao retinaldeído 2 (RBP2) e é reduzida a all-trans-retinol por retinol desidrogenases (RDH), convertido em ésteres de retinil pela lecitina retinol aciltransferase (LRAT) e, em seguida, enviado para a corrente sanguínea em quilomícrons 11,12,13,14. Os ésteres de retinila, como o palmitato de retinila, por outro lado, servem como a pró-vitamina A predominante de fontes animais. O palmitato de retinila do lúmen intestinal é hidrolisado em all-trans-retinol pela carboxilesterase 1 (CES1) e se difunde no enterócito intestinal15. O fígado é o principal órgão de armazenamento e homeostático da homeostase da vitamina A, que absorve os ésteres de retinilo dentro desses quilomícrons, que são hidrolisados em all-trans-retinol ligado à proteína de ligação ao retinol celular 1 (CRBP1) por hidrolases de éster de retinol, entra nas células estreladas hepáticas e é convertido novamente em ésteres de retinil por LRAT para armazenamento13,16, 17. Agosto Para manter um nível homeostático de vitamina A no organismo, o fígado libera vitamina A na forma de todo o trans-retinol ligado a um complexo de transporte sérico, consistindo na proteína de ligação ao retinol 4 (RBP4) e transtirretina (TTR) 15 , 18 , 19 . Este complexo será referido como holo-RBP4 neste manuscrito.
Para usar esse suprimento sistêmico de vitamina A no sangue, os tecidos sistêmicos, incluindo o tecido ocular, onde uma fonte robusta de vitamina A é mantida, devem ter um método para absorver o holo-RBP4 no tecido. Dentro da retina rica em fotorreceptores no tecido ocular, o receptor de membrana estimulado pelo ácido retinóico 6 (STRA6) é o transportador implicado nessa função. Em estudos mecanísticos, o STRA6 demonstrou ser capaz de facilitar a ingestão de all-trans-retinol extracelular do holo-RBP4 no RPE20. Este all-trans-retinol importado entrará então no ciclo visual, que é o processo pelo qual o all-trans-retinol é convertido em 11-cis-retinal dentro do EPR e do segmento externo do fotorreceptor, facilitando assim a função visual quando ligado à rodopsina 9,21.
Uma vez que o all-trans-retinol do holo-RBP4 circulatório atravessa a barreira sangue-retina para o EPR dentro do tecido ocular através do STRA6, o all-trans-retinol no RPE é primeiro esterificado em ésteres de retinil por LRAT, depois hidrolisado em 11-cis-retinol pela proteína de 65 kDa específica do epitélio pigmentar da retina (RPE65). O 11-cis-retinol é então convertido em 11-cis-retinal pela retinol desidrogenase 5. Este 11-cis-retinal é então transportado para o segmento externo do fotorreceptor (OS) pela proteína de ligação ao retinóide interfotorreceptor (IRBP) 9 , 21 . Dentro do retículo endoplasmático que envolve o núcleo do fotorreceptor dentro da camada nuclear externa (ONL), os GPCRs de opsina são sintetizados e transportados através do cílio de conexão (CC). As proteínas motoras envolvidas nesse transporte através do CC são controversas, mas as hipóteses atuais implicam o transporte intraflagelar (IFT) baseado em cinesina e dineína ou o transporte baseado em miosina como prováveis facilitadores desse processo 14,22,23,24,25,26. Uma vez que esses dois componentes se encontram dentro dos discos membranosos dentro do OS, 11-cis-retinal e opsina formam 11-cis-retinilideno através de uma ligação covalente de base de Schiff na lisina 196 na rodopsina, pronta para fototransdução8.
Embora a expressão de STRA6 no EPR da retina ajude a facilitar a ingestão de all-trans-retinol de holo-RBP4, STRA6 não foi encontrado expresso no fígado, apesar de seu papel como o principal órgão homeostático para vitamina A e exibindo capacidades na ingestão de all-trans-retinol de holo-RBP4 15,19,27,28, 29,30,31. Eventualmente, um receptor análogo chamado receptor 2 da proteína de ligação ao retinol 4 (RBPR2) foi descoberto, exibindo a capacidade de ingerir todo o trans-retinol do holo-RBP4, muito parecido com o STRA6, mas é expresso no tecido hepático32.
Portanto, uma compreensão completa do papel da rodopsina na função visual requer uma compreensão dos processos biológicos que culminam na regeneração do pigmento visual. Isso, por sua vez, está intimamente relacionado aos processos descritos anteriormente, incluindo o metabolismo de precursores de pró-vitamina A, armazenamento no fígado, liberação de holo-RBP4 pelo fígado e eventual captação de holo-RBP4 através dos receptores de membrana STRA6 e RBPR2. Como mencionado acima, modelos animais como camundongos continuam sendo um dos principais modelos no estudo de tais processos. Assim, gostaríamos de apresentar um método de extração de retinóides em tecido murino, bem como um método de cromatografia líquida de alta eficiência (HPLC) de fase normal que possa detectar e quantificar esses retinóides. Usando esses métodos, os retinóides importantes descritos acima, como o ligante de rodopsina 11-cis-retiniano ou o principal retinóide de transporte all-trans-retinol, podem ser analisados em órgãos oculares, hepáticos e sistêmicos. Ao avaliar o suprimento de retinóides no tecido murino, nossa compreensão dos estados de doença e patologias relacionadas ao suprimento logístico de retinóides pode ser ainda mais avançada.
Além de funcionar como um cromóforo na função visual por meio da associação com GPCRs de opsina, os retinóides também desempenham um papel importante na sinalização de células de mamíferos por meio da sinalização do ácido retinóico, facilitada por duas famílias de receptores nucleares, receptores de ácido retinóico (RARs) e receptores de retinóide X (RXRs), que se ligam diretamente ao DNA e regulam a transcrição gênica33. Essas duas famílias ou receptores utilizam retinóides na forma de ácidos retinóicos como ligante. Os RARs demonstraram ter afinidade tanto pelo ácido trans-retinóico quanto pelo ácido 9-cis-retinóico, enquanto os RXRs expressam afinidade apenas pelo ácido 9-cis-retinóico34,35. Os ácidos retinóicos em quantidades não controladas são teratogênicos e a sinalização do ácido retinóico deve ser extremamente rigidamente controlada36. A produção de ácidos retinóicos para sinalização deve ocorrer localmente e em momentos muito específicos para o desenvolvimento adequado dos tecidos, como no desenvolvimento do rombencéfalo e dos membros, mas inúmeros outros exemplos utilizam a sinalização do ácido retinóico37,38. Dentro das células que participam da sinalização do ácido retinóico, os ácidos retinóicos são sintetizados por dois grupos de enzimas, álcool/retinol desidrogenase (ADHs/RDHs) que facilitam a oxidação de retinóis absorvidos por STRA6 ou RBPR2 em retinaldeídos, e retinaldeído desidrogenase (RALDHs) que facilitam a oxidação de retinaldeídos em ácidosretinóicos 39. Embora não participem da sinalização GPCR per se, os ácidos retinóicos se apresentam como um retinóide crucial que também funciona como um ligante para receptores de sinalização.
Embora não seja descrito em detalhes aqui, gostaríamos de reconhecer os métodos previamente estabelecidos para detecção de retinóides usando HPLC em vários contextos, como na pesquisa de alimentos e no estudo da rodopsina microbiana. Esses métodos empregam diferentes objetivos e abordagens para a detecção de retinóides, incluindo o uso de técnicas de fase reversa que requerem fases móveis menos voláteis e perigosas 40,41,42, a detecção de ácidos retinóicos e seus isômeros associados 40,41 e purificação e extração de diferentes fontes biológicas43. Nosso método se concentra especificamente na detecção de palmitato de retinila, isômeros de retinaldeído e isômeros de retinol de tecidos de mamíferos. Diferentes protocolos devem ser considerados se o caso de uso pretendido for diferente dessa aplicação específica.
Protocolo
NOTA: Todos os experimentos com animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade de Minnesota (protocolo # 2312-41637A) e realizados em conformidade com a Declaração ARVO para o Uso de Animais em Pesquisa Oftálmica e Visual. Realize todas as extrações no escuro, sob uma luz vermelha fraca para iluminação. Esteja ciente da luz residual emitida pelos visores de instrumentos e LEDs acessórios.
1. Geração de padrão de retinóide espectrofotométrico e geração de curva padrão externa
NOTA: Prepare um recipiente de gelo seco para armazenamento temporário de retinóides antes da análise com o HPLC.
- Pesar uma quantidade arbitrária mas adequada de retinóides e dissolvê-los num solvente adequado para quantificação por espectrofotometria.
NOTA: O solvente de escolha usado neste estudo é o etanol, e os valores de absortividade molar dos retinóides dissolvidos em etanol estão detalhados na Tabela 1. Etanol anidro de grau HPLC deve ser usado para dissolver padrões e amostras. O etanol purificado exclusivamente por destilação forma uma mistura azeotrópica com água, contendo aproximadamente 4% de água em volume. A água é imiscível com a fase móvel hexanóica e resultará na hidratação da fase estacionária da sílica, levando a uma eventual degradação da coluna. - Utilizando a Lei de Beer-Lambert e a absortividade molar do retinóide pertinente, quantificar a concentração do padrão gerado (Tabela 1).
Absorbância = Absorvibilidade Molar (ε) × Concentração Molar × Comprimento do Caminho - Realize diluições seriadas para criar concentrações que possam gerar uma curva padrão dentro da faixa de quantificação para o tecido desejado.
NOTA: Esteja ciente das limitações fundamentais da Lei Beer-Lambert, como sua falta de validade com altas concentrações de analito. Para evitar esse problema, os padrões de retinóides diluídos devem evitar a geração de valores de absorbância maiores que 1. Para nossas aplicações em quantificação de retinol e retinaldeído em órgãos murinos, descobrimos que uma curva de calibração com faixa de 1 a 10 ng foi capaz de cobrir as quantidades típicas encontradas. Para a quantificação do palmitato de retinila do fígado murino, descobrimos que uma curva de calibração com uma faixa de 20-80 μg foi capaz de cobrir as quantidades típicas encontradas. - Alterando incrementalmente o volume de injeção da solução estoque criada anteriormente, alterando assim incrementalmente a quantidade injetada de retinóide, integre os picos para gerar uma curva padrão externa adequada para quantificação de retinóides, onde a integração de picos é diretamente proporcional à quantidade de retinóide injetada.
2. Colheita de tecidos e coleta de amostras
NOTA: Prepare um recipiente de gelo seco para armazenamento temporário de tecido antes da homogeneização do tecido e extração de retinóide. As quantidades recomendadas de colheita de tecido estão detalhadas na Tabela 2. Para levar em conta as variações retinóides devido a variações no conteúdo sanguíneo de cada tecido, a extração de tecido deve ser feita em camundongos totalmente perfundidos e a extração de sangue deve ser concluída em camundongos separados.
- Eutanasiar os camundongos seguindo as diretrizes estabelecidas pelo protocolo ditado pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) (asfixia CO2 aqui).
- Sangue: Imediatamente após a eutanásia, decapite os camundongos com uma tesoura e drene o sangue do tronco principal dos camundongos para um tubo de 1,5 mL.
- Olho: Usando uma pinça, remova os olhos da cabeça decapitada.
- Cérebro: Usando uma tesoura pequena, corte a cabeça decapitada e remova o cérebro usando uma pinça.
- Rim, fígado, baço, coração e pulmão: Usando uma tesoura pequena, faça uma incisão no abdômen, corte na direção superior ao longo da linha média e corte o esterno e a caixa torácica. Remova o tecido exposto usando uma pinça.
3. Homogeneização de tecidos
NOTA: Se a análise de partições menores de órgãos for desejada, como em órgãos maiores (por exemplo, fígado ou tecido pulmonar), todo o órgão deve ser homogeneizado para evitar diferenças no conteúdo retinóide em diferentes partes do tecido. Em vez disso, divida o homogeneizado se forem desejadas quantidades menores de tecido. Um esquema para o protocolo é detalhado na Figura 2. Esse protocolo modificado foi adaptado de Kane e Napoli44.
- Coloque o lenço no tubo do moedor de tecidos, junto com 50% de solução salina gelada (0,9%) e 50% de metanol. Consulte a Tabela 2 para o volume usado para cada tipo de tecido.
- Coloque o pilão no tubo do moedor, lenta e suavemente execute cinco rotações completas com o pilão para obter um homogeneizado.
- Transfira as amostras para tubos de 15 mL imediatamente após a homogeneização.
- Adicione 2 mL de metanol e deixe descansar por 15 min em temperatura ambiente.
NOTA: Se a análise de derivados de retinaldeído oxima for desejada, adicione 1 mL de cloridrato de hidroxilamina 0,1 M em HEPES 0,1 M (pH 6,5) (Figura 1).
4. Extração de retinóides
CUIDADO: O hexano é altamente inflamável, altamente volátil e altamente tóxico. Respiradores aprovados pelo Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH), proteção para os olhos, luvas de butil e um exaustor devem ser usados ao manusear hexano. Ao evaporar o hexano das amostras, alguma forma de aparelho de circulação de ar aprimorado é recomendada para evitar o acúmulo de fumaça de solvente, por exemplo, um aparelho de sucção de snorkel.
- Adicionar 10 ml de hexano ao homogeneizado e misturar o tubo horizontalmente durante pelo menos 10 s.
NOTA: É fundamental que as fases se misturem totalmente. - Centrifugue a mistura homogeneizado/hexano durante 3 min a 1.000 × g para facilitar a separação de fases.
- Realize a extração 2x para garantir a extração total de retinóides do homogeneizado. Repita as etapas 4.1 e 4.2.
- Retire a camada de hexano usando uma pipeta e coloque a camada de hexano em um conjunto separado de tubos de vidro de 15 mL para evaporação a vácuo.
NOTA: Para evaporação, use tubos de VIDRO de 15 mL para evitar a adesão de retinóides às paredes do tubo. - Usando uma centrífuga a vácuo, evapore completamente o hexano.
5. Análise de ressuspensão e HPLC
NOTA: Como o sistema de HPLC usado neste manuscrito era um sistema de bomba binária, a fase móvel de quatro componentes foi pré-misturada em um único frasco antes da operação.
CUIDADO: Todos os quatro solventes orgânicos usados neste método são altamente inflamáveis, altamente voláteis e altamente tóxicos. O 1,4-dioxano é suscetível à formação de peróxido explosivo após a exposição ao oxigênio. Manter todos os recipientes que contenham 1,4-dioxano fechados quando não estiverem a ser utilizados. Respiradores aprovados pelo Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH), proteção para os olhos, luvas de butilo e um exaustor devem ser usados ao manusear esses solventes. Ao executar esses solventes em uma HPLC, alguma forma de aparelho de circulação de ar aprimorado é recomendada para evitar o acúmulo de fumaça de solvente, por exemplo, um aparelho de sucção de snorkel.
- Ressuspenda o tubo seco de 15 mL com 100 μL de hexano; vórtice bem para garantir que todos os retinóides sejam dissolvidos.
- Pipetar todos os 100 μL de hexano num único inserto de vidro para análise por HPLC.
- Configurar a HPLC (adaptada de Landers e Olson45): fase móvel: 85,4% hexano (v/v), 11,2% acetato de etilo (v/v), 2% dioxano (v/v), 1,4% 1-octanol (v/v); coluna: duas colunas de 4,6 mm ID x 250 nm, 5 μm, conectadas em série; uma temperatura do termostato multicoluna: 25 °C; volume de injeção: 100 μL; vazão: 1 mL/min; Duração: 40 min. Use detecção de absorbância de espectro UV; manter a opção verificada para adquirir o espectro UV de 200 nm a 400 nm.
6. Identificação e integração de picos
- Identifique os picos usando o tempo de retenção e os espectros UV de cada retinóide de interesse, conforme observado na análise dos padrões retinóides (Figura 3, Tabela 3 e Tabela 4).
- Utilizando o sistema de dados cromatográficos do sistema de HPLC escolhido, integrar os picos identificados. A integração, ou área sob a curva, é diretamente proporcional à quantidade de analito. Fazer referência à curva-padrão externa gerada na etapa 1 para quantificar a substância a analisar.
- Para análise de cromatogramas gerados a partir de tecido biológico, use a integração manual em vez da integração automática oferecida por sistemas de dados cromatográficos típicos, uma vez que variabilidades em parâmetros como o tempo de retenção são frequentemente observadas em tais amostras.
- Certifique-se de que os cromatogramas não exibam irregularidades que possam indicar problemas durante a execução, como linhas de base ruidosas ou picos não gaussianos. Esses problemas indicam contaminantes na HPLC ou desgaste nas colunas e devem ser corrigidos para uma análise válida.
Resultados
Aqui, utilizamos o método descrito acima para detectar e quantificar retinóides em tecido ocular e sistêmico murino e geramos cromatogramas representativos. Além disso, daremos um resumo dos retinóides típicos que podem ser detectados nesses tecidos.
Aos 6 meses de idade, os camundongos foram eutanasiados por asfixia por CO2 . Para manter o conteúdo retinóide ocular, os camundongos foram adaptados ao escuro por 2 dias antes da eutanásia e extração. Dois olhos, 0,2 g de fígado e 75 μL de sangue foram colhidos para extração de retinóides e posterior análise por HPLC. Para o tecido ocular, um olho foi extraído sem a adição de hidroxilamina, enquanto o outro foi submetido ao tratamento com hidroxilamina. Para fígado e sangue, o tratamento com hidroxilamina não foi necessário, uma vez que os retinaldeídos não são normalmente detectados nesses tecidos.
No cromatograma do olho de camundongo não tratado com hidroxilamina, foi identificado 13-cis-retinal, um dos dois isômeros não canônicos de retinaldeído. Além disso, foram identificados 11-cis-retinal e all-trans-retinal, os dois isômeros canônicos de retinaldeído. Em ambos os cromatogramas, foram identificados o 11-cis-retinol intermediário do ciclo visual, bem como a principal forma de transporte de vitamina A, o all-trans-retinol (Figura 4A).
No cromatograma do olho de camundongo tratado com hidroxilamina, todos os isômeros de retinaldeído mencionados anteriormente ainda estavam presentes. No entanto, os tempos de retenção para esses isômeros foram significativamente aumentados. Além disso, esses isômeros de retinaldeído agora se apresentam como isômeros syn e anti . Durante a quantificação por meio da integração de picos, os picos syn e anti devem ser somados para obter um valor de integração preciso. Tanto o 11-cis-retinol quanto o all-trans-retinol ainda estavam presentes (Figura 4B).
No cromatograma do tecido hepático de camundongos, palmitato de retinila e all-trans-retinol foram identificados dentro desses tecidos. O palmitato de retinila, um éster de retinila, serve como a principal forma de armazenamento de vitamina A em mamíferos e pode ser encontrado em quantidades significativas no tecido hepático de mamíferos. O fígado libera vitamina A nos tecidos sistêmicos como holo-RBP4, contendo todo o trans-retinol dentro do complexo RBP4-transtricatina Posteriormente, um grande pico de todo o trans-retinol pode ser identificado neste cromatograma ( Figura 4C ).
No cromatograma do sangue de camundongos, foi identificado um grande pico de todo o trans-retinol. Dado que o holo-RBP4 do fígado é liberado para os tecidos sistêmicos através do sistema circulatório, isso é o esperado ( Figura 4D ). A absorbância característica do espectro UV (~ 250-400 nm) das isoformas retinóides nos picos de HPLC resolvidos dependentes do tempo pode ser útil na confirmação cruzada inicial da qualidade da presença da isoforma em um pico respectivo específico (Figura 5).

Figura 1: Estruturas químicas dos retinóides. (A) Esses retinóides são normalmente encontrados em tecido murino extraído. Observe os diferentes grupos de extremidades polares, bem como as diferentes localizações das ligações duplas cis nos isômeros retinóides. (B) A conversão de retinaldeídos em oximas retinianos aumenta a eficiência da extração, evita a coeluição de picos com palmitato de retinila, bem como a coeluição dentro dos isômeros de retinaldeído. Clique aqui para ver uma versão maior desta figura.

Figura 2: Fluxo de trabalho para coleta de tecido, homogeneização, extração e análise de retinóides. Retinas e amostras de tecido de camundongos adaptados ao escuro foram homogeneizadas e extraídas. Passo 1: Após a eutanásia dos camundongos de acordo com as diretrizes, sangue e vários tecidos são coletados. Etapas 2-4: A homogeneização do tecido é então feita com solução salina e metanol, com cloridrato de hidroxilamina para análises quantitativas. Etapas 5-7: Os retinóides são tratados com hexano, seguido de evaporação. Passos 8,9: Ressuspenso com 100 μL de hexano para garantir que todos os retinóides sejam dissolvidos. Passo 10: Finalmente, as amostras são analisadas por HPLC. Abreviatura: HPLC = Cromatografia Líquida de Alta Resolução. Clique aqui para ver uma versão maior desta figura.

Figura 3: Cromatograma de padrões retinóides e padrões de retinóides tratados com hidroxilamina. (A) Este cromatograma contém padrões de palmitato de retinila, 13-cis-retinal, 11-cis-retinal, all-trans-retinal, 11-cis-retinol, 13-cis-retinol e all-trans-retinol. (B) Este cromatograma contém os padrões de palmitato de retinila, 13-cis-retinal, 11-cis-retinal, all-trans-retinal, 11-cis-retinol, 13-cis-retinol e all-trans-retinol. Este cromatograma contém os isômeros syn e anti-oxima retinaldeído, além de isômeros de retinol. Clique aqui para ver uma versão maior desta figura.

Figura 4: Cromatogramas representativos. (A) Cromatograma representativo do tecido ocular de camundongo. Este cromatograma contém retinóides normalmente encontrados no tecido ocular murino, incluindo isômeros de retinaldeído, além de isômeros de retinol. (B) Cromatograma representativo do tecido ocular de camundongo tratado com hidroxilamina. Observe que, em vez dos retinaldeídos não quimicamente modificados encontrados nos cromatogramas anteriores (Figura 4A), este cromatograma contém os isômeros syn e anti-oxima retinaldeyde, além dos isômeros de retinol. (C) Cromatograma representativo do tecido hepático de camundongo. Este cromatograma contém retinóides normalmente encontrados no tecido hepático murino, incluindo palmitato de retinila e all-trans-retinol. (D) Cromatograma representativo de sangue de camundongo. Este cromatograma contém retinóides normalmente encontrados no sangue murino, incluindo todo o trans-retinol. Clique aqui para ver uma versão maior desta figura.
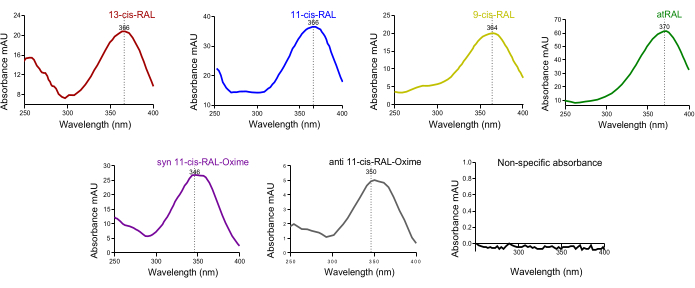
Figura 5: Espectro de absorbância UV dos isômeros de retinaldeído do tecido ocular murino. Espectros de absorbância de (A) 13-cis-retinal, (B) 11-cis-retinal, (C) 9-cis-retinal, (D) totalmente trans-retiniano, (E) syn 11-cis-retinal oxima, (F) anti 11-cis-retinal oxima. Clique aqui para ver uma versão maior desta figura.

Figura 6: Visão geral dos módulos de HPLC, fluxo de fase móvel e outros instrumentos. O fluxo de fase móvel começa a partir dos frascos de solvente preparados e é bombeado em alta pressão pela bomba binária para o amostrador automático, onde o analito é incorporado ao fluxo de solvente. A fase móvel e o analito atingem o compartimento da coluna com temperatura regulada e, finalmente, o detector de matriz de diodos para medição. (A) Tela de monitor de cor vermelha minimizando a fotoisomerização de retinóides. (B) Bomba binária. (C) Amostrador de frascos. (D) Termostato multicoluna. (E) Detector de arranjo de diodos. (F) Coletor de frações analíticas. (G) Recipiente de resíduos poli de alta densidade. (H) Da esquerda para a direita, tampa de crimpagem de alumínio, inserto de 250 μL com pés de polímero, frasco superior de crimpagem de cor âmbar, montagem final do frasco de injeção. (I) Centrífuga refrigerada esquerda. Certo, concentrador de centrífuga. Clique aqui para ver uma versão maior desta figura.
| Composto | Absortividade molar (ε) | Solvente | Referência |
| Palmitato de Retinilo | 49260 | Etanol | Hubbard et al.49 |
| 13-cis-Retinal | 35500 | Etanol | Hubbard et al.49 |
| 11-cis-Retinal | 24935 | Etanol | Hubbard et al.49 |
| 9-cis-Retinal | 36100 | Etanol | Robeson et al.51 |
| Totalmente trans-retinal | 42880 | Etanol | Hubbard et al.49 |
| 11-cis-Retinol | 34890 | Etanol | Hubbard et al.49 |
| 13-cis-Retinol | 48305 | Etanol | Robeson et al.50 e Robeson et al.51 |
| Totalmente trans-retinol | 52770 | Etanol | Hubbard et al.49 |
Tabela 1: Absortividade molar de retinóides em etanol. Os valores de absortividade molar dos retinóides foram coletados de Kane e Napoli44, Hubbard et al.46, Robeson et al.47 e Robeson et al.48. A absortividade molar depende do solvente. Os valores listados aqui são específicos para retinóides dissolvidos em etanol.
| Tecido | Quantidade de colheita de tecido | Volume para Homogeneização |
| Sangue | 75 μL | N/A |
| Fígado | 0,2 g | 2 mL |
| Rim | 2 Rins inteiros | 2 mL |
| Pele | 0,2 g | 1 mL – 1,5 mL |
| Baço | 1 Baço inteiro | 1 mL |
| Olho | Ambos Retina, pool 4 Retina | 1 mL |
| Cérebro | 1 Cérebro inteiro | 2 mL |
| Coração | 1 Coração Inteiro | 1 mL |
| Pulmão | 0,2 g | 2 mL |
Tabela 2: Quantidade de tecido recomendada por análise. Quantidade de tecido por análise e volume de soro fisiológico gelado a 50% (0,9%) e metanol a 50% para homogeneização tecidual, conforme preconizado por Kane e Napoli44.
| Composto | Tempo de retenção (min) | Máximos de absorbância UV (nm) |
| Palmitato de Retinilo | 5.177 | 326 |
| 13-cis-Retinal | 7.268 | 366 |
| 11-cis-Retinal | 7.691 | 366 |
| 9-cis-Retinal | 7.931 | 364 |
| Totalmente trans-retinal | 8.993 | 370 |
| 11-cis-Retinol | 17.003 | 318 |
| 13-cis-Retinol | 17.83 | 328 |
| Totalmente trans-retinol | 23.933 | 326 |
Tabela 3: Tempos de retenção e comprimentos de onda máximos de absorbância dos retinóides. Esses valores foram observados quando usados com o método descrito e a fase móvel, conforme detectado com o detector de matriz de diodos referenciado.
| Composto | Tempo de retenção (min) | Máximos de absorbância UV (nm) |
| Syn 11-cis-Oxima Retiniana | 9.59 | 346 |
| Syn Oxima totalmente trans-retiniana | 10.6 | 356 |
| Syn 13-cis-retinal oxima | 11.3 | 352 |
| Oxima anti-13-cis-retiniana | 13 | 356 |
| Oxima anti-11-cis-retiniana | 15.1 | 350 |
| Anti Oxima totalmente trans-retiniana | 19.7 | 360 |
Tabela 4: Tempos de retenção e comprimentos de onda máximos de absorbância de retinaldeídos tratados com hidroxilamina, resultando em isômeros syn e anti-oxima de cada retinaldeído. Esses valores foram observados quando usados com o método descrito e a fase móvel, conforme detectado com o detector de matriz de diodos referenciado.
Discussão
Neste método, a HPLC de fase normal é usada para detectar e quantificar retinóides relevantes, incluindo ésteres de retinil, retinaldeídos e retinóis. Dada a importância do 11-cis-retinal como o cromóforo crítico na ativação do GPCR da rodopsina, um método que possa detectar os metabólitos relacionados à produção de 11-cis-retinal é fundamental para o estudo da função visual geral. A principal vantagem deste método é que todos os isômeros relevantes de retinaldeídos e retinóis podem ser detectados e quantificados simultaneamente com uma única execução. Dada a escassez de tecidos experimentais viáveis, este método permite o uso eficiente do tecido na detecção de retinóides. Embora o uso de fases móveis à base de hexano e acetato de etila tenha sido relatado na separação de retinóides49, a adição de 1,4-dioxano e 1-octanol melhora a resolução dos isômeros retinóides. O 1,4-dioxano é necessário para a resolução do 13-cis-retinol e do 11-cis-retinol50, enquanto os álcoois de cadeia longa, como o 1-octanol, melhoram ainda mais a separação dos isômeros do retinol 45,51,52.
Para a quantificação dos isômeros de retinaldeído, é necessária a conversão prévia para as oximas de retinaldeído correspondentes com hidroxilamina, uma vez que o grupo aldeído reativo é propenso a reagir com outras biomoléculas, como proteínas e lipídios 45,53,54. As oximas de retinaldeído são extraídas mais facilmente e fazem com que os picos de retinaldeído sejam eluídos mais tarde na corrida, evitando assim o pico de coeluição com o grupo desconhecido de picos e o pico de palmitato de retinila que elui em ~ 5-8 min para tecidos biológicos. O tratamento de retinaldeídos com hidroxilamina também previne a coeluição de retinaldeídos com tempos de eluição semelhantes45. A conversão em oximas de retinaldeído gera isômeros syn e anti, que eluem em dois momentos diferentes com dois picos diferentes para cada isômero de retinaldeído. A integração para ambos os picos deve ser somada para quantificar adequadamente cada isômero de retinaldeído. Além do tempo de retenção, os espectros UV fornecem outra métrica que pode ser utilizada na identificação de picos. Cada retinóide exibe um máximo de absorbância UV ligeiramente diferente. Quando levadas em consideração juntamente com o tempo de retenção, essas duas métricas permitem a identificação precisa dos picos (Tabela 3 e Tabela 4).
Embora a presença de isômeros canônicos de retinaldeído, como 11-cis-retinal e all-trans-retinal, seja esperada no tecido ocular, com 11-cis-retinal sendo o cromóforo crítico do ligante de rodopsina e all-trans-retinal sendo o ligante fotoisomerizado, outros isômeros de retinaldeído não canônicos são detectados com este método. Em particular, o 13-cis-retinal foi prontamente detectado em HPLC de tecido ocular murino durante nossa análise ( Figura 4A-D ). O aparecimento desses retinaldeídos não canônicos não é completamente inesperado, no entanto, tanto o 13-cis-retinal quanto o 9-cis-retinal são subprodutos conhecidos resultantes do estresse induzido pela luz na retina55,56. Esses isômeros de retinaldeído não participam da via canônica conhecida da cascata de fototransdução e seus destinos metabólicos permanecem relativamente desconhecidos. No entanto, o 9-cis-retinal também se liga de forma estável à bolsa de ligação da rodopsina, formando isorodopsina. O papel da isorodopsina ainda não foi totalmente caracterizado, mas estudos mostraram que a isorodopsina exibe capacidades fotossensíveis muito parecidas com a rodopsina baseada em 11-cis-retinal 57,58. No mínimo, a capacidade do 9-cis-retinal de formar isorodopsina e fotoisomerizar de forma estável em totalmente trans-retinal fornece uma explicação razoável para sua ausência em nossa análise de HPLC56. O 13-cis-retinal, por outro lado, não demonstrou participar de nenhuma via bioquímica ocular conhecida, e seu acúmulo no tecido ocular pode resultar em estresse oxidativo na retina 55,59,60.
Embora o 9-cis-retinal normalmente não seja encontrado no tecido murino, deve-se mencionar que o método tratado com hidroxilamina não é um método viável para a separação e quantificação do 9-cis-retinal. Os picos de syn 9-cis-retinal e syn 13-cis-retinal coeluírão em 11,2 min. Nos casos em que são esperadas quantidades significativas de 9-cis-retinal, como quando aplicado de forma exógena, apenas a quantificação de 9-cis-retinal e 13-cis-retinal combinados será possível. Para identificação qualitativa, a realização do método sem tratar o tecido com hidroxilamina permite a separação completa dos picos de 13-cis-retinal e 9-cis-retinal.
Além do tecido ocular, esse método também pode ser facilmente aplicado ao tecido sistêmico. Embora os retinaldeídos em suas várias formas isoméricas normalmente não sejam encontrados no tecido sistêmico, o all-trans-retinol ligado à proteína de ligação ao retinol 4 (holo-RBP4) é a principal forma de transporte de vitamina A em organismos mamíferos e o all-trans-retinol pode ser prontamente detectado no sangue usando este método. Além do sangue, o all-trans-retinol também pode ser detectado em todos os tecidos sistêmicos. Portanto, usando este método, um perfil retinóide sistêmico completo em todo o tecido pode ser criado usando este método.
Como os retinaldeídos, especialmente o ligante crítico de rodopsina 11-cis-retinal, são extremamente suscetíveis à fotoisomerização, é fundamental que medidas preventivas sejam tomadas para evitar a exposição acidental à luz durante qualquer uma das etapas descritas acima. Além das fontes óbvias de iluminação de salas e painéis de instrumentos, descobrimos que a luz errante de LEDs acessórios em vários instrumentos, como os encontrados atrás dos instrumentos, incluindo o próprio HPLC, são as principais fontes de exposição acidental à luz (Figura 6). Além disso, descobrimos que uma sala escura dedicada era vital para o manuseio adequado dos isômeros de retinaldeído e tecidos experimentais. Além da minimização da luz, recomendamos que o tecido seja processado rápida e prontamente após a eutanásia e a colheita, uma vez que a degradação dos isômeros do retinaldeído ocorre mesmo na ausência de luz. Idealmente, a coleta de tecido, a extração e a análise de HPLC devem ser concluídas no mesmo dia.
O tecido que não é processado imediatamente deve ser armazenado no escuro a -80 °C e não deve ser armazenado por mais de uma semana antes do processamento. Como foi mencionado acima, todos os solventes usados na fase móvel e nas etapas de extração no método acima são altamente tóxicos, voláteis e inflamáveis. Procedimentos e equipamentos adequados devem ser usados ao manusear esses solventes perigosos. Equipamentos de proteção individual (EPI) adequados, como luvas de butila, respiradores aprovados pelo NIOSH e proteção para os olhos, devem ser colocados antes do manuseio do solvente, e todas as transferências de solvente devem ser feitas dentro de uma capela de exaustão. Esteja ciente de que o 1,4-dioxano é suscetível à formação de peróxido explosivo após a exposição ao oxigênio e mantenha todos os recipientes de solvente com 1,4-dioxano hermeticamente fechados ao ar.
Se um método de HPLC de fase normal for inviável devido a materiais ou equipamentos inadequados, existem métodos de fase reversa mais típicos com solventes menos voláteis, como acetonitrila e água, para detectar e quantificar retinaldeídos e retinóis. No entanto, esses métodos não são capazes de separar isômeros e só são capazes de detectar retinaldeídos totais ou retinóis totais44,54.
Divulgações
Os autores declaram não haver conflito de interesses.
Agradecimentos
Este trabalho foi apoiado por bolsas NIH-NEI (EY030889 e 3R01EY030889-03S1) e em parte pelos fundos iniciais da Universidade de Minnesota para GPL Também gostaríamos de agradecer ao National Eye Institute por nos fornecer o padrão 11-cis-retinal usado neste manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| 1-Octanol, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 203-917-6 | |
| 1,4-Dioxane, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 204-661-8 | |
| 11-cis-retinal | National Eye Institute | N/A | |
| 11-cis-Retinol | Toronto Research Chemicals | TRC-R252105 | |
| 13-cis-retinal | Toronto Research Chemicals | TRC-R239900 | |
| 13-cis-retinol | Toronto Research Chemicals | TRC-R252110 | |
| All-trans-Retinal | Toronto Research Chemicals | TRC-R240000 | |
| All-trans-Retinol | Toronto Research Chemicals | TRC-R252002 | |
| Ethyl Acetate, suitable for HPLC, ≥99.7% | Sigma-Aldrich, Millipore Sigma | 205-500-4 | |
| Hexane, HPLC Grade | Fisher Scientific, Spectrum Chemical | 18-610-808 | |
| Methanol (HPLC) | Fisher Scienctific | A452SK-4 | |
| Retinyl Palmitate | Toronto Research Chemicals | TRC-R275450 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| Instruments | |||
| 1260 Infinity II Analytical Fraction Collector | Agilent | G1364F | |
| 1260 Infinity II Binary Pump | Agilent | G7112B | |
| 1260 Infinity II Diode Array Detector | Agilent | G7115A | |
| 1260 Infinity II Multicolumn Thermostat | Agilent | G7116A | |
| 1260 Infinity II Vialsampler | Agilent | G7129A | |
| ST40R Refrigerated Centrifuge | Thermo Scientific | TSST40R | |
| Vacufuge Plus Centrifuge Concentrator | Eppendorf | 22820168 | |
| Consumables | |||
| 2 mL Amber Screw Top Vials | Agilent | 5188-6535 | |
| Crimp Cap with PTFE/red rubber septa, 11 mm | Agilent | 5183-4498 | |
| Disposable Glass Conical Centrifuge Tubes | Millipore Sigma | CLS9950215 | |
| Screw cap tube, 15 mL | Sarstedt | 62.554.502 | |
| Vial insert, 150 µL, glass with polymer feet | Agilent | 5183-2088 |
Referências
- Palczewski, K., et al. Crystal structure of rhodopsin: A G protein-coupled receptor. Science. 289 (5480), 739-745 (2000).
- Rosenbaum, D. M., Rasmussen, S. G. F., Kobilka, B. K. The structure and function of G-protein-coupled receptors. Nature. 459 (7245), 356-363 (2009).
- Alhosaini, K., Azhar, A., Alonazi, A., Al-Zoghaibi, F. GPCRs: The most promiscuous druggable receptor of the mankind. Saudi Pharm J. 29 (6), 539-551 (2021).
- Hu, G. -. M., Mai, T. -. L., Chen, C. -. M. Visualizing the GPCR network: Classification and evolution. Sci Rep. 7 (1), 15495 (2017).
- Lerea, C. L., Somers, D. E., Hurley, J. B., Klock, I. B., Bunt-Milam, A. H. Identification of specific transducin α subunits in retinal rod and cone photoreceptors. Science. 234 (4772), 77-80 (1986).
- Gao, Y., Hu, H., Ramachandran, S., Erickson, J. W., Cerione, R. A., Skiniotis, G. Structures of the rhodopsin-transducin complex: Insights into G protein activation. Mol Cell. 75 (4), 781-790.e3 (2019).
- Zhou, X. E., Melcher, K., Xu, H. E. Structure and activation of rhodopsin. Acta Pharmacol Sin. 33 (3), 291-299 (2012).
- Robinson, P. R., Cohen, G. B., Zhukovsky, E. A., Oprian, D. D. Constitutively active mutants of rhodopsin. Neuron. 9 (4), 719-725 (1992).
- Kiser, P. D., Golczak, M., Palczewski, K. Chemistry of the retinoid (visual) cycle. Chem Rev. 114 (1), 194-232 (2014).
- Sani, B. P., Hill, D. L. [3] Structural characteristics of synthetic retinoids. Methods Enzymol. 189, 43-50 (1990).
- Lobo, G. P., Amengual, J., Palczewski, G., Babino, D., von Lintig, J. Carotenoid-oxygenases: Key players for carotenoid function and homeostasis in mammalian biology. Biochim Biophys Acta. 1821 (1), 78-87 (2012).
- Amengual, J., et al. Two carotenoid oxygenases contribute to mammalian provitamin A metabolism. J Biol Chem. 288 (47), 34081-34096 (2013).
- Harrison, E. H. Mechanisms involved in the intestinal absorption of dietary vitamin A and provitamin A carotenoids. Biochim Biophys Acta. 1821 (1), 70-77 (2012).
- Leung, M., et al. The logistical backbone of photoreceptor cell function: Complementary mechanisms of dietary vitamin A receptors and rhodopsin transporters. Int J Mol Sci. 25 (8), 4278 (2024).
- Martin Ask, N., Leung, M., Radhakrishnan, R., Lobo, G. P. Vitamin A transporters in visual function: A mini review on membrane receptors for dietary vitamin A uptake, storage, and transport to the eye. Nutrients. 13 (11), 3987 (2021).
- Harrison, E. H. Carotenoids, β-apocarotenoids, and retinoids: The long and the short of it. Nutrients. 14 (7), 1411 (2022).
- Li, Y., Wongsiriroj, N., Blaner, W. S. The multifaceted nature of retinoid transport and metabolism. Hepatobiliary Surg Nutr. 3 (3), 126-139 (2014).
- D'Ambrosio, D. N., Clugston, R. D., Blaner, W. S. Vitamin A metabolism: An update. Nutrients. 3 (1), 63-103 (2011).
- Yamamoto, Y., et al. Interactions of transthyretin (TTR) and retinol-binding protein (RBP) in the uptake of retinol by primary rat hepatocytes. Exp Cell Res. 234 (2), 373-378 (1997).
- Kawaguchi, R., et al. A membrane receptor for retinol binding protein mediates cellular uptake of vitamin A. Science. 315 (5813), 820-825 (2007).
- Kiser, P. D., Golczak, M., Maeda, A., Palczewski, K. Key enzymes of the retinoid (visual) cycle in vertebrate retina. Biochim Biophys Acta. 1821 (1), 137-151 (2012).
- Radhakrishnan, R., et al. The role of motor proteins in photoreceptor protein transport and visual function. Ophthalmic Genet. 43 (3), 285-300 (2022).
- Solanki, A. K., et al. Loss of motor protein MYO1C causes rhodopsin mislocalization and results in impaired visual function. Cells. 10 (6), 1322 (2021).
- Liu, X., Udovichenko, I. P., Brown, S. D. M., Steel, K. P., Williams, D. S. Myosin VIIa participates in opsin transport through the photoreceptor cilium. J Neurosci. 19 (15), 6267-6274 (1999).
- Insinna, C., Besharse, J. C. Intraflagellar transport and the sensory outer segment of vertebrate photoreceptors. Dev Dyn. 237 (8), 1982-1992 (2008).
- Krock, B. L., Mills-Henry, I., Perkins, B. D. Retrograde intraflagellar transport by cytoplasmic dynein-2 is required for outer segment extension in vertebrate photoreceptors but not arrestin translocation. Invest Ophthalmol Vis Sci. 50 (11), 5463-5471 (2009).
- Blaner, W. S. STRA6, a cell-surface receptor for retinol-binding protein: The plot thickens. Cell Metab. 5 (3), 164-166 (2007).
- Bouillet, P., et al. Developmental expression pattern of Stra6, a retinoic acid-responsive gene encoding a new type of membrane protein. Mech Dev. 63 (2), 173-186 (1997).
- Blomhoff, R., Norum, K. R., Berg, T. Hepatic uptake of [3H]retinol bound to the serum retinol binding protein involves both parenchymal and perisinusoidal stellate cells. J Biol Chem. 260 (25), 13571-13575 (1985).
- Kelly, M., von Lintig, J. STRA6: role in cellular retinol uptake and efflux. Hepatobiliary Surg Nutr. 4 (4), 229-242 (2015).
- Quadro, L., et al. The role of extrahepatic retinol binding protein in the mobilization of retinoid stores. J. Lipid Res. 45 (11), 1975-1982 (2004).
- Alapatt, P., et al. Liver retinol transporter and receptor for serum retinol-binding protein (RBP4). J Biol Chem. 288 (2), 1250-1265 (2013).
- Chawla, A., Repa, J. J., Evans, R. M., Mangelsdorf, D. J. Nuclear receptors and lipid physiology: Opening the X-files. Science. 294 (5548), 1866-1870 (2001).
- Heyman, R. A., et al. 9-cis retinoic acid is a high affinity ligand for the retinoid X receptor. Cell. 68 (2), 397-406 (1992).
- Allenby, G., et al. Retinoic acid receptors and retinoid X receptors: interactions with endogenous retinoic acids. Proc Natl Acad Sci USA. 90 (1), 30-34 (1993).
- Das, B. C., et al. Retinoic acid signaling pathways in development and diseases. Bioorg Med Chem. 22 (2), 673-683 (2014).
- Hernandez, R. E., Putzke, A. P., Myers, J. P., Margaretha, L., Moens, C. B. Cyp26 enzymes generate the retinoic acid response pattern necessary for hindbrain development. Development. 134 (1), 177-187 (2007).
- Yashiro, K., et al. Regulation of retinoic acid distribution is required for proximodistal patterning and outgrowth of the developing mouse limb. Dev Cell. 6 (3), 411-422 (2004).
- Duester, G. Families of retinoid dehydrogenases regulating vitamin A function. Eur J Biochem. 267 (14), 4315-4324 (2000).
- Tatum, V., Chow, C. K. Rapid measurement of retinol, retinal, 13-cis-retinoic acid and all-trans-retinoic acid by high performance liquid chromatography. J Food Drug Anal. 13 (3), (2020).
- Teerlink, T., Copper, M. P., Klaassen, I., Braakhuis, B. J. M. Simultaneous analysis of retinol, all-trans- and 13-cis-retinoic acid and 13-cis-4-oxoretinoic acid in plasma by liquid chromatography using on-column concentration after single-phase fluid extraction. J Chromatogr B. Biomed Sci App. 694 (1), 83-92 (1997).
- Egberg, D. C., Heroff, J. C., Potter, R. H. Determination of all-trans and 13-cis vitamin A in food products by high-pressure liquid chromatography. J Agric Food Chem. 25 (5), 1127-1132 (1977).
- Sudo, Y., et al. A microbial rhodopsin with a unique retinal composition shows both sensory rhodopsin II and bacteriorhodopsin-like properties. J Biol Chem. 286 (8), 5967-5976 (2011).
- Kane, M. A., Napoli, J. L. Quantification of endogenous retinoids. Methods Mol Biol. 652, 1-54 (2010).
- Landers, G. M., Olson, J. A. Rapid, simultaneous determination of isomers of retinal, retinal oxime and retinol by high-performance liquid chromatography. J Chromatogr A. 438, 383-392 (1988).
- Hubbard, R., Brown, P. K., Bownds, D. [243] Methodology of vitamin A and visual pigments. Methods Enzymol. 18, 615-653 (1971).
- Robeson, C. D., et al. Chemistry of vitamin A. XXIV. The synthesis of geometric isomers of vitamin A via methyl β-methylglutaconate1. J Am Chem Soc. 77 (15), 4111-4119 (1955).
- Robeson, C. D., Blum, W. P., Dieterle, J. M., Cawley, J. D., Baxter, J. G. Chemistry of vitamin A. XXV. Geometrical isomers of vitamin A aldehyde and an isomer of its α-ionone analog1. J Am Chem Soc. 77 (15), 4120-4125 (1955).
- Hubinger, J. C. Determination of retinol, retinyl palmitate, and retinoic acid in consumer cosmetic products. J Cosmet Sci. 60 (5), 485-500 (2009).
- Bhat, P. V., Co, H. T., Lacroix, A. Effect of 2-alkanols on the separation of geometric isomers of retinol in non-aqueous high-performance liquid chromatography. J Chromatogr A. 260, 129-136 (1983).
- Stancher, B., Zonta, F. Quantitative high-performance liquid chromatographic method for determining the isomer distribution of retinol (vitamin A1) and 3-dehydroretinol (vitamin A2) in fish oils. J Chromatogr. 312, 423-434 (1984).
- Zonta, F., Stancher, B. High-performance liquid chromatography of retinals, retinols (vitamin A1) and their dehydro homologues (vitamin A2): improvements in resolution and spectroscopic characterization of the stereoisomers. J Chromatogr A. 301, 65-75 (1984).
- van Kuijk, F. J., Handelman, G. J., Dratz, E. A. Rapid analysis of the major classes of retinoids by step gradient reversed-phase high-performance liquid chromatography using retinal (O-ethyl) oxime derivatives. J Chromatogr. 348 (1), 241-251 (1985).
- Kane, M. A., Folias, A. E., Napoli, J. L. HPLC/UV quantitation of retinal, retinol, and retinyl esters in serum and tissues. Anal Biochem. 378 (1), 71-79 (2008).
- Widjaja-Adhi, M. A. K., Ramkumar, S., von Lintig, J. Protective role of carotenoids in the visual cycle. FASEB J. 32 (11), 6305-6315 (2018).
- Ramkumar, S., Jastrzebska, B., Montenegro, D., Sparrow, J. R., von Lintig, J. Unraveling the mystery of ocular retinoid turnover: Insights from albino mice and the role of STRA6. J Biol Chem. 300 (3), 105781 (2024).
- de Grip, W. J., Lugtenburg, J. Isorhodopsin: An undervalued visual pigment analog. Colorants. 1 (3), 256-279 (2022).
- Fan, J., Rohrer, B., Moiseyev, G., Ma, J., Crouch, R. K. Isorhodopsin rather than rhodopsin mediates rod function in RPE65 knock-out mice. Proc Natl Acad Sci USA. 100 (23), 13662-13667 (2003).
- Sparrow, J. R. Bisretinoids of RPE lipofuscin: Trigger for complement activation in age-related macular degeneration. Adv Exp Med Biol. 703, 63-74 (2010).
- Różanowska, M., Handzel, K., Boulton, M. E., Różanowski, B. Cytotoxicity of all-trans-retinal increases upon photodegradation. Photochem Photobiol. 88 (6), 1362-1372 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados