Method Article
使用高效液相色谱定量分析小鼠眼部和非眼部组织中的膳食维生素 A 代谢物
摘要
在这里,描述了一种正相、高效液相色谱方法,用于检测和量化参与促进眼部和全身组织中视觉功能的关键类视黄醇,在全身维生素 A 供应的背景下产生必需的光敏视紫红质发色团 11-顺式-视黄醛。
摘要
G 蛋白偶联受体 (GPCR) 是跨膜蛋白的一个超家族,在与其配体结合时通过激活其 G 蛋白来启动信号级联反应。在所有哺乳动物的视觉中,视紫红质是负责启动光转导级联反应的 GPCR。在光感受器中,视紫红质与其发色团 11-顺式-视黄醛结合,并通过 11-顺式-视黄醛的光敏异构化为全反式视黄醛而被激活,从而激活转导素 G 蛋白,导致光转导级联反应。
虽然光转导已广为人知,但为眼睛中 11-顺式-视黄醛的生成提供膳食维生素 A 前体所涉及的过程,以及导致这种供应中断的疾病,尚不完全清楚。一旦维生素 A 前体被肠道吸收,它们就会以视黄酯的形式储存在肝脏中,并以与视黄醇结合蛋白 4 (RBP4) 结合的全反式视黄醇的形式释放到血液中。这种循环 RBP4-视黄醇将被全身器官吸收,例如肝脏、肺、肾脏和眼睛。因此,定量眼睛和全身器官中膳食维生素 A 的各种代谢物的方法对于研究正确的视紫红质 GPCR 功能至关重要。
在该方法中,我们提出了一种用于小鼠组织中维生素 A 分析的综合提取和分析方法。通过正相高效液相色谱分析,可以通过单次运行同时检测视黄醛、视黄醇和视黄酯的所有相关异构体,从而可以高效利用实验样品并提高同一样品中不同维生素 A 代谢物的内部可靠性。通过这种全面的方法,研究人员将能够更好地评估视紫红质 GPCR 功能中的全身维生素 A 供应。
引言
G 蛋白偶联受体 (GPCR) 是已知研究和特征最多的蛋白质超家族之一。在其最著名的功能中,GPCR 在信号转导中充当细胞表面受体,在与特定配体结合时初始化细胞内反应。GPCR 的特征是 7 个跨膜 (TM) 螺旋结构域和 6 个总环结构域。在这 6 个环中,3 个环向细胞外方向以促进配体结合,而其他 3 个细胞内环与由 Gα、Gβ 和 Gγ 亚基组成的异源三聚体 G 蛋白偶联 1,2。
GPCR 分为几类,包括 A 类视紫红质样、B 类促胰液素受体家族、C 类谷氨酸、D 类真菌交配信息素受体、E 类环状 AMP 受体和 F 类卷曲/平滑 3,4。顾名思义,GPCR 视紫红质样 A 类亚类包括视紫红质,这是负责光转导和视觉功能的关键 GPCR。视紫红质包含在 GPCR 经典模型中发现的所有相关关键特征和结构元件,包括前面提到的七个 TM 螺旋结构域、六个细胞外和细胞内环,以及与异源三聚体 G 蛋白的关联,在光感受器中也称为转导蛋白 (Gt) 1,5,6,7。在视紫红质的结合口袋内,光敏发色团配体 11-顺式-视黄醛通过共价席夫碱基键与赖氨酸 296 上的视紫红质结合,从而形成 11-顺式-视黄基 1,8。在光子吸收后,11-顺式-视黄基亚胺光异构化为全反式视黄基,诱导视紫红质内部的构象变化。因此,11-顺式-视黄醇配体对视紫红质 GPCR 的功能至关重要,必须持续维持稳健有效的 11-顺式-视黄醇供应,以克服光感受器内的高周转率。
视黄醛(如 11-顺式视黄醛)属于一组统称为类视黄醇的分子,而生物学相关的类视黄醇更广泛地被称为维生素 A。类视黄醇的特征是环状端基连接到共轭多烯链,另一端是极性端基。维生素 A 的视黄醛和相关的维生素单体也不例外,它们包含作为环状端基的β-紫罗兰酮环、二萜多烯链和取决于维生素的不同极性端基,即视黄醛的醛基、视黄醇的羟基、视黄酸的羧基、视黄酯的酯键, 等(图 1)9,10。
哺乳动物不能从头合成维生素 A,但植物可以;因此,哺乳动物系统中的所有类维生素 A 必须来自植物性生产者对食物链中消费者的饮食。在维生素 A 代谢的经典模型中,β-胡萝卜素(原型植物维生素原 A)通过清道夫受体 B 类成员 1 (SCARB1) 吸收到肠道上皮细胞中,被 β-胡萝卜素加氧酶 1 (BCO1/BCMO1) 裂解成两个全反式视网膜分子,它与视黄醛结合蛋白 2 (RBP2) 结合并还原为全反式-视黄醇被视黄醇脱氢酶 (RDH) 转化为视黄醇酯,被卵磷脂视黄醇酰基转移酶 (LRAT) 转化为视黄酯,然后在乳糜微粒11、12、13、14 中输送到血液中。另一方面,视黄酯,如棕榈酸视黄酯,是动物来源的主要维生素原 A。来自肠腔的棕榈酸视黄酯被羧酸酯酶 1 (CES1) 水解成全反式视黄醇,并扩散到肠上皮细胞15。肝脏是维生素 A 稳态的主要储存和稳态器官,它吸收这些乳糜微粒中的视黄酯,这些视黄酯被视黄酯水解成与细胞视黄醇结合蛋白 1 (CRBP1) 结合的全反式视黄醇,进入肝星状细胞并被 LRAT 转化回视黄酯储存13,16,17.为了维持生物体中维生素 A 的稳态水平,肝脏以全反式视黄醇的形式释放维生素 A,这些维生素与血清转运复合物结合,由视黄醇结合蛋白 4 (RBP4) 和转甲状腺素蛋白 (TTR) 组成15,18,19。这种复合物在本手稿中被称为 holo-RBP4。
为了在血液中使用这种全身性维生素 A 供应,全身组织,包括维持维生素 A 强大来源的眼组织,必须有一种将 holo-RBP4 吸收到组织中的方法。在眼组织中富含光感受器的视网膜中,受视黄酸 6 (STRA6) 刺激的膜受体是与此功能有关的转运蛋白。在机制研究中,STRA6 已被证明能够促进细胞外全反式视黄醇从 holo-RBP4 摄入 RPE20。然后,这种进口的全反式视黄醇将进入视觉周期,这是全反式视黄醇在 RPE 和感光器外段转化为 11-顺式视黄醇的过程,从而在与视紫红质结合时促进视觉功能 9,21。
一旦来自循环全息 RBP4 的全反式视黄醇通过 STRA6 穿过血视网膜屏障进入眼组织内的 RPE,RPE 中的全反式视黄醇首先通过 LRAT 酯酯化成视黄酯,然后被视网膜色素上皮特异性 65 kDa 蛋白 (RPE65) 水解成 11-顺式视黄醇。然后 11-顺式-视黄醇被视黄醇脱氢酶 5 转化为 11-顺式-视黄醇。然后,这种 11-顺式-视黄醛被光感受器间类视黄醇结合蛋白 (IRBP) 带入光感受器的外段 (OS) 9,21。在外核层 (ONL) 内围绕感光细胞核的内质网中,视蛋白 GPCR 合成并通过连接纤毛 (CC) 运输。参与这种跨 CC 运输的运动蛋白是有争议的,但目前的假设表明基于驱动蛋白和动力蛋白的鞭毛内运输 (IFT) 或基于肌球蛋白的运输可能是这一过程的促进因素 14,22,23,24,25,26。一旦这两个成分在 OS 内的膜盘内相遇,11-顺式-视黄醛和视蛋白就会通过视紫红质上赖氨酸 196 处的 Schiff 碱共价键形成 11-顺式-视黄基,为光转导做好准备8。
虽然 STRA6 在视网膜 RPE 内的表达有助于促进从 holo-RBP4 摄入全反式视黄醇,但未发现 STRA6 在肝脏中表达,尽管它作为维生素 A 的主要稳态器官发挥作用,并表现出从 holo-RBP4 摄入全反式视黄醇的能力 15,19,27,28, 29,30,31.最终,发现了一种称为视黄醇结合蛋白 4 受体 2 (RBPR2) 的类似受体,它表现出从 holo-RBP4 中摄取全反式视黄醇的能力,与 STRA6 非常相似,但在肝组织中表达32。
因此,要完全了解视紫红质在视觉功能中的作用,就需要了解最终导致视觉色素再生的生物过程。反过来,这与前面描述的过程密切相关,包括维生素原 A 前体的代谢、肝脏内的储存、肝脏释放 holo-RBP4 以及最终通过 STRA6 和 RBPR2 膜受体摄取 holo-RBP4。如上所述,小鼠等动物模型仍然是研究此类过程的主要模型之一。因此,我们想提出一种小鼠组织中类视黄醇的提取方法,以及一种可以检测和定量这些类视黄醇的正相高效液相色谱 (HPLC) 方法。使用这些方法,可以分析眼、肝和全身器官中上述重要的类视黄醇,例如 11-顺式-视网膜视紫红质配体或主要转运类视黄醇全反式视黄醇。通过评估小鼠组织中的类视黄醇供应,我们可以进一步加深对与类视黄醇物流供应相关的疾病状态和病理的理解。
除了通过与视蛋白 GPCR 结合在视觉功能中起发色团的作用外,类视黄酸还通过视黄酸信号传导在哺乳动物细胞信号传导中发挥重要作用,这由两个核受体家族,即视黄酸受体 (RAR) 和类视黄醇 X 受体 (RXR) 促进,它们直接与 DNA 结合并调节基因转录33.这两个家族或受体都利用视黄酸形式的类视黄醇作为配体。RAR 已被证明对全反式维甲酸和 9-顺式-维甲酸均具有亲和力,而 RXR 仅对 9-顺式-维甲酸表达亲和力34,35。数量不受控制的视黄酸具有致畸性,视黄酸信号转导必须受到极其严格的控制36。用于信号传导的视黄酸的产生必须在局部和非常特定的时间点发生,以实现组织的正常发育,例如后脑和肢体发育,但无数其他例子利用视黄酸信号传导37,38。在参与视黄酸信号传导的细胞内,视黄酸由两组酶合成,醇/视黄醇脱氢酶 (ADH/RDH) 促进 STRA6 或 RBPR2 吸收的视黄醇氧化成视黄醛,以及视黄醛脱氢酶 (RALDH) 促进视黄醛氧化为视黄酸39。虽然视黄酸本身不参与 GPCR 信号传导,但视黄酸仍然作为一种关键的类视黄醇存在,它也作为信号受体的配体发挥作用。
虽然这里没有详细描述,但我们想承认以前在各种情况下使用 HPLC 检测类视黄醇的方法,例如在食品研究和微生物视紫红质研究中。这些方法采用不同的目标和方法进行类视黄醇检测,包括使用需要较少挥发性和危险性流动相的反相技术 40,41,42,检测视黄酸及其相关异构体40,41,以及从不同生物来源进行纯化和提取43.我们的方法特别侧重于检测哺乳动物组织中的棕榈酸视黄酯、视黄醛异构体和视黄醇异构体。如果预期用例与此特定应用程序不同,则应考虑不同的协议。
研究方案
注意:所有动物实验均已获得明尼苏达大学机构动物护理和使用委员会 (IACUC) 的批准(协议 # 2312-41637A),并按照 ARVO 关于在眼科和视觉研究中使用动物的声明进行。在黑暗中,在昏暗的红光下进行所有提取。注意仪器显示器和附件 LED 发出的残余光。
1. 分光光度法类视黄醇标准生成和外部标准曲线生成
注:在使用 HPLC 分析之前,准备一个干冰容器用于临时储存类维生素 A。
- 称取任意但适量的类视黄醇,并将其溶解在适当的溶剂中,以便通过分光光度法进行定量。
注:本研究中使用的溶剂是乙醇,溶于乙醇的类维生素 A 的摩尔吸收值详见 表 1。必须使用无水 HPLC 级乙醇来溶解标准品和样品。仅通过蒸馏纯化的乙醇与水形成共沸混合物,体积含水量约为 4%。水与己酸流动相不混溶,会导致硅胶固定相水合,最终导致色谱柱降解。 - 利用比尔-朗伯定律和相关类视黄醇的摩尔吸收率,定量生成的标准品的浓度(表 1)。
吸光度 = 摩尔吸收率 (ε) × 摩尔浓度 × 光程长度 - 进行连续稀释,以产生可在所需组织定量范围内生成标准曲线的浓度。
注意:请注意比尔-朗伯定律的基本局限性,例如它在高浓度分析物中缺乏有效性。为避免此问题,稀释的类维生素 A 标准品应避免产生大于 1 的吸光度值。对于小鼠器官中视黄醇和视黄醛定量的应用,我们发现 1-10 ng 范围的校准曲线能够覆盖发现的典型数量。对于小鼠肝脏的棕榈酸视黄酯定量,我们发现 20-80 μg 的校准曲线能够覆盖发现的典型量。 - 通过逐渐改变先前制备的储备液的进样体积,从而逐渐改变类视黄醇的进样量,对峰进行积分以生成适用于类视黄醇定量的外部标准曲线,其中峰积分与进样的类视黄醇量成正比。
2. 组织收获和样本采集
注意:准备一个干冰容器,用于在组织匀浆和类视黄醇提取之前临时储存组织。推荐的组织收获量详见 表 2。为了解释由于每个组织血液含量的变化而导致的类维生素 A 变异,应在完全灌注的小鼠上进行组织提取,并且应在单独的小鼠上完成血液提取。
- 按照机构动物护理和使用委员会 (IACUC) 规定的方案(此处为 CO2 窒息)制定的指南对小鼠实施安乐死。
- 血液:安乐死后立即用剪刀将小鼠斩首,并将小鼠主干的血液排入 1.5 mL 试管中。
- 眼睛:使用一把镊子,从被斩首的头部中取出眼睛。
- 大脑:用一把小剪刀,切入被斩首的头部,用一把镊子取出大脑。
- 肾、肝、脾、心、肺:用一把小剪刀在腹部切开,沿中线向上切开,切开胸骨和胸腔。使用一对镊子去除暴露的组织。
3. 组织匀浆
注:如果需要分析较小的器官分区,例如较大的器官(例如,肝脏或肺组织),则应将整个器官匀浆,以避免组织不同部分的类维生素 A 含量差异。相反,如果需要少量组织,请分配匀浆。 图 2 中详细介绍了该协议的原理图。这个修改后的协议改编自 Kane 和 Napoli44。
- 将组织与 50% 冰冷的盐水 (0.9%) 和 50% 甲醇一起放入组织研磨管中。有关每种组织类型使用的体积,请参见 表 2 。
- 将研杵放入研磨管中,用研杵缓慢而轻柔地旋转五圈以获得匀浆。
- 均质化后立即将样品转移至 15 mL 试管中。
- 加入 2 mL 甲醇,在室温下静置 15 分钟。
注:如果需要分析视黄醛肟衍生物,请在 0.1 M HEPES (pH 6.5) 中加入 1 mL 0.1 M 羟胺盐酸盐(图 1)。
4. 类视黄醇提取
注意:己烷高度易燃、极易挥发且剧毒。处理己烷时,必须使用美国国家职业安全与健康研究所 (NIOSH) 批准的呼吸器、护目镜、丁基手套和通风橱。从样品中蒸发己烷时,建议使用某种形式的增强型空气循环装置,以防止溶剂烟雾积聚,例如,通气管抽吸装置。
- 向匀浆中加入 10 mL 己烷并涡旋混合试管至少 10 秒。
注意:各相充分混合至关重要。 - 将匀浆/己烷混合物以 1,000 × g 离心 3 分钟,以促进相分离。
- 进行提取 2 次以确保从匀浆中完全提取类维生素 A。重复步骤 4.1 和 4.2。
- 使用移液器吸出己烷层,并将己烷层放入一组单独的 15 mL 玻璃管中进行真空蒸发。
注:对于蒸发,请使用 GLASS 15 mL 试管,以避免类视黄醇粘附到试管壁上。 - 使用真空离心机,完全蒸发己烷。
5. 重悬和 HPLC 分析
注:由于本手稿中使用的 HPLC 系统是二元泵系统,因此在操作前将四组分流动相预混合到一个瓶子中。
注意:该方法中使用的所有四种有机溶剂都是高度易燃、高挥发性和剧毒的。1,4-二恶烷在暴露于氧气时易形成爆炸性过氧化物。不使用时,请保持所有含有 1,4-二恶烷的容器密闭。处理这些溶剂时,必须使用美国国家职业安全与健康研究所 (NIOSH) 批准的呼吸器、护目镜、丁基手套和通风橱。在 HPLC 中运行这些溶剂时,建议使用某种形式的增强型空气循环装置,以防止溶剂烟雾积聚,例如通气管抽吸装置。
- 用 100 μL 己烷重悬干燥的 15 mL 试管;充分涡旋以确保所有类视黄醇都溶解。
- 将所有 100 μL 己烷移液到单个玻璃插件中进行 HPLC 分析。
- 设置 HPLC 运行(改编自 Landers 和 Olson45):流动相:85.4% 己烷 (v/v)、11.2% 乙酸乙酯 (v/v)、2% 二恶烷 (v/v)、1.4% 1-辛醇 (v/v);色谱柱:两根 4.6 mm 内径 x 250 nm、5 μm 色谱柱,串联;a 多柱恒温器温度:25 °C;进样量:100 μL;流速:1 mL/min;片长: 40 min.使用紫外光谱吸光度检测;保持选中此选项以采集 200 nm 至 400 nm 的 UV 光谱。
6. 峰识别和积分
- 使用从类视黄醇标准品分析中观察到的每种目标类视黄醇的保留时间和 UV 谱图来识别峰(图 3、表 3 和表 4)。
- 使用所选 HPLC 系统的色谱数据系统,对鉴定出的峰进行积分。积分或曲线下面积与分析物的量成正比。参考步骤 1 中生成的外部标准曲线以定量分析物。
- 对于生物组织生成的色谱图的分析,请使用手动积分,而不是典型色谱数据系统提供的自动积分,因为在此类样品中经常观察到保留时间等参数的变化。
- 确保色谱图没有出现可能表明运行过程中出现问题的不规则性,例如基线噪声或非高斯峰。这些问题表明 HPLC 中存在污染物或色谱柱磨损,应进行纠正以进行有效分析。
结果
在这里,我们利用上述方法来检测和量化小鼠、眼部和全身组织中的类视黄醇,并生成具有代表性的色谱图。我们还将总结可以在这些组织中检测到的典型类视黄醇。
在 6 个月大时,小鼠通过 CO2 窒息被安乐死。为了维持眼部类维生素 A 含量,小鼠在安乐死和提取前暗适应 2 天。收获两只眼睛、0.2 g 肝脏和 75 μL 血液用于类维生素 A 提取和随后的 HPLC 分析。对于眼组织,一只眼睛在不添加羟胺的情况下被提取,而另一只眼睛则进行羟胺处理。对于肝脏和血液,不需要羟胺处理,因为在这些组织中通常不会检测到视黄醛。
在未用羟胺处理的小鼠眼的色谱图中,鉴定出 13-顺式-视黄醛,两种非经典视黄醛异构体之一。此外,还鉴定了两种经典视黄醛异构体 11-顺式-视黄醛和全反式视黄醛。在两张色谱图中,均鉴定出视觉循环中间体 11-顺式视黄醇以及主要维生素 A 转运形式全反式视黄醇(图 4A)。
在用羟胺处理的小鼠眼睛的色谱图中,所有先前提到的视黄醛异构体仍然存在。然而,这些异构体的保留时间显著增加。此外,这些视黄醛异构体现在以 syn 和 抗 异构体的形式存在。在通过峰积分进行定量时,必须对 syn 峰和 anti 峰求和才能获得准确的积分值。11-顺式视黄醇和全反式视黄醇仍然存在(图 4B)。
在小鼠肝组织的色谱图中,在这些组织中鉴定出棕榈酸视黄酯和全反式视黄醇。棕榈酸视黄酯是一种视黄酯,是哺乳动物体内维生素 A 的主要储存形式,在哺乳动物肝组织中可大量存在。肝脏以 holo-RBP4 的形式将维生素 A 释放到全身组织中,在 RBP4-transthryetin 复合物中含有全反式视黄醇。随后,可以在该色谱图中鉴定出一个大的全反式视黄醇峰(图 4C)。
在小鼠血液的色谱图中,鉴定出一个大的全反式视黄醇峰。鉴于肝脏的 holo-RBP4 通过循环系统释放到全身组织,这符合预期(图 4D)。类视黄醇亚型在时间依赖性分离的 HPLC 峰上的特征紫外光谱吸光度 (~250-400 nm) 有助于初步交叉确认特定相应峰中存在的亚型的质量(图 5)。

图 1:类维生素 A 的化学结构。 (A) 这些类视黄醇通常存在于提取的小鼠组织中。注意不同的极性末端基团,以及类视黄醇异构体中 顺式 双键的不同位置。(B) 视黄醛转化为视黄醛肟可提高提取效率,防止峰与棕榈酸视黄酯共洗脱,以及视黄醛异构体内的共洗脱。 请单击此处查看此图的较大版本。

图 2:组织收获、匀浆、类维生素 A 提取和分析的工作流程。 对暗适应小鼠的视网膜和组织样本进行匀浆和提取。步骤1:根据指南对小鼠实施安乐死后,收集血液和各种组织。步骤 2-4:然后用盐水和甲醇进行组织匀浆,用盐酸羟胺进行定量分析。步骤 5-7:使用己烷处理类视黄醇,然后蒸发。步骤 8,9:用 100 μL 己烷重悬,以确保所有类视黄醇都溶解。步骤10:最后,使用 HPLC 分析样品。简称:HPLC = High-performance Liquid Chromatography。请单击此处查看此图的较大版本。

图 3:类视黄醇标准品和羟胺处理的类视黄醇标准品的色谱图。(A) 该色谱图包含棕榈酸视黄酯、13-顺式-视黄醇、11-顺式-视黄醇、11-顺式-视黄醇、13-顺式-视黄醇和全反式视黄醇标准品。(B) 该色谱图包含棕榈酸视黄酯、13-顺式-视黄醇、11-顺式-视黄醇、全反式视黄醇、11-顺式视黄醇、13-顺式视黄醇和全反式视黄醇标准品。该色谱图除了包含视黄醇异构体外,还包含 syn 和抗肟视黄醛异构体。请单击此处查看此图的较大版本。

图 4:代表性色谱图。(A) 小鼠眼组织的代表性色谱图。该色谱图包含通常在小鼠眼组织中发现的类视黄醇,包括视黄醛异构体以及视黄醇异构体。(B) 羟胺处理的小鼠眼组织的代表性色谱图。请注意,除了视黄醇异构体外,该色谱图还包含syn和抗肟视黄醛异构体,而不是之前色谱图中发现的非化学修饰视黄醛(图4A)。(C) 小鼠肝组织的代表性色谱图。该色谱图包含通常在小鼠肝组织中发现的类视黄醇,包括棕榈酸视黄酯和全反式视黄醇。 (D) 小鼠血液的代表性色谱图。该色谱图包含通常在小鼠血液中发现的类视黄醇,包括全反式视黄醇。请点击此处查看此图的较大版本。
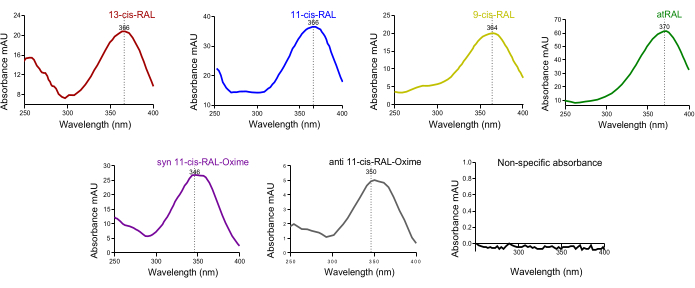
图 5:小鼠眼组织中视黄醛异构体的紫外吸光度光谱。 (A) 13-顺式-视黄醛、(B) 11-顺式-视黄醛、(C) 9-顺式-视黄醛、(D) 全反式视黄醛、(E) syn 11-顺式-视黄醛肟、(F) 抗 11-顺式-视黄醛肟的吸光度光谱。 请单击此处查看此图的较大版本。

图 6:HPLC 模块、流动相流和其他仪器概述。 流动相流从准备好的溶剂瓶开始,由二元泵在高压下泵入自动进样器,分析物被掺入溶剂流中。流动相和分析物到达温度调节柱温箱,最后进入二极管阵列检测器进行测量。(A) 红色监测屏幕,最大限度地减少类视黄醇的光异构化。(B) 二元泵。(C) 样品瓶取样器。(D) 多塔恒温器。(E) 二极管阵列探测器。(F) 分析馏分收集器。(G) 高密度聚乙烯废物容器。(H) 从左到右:铝制钳口盖、带聚合物支脚的 250 μL 内插管、琥珀色钳口样品瓶、注射样品瓶的最终组件。(I) 左图,冷冻离心机。右图为离心浓缩器。 请单击此处查看此图的较大版本。
| 复合 | 摩尔吸收率 (ε) | 溶剂 | 参考 |
| 棕榈酸视黄酯 | 49260 | 乙醇 | Hubbard 等人49 |
| 13-顺式视黄醛 | 35500 | 乙醇 | Hubbard 等人49 |
| 11-顺式视黄醛 | 24935 | 乙醇 | Hubbard 等人49 |
| 9-顺式视黄醇 | 36100 | 乙醇 | Robeson 等人51 |
| 全反式视网膜 | 42880 | 乙醇 | Hubbard 等人49 |
| 11-顺式视黄醇 | 34890 | 乙醇 | Hubbard 等人49 |
| 13-顺式视黄醇 | 48305 | 乙醇 | Robeson 等人50 和 Robeson 等人51 |
| 全反式视黄醇 | 52770 | 乙醇 | Hubbard 等人49 |
表 1:类维生素 A 在乙醇中的摩尔吸收率。 从 Kane 和 Napoli44、Hubbard 等人46、Robeson 等人47 和 Robeson 等人48 中收集了类维生素 A 的摩尔吸收值。摩尔吸收率取决于溶剂。此处列出的值特定于溶解在乙醇中的类视黄醇。
| 组织 | 组织收获量 | 均质体积 |
| 血 | 75 微升 | 不适用 |
| 肝 | 0.2 克 | 2 毫升 |
| 肾 | 2 个全肾 | 2 毫升 |
| 皮肤 | 0.2 克 | 1 毫升 – 1.5 毫升 |
| 脾 | 1 个全脾 | 1 毫升 |
| 眼睛 | 两个 Retina,池 4 个 Retina | 1 毫升 |
| 脑 | 1 个全脑 | 2 毫升 |
| 心 | 1 全心 | 1 毫升 |
| 肺 | 0.2 克 | 2 毫升 |
表 2:每次分析的推荐组织数量。 根据 Kane 和 Napoli44 的建议,每次分析的组织数量以及 50% 冰冷盐水 (0.9%) 和 50% 甲醇用于组织匀浆的体积。
| 复合 | 保留时间 (min) | 最大紫外吸光度 (nm) |
| 棕榈酸视黄酯 | 5.177 | 326 |
| 13-顺式视黄醛 | 7.268 | 366 |
| 11-顺式视黄醛 | 7.691 | 366 |
| 9-顺式视黄醇 | 7.931 | 364 |
| 全反式视网膜 | 8.993 | 370 |
| 11-顺式视黄醇 | 17.003 | 318 |
| 13-顺式视黄醇 | 17.83 | 328 |
| 全反式视黄醇 | 23.933 | 326 |
表 3:类维生素 A 的保留时间和最大吸光度波长。 当与所述方法和流动相一起使用时,观察到这些值,如使用参考二极管阵列检测器检测到的那样。
| 复合 | 保留时间 (min) | 最大紫外吸光度 (nm) |
| Syn 11-顺式-视黄醛肟 | 9.59 | 346 |
| 辛 全反式视黄醇肟 | 10.6 | 356 |
| Syn 13-顺式-视黄醇肟 | 11.3 | 352 |
| 抗 13-顺式-视黄醇肟 | 13 | 356 |
| 抗 11-顺式-视黄醇肟 | 15.1 | 350 |
| 反 全反式视黄醇肟 | 19.7 | 360 |
表 4:羟胺处理的视黄醛的保留时间和最大吸光度波长,导致每种视黄醛的 合成 异构体和 抗 肟异构体。 当与所述方法和流动相一起使用时,观察到这些值,如使用参考二极管阵列检测器检测到的那样。
讨论
在该方法中,正相 HPLC 用于检测和定量相关的类视黄醇,包括视黄酯、视黄醛和视黄醇。鉴于 11-顺式-视黄醛作为视紫红质 GPCR 激活的关键发色团的重要性,一种可以检测与 11-顺式-视黄醛产生相关的代谢物的方法对于整体视觉功能的研究至关重要。该方法的主要优点是,可以通过一次运行同时检测和定量视黄醛和视黄醇的所有相关异构体。鉴于活的实验组织是多么稀缺,这种方法允许在类视黄醇检测中有效利用组织。虽然据报道在分离类视黄醇49中使用了基于己烷和乙酸乙酯的流动相,但添加1,4-二恶烷和1-辛醇可提高类视黄醇异构体的分离度。1,4-二恶烷是 13-顺式-视黄醇和 11-顺式-视黄醇50 的分离所必需的,而 1-辛醇等长链醇进一步改善了视黄醇异构体 45,51,52 的分离。
对于视黄醛异构体的定量,需要事先用羟胺转化为相应的视黄醛肟,因为反应性醛基容易与其他生物分子(如蛋白质和脂质)反应 45,53,54。视黄醛肟更容易提取,并导致视黄醛峰在运行后期洗脱,从而防止与未知峰组和棕榈酸视黄酯峰共洗脱,该峰在 ~5-8 分钟时洗脱生物组织。用羟胺处理视黄醛还可以防止洗脱时间相似的视黄醛共洗脱45。转化为视黄醛肟会产生 syn 和抗异构体,它们在两个不同的时间洗脱,每个视黄醛异构体有两个不同的峰。必须对两个峰的积分求和,才能正确定量每种视黄醛异构体。除了保留时间之外,UV 谱图还提供了另一个可用于峰鉴定的指标。每种类视黄醇的最大紫外线吸光度略有不同。当与保留时间一起考虑时,这两个指标可以准确识别峰(表 3 和表 4)。
虽然眼组织中预计存在 11-顺式-视黄醛和全反式视黄醛异构体,其中 11-顺式-视黄醛是关键的视紫红质配体发色团,全反式视黄醛是光异构化配体,但其他非经典视黄醛异构体用这种方法检测。特别是,在我们的分析过程中,在小鼠眼组织的 HPLC 运行中很容易检测到 13-顺式-视黄醇(图 4A-D)。这些非经典视黄醛的出现并不完全出乎意料,然而,13-顺式-视黄醛和 9-顺式-视黄醛都是已知的副产物,由光诱导对视网膜产生的压力产生55,56。这些视黄醛异构体不参与已知的经典光转导级联途径,它们的代谢命运仍然相对未知。然而,9-顺式-视黄醛也被证明也可以稳定地与视紫红质的结合口袋结合,形成异视紫红质。异视紫红质的作用尚未完全表征,但研究表明,异视紫红质确实表现出光敏能力,就像基于 11-顺式-视红质的视紫红质57,58 一样。至少,9-顺式视黄醛稳定形成异视紫红质并光异构化成全反式视黄醛的能力为我们的 HPLC 分析中不存在它提供了一个合理的解释56。另一方面,13-顺式-视黄醛尚未显示参与任何已知的眼部生化途径,它在眼组织内的积累可能导致视网膜内的氧化应激 55,59,60。
虽然在小鼠组织中通常没有发现 9-顺式-视黄醛,但应该提到的是,羟胺处理的方法不是分离和定量 9-顺式-视黄醛的可行方法。 syn 9-顺式-视黄醛和 syn 13-顺式-视黄醇的峰将在 11.2 分钟时共洗脱。在预期大量 9-顺式-视黄醛的情况下,例如当外源性应用时,只能定量 9-顺式-视黄醛和 13-顺式-视黄醛的组合。对于定性鉴定,在不用羟胺处理组织的情况下执行该方法,可以完全分离 13-顺式-视黄醛和 9-顺式-视黄醇峰。
除了眼组织,这种方法也可以很容易地应用于全身组织。虽然在全身组织中通常不存在各种异构体形式的视黄醛,但与视黄醇结合蛋白 4 (holo-RBP4) 结合的全反式视黄醇是维生素 A 在哺乳动物生物体中的主要运输形式,使用这种方法可以很容易地在血液中检测到全反式视黄醇。除了血液,通常也可以在所有全身组织中检测到全反式视黄醇。因此,使用这种方法,可以使用这种方法创建完整的全身组织范围的类视黄醇概况。
由于视黄醛,尤其是关键的视紫红质配体 11-顺式-视黄醛,极易发生光异构化,因此在上述任何步骤中采取预防措施以防止意外暴露在光线下至关重要。除了来自室内照明和仪表板的明显光源外,我们还发现,来自各种仪器中附件 LED 的错误光,例如仪器后面的 LED,包括 HPLC 本身,是意外曝光的主要光源(图 6)。此外,我们发现专用暗室对于正确处理视黄醛异构体和实验组织至关重要。除了光最小化外,我们建议在安乐死和收获后迅速处理组织,因为即使在没有光线的情况下也会发生视黄醛异构体的降解。理想情况下,组织收获、提取和 HPLC 分析都应在同一天完成。
未立即处理的组织必须在 -80 °C 的黑暗中储存,并且在处理前不应储存超过一周。如上所述,上述方法中流动相和萃取步骤中使用的所有溶剂都具有剧毒、易挥发和易燃。处理这些有害溶剂时,必须使用适当的程序和设备。在溶剂处理之前,必须穿戴适当的个人防护装备 (PPE),例如丁基手套、NIOSH 批准的呼吸器和护目镜,并且所有溶剂转移必须在通风橱内进行。请注意,1,4-二恶烷在暴露于氧气时容易形成爆炸性过氧化物,并应保持所有装有 1,4-二恶烷的溶剂容器与空气密闭。
如果正相 HPLC 方法由于材料或设备不足而不可行,则确实存在更典型的反相方法,使用挥发性较低的溶剂(如乙腈和水)来检测和定量视黄醛和视黄醇。然而,这些方法不能分离异构体,只能检测总视黄醛或总视黄醇44,54。
披露声明
作者声明没有利益冲突。
致谢
这项工作得到了 NIH-NEI 赠款(EY030889 和 3R01EY030889-03S1)的支持,部分由明尼苏达大学对 GPL 的启动基金支持。我们还要感谢美国国家眼科研究所为我们提供本手稿中使用的 11-顺式-视网膜标准品。
材料
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| 1-Octanol, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 203-917-6 | |
| 1,4-Dioxane, suitable for HPLC, ≥99.5% | Sigma-Aldrich, Millipore Sigma | 204-661-8 | |
| 11-cis-retinal | National Eye Institute | N/A | |
| 11-cis-Retinol | Toronto Research Chemicals | TRC-R252105 | |
| 13-cis-retinal | Toronto Research Chemicals | TRC-R239900 | |
| 13-cis-retinol | Toronto Research Chemicals | TRC-R252110 | |
| All-trans-Retinal | Toronto Research Chemicals | TRC-R240000 | |
| All-trans-Retinol | Toronto Research Chemicals | TRC-R252002 | |
| Ethyl Acetate, suitable for HPLC, ≥99.7% | Sigma-Aldrich, Millipore Sigma | 205-500-4 | |
| Hexane, HPLC Grade | Fisher Scientific, Spectrum Chemical | 18-610-808 | |
| Methanol (HPLC) | Fisher Scienctific | A452SK-4 | |
| Retinyl Palmitate | Toronto Research Chemicals | TRC-R275450 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| Instruments | |||
| 1260 Infinity II Analytical Fraction Collector | Agilent | G1364F | |
| 1260 Infinity II Binary Pump | Agilent | G7112B | |
| 1260 Infinity II Diode Array Detector | Agilent | G7115A | |
| 1260 Infinity II Multicolumn Thermostat | Agilent | G7116A | |
| 1260 Infinity II Vialsampler | Agilent | G7129A | |
| ST40R Refrigerated Centrifuge | Thermo Scientific | TSST40R | |
| Vacufuge Plus Centrifuge Concentrator | Eppendorf | 22820168 | |
| Consumables | |||
| 2 mL Amber Screw Top Vials | Agilent | 5188-6535 | |
| Crimp Cap with PTFE/red rubber septa, 11 mm | Agilent | 5183-4498 | |
| Disposable Glass Conical Centrifuge Tubes | Millipore Sigma | CLS9950215 | |
| Screw cap tube, 15 mL | Sarstedt | 62.554.502 | |
| Vial insert, 150 µL, glass with polymer feet | Agilent | 5183-2088 |
参考文献
- Palczewski, K., et al. Crystal structure of rhodopsin: A G protein-coupled receptor. Science. 289 (5480), 739-745 (2000).
- Rosenbaum, D. M., Rasmussen, S. G. F., Kobilka, B. K. The structure and function of G-protein-coupled receptors. Nature. 459 (7245), 356-363 (2009).
- Alhosaini, K., Azhar, A., Alonazi, A., Al-Zoghaibi, F. GPCRs: The most promiscuous druggable receptor of the mankind. Saudi Pharm J. 29 (6), 539-551 (2021).
- Hu, G. -. M., Mai, T. -. L., Chen, C. -. M. Visualizing the GPCR network: Classification and evolution. Sci Rep. 7 (1), 15495 (2017).
- Lerea, C. L., Somers, D. E., Hurley, J. B., Klock, I. B., Bunt-Milam, A. H. Identification of specific transducin α subunits in retinal rod and cone photoreceptors. Science. 234 (4772), 77-80 (1986).
- Gao, Y., Hu, H., Ramachandran, S., Erickson, J. W., Cerione, R. A., Skiniotis, G. Structures of the rhodopsin-transducin complex: Insights into G protein activation. Mol Cell. 75 (4), 781-790.e3 (2019).
- Zhou, X. E., Melcher, K., Xu, H. E. Structure and activation of rhodopsin. Acta Pharmacol Sin. 33 (3), 291-299 (2012).
- Robinson, P. R., Cohen, G. B., Zhukovsky, E. A., Oprian, D. D. Constitutively active mutants of rhodopsin. Neuron. 9 (4), 719-725 (1992).
- Kiser, P. D., Golczak, M., Palczewski, K. Chemistry of the retinoid (visual) cycle. Chem Rev. 114 (1), 194-232 (2014).
- Sani, B. P., Hill, D. L. [3] Structural characteristics of synthetic retinoids. Methods Enzymol. 189, 43-50 (1990).
- Lobo, G. P., Amengual, J., Palczewski, G., Babino, D., von Lintig, J. Carotenoid-oxygenases: Key players for carotenoid function and homeostasis in mammalian biology. Biochim Biophys Acta. 1821 (1), 78-87 (2012).
- Amengual, J., et al. Two carotenoid oxygenases contribute to mammalian provitamin A metabolism. J Biol Chem. 288 (47), 34081-34096 (2013).
- Harrison, E. H. Mechanisms involved in the intestinal absorption of dietary vitamin A and provitamin A carotenoids. Biochim Biophys Acta. 1821 (1), 70-77 (2012).
- Leung, M., et al. The logistical backbone of photoreceptor cell function: Complementary mechanisms of dietary vitamin A receptors and rhodopsin transporters. Int J Mol Sci. 25 (8), 4278 (2024).
- Martin Ask, N., Leung, M., Radhakrishnan, R., Lobo, G. P. Vitamin A transporters in visual function: A mini review on membrane receptors for dietary vitamin A uptake, storage, and transport to the eye. Nutrients. 13 (11), 3987 (2021).
- Harrison, E. H. Carotenoids, β-apocarotenoids, and retinoids: The long and the short of it. Nutrients. 14 (7), 1411 (2022).
- Li, Y., Wongsiriroj, N., Blaner, W. S. The multifaceted nature of retinoid transport and metabolism. Hepatobiliary Surg Nutr. 3 (3), 126-139 (2014).
- D'Ambrosio, D. N., Clugston, R. D., Blaner, W. S. Vitamin A metabolism: An update. Nutrients. 3 (1), 63-103 (2011).
- Yamamoto, Y., et al. Interactions of transthyretin (TTR) and retinol-binding protein (RBP) in the uptake of retinol by primary rat hepatocytes. Exp Cell Res. 234 (2), 373-378 (1997).
- Kawaguchi, R., et al. A membrane receptor for retinol binding protein mediates cellular uptake of vitamin A. Science. 315 (5813), 820-825 (2007).
- Kiser, P. D., Golczak, M., Maeda, A., Palczewski, K. Key enzymes of the retinoid (visual) cycle in vertebrate retina. Biochim Biophys Acta. 1821 (1), 137-151 (2012).
- Radhakrishnan, R., et al. The role of motor proteins in photoreceptor protein transport and visual function. Ophthalmic Genet. 43 (3), 285-300 (2022).
- Solanki, A. K., et al. Loss of motor protein MYO1C causes rhodopsin mislocalization and results in impaired visual function. Cells. 10 (6), 1322 (2021).
- Liu, X., Udovichenko, I. P., Brown, S. D. M., Steel, K. P., Williams, D. S. Myosin VIIa participates in opsin transport through the photoreceptor cilium. J Neurosci. 19 (15), 6267-6274 (1999).
- Insinna, C., Besharse, J. C. Intraflagellar transport and the sensory outer segment of vertebrate photoreceptors. Dev Dyn. 237 (8), 1982-1992 (2008).
- Krock, B. L., Mills-Henry, I., Perkins, B. D. Retrograde intraflagellar transport by cytoplasmic dynein-2 is required for outer segment extension in vertebrate photoreceptors but not arrestin translocation. Invest Ophthalmol Vis Sci. 50 (11), 5463-5471 (2009).
- Blaner, W. S. STRA6, a cell-surface receptor for retinol-binding protein: The plot thickens. Cell Metab. 5 (3), 164-166 (2007).
- Bouillet, P., et al. Developmental expression pattern of Stra6, a retinoic acid-responsive gene encoding a new type of membrane protein. Mech Dev. 63 (2), 173-186 (1997).
- Blomhoff, R., Norum, K. R., Berg, T. Hepatic uptake of [3H]retinol bound to the serum retinol binding protein involves both parenchymal and perisinusoidal stellate cells. J Biol Chem. 260 (25), 13571-13575 (1985).
- Kelly, M., von Lintig, J. STRA6: role in cellular retinol uptake and efflux. Hepatobiliary Surg Nutr. 4 (4), 229-242 (2015).
- Quadro, L., et al. The role of extrahepatic retinol binding protein in the mobilization of retinoid stores. J. Lipid Res. 45 (11), 1975-1982 (2004).
- Alapatt, P., et al. Liver retinol transporter and receptor for serum retinol-binding protein (RBP4). J Biol Chem. 288 (2), 1250-1265 (2013).
- Chawla, A., Repa, J. J., Evans, R. M., Mangelsdorf, D. J. Nuclear receptors and lipid physiology: Opening the X-files. Science. 294 (5548), 1866-1870 (2001).
- Heyman, R. A., et al. 9-cis retinoic acid is a high affinity ligand for the retinoid X receptor. Cell. 68 (2), 397-406 (1992).
- Allenby, G., et al. Retinoic acid receptors and retinoid X receptors: interactions with endogenous retinoic acids. Proc Natl Acad Sci USA. 90 (1), 30-34 (1993).
- Das, B. C., et al. Retinoic acid signaling pathways in development and diseases. Bioorg Med Chem. 22 (2), 673-683 (2014).
- Hernandez, R. E., Putzke, A. P., Myers, J. P., Margaretha, L., Moens, C. B. Cyp26 enzymes generate the retinoic acid response pattern necessary for hindbrain development. Development. 134 (1), 177-187 (2007).
- Yashiro, K., et al. Regulation of retinoic acid distribution is required for proximodistal patterning and outgrowth of the developing mouse limb. Dev Cell. 6 (3), 411-422 (2004).
- Duester, G. Families of retinoid dehydrogenases regulating vitamin A function. Eur J Biochem. 267 (14), 4315-4324 (2000).
- Tatum, V., Chow, C. K. Rapid measurement of retinol, retinal, 13-cis-retinoic acid and all-trans-retinoic acid by high performance liquid chromatography. J Food Drug Anal. 13 (3), (2020).
- Teerlink, T., Copper, M. P., Klaassen, I., Braakhuis, B. J. M. Simultaneous analysis of retinol, all-trans- and 13-cis-retinoic acid and 13-cis-4-oxoretinoic acid in plasma by liquid chromatography using on-column concentration after single-phase fluid extraction. J Chromatogr B. Biomed Sci App. 694 (1), 83-92 (1997).
- Egberg, D. C., Heroff, J. C., Potter, R. H. Determination of all-trans and 13-cis vitamin A in food products by high-pressure liquid chromatography. J Agric Food Chem. 25 (5), 1127-1132 (1977).
- Sudo, Y., et al. A microbial rhodopsin with a unique retinal composition shows both sensory rhodopsin II and bacteriorhodopsin-like properties. J Biol Chem. 286 (8), 5967-5976 (2011).
- Kane, M. A., Napoli, J. L. Quantification of endogenous retinoids. Methods Mol Biol. 652, 1-54 (2010).
- Landers, G. M., Olson, J. A. Rapid, simultaneous determination of isomers of retinal, retinal oxime and retinol by high-performance liquid chromatography. J Chromatogr A. 438, 383-392 (1988).
- Hubbard, R., Brown, P. K., Bownds, D. [243] Methodology of vitamin A and visual pigments. Methods Enzymol. 18, 615-653 (1971).
- Robeson, C. D., et al. Chemistry of vitamin A. XXIV. The synthesis of geometric isomers of vitamin A via methyl β-methylglutaconate1. J Am Chem Soc. 77 (15), 4111-4119 (1955).
- Robeson, C. D., Blum, W. P., Dieterle, J. M., Cawley, J. D., Baxter, J. G. Chemistry of vitamin A. XXV. Geometrical isomers of vitamin A aldehyde and an isomer of its α-ionone analog1. J Am Chem Soc. 77 (15), 4120-4125 (1955).
- Hubinger, J. C. Determination of retinol, retinyl palmitate, and retinoic acid in consumer cosmetic products. J Cosmet Sci. 60 (5), 485-500 (2009).
- Bhat, P. V., Co, H. T., Lacroix, A. Effect of 2-alkanols on the separation of geometric isomers of retinol in non-aqueous high-performance liquid chromatography. J Chromatogr A. 260, 129-136 (1983).
- Stancher, B., Zonta, F. Quantitative high-performance liquid chromatographic method for determining the isomer distribution of retinol (vitamin A1) and 3-dehydroretinol (vitamin A2) in fish oils. J Chromatogr. 312, 423-434 (1984).
- Zonta, F., Stancher, B. High-performance liquid chromatography of retinals, retinols (vitamin A1) and their dehydro homologues (vitamin A2): improvements in resolution and spectroscopic characterization of the stereoisomers. J Chromatogr A. 301, 65-75 (1984).
- van Kuijk, F. J., Handelman, G. J., Dratz, E. A. Rapid analysis of the major classes of retinoids by step gradient reversed-phase high-performance liquid chromatography using retinal (O-ethyl) oxime derivatives. J Chromatogr. 348 (1), 241-251 (1985).
- Kane, M. A., Folias, A. E., Napoli, J. L. HPLC/UV quantitation of retinal, retinol, and retinyl esters in serum and tissues. Anal Biochem. 378 (1), 71-79 (2008).
- Widjaja-Adhi, M. A. K., Ramkumar, S., von Lintig, J. Protective role of carotenoids in the visual cycle. FASEB J. 32 (11), 6305-6315 (2018).
- Ramkumar, S., Jastrzebska, B., Montenegro, D., Sparrow, J. R., von Lintig, J. Unraveling the mystery of ocular retinoid turnover: Insights from albino mice and the role of STRA6. J Biol Chem. 300 (3), 105781 (2024).
- de Grip, W. J., Lugtenburg, J. Isorhodopsin: An undervalued visual pigment analog. Colorants. 1 (3), 256-279 (2022).
- Fan, J., Rohrer, B., Moiseyev, G., Ma, J., Crouch, R. K. Isorhodopsin rather than rhodopsin mediates rod function in RPE65 knock-out mice. Proc Natl Acad Sci USA. 100 (23), 13662-13667 (2003).
- Sparrow, J. R. Bisretinoids of RPE lipofuscin: Trigger for complement activation in age-related macular degeneration. Adv Exp Med Biol. 703, 63-74 (2010).
- Różanowska, M., Handzel, K., Boulton, M. E., Różanowski, B. Cytotoxicity of all-trans-retinal increases upon photodegradation. Photochem Photobiol. 88 (6), 1362-1372 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。