Method Article
Primer İnsan Meme Epitel Hücrelerinin İzolasyonu ve Kültürü
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu çalışma, primer insan meme epitel hücrelerini (HMEC'ler) küçük miktarlarda meme dokusundan verimli bir şekilde izole etmek ve büyütmek için daha kolay, zaman kazandıran ve ekonomik bir protokol bildirmektedir. Bu protokol, hem laboratuvar hem de klinik uygulamalar için birincil HMEC'lerin hızlı bir şekilde üretilmesi için uygundur.
Özet
Meme bezi, memenin temel bir yapısıdır ve üremede önemli bir rol oynar. Meme kanseri ve diğer meme ile ilgili enflamatuar hastalıkların köken hücreleri olan insan meme epitel hücreleri (HMEC'ler) büyük ilgi görmüştür. Bununla birlikte, birincil HMEC'lerin araştırma amacıyla in vitro olarak izole edilmesi ve kültürlenmesi, oldukça farklılaşmış, keratinize yapıları ve kısa ömürleri nedeniyle zor olmuştur. Bu nedenle, HMEC'leri izole etmek ve kültürlemek için basit ve etkili bir yöntem geliştirmek, meme biyolojisi ve meme ile ilgili hastalıkların incelenmesi için büyük bilimsel değere sahiptir. Bu çalışmada, Rho ile ilişkili kinaz (ROCK) inhibitörü Y-27632 içeren %5'lik fetal sığır serumu-DMEM'de bir başlangıç kültürü ile birleştirilmiş bir enzim karışımı ile sindirim yoluyla küçük miktarlarda meme dokusundan primer HMEC'leri başarılı bir şekilde izole ettik ve ardından serumsuz keratinosit ortamında kültür genişletmesi izledik. Bu yaklaşım, epitel hücrelerinin büyümesini seçici olarak teşvik ederek optimize edilmiş bir hücre verimi ile sonuçlanır. Bu yöntemin basitliği ve rahatlığı, onu hem laboratuvar hem de klinik araştırmalar için uygun hale getirir ve bu da bu önemli çalışma alanlarına değerli bilgiler sağlamalıdır.
Giriş
Meme kanseri, tüm dünyada kadınlarda teşhis edilen birincil kanser türüdür ve kanserden ölümlerin birincil nedenidir1. Meme kanserinin patogenezi karmaşıktır ve genetik, çevre ve yaşam tarzı gibi birçok faktörü içerir. Aktif süt üreten hücreler olan HMEC'ler, meme dokusunun en önemli bileşenlerinden biridir ve muhtemelen meme kanseri karsinogenezinde yer alan orijinal hücrelerdir. Bu nedenle, HMEC'ler meme kanseri çalışması için araştırmacılardan en fazla ilgiyi görmüştür2. Ayrıca, birincil hücreler, genetik stabiliteyi, normal morfolojiyi ve ölümsüzleştirilmiş hücre dizileri ile elde edilemeyen daha eksiksiz bir temel hücresel işlevler setini korumaları nedeniyle karmaşık hücresel süreçlerin biyolojik olarak ilgili bir karakterizasyonunu sağlama yeteneğine sahiptir3. Bu nedenle, primer HMEC'lerin izolasyonu ve kültürü, meme kanseri ve meme inflamatuar hastalıkları gibi meme ile ilgili hastalıkların çoğunun incelenmesi için önemli bir adımdır.
Şu anda, sıçanlardan,, domuzlardan ve keçilerden meme epitel hücrelerinin izolasyonu, kültürü ve tanımlanması için kararlı ve tekrarlanabilir bir sistem kurulmuştur 4,5,6,7. Bununla birlikte, birincil HMEC'lerin izolasyonu ve kültürü, karmaşık mikro çevre ve düşük hücre verimi nedeniyle zordur. Onlarca yıldır bilim adamları, HMEC'ler için bir kültür sistemi yaklaşık 20 yıl önce kurulmuş olmasına rağmen, HMEC'leri izole etmek ve yetiştirmek için en etkili yöntemi arıyorlar. Örneğin, Hammond ve ark. HMEC'lerin verimli bir şekilde büyüdüğü serum içermeyen bir kültür ortamı geliştirdi8. Son zamanlarda, Zubeldia-Plazaola ve ark. HMEC'leri elde etmek için sıralı filtrasyon veya diferansiyel santrifüjleme adımları ile birlikte hızlı/yavaş enzim sindirim prosedürlerini kullanarak dört farklı izolasyon yöntemini test etti9. Diferansiyel santrifüjleme ile birlikte yavaş sindirim yönteminin, HMEC'leri taze meme dokusundan izole etmek için en etkili yöntem olduğunu buldular. Bununla birlikte, bu izolasyon yöntemi büyük doku parçaları (40-75 g) gerektirir ve daha büyük miktarlarda sindirim enzimleri kullanır. Prosedürleri karmaşıktır (farklı hücre fraksiyonları elde etmek için en az üç farklı santrifüjleme) ve zaman alıcıdır. Bu nedenle, araştırma ve klinik uygulamalar için küçük miktarlarda meme dokusundan HMEC popülasyonlarını verimli bir şekilde elde etmek için hala basit ve hızlı bir yönteme ihtiyaç vardır9.
Önceki çalışmalarımız, Rho ile ilişkili kinaz (ROCK) inhibitörü Y-27632'nin ilk kültür ortamına eklenmesinin, diş eti epitel hücrelerinin11 izolasyonu için de başarıyla kullanılan insan derisi epidermal hücrelerinin10 izole edilmesi sürecini basitleştirebileceğini göstermiştir. Ek olarak, Zubeldia-Plazaola'nın grubu ve Jin'in grubu tarafından yürütülen daha önceki araştırmalar, Y-27632'nin meme dokusundantüretilen primer epitel hücrelerinin hızlı ve sınırsız in vitro büyümesini uyarma yeteneğine sahip olduğunu göstermiştir 9,12. Bu çalışma, Y-27632 kullanımının HMEC'lerin izolasyonunu ve kültürünü basitleştirip basitleştirmeyeceğini test etmeyi amaçladı ve HMEC'leri küçük meme dokusu parçalarından (1 g) izole etmek için basit ve kolay uygulanabilir bir yöntemi başarıyla oluşturduk.
Protokol
Bu protokolde kullanılan taze normal meme dokuları, Zhejiang Çin Tıp Üniversitesi Birinci Bağlı Hastanesi'nde, Zhejiang Çin Tıp Üniversitesi Birinci Bağlı Hastanesi Tıbbi Etik Komitesi'nin yönergelerine göre refrakter granülomatöz lobüler mastit lezyonu etrafındaki cerrahiden toplanır (Protokol No. ChiMCTR2100005281, Tarih: 2017-07-17).
1. Doku edinimi
- Yetişkin kadınlardan alınan cerrahi örneklerden taze meme dokularını% 3 penisilin / streptomisin (P / S) içeren 10 mL fosfat tamponlu salin (PBS) içeren steril tüplere toplayın.
NOT: Meme dokuları, ameliyattan alındıktan sonraki 24 saat içinde aşağıdaki ayrıntılara göre ele alınmalıdır.
2. Dokunun ön tedavisi
- Yağ dokusunu meme dokusundan iki çift forseps ile çıkarın ve kalan meme dokusunun ~1 g ağırlığında olduğundan emin olun.
- Meme dokusunu 5 saniye boyunca% 75 etanol çözeltisinde (5 mL) durulayın ve ardından 20 mL yıkama çözeltisi (Tablo 1) ile 2 x 5 dakika yıkayın.
3. Dokunun sindirimi
- Meme dokusunu daha küçük parçalara bölün ve doku homojenatını elde etmek için 15 dakikalık bir süre boyunca iki cerrahi bıçak kullanarak dokuyu parçalayın. Doku parçalarını 50 mL'lik bir santrifüj tüpüne aktarın.
- Meme dokusu parçalarını içeren 50 mL'lik bir santrifüj tüpünde toplam 20 mL sindirim solüsyonuna 10 mL 5.0 mg / mL dispas + 5.0 mg / mL kollajenaz solüsyonu, 3 mL %0.25 tripsin ve 7 mL PBS ekleyin. Tüpü 37 ° C'de bir su banyosuna yerleştirin ve 1,5 saat inkübe edin; Tüpü her 20 dakikada bir çalkalayın.
- 20 mL nötralize edici solüsyon enjekte ederek sindirim işlemini durdurun. İçeriği ~15x pipetleyerek karıştırın.
- Karışımı 100 μm'lik bir gözenekli filtreden süzün. 156 × g'da 5 dakika santrifüjleyin.
- Süpernatanı çıkarın ve peletin inkübasyonunu 20 mL nötralize edici çözelti ile tekrarlayın. İçeriği 15x pipetleyerek karıştırın ve 156 × g'da 5 dakika santrifüjleyin.
- Süpernatanı dikkatlice çıkarın ve hücre peletini 10 mL başlangıç kültür ortamı ile yeniden süspanse edin. Hücre süspansiyonunu 100 mm'lik bir hücre kültürü kabına yerleştirin.
- Hücreleri 37 ° C'de% 5 CO2 inkübatörde yetiştirin. Orijinal kültür ortamını her üç günde bir taze epitel hücre ortamı ile değiştirin. Hücreleri kontrol edin ve ortamı her 2 günde bir yenileyin.
4. Hücre geçişi
- Hücreler %80-90 birleşime ulaştığında 100 mm'lik kabı inkübatörden çıkarın, kullanılan ortamı atın ve kabı 2 mL PBS ile 2 kez durulayın. PBS'yi çıkarın ve ardından her 100 mm'lik tabağa 2 mL% 0.05 tripsin ekleyin.
NOT: Tripsin çözeltisinin tabağın dibi ile yeterli temas ettiğinden emin olmak için tabağı döndürün. - Sindirim işlemi için 100 mm'lik kabı 37 °C'lik bir inkübatöre ~7 dakika yerleştirin.
- Hücrelerin çoğunun tabağın dibinden ayrıldığından emin olmak için 40x objektif kullanarak hücreleri mikroskopla inceleyin.
- 8 mL nötralize edici solüsyon ekleyerek sindirim işlemini durdurun ve hücreleri 15 mL'lik bir tüpe aktarın. Hücreleri 10-15 kat yukarı ve aşağı pipetleyerek karıştırın. Hücreleri 156 × g'da 5 dakika santrifüjleyin.
- Süpernatanı dikkatlice çıkarın, hücreleri 10 mL epitel hücre ortamı ile yeniden süspanse edin ve hücre sayısını sayın.
- 100 mm'lik bir tabakta 10 mL epitel hücre ortamında 1 ×10 6 hücre ekleyin.
- Epitel hücre ortamını yenileyin ve hücreleri her 2 günde bir gözlemleyin.
5. Hücre kriyoprezervasyonu
- 4.1-4.4 adımlarını tekrarlayın.
- Süpernatanı dikkatlice çıkarın ve hücreleri 2 mL hücre kriyoprezervasyon solüsyonunda yeniden süspanse edin.
- Hücreleri içeren kriyoprezervasyon solüsyonunun 1 mL'sini her bir kriyojenik şişeye aktarın.
- Dondurularak saklanmış hücrelerin adlarını, geçiş numaralarını ve tarihlerini kaydedin.
- Şişeleri gece boyunca -80 ° C'de kontrollü bir dondurma kabına koyun.
- Kriyojenik şişeleri -80 °C dondurucudan çıkarın ve uzun süreli saklama için hızlı bir şekilde sıvı nitrojene aktarın.
Sonuçlar
Şekil 1 , prosedürün bir şemasını göstermektedir. Protokol, dispas, kollajenaz ve tripsin gibi bir enzim kombinasyonunun kullanılmasını içerir. Bu kombinasyon, epitel tabakasını altındaki fibroblast tabakasından ayırmak ve daha sonra meme epitel hücrelerini bir süspansiyona ayırmak için tripsin kullanmak amacıyla kullanılır. Ek olarak, epitel hücrelerinin büyümesi, ilk kültür ortamına Y-27632 eklenerek etkili bir şekilde desteklendi. Sonuç olarak, bu yöntem, yalnızca ortalama 10 gün içinde geçiş gereksinimlerini karşılayan çok sayıda HMEC verir.
Y-27632'nin izolasyondan sonra hücre büyümesindeki önemli rolünü test etmek için, yeni izole edilmiş hücreleri iki gruba ayırdık: bir grup, 10 mM Y-27632 içeren başlangıç ortamı ile kaplandı (Şekil 2A); diğer grup, kontrol grubu olarak Y-27632 eklenmeden başlangıç ortamı ile kaplandı (Şekil 2B). 2 günlük kültürden sonra, her iki gruptaki hücreler epidermal hücre ortamına geçirildi (Şekil 1). Şekil 2'den, üçüncü güne kıyasla, Y-27632 ile yapılan yöntemin dokuzuncu günde HMEC sayısını gözle görülür şekilde artırdığını gözlemleyebiliriz. HMEC'ler, belirgin sınırları ve hücreler arasında güçlü bağlantıları olan bir adaya benzeyen uyumlu bir grup oluşturdu. Bu hücreler çevreye doğru genişledi. Y-27632 ile kaplanmış hücreler (Şekil 2A), kontrol grubundaki hücrelerden çok daha hızlı büyüdü (Şekil 2B). Y-27632'nin HMEC büyümesini arttırdığını doğrulamak için, donmuş P0 hücreleri çözüldü ve 10 mM Y-27632 eklenerek veya eklenmeden kaplandı ve geçiş 1 (P1) hücreleri, Şekil 3'te gösterildiği gibi farklı günlerde toplandı. Hücreler, hücre sayım kiti-8 (CCK-8) kullanılarak canlılık ve proliferasyon açısından analiz edildi. Şekil 3'te gösterildiği gibi, Y-27632 içeren ortamla muamele edilen hücrelerin büyüme hızı, Y-27632 içermeyen kontrol grubundaki hücrelerden önemli ölçüde daha yüksekti. Bu veriler bir araya getirildiğinde, ilk ortama Y-27632 ilavesinin, izolasyondan sonra bağlı hücrelerin büyümesini önemli ölçüde arttırdığı görülebilir.
Bu yöntemle elde edilen hücrelerin HMEC'ler olduğunu doğrulamak için, iki meme epitel hücresi belirteci için P0 HMEC'lerin immünofloresan analizini gerçekleştirdik: CK7 ve GATA3. Tanısal olarak önemli bir sitokeratin olan CK7, normal meme epitelinde glandüler farklılaşmanın ve proliferatif epitel süreçlerinin bir belirtecidir13. Ek olarak, Kouros-Mehr ve ark. GATA3'ün meme epitel hücreleri içinde bir transkripsiyon faktörü olarak işlev gördüğünü ve tam gelişmiş meme bezlerinde luminal epitel farklılaşmasının sürdürülmesinde rol oynadığını bildirmişlerdir14. Şekil 3'te gösterildiği gibi, kültürlediğimiz ve genişlettiğimiz hücreler hem CK7'yi (Şekil 4A) hem de GATA3'ü (Şekil 4B) güçlü bir şekilde ifade eder. Hem CK7- hem de GATA3 pozitif hücrelerin kantifikasyon analizi, hücrelerin% 98'inden fazlasının hem CK7 hem de GATA3 eksprese ettiğini gösterdi (Şekil 4C), bu da fibroblastlar gibi diğer hücre tiplerinin sınırlı kontaminasyonunu gösterir. Zaman zaman ilk kültürde sınırlı sayıda fibroblast benzeri hücre (uzamış morfoloji) gözlemledik (P0, Şekil 2), ancak bu hücrelerin pasajlı hücrelerde nadiren göründüğünü görüyoruz (P3, Şekil 4D).
HMEC'lerin epitel karakteristiğinin birkaç geçişten sonra korunup korunamayacağını test etmek için, Y-27632 ile veya Y-27632 olmadan kültürlenen hücrelerde meme epitel hücre belirteçleri CK7 ve GATA3'ün qRT-PCR analizini gerçekleştirdik (Şekil 5). Hem CK7 hem de GATA3'ün ekspresyon seviyeleri, Y-27632 olsun ya da olmasın, hem P0 hem de P3 hücrelerinde önemli ölçüde farklı değildi, bu da fenotipik ve farklılaşma özelliklerinin kültür genişlemesi sırasında zaman içinde değişmediğini gösterdi.
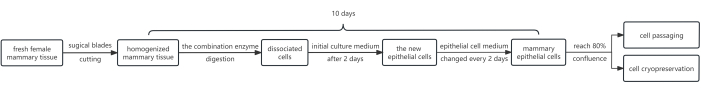
Şekil 1: HMEC'leri izole etmek ve kültürlemek için protokolün akış şeması. Başlangıçta, dişi meme dokusu parçaları cerrahi bıçaklarla dilimlendi ve bir enzim kombinasyonu ile sindirildi. Daha sonra, elde edilen hücre peletleri, 10 mM Y-27632 içeren ilk kültür ortamında kültürlendi. 2 gün sonra, ilk kültür ortamı epitel hücre ortamı ile değiştirildi. Meme epitel hücreleri, ~ 8 gün sonra tatmin edici bir kapsama elde etmek için epidermal hücre ortamında kültürlendi, şimdi pasaj için uygun. Gerekirse, bazı hücreler hücre kriyoprezervasyonuna tabi tutulabilir. Kısaltma: HMEC'ler = insan meme epitel hücreleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: İlk aşılamadan sonra elde edilen HMEC görüntüleri. Aşılamadan sonraki 2 gün içinde, (A) birincil HMEC'ler Y-27632 içeren başlangıç ortamında kültürlendi ve (B) birincil HMEC'ler, Y-27632 içermeyen başlangıç ortamında kültürlendi. 48 saatlik bir kültürleme periyodundan sonra, serumsuz keratinosit kültür ortamı her iki grupta da değiştirildi. Hücrelerin büyüme durumunu gün aşırı kaydetmek için fotoğraflar çekildi. Her iki temsili görüntü serisi, aşılamadan sonraki 3, 5 ve 9. günlerde ters mikroskop (100x) kullanılarak çekildi. Ölçek çubukları = 100 μm. Kısaltma: HMEC'ler = insan meme epitel hücreleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
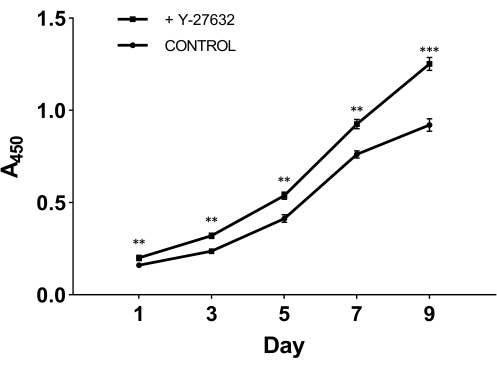
Şekil 3: Y-27632 ile Passage 1 HMEC'lerin (P1) gelişmiş büyümesi. Donmuş P0 hücreleri çözüldü ve Y-27632 ile veya Y-27632 olmadan kültürlendi. Hücreler (P1) 1, 3, 5, 7 ve 9 günlerde toplandı ve absorbans CCK-8 kiti kullanılarak 450 nm'de analiz edildi. 1. günde, Y-27632 içeren ilk ortamdaki yapışık canlı hücrelerin sayısı, Y-27632 olmayandan önemli ölçüde daha yüksekti. Ek olarak, Y-27632 ile tedavi edilen hücrelerin büyüme eğrisi daha dik bir artış gösterdi. **p < 0.01, ***p < 0.001. Kısaltma: HMEC'ler = insan meme epitel hücreleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: HMEC belirteçlerinin ifadesi (P0). HMEC'lerde CK7 ve GATA3 ekspresyonu immünofloresan boyama ile analiz edildi. HMEC'ler (A) CK7 (kırmızı) ve (B) GATA3 (kırmızı); Çekirdekleri boyamak için DAPI (mavi) kullanıldı. Görüntüler lazer taramalı konfokal mikroskop (400x) kullanılarak çekildi. Ölçek çubukları = 20 μm. (C) Boyamadaki pozitif hücrelerin yüzdesi; (D) HMEC'lerin temsili görüntüsü (P3). Ölçek çubukları = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
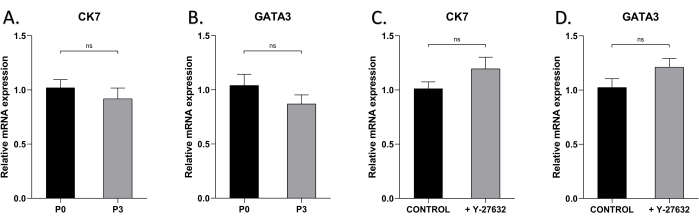
Şekil 5: HMEC'lerin CK7 ve GATA3'ünün P0 ve P3'teki ifadesi. 7. günde P0 ve P3 HMEC'lerinde (A) CK7, (B) P0 ve P3 HMEC'lerinde GATA3, (C) 7. günde Y27632 ile veya Y27632 olmadan kültürlenen P1 HMEC'lerde CK7 ekspresyonunu tespit etmek için qRT-PCR kullanma, (D) 7. günde Y-27632 ile veya Y-27632 olmadan kültürlenen P1 HMEC'lerde GATA3. NSP > 0.05. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
HMEC'ler, meme dokusunun anatomik ve fonksiyonel bütünlüğünün korunmasında hayati öneme sahiptir ve bilimsel araştırmalarda, klinik uygulamalarda ve ilgili alanlarda faydalıdırlar15. Birincil epitel hücreleri, sınırlı geçişlere ve daha kısa ömürlere sahip bir tür özel hücredir. Bununla birlikte, HMEC'lerin büyümesi, meme kanseri ve meme ile ilgili diğer enflamatuar hastalıklardaki araştırma ilerlemelerini engelleyen teknik kısıtlamalar tarafından engellenmiştir16.
Bu nedenle, taze meme dokularından HMEC'leri elde etmek için kararlı, uygulanabilir ve verimli bir yöntem geliştirmeye acil bir ihtiyaç vardır. Hammond ve ark.8 ve Band ve Sager17 meme epitel hücrelerini başarıyla çıkardı ve kültürledi. Bununla birlikte, gerekli kültür ortamının bileşimi aşırı derecede karmaşıktı. Taylor-Papidamitriou ve ark. tarafından yapılan önceki çalışmalar, anne sütündeki kavite hücrelerinin, büyüme faktörleri ve serum18 ile desteklenmiş bir ortam kullanılarak kültürlenebileceğini göstermiştir. Yöntemleri, HMEC'lerin anne sütünden doğrudan ekstraksiyonuna izin verirken, epitel olmayan hücrelerin varlığı HMEC'lerin büyümesini etkileyebilir ve bu da hücre sayımlarını doğru bir şekilde belirlemeyi zorlaştırır. Jin ve ark. birincil HMEC'lerin geleneksel kültür yöntemlerine kıyasla daha uzun bir yaşam döngüsüne sahip olmasını ve hücre heterojenliğini korumasını sağlayan koşullu bir yeniden programlama yöntemi geliştirdi, ancak bu, belirli kültür koşullarına büyük ölçüde bağımlıydı ve bu yöntemin diğer laboratuvarlarda ve uygulamalarda kullanımını kısıtladı12.
Zubeldia-Plazaola'nın grubundan yapılan bir çalışmada, kıyılmış doku parçalarının bir kollajenaz ve hyaluronidaz karışımı ile yavaş sindirimini (gece boyunca) içeren optimize edilmiş bir izolasyon yöntemi oluşturuldu ve ardından stromal/epitel fraksiyonlarını ayırmak için ikinci gün üç farklı santrifüjleme yapıldı. Bu izolasyon yöntemi ve kültüre Y-27632'nin eklenmesi, yüksek sayıda canlı epitel hücresi verdi. Ancak çalışmalarında kullanılan meme dokusu miktarı 40-75 g idi ve izolasyon işlemi yaklaşık 2 gün sürdü9. Burada, bu protokolde sadece 1 g doku kullanıldığını bildiriyoruz ve bu yöntemin de 0.25 g doku için işe yaradığını test ettik ve bulduk. Kollajenaz, dispas ve tripsin enzim karışımı, 1.5 saatte 1 g dokuyu verimli bir şekilde sindirdi ve tüm prosedür ~ 3 saat sürdü. Başlangıç kültür ortamına Y-27632'nin eklenmesi, epitel hücre bağlanmasını ve proliferasyonunu teşvik edebilir, ancak aynı zamanda stromal hücrelerin büyümesini de inhibe edebilir19. Bu çalışmada önemli olarak, başlangıç ortamının bileşenlerini test ettik ve önceki yayında kullanılan G ortamının yerini almak için DMEM'de% 5 FBS'nin epidermal hücre bağlanmasını ve büyümesini teşvik etmek için yeterli olduğunu bulduk10.
Başlangıç besiyerinde 2 günlük kültürden sonra, hücreler serumsuz keratinosit besiyerinde kültürlendi. Aşılamadan sonra ilk kültür (P0) için hücre büyüme modeli, bir koloni büyüme modelini gösteren Şekil 2'de gösterilmiştir. Bu izolasyon yöntemi muhtemelen, gelecekte daha fazla karakterize edilmesi gereken meme dokularından alınan miyoepitel hücreleri de dahil olmak üzere her türlü epitel hücresini verir. Bununla birlikte, Y-27632 varlığında hücrelerin büyümesini, başlangıç kültür ortamına Y-27632 eklemeden kontrol grubuyla karşılaştırarak, Y-27632 ile yöntemin hücre üretimini önemli ölçüde artırdığını ve hücre kültürünün verimliliğini artırdığını görebiliriz (Şekil 2A). Genellikle aşılamadan ~ 9-10 gün sonra kültür, epidermal hücreler pasaj için uygun bir yoğunluğa ulaşabilir. Ek olarak, Y-27632'nin varlığının, ilk kültürün sonunda donmuş P0 hücrelerinin geri kazanılmasından sonra P1 HMEC büyümesini artırabileceğini de gösterdik (Şekil 3). Elimizde, hücrelerin %90'ından fazlasının donmuş depodan çözüldükten sonra hayatta kalabildiğini gördük. Hücrelerin iki katına çıkma süresi yaklaşık 72 saatti ve HMEC'ler 7. geçişe kadar normal büyümeyi sürdürebildi.
Bu çalışmada, hücreler yüksek seviyelerde meme epitel hücre belirteçleri CK7 ve GATA3 eksprese etti ve daha da önemlisi, ilk kültürün geç evresindeki hücrelerin yaklaşık %100'ü CK7 ve GATA3 için pozitifti (Şekil 4), bu da bu yöntemden elde edilen epitel hücrelerinin yüksek saflığını gösterir. Son olarak, bu çalışma, P0 ve P3 hücrelerinde CK7 ve GATA3'ün ekspresyon seviyelerini karşılaştırdı ve her ikisinde de yüksek ekspresyon seviyelerini ortaya çıkardı ve pasajın hücrelerin fenotipini değiştirmediğini düşündürdü (Şekil 5A,B). Ayrıca, Y-27632'nin varlığından bağımsız olarak, CK7 ve GATA3 sürekli olarak yüksek oranda eksprese edildi, bu da Y-27632 ilavesinin hücre fenotipini etkilemediğini ima etti (Şekil 5C, D).
Yaklaşımımızla hücre proliferasyonunun arttırılmasının birincil nedeni, insan epitel hücrelerininçoğalması ve uzmanlaşması üzerinde avantajlı etkileri olduğu gösterilen Y-27632'nin dahil edilmesidir 19,20. Chapman ve ark. Y-27632 kullanmanın epitel hücrelerinin çoğalma yeteneğini önemli ölçüde artırdığını ve herhangi bir hücre krizi belirtisi olmadan hücrelerin başarılı bir şekilde ölümsüzleştirilmesine yol açtığını buldu21. Çalışmamızda, Y-27632, bağlanmalarını ve proliferasyonlarını artırarak bu epitel hücrelerinin verimini önemli ölçüde artırmıştır19.
Bu yöntemin temel bir özelliği, epitel dokusunu bağ dokusundan ayırmak için dispas ve kollajenazı birleştirirken, aynı zamanda epitel hücrelerini epitel dokusundan ayırmak için tripsin kullanmaktır22. Dispase'nin, epitel hücrelerinin canlılığını korurken, hasarsız epidermisi dermisten ve kültürdeki hasar görmemiş epitel hücresi katmanlarını alttaki yüzeyden ayırmak için hızlı ve verimli ancak nazik bir enzim olduğu kanıtlanmıştır23. Tip I kollajenaz, epitel hücrelerinin izolasyonunu kolaylaştırır ve hücrelerin canlılığını ve bütünlüğünü sağlar24. Bu yöntemin bir diğer önemli özelliği, yeni izole edilen HMEC'leri kültürlemek için Y-27632 ile başlangıç ortamının kullanılmasıdır. Hücreler üçüncü gün tabağa yapıştıktan sonra, kültür ortamı Keratinosit Serumsuz Ortam olarak değiştirilir. Bu yaklaşım, deney adımlarını belirgin bir şekilde basitleştirir ve deneyin maliyetini azaltır. Sonuç olarak, bu yöntemle sadece küçük bir hacimde meme dokusu kullanarak çok tatmin edici hücre sayıları elde ettik, bu da büyük miktarda başlangıç dokusunun gerekli olmadığını gösteriyor. Bununla birlikte, bu yaklaşımın bir dezavantajı, tripsin varlığının epitel hücrelerinin bütünlüğünü yeterince korumamasıdır. Yöntemin potansiyel olarak sınırlayıcı bir başka yönü, ilk kültür9 sırasında miyoepitelyal hücrelerin küçük (% <1) kontaminasyon olasılığıdır.
Yöntemimiz, yetişkin meme dokusundan türetilen primer HMEC'leri izole etmek ve kültürlemek için aerodinamik ve verimli bir yaklaşım sunar. Bu teknik, basitliği, zaman kazandıran doğası ve temel hücresel işlevleri sürdürme yeteneği ile karakterize edilir. Sonuç olarak, bu tekniğin açık avantajları vardır ve önemli miktarda epitel hücresi üretmek için oldukça umut vericidir. Ayrıca, yöntem, hem laboratuvar araştırmaları hem de klinik uygulamalar için uygun olan çok çeşitli donörlerden HMEC'lerin izolasyonuna ve kültürüne izin verir, bu da onu çok yönlü ve yaygın olarak uygulanabilir hale getirir.
Açıklamalar
Yazarlar, bu makalenin yayınlanması ile ilgili herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma, Çin'in Zhejiang Eyaleti TCM Bilim ve Teknoloji Programından alınan hibelerle desteklenmiştir (2017ZA055; 2018ZA036) ve Çin'in Guizhou eyaleti, Zunyi Bilim ve Teknoloji Projesi (Zunyi Şehri Kehe Destek NS (2020) No. 18) X. Xu'ya. Yazarlar, hücre kültürü eğitimi verdiği için Youjia (Hangzhou) Biyomedikal Teknoloji Şirketi Moleküler Biyoloji Laboratuvarı'na teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin | Basalmedia | K431010 | For HMECs dissociation |
| 1.5 mL microcentrifuge Tubes | NEST | 081722CK01 | For cell digestion |
| 100 µm mesh filter | Solarbio | 431752 | For HMECs filtration |
| 100 mm Cell Culture Dish | Corning | 430167 | For cell culture |
| 4% paraformaldehyde | solarbio | P1110-100ml | For immunofluorescence staining to check differentiation marker of HMECs |
| 50 mL Centrifuge Tube | Corning | 430829 | For cell centrifugation |
| Cell Strainer | Solarbio | 431752 | Cell filtration |
| Centrifuge | Eppendorf | 5404HN133048 | Cell centrifuge |
| CO2 Incubator | Thermo Scientific | 42820906 | For cell incubation |
| Collagenase Type I | Merck | SKU:SCR103 | For HMECs isolation |
| Dispase | Solarbio | CAS:42613-33-2 | For HMECs isolation |
| DMEM | Gibco | 8122622 | Component of neutralization medium |
| Fetal Bovine Serum | Gibco | 2556132P | Component of neutralization medium |
| Penicillin/Streptomycin | Thermo Scientific | 15140-122 | Antibiotics |
| Phosphate buffered solution | Tecono | 20201033 | Washing solution |
| rabbit anti CK7 | abcam | ab68459 | For immunofluorescence staining to check differentiation marker of HMECs |
| rabbit anti GATA3 | abcam | ab199428 | For immunofluorescence staining to check differentiation marker of HMECs |
| Y-27632 | Solarbio | IY0040 | ROCK inhibitor |
Referanslar
- Smolarz, B., Nowak, A. Z., Romanowicz, H. Breast cancer-epidemiology, classification, pathogenesis and treatment (review of literature). Cancers (Basel). 14 (10), 2569 (2022).
- Gudjonsson, T., Adriance, M. C., Sternlicht, M. D., Petersen, O. W., Bissell, M. J. Myoepithelial cells: Their origin and function in breast morphogenesis and neoplasia. J Mammary Gland Biol Neoplasia. 10 (3), 261-272 (2005).
- Faridi, N., et al. Isolation and characterization of the primary epithelial breast cancer cells and the adjacent normal epithelial cells from iranian women's breast cancer tumors. Cytotechnology. 70 (2), 625-639 (2018).
- Tovar, E. A., et al. Dissecting the rat mammary gland: Isolation, characterization, and culture of purified mammary epithelial cells and fibroblasts. Bio Protoc. 10 (22), e3818 (2020).
- Jiang, X., Yang, H., Jing, Q., He, X. A "selective secondary tissue attachment" method for isolation and purification of mammary epithelial cells. Acta Histochem. 124 (8), 151972 (2022).
- Bernardini, C., et al. Development of a pig mammary epithelial cell culture model as a non-clinical tool for studying epithelial barrier-a contribution from the imi-conception project. Animals (Basel). 11 (7), 2012 (2021).
- Zhang, D., et al. Transdifferentiation of goat ear fibroblasts into lactating mammary epithelial cells induced by small molecule compounds. Biochem Biophys Res Commun. 573, 55-61 (2021).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: Rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc Natl Acad Sci U S A. 81 (17), 5435-5439 (1984).
- Zubeldia-Plazaola, A., et al. Comparison of methods for the isolation of human breast epithelial and myoepithelial cells. Front Cell Dev Biol. 3, 32 (2015).
- Liu, Z., et al. A simplified and efficient method to isolate primary human keratinocytes from adult skin tissue. J Vis Exp. (138), e57784 (2018).
- Xie, Z., et al. Isolation and culture of primary human gingival epithelial cells using y-27632. J Vis Exp. (177), e62978 (2021).
- Jin, L., et al. Characterization of primary human mammary epithelial cells isolated and propagated by conditional reprogrammed cell culture. Oncotarget. 9 (14), 11503-11514 (2018).
- Böcker, W., Hungermann, D., Decker, T. Anatomy of the breast. Pathologe. 30 (1), 6-12 (2009).
- Kouros-Mehr, H., Slorach, E. M., Sternlicht, M. D., Werb, Z. Gata-3 maintains the differentiation of the luminal cell fate in the mammary gland. Cell. 127 (5), 1041-1055 (2006).
- Wang, X., Reagan, M. R., Kaplan, D. L. Synthetic adipose tissue models for studying mammary gland development and breast tissue engineering. J Mammary Gland Biol Neoplasia. 15 (3), 365-376 (2010).
- Ethier, S. P., Mahacek, M. L., Gullick, W. J., Frank, T. S., Weber, B. L. Differential isolation of normal luminal mammary epithelial cells and breast cancer cells from primary and metastatic sites using selective media. Cancer Res. 53 (3), 627-635 (1993).
- Band, V., Sager, R. Distinctive traits of normal and tumor-derived human mammary epithelial cells expressed in a medium that supports long-term growth of both cell types. Proc Natl Acad Sci U S A. 86 (4), 1249-1253 (1989).
- Taylor-Papadimitriou, J., Shearer, M., Tilly, R. Some properties of cells cultured from early-lactation human milk. J Natl Cancer Inst. 58 (6), 1563-1571 (1977).
- Wen, J., Zu, T., Zhou, Q., Leng, X., Wu, X. Y-27632 simplifies the isolation procedure of human primary epidermal cells by selectively blocking focal adhesion of dermal cells. J Tissue Eng Regen Med. 12 (2), e1251-e1255 (2018).
- Yin, J., Yu, F. S. Rho kinases regulate corneal epithelial wound healing. Am J Physiol Cell Physiol. 295 (2), C378-C387 (2008).
- Chapman, S., Liu, X., Meyers, C., Schlegel, R., Mcbride, A. A. Human keratinocytes are efficiently immortalized by a rho kinase inhibitor. J Clin Invest. 120 (7), 2619-2626 (2010).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Dermatol. 28 (2), 107-112 (2019).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. J Invest Dermatol. 93 (2), 287-290 (1989).
- Ren, H. J., et al. Primary cultures of mouse small intestinal epithelial cells using the dissociating enzyme type I collagenase and hyaluronidase. Braz J Med Biol Res. 50 (5), e5831 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır