Method Article
בידוד ותרבית של תאי אפיתל ראשוניים של חלב אנושי
* These authors contributed equally
In This Article
Summary
המחקר הנוכחי מדווח על פרוטוקול קל יותר, חוסך זמן וחסכוני לבידוד וגידול יעיל של תאי אפיתל חלב אנושיים ראשוניים (HMECs) מכמויות קטנות של רקמת חלב. פרוטוקול זה מתאים לייצור מהיר של HMECs ראשוניים הן ליישומים מעבדתיים והן ליישומים קליניים.
Abstract
בלוטת החלב היא מבנה בסיסי של השד וממלאת תפקיד חיוני ברבייה. תאי אפיתל חלב אנושיים (HMECs), שהם תאי המקור של סרטן השד ומחלות דלקתיות אחרות הקשורות לשד, זכו לתשומת לב רבה. עם זאת, בידוד וטיפוח של HMECs ראשוניים במבחנה למטרות מחקר היה מאתגר בשל אופיים המובחן והקרטיני ותוחלת החיים הקצרה שלהם. לכן, פיתוח שיטה פשוטה ויעילה לבידוד ותרבית של קופות חולים הוא בעל ערך מדעי רב לחקר ביולוגיה של השד ומחלות הקשורות לשד. במחקר זה, בודדנו בהצלחה HMECs ראשוניים מכמויות קטנות של רקמת חלב על ידי עיכול עם תערובת של אנזימים בשילוב עם תרבית ראשונית בסרום בקר עוברי 5% DMEM המכיל מעכב קינאז הקשור לרו (ROCK) Y-27632, ולאחר מכן הרחבת תרבית בתווך קרטינוציטים ללא סרום. גישה זו מקדמת באופן סלקטיבי את הצמיחה של תאי אפיתל, וכתוצאה מכך תפוקת תאים אופטימלית. הפשטות והנוחות של שיטה זו הופכות אותה למתאימה הן למחקר מעבדה והן למחקר קליני, אשר אמור לספק תובנות חשובות בתחומי מחקר חשובים אלה.
Introduction
סרטן השד הוא סוג הסרטן העיקרי המאובחן אצל נשים ברחבי העולם והוא הגורם העיקרי למוות מסרטן1. הפתוגנזה של סרטן השד היא מורכבת, וכוללת גורמים רבים כגון גנטיקה, סביבה ואורח חיים. HMECs, תאים פעילים מייצרי חלב, הם אחד המרכיבים החשובים ביותר של רקמת החלב וככל הנראה הם התאים המקוריים המעורבים בקרצינוגנזה של סרטן השד. לכן, HMECs קיבלו את מירב תשומת הלב מהחוקרים לחקר סרטן השד2. יתר על כן, לתאים ראשוניים יש את היכולת לספק אפיון רלוונטי ביולוגית של תהליכים תאיים מורכבים בשל אגירתם של יציבות גנטית, מורפולוגיה נורמלית, ומערך שלם יותר של תפקודים תאיים בסיסיים שלא ניתן להשיג עם קווי תאים אימורטליים3. לפיכך, הבידוד והתרבות של קופות חולים ראשוניות הוא צעד חיוני לחקר רוב המחלות הקשורות לשד כגון סרטן השד ומחלות דלקתיות בשד.
כיום, מערכת יציבה וניתנת לשחזור לבידוד, תרבית וזיהוי של תאי אפיתל חלב מחולדות, פרות, חזירים ועזים הוקמה 4,5,6,7. עם זאת, הבידוד והתרבית של HMECs ראשוניים הם מאתגרים בשל המיקרו-סביבה המורכבת והתנובה הנמוכה של תאים. במשך עשרות שנים, מדענים חיפשו את השיטה היעילה ביותר לבודד ולטפח HMECs למרות מערכת תרבות עבור HMECs הוקמה לפני כמעט 20 שנה. לדוגמה, האמונד ועמיתיו פיתחו מדיום תרבית ללא סרום שבו HMECs גדלו ביעילות8. לאחרונה, Zubeldia-Plazaola et al. בדקו ארבע שיטות בידוד שונות באמצעות הליכי עיכול אנזימים מהירים/איטיים בשילוב עם סינון רציף או שלבי צנטריפוגה דיפרנציאליים כדי להשיג HMECs9. הם מצאו כי שיטת העיכול האיטי יחד עם צנטריפוגה דיפרנציאלית היא השיטה היעילה ביותר לבודד HMECs מרקמת שד טרייה. עם זאת, שיטת בידוד זו דורשת חתיכות גדולות של רקמה (40-75 גרם) ומשתמשת בכמויות גדולות יותר של אנזימי עיכול. ההליך שלהם מסובך (לפחות שלוש צנטריפוגות שונות כדי להשיג שברי תאים שונים), כמו גם זמן רב. לכן, עדיין נדרשת שיטה פשוטה ומהירה כדי להשיג ביעילות אוכלוסיות של HMECs מכמויות קטנות של רקמת חלב למחקר וליישומים קליניים9.
המחקרים הקודמים שלנו הראו כי הוספת מעכב קינאז הקשור ל-Rho (ROCK) Y-27632 למדיום התרבית הראשוני יכולה לפשט את תהליך בידוד תאי האפידרמיס של העור האנושי10, אשר שימש בהצלחה גם לבידוד תאי אפיתל חניכיים11. בנוסף, מחקר קודם שנערך על ידי הקבוצה של Zubeldia-Plazaola והקבוצה של ג'ין הצביע על כך של- Y-27632 יש את היכולת לעורר צמיחה מהירה ובלתי מוגבלת במבחנה של תאי אפיתל ראשוניים שמקורם ברקמת החלב 9,12. המחקר הנוכחי נועד לבדוק אם שימוש ב-Y-27632 יפשט את הבידוד והתרבות של HMECs והצלחנו לבסס שיטה פשוטה וקלה לביצוע לבידוד HMECs מחתיכות קטנות (1 גרם) של רקמת החלב.
Protocol
רקמות חלב נורמליות טריות המשמשות בפרוטוקול זה נאספות מניתוח סביב הנגע של דלקת שד לובולרית גרנולומטית עקשנית בבית החולים המסונף הראשון של האוניברסיטה הרפואית הסינית ג'ג'יאנג על פי הנחיות ועדת האתיקה הרפואית של בית החולים המסונף הראשון של האוניברסיטה הרפואית הסינית ג'ג'יאנג (פרוטוקול מס '. ChiMCTR2100005281, תאריך: 2017-07-17).
1. רכישת רקמות
- איסוף רקמות חלב טריות מדגימות כירורגיות שנלקחו מנשים בוגרות לתוך צינורות סטריליים המכילים 10 מ"ל של מלח חוצץ פוספט (PBS) עם 3% פניצילין/סטרפטומיצין (P/S).
הערה: יש לטפל ברקמות החלב על פי הפרטים הבאים תוך 24 שעות לאחר האיסוף מהניתוח.
2. טיפול מקדים ברקמה
- הסר את רקמת השומן מרקמת החלב עם שני זוגות של מלקחיים, להבטיח כי רקמת החלב הנותרת היא ~ 1 גרם במשקל.
- שטפו את רקמת החלב בתמיסת אתנול 75% (5 מ"ל) במשך 5 שניות ולאחר מכן שטפו עם 20 מ"ל של תמיסת כביסה (טבלה 1) במשך 2 x 5 דקות.
3. עיכול של רקמות
- פורסים את רקמת החלב לשברים קטנים יותר, גורסים את הרקמה באמצעות שני להבים כירורגיים למשך 15 דקות כדי לקבל את הרקמה הומוגנית. מעבירים את חתיכות הרקמה לצינור צנטריפוגה של 50 מ"ל.
- הוסף 10 מ"ל של 5.0 מ"ג / מ"ל dispase + 5.0 מ"ג / מ"ל תמיסת collagenase, 3 מ"ל של 0.25% טריפסין, ו 7 מ"ל של PBS לסך של 20 מ"ל של תמיסת עיכול בצינור צנטריפוגה 50 מ"ל המכיל את שברי רקמת החלב. מניחים את הצינור באמבט מים ב 37 °C (77 °F) ולדגור במשך 1.5 שעות; נערו את הצינור כל 20 דקות.
- עצור את תהליך העיכול על ידי הזרקת 20 מ"ל של תמיסה מנטרלת. מערבבים את התוכן על ידי pipetting ~ 15x.
- סננו את התערובת דרך מסנן רשת שינוי בגודל 100 מיקרומטר. צנטריפוגה ב 156 × גרם במשך 5 דקות.
- מוציאים את הסופרנאטנט וחוזרים על הדגירה של הגלולה עם 20 מ"ל של תמיסה מנטרלת. מערבבים את התכולה על ידי פיפטינג 15x וצנטריפוגה ב 156 × גרם במשך 5 דקות.
- הסר את supernatant בזהירות להשעות מחדש את גלולת התא עם 10 מ"ל של מדיום תרבית ראשונית. לוחים את תרחיף התא בצלחת תרבית תאים בקוטר 100 מ"מ.
- לטפח את התאים באינקובטור 5% CO2 ב 37 ° C. החליפו את מדיום התרבית המקורי בתווך תאי אפיתל טריים כל שלושה ימים. בדוק את התאים ורענן את המדיום כל יומיים.
4. מעבר תאים
- הסר את צלחת 100 מ"מ מן האינקובטור כאשר התאים מגיעים 80%-90% מפגש, להשליך את המדיום משומש, ולשטוף את צלחת 2x עם 2 מ"ל של PBS. הסר PBS ולאחר מכן הוסף 2 מ"ל של 0.05% טריפסין לכל צלחת 100 מ"מ.
הערה: מערבלים את התבשיל כדי לוודא שתמיסת הטריפסין באה במגע מספיק עם תחתית המנה. - מניחים את צלחת 100 מ"מ באינקובטור 37 מעלות צלזיוס למשך ~7 דקות לתהליך העיכול.
- בחנו את התאים במיקרוסקופ באמצעות מטרה של פי 40 כדי לוודא שרוב התאים נותקו מתחתית הצלחת.
- עצור את תהליך העיכול על ידי הוספת 8 מ"ל של תמיסה מנטרלת ולהעביר את התאים לצינור 15 מ"ל. מערבבים את התאים על ידי פיפטינג למעלה ולמטה 10-15x. צנטריפוגה את התאים ב 156 × גרם במשך 5 דקות.
- הסר את supernatant בזהירות, resuspend את התאים עם 10 מ"ל של תווך תא אפיתל, ולספור את מספר התאים.
- הוסף 1 × 106 תאים ב 10 מ"ל של תא אפיתל בינוני בצלחת 100 מ"מ.
- רענן את תווך תא האפיתל והתבונן בתאים כל יומיים.
5. שימור תאים בהקפאה
- חזור על שלבים 4.1-4.4.
- הסר את supernatant בזהירות להשעות מחדש את התאים ב 2 מ"ל של תמיסת שימור הקפאה התא.
- העבירו 1 מ"ל של תמיסת ההקפאה המכילה את התאים לכל בקבוקון קריוגני.
- רשום את שמות התאים השמורים, את מספרי המעבר ואת התאריכים.
- הניחו את הבקבוקונים במיכל הקפאה בקצב מבוקר בטמפרטורה של -80°C למשך הלילה.
- הוציאו את הבקבוקונים הקריוגניים מהמקפיא בטמפרטורה של -80°C והעבירו אותם במהירות לחנקן נוזלי לאחסון לטווח ארוך.
תוצאות
איור 1 מציג סכמה של ההליך. הפרוטוקול כולל שימוש בשילוב של אנזימים, כלומר דיספאז, קולגנאז וטריפסין. שילוב זה מנוצל לצורך ניתוק יריעת האפיתל משכבת הפיברובלסטים שמתחתיה ולאחר מכן שימוש בטריפסין לניתוק תאי אפיתל החלב לתרחיף. בנוסף, הצמיחה של תאי אפיתל קודמה ביעילות על ידי הוספת Y-27632 למדיום התרבית הראשוני. כתוצאה מכך, שיטה זו מניבה מספר רב של HMECs, העומדים בדרישות למעבר תוך 10 ימים בממוצע בלבד.
כדי לבחון את התפקיד המכריע של Y-27632 בגדילת תאים לאחר בידוד, חילקנו תאים שבודדו לאחרונה לשתי קבוצות: קבוצה אחת הייתה מצופה בתווך הראשוני שהכיל 10 מילימטר Y-27632 (איור 2A); הקבוצה השנייה הייתה מצופה בתווך הראשוני מבלי להוסיף Y-27632 כקבוצת ביקורת (איור 2B). לאחר יומיים של תרבית, התאים משתי הקבוצות עברו למדיום של תאי אפידרמיס (איור 1). מאיור 2 אנו יכולים לראות שבהשוואה ליום השלישי, השיטה עם Y-27632 הגדילה באופן ניכר את מספר ה-HMECs ביום התשיעי. ה-HMECs יצרו קבוצה מלוכדת שדמתה לאי שהיו לו גבולות ברורים וקשרים חזקים בין תאים. תאים אלה התפשטו החוצה אל הסביבה. התאים שצופו ב-Y-27632 (איור 2A) גדלו הרבה יותר מהר מהתאים בקבוצת הביקורת (איור 2B). כדי לוודא ש-Y-27632 משפר את צמיחת ה-HMEC, תאי P0 הקפואים הופשרו וצופו עם או בלי הוספה של 10 mM Y-27632, ותאי מעבר 1 (P1) נאספו בימים שונים כפי שמוצג באיור 3. התאים נותחו לצורך כדאיות והתפשטות באמצעות ערכת ספירת התאים 8 (CCK-8). כפי שניתן לראות באיור 3, קצב הגדילה של תאים שטופלו בתווך המכיל Y-27632 היה גבוה משמעותית מזה של התאים בקבוצת הביקורת ללא Y-27632. אם ניקח את הנתונים האלה יחד, ניתן לראות כי תוספת של Y-27632 בתווך הראשוני משפרת באופן משמעותי את הצמיחה של התאים המחוברים לאחר בידוד.
כדי לוודא שהתאים המתקבלים בשיטה זו הם HMECs, ביצענו ניתוח אימונופלואורסצנטי של P0 HMECs עבור שני סמנים של תאי אפיתל החלב: CK7 ו-GATA3. CK7, ציטוקרטין בעל חשיבות אבחנתית, הוא סמן של התמיינות בלוטות באפיתל חלב תקין ובתהליכי אפיתל השגשוג שלו13. בנוסף, Kouros-Mehr et al. דיווחו כי GATA3 מתפקד כגורם שעתוק בתוך תאי אפיתל חלב ומעורב בשמירה על התמיינות אפיתל לומינלי בבלוטות חלב מפותחותלחלוטין 14. כפי שניתן לראות באיור 3, התאים שתרבנו בתרבית והרחבנו מבטאים בחוזקה גם CK7 (איור 4A) וגם GATA3 (איור 4B). ניתוח הכימות של תאים חיוביים ל-CK7 ו-GATA3 הראה שיותר מ-98% מהתאים ביטאו גם CK7 וגם GATA3 (איור 4C), מה שמצביע על זיהום מוגבל של סוגים אחרים של תאים, כמו למשל פיברובלסטים. מדי פעם צפינו במספר מוגבל של תאים דמויי פיברובלסטים (מורפולוגיה מוארכת) בתרבית הראשונית (P0, איור 2), אולם רק לעתים רחוקות אנו רואים את התאים האלה מופיעים בתאים שעברו (P3, איור 4D).
כדי לבדוק אם ניתן לשמור על מאפיין האפיתל של HMECs לאחר מספר מעברים, ביצענו ניתוח qRT-PCR של סמני תאי אפיתל חלב CK7 ו-GATA3 בתאים שגודלו בתרבית עם או בלי Y-27632 (איור 5). רמות הביטוי של CK7 ו-GATA3 לא היו שונות באופן משמעותי הן בתאי P0 והן בתאי P3, עם או בלי Y-27632, מה שמצביע על כך שמאפייני הפנוטיפ וההתמיינות שלהם לא השתנו עם הזמן במהלך התרחבות התרבית.
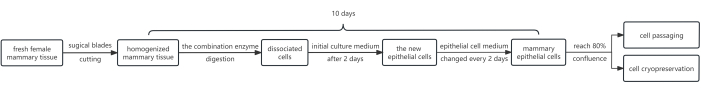
איור 1: תרשים זרימה של הפרוטוקול לבידוד ותרבית של HMECs. בתחילה, שברי רקמת החלב הנשית נחתכו בלהבים כירורגיים ועוכלו בשילוב של אנזימים. לאחר מכן, כדורי התא שהתקבלו תורבתו בתווך תרבית ראשוני שהכיל 10 mM Y-27632. לאחר יומיים, מדיום התרבית הראשוני הוחלף בתווך תאי אפיתל. תאי אפיתל החלב גודלו בתרבית בתווך של תאי אפידרמיס כדי להשיג כיסוי משביע רצון לאחר ~8 ימים, המתאימים כעת למעבר. במידת הצורך, תאים מסוימים יכולים להיות נתונים לשימור בהקפאה של תאים. קיצור: HMECs = תאי אפיתל חלב אנושיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: תמונות של HMECs שהתקבלו לאחר החיסון הראשוני. בתוך יומיים לאחר החיסון, (A) קופות חולים ראשוניות תורבתו בתווך ראשוני שהכיל Y-27632 ו-(B) HMECs ראשוניים תורבתו בתווך ראשוני ללא Y-27632. לאחר תקופת גידול של 48 שעות, מדיום תרבית קרטינוציטים ללא נסיוב הוחלף בשתי הקבוצות. התמונות צולמו כדי לתעד את מצב הצמיחה של תאים אחת ליומיים. שתי סדרות התמונות המייצגות צולמו באמצעות מיקרוסקופ הפוך (100x) בימים 3, 5 ו-9 לאחר החיסון. פסי קנה מידה = 100 מיקרומטר. קיצור: HMECs = תאי אפיתל חלב אנושיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
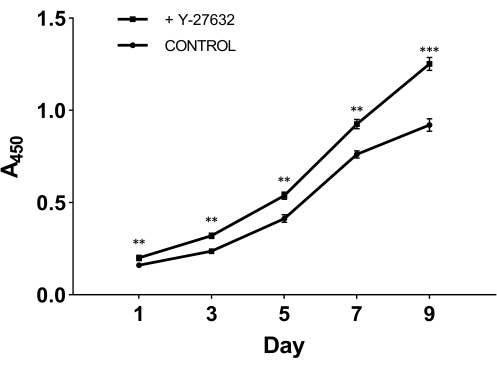
איור 3: גידול מוגבר של HMECs מעבר 1 (P1) עם Y-27632. תאי P0 הקפואים הופשרו ותורבתו עם או בלי Y-27632. התאים (P1) נאספו במשך 1, 3, 5, 7 ו-9 ימים והספיגה נותחה ב-450 ננומטר באמצעות ערכת CCK-8. ביום הראשון, מספר התאים הדבקים בתווך הראשוני שהכיל Y-27632 היה גבוה משמעותית מזה ללא Y-27632. בנוסף, עקומת הגדילה של תאים שטופלו ב-Y-27632 הראתה עלייה תלולה יותר. **p < 0.01, ***p < 0.001. קיצור: HMECs = תאי אפיתל חלב אנושיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: ביטוי סמני HMEC (P0). הביטוי של CK7 ו- GATA3 ב- HMECs נותח על ידי צביעה אימונופלואורסצנטית. HMECs הוכתמו עבור (A) CK7 (אדום) ו- (B) GATA3 (אדום); DAPI (כחול) שימש להכתמת הגרעינים. התמונות צולמו באמצעות מיקרוסקופ קונפוקלי סורק לייזר (400x). פסי קנה מידה = 20 מיקרומטר. (C) אחוז התאים החיוביים בצביעה; (D) התמונה המייצגת של HMECs (P3). פסי קנה מידה = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
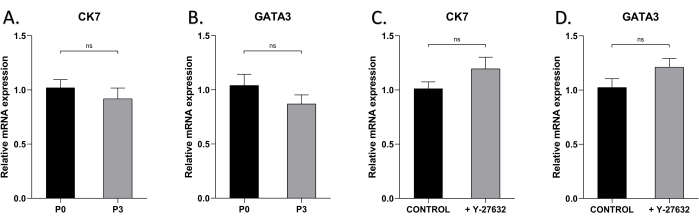
איור 5: הביטוי של CK7 ו-GATA3 של HMECs ב-P0 וב-P3. שימוש ב- qRT-PCR כדי לזהות ביטוי של (A) CK7 ב- HMECs של P0 ו- P3 ביום 7, (B) GATA3 ב- HMECs של P0 ו- P3, (C) CK7 ב- P1 HMECs בתרבית עם או בלי Y27632 ביום 7, (D) GATA3 ב- P1 HMECs בתרבית עם או בלי Y-27632 ביום 7. NSP > 0.05. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
HMECs חיוניים לשמירה על השלמות האנטומית והתפקודית של רקמת החלב והם שימושיים בחקירות מדעיות, יישומים קליניים ותחומים קשורים15. תאי אפיתל ראשוניים הם סוג של תאים מיוחדים בעלי מעברים מוגבלים ותוחלת חיים קצרה יותר. עם זאת, הצמיחה של HMECs עוכבה על ידי אילוצים טכניים, אשר כתוצאה מכך עיכבו את התקדמות המחקר בסרטן השד ומחלות דלקתיות אחרות הקשורות השד16.
לכן, יש צורך דחוף לפתח שיטה יציבה, ישימה ויעילה להשגת HMECs מרקמות חלב טריות. Hammond et al.8 ו- Band and Sager17 חילצו בהצלחה תאי אפיתל שד ותרבו אותם. עם זאת, הרכב המדיום התרבותי הנדרש היה מורכב מדי. מחקרים קודמים של Taylor-Papidamitriou et al. הראו כי ניתן לתרבית תאי חלל מחלב אם באמצעות מדיום בתוספת גורמי גדילה וסרום18. בעוד השיטה שלהם מאפשרת מיצוי ישיר של HMECs מחלב אם, נוכחותם של תאים שאינם אפיתל יכולה להשפיע על הצמיחה של HMECs, מה שהופך את זה מאתגר לקבוע במדויק את ספירת התאים. ג'ין ועמיתיו פיתחו שיטת תכנות מחדש מותנית שאפשרה ל-HMECs ראשוניים להיות בעלי מחזור חיים ארוך יותר ולשמור על הטרוגניות התא בהשוואה לשיטות תרבית מסורתיות, אך היא הייתה תלויה מאוד בתנאי תרבית ספציפיים והגבילה את השימוש בשיטה זו במעבדות וביישומים אחרים12.
מחקר מקבוצתו של זובלדיה-פלאזולה ביסס שיטת בידוד אופטימלית שכללה עיכול איטי (בן לילה) של שברי רקמות טחונות על ידי תערובת של קולגנאז והיאלורונידאז, ולאחר מכן שלוש צנטריפוגות דיפרנציאליות ביום השני להפרדת שברי סטרומה/אפיתל. שיטת בידוד זו בתוספת תוספת Y-27632 בתרבית הניבו מספר גבוה של תאי אפיתל בני קיימא. עם זאת, כמות רקמת החלב ששימשה במחקר שלהם הייתה 40-75 גרם והליך הבידוד נמשך כמעט יומיים9. כאן, אנו מדווחים על שימוש של רק 1 גרם של רקמה בפרוטוקול זה, ובדקנו ומצאנו כי שיטה זו עבדה גם עבור מעט כמו 0.25 גרם של רקמה. תערובת האנזימים של collagenase, dispase וטריפסין עיכלה ביעילות 1 גרם של רקמה תוך 1.5 שעות, וההליך כולו לקח ~ 3 שעות. הוספת Y-27632 למדיום התרבית הראשוני יכולה לקדם התקשרות ושגשוג של תאי אפיתל, אך גם לעכב את צמיחתם של תאי סטרומה19. חשוב לציין במחקר זה, בדקנו את המרכיבים של התווך הראשוני ומצאנו כי 5% FBS ב- DMEM כדי להחליף את מדיום G ששימש בפרסום הקודם היה מספיק כדי לקדם התקשרות תאי אפידרמיס וצמיחה10.
לאחר יומיים של תרבית בתווך הראשוני, התאים גודלו בתרבית בתווך קרטינוציטים ללא סרום. דפוס גדילת התאים בתרבית ראשונית (P0) לאחר החיסון מוצג באיור 2, שמראה דפוס גידול מושבה. שיטת בידוד זו מניבה ככל הנראה את כל סוגי תאי האפיתל, כולל תאי מיואפיתל מרקמות החלב, שאותם יהיה צורך לאפיין עוד יותר בעתיד. אף על פי כן, על-ידי השוואת גדילת התאים בנוכחות Y-27632 לקבוצת הביקורת מבלי להוסיף Y-27632 למדיום התרבית הראשוני, יכולנו לראות שהשיטה עם Y-27632 שיפרה באופן משמעותי את ייצור התאים ושיפרה את יעילות תרבית התאים (איור 2A). בדרך כלל ~ 9-10 ימים של תרבית לאחר החיסון, תאי האפידרמיס יכולים להשיג צפיפות המתאימה למעבר. נוסף על כך, הראינו גם שנוכחות של Y-27632 יכולה לשפר את צמיחת P1 HMEC לאחר שחזור תאי P0 שהוקפאו בסוף התרבית הראשונית (איור 3). בידינו מצאנו שיותר מ-90% מהתאים הצליחו לשרוד לאחר שהופשרו מאחסון קפוא. זמן ההכפלה של התאים היה כ-72 שעות, ו-HMECs הצליחו לשמור על גדילה תקינה עד המעבר השביעי.
במחקר זה, התאים ביטאו רמות גבוהות של סמני תאי אפיתל חלב CK7 ו-GATA3, וחשוב מכך, כמעט 100% מהתאים בשלב המאוחר של התרבית הראשונית היו חיוביים עבור CK7 ו-GATA3 (איור 4), מה שמצביע על טוהר גבוה של תאי אפיתל שהתקבלו בשיטה זו. לבסוף, מחקר זה השווה את רמות הביטוי של CK7 ו-GATA3 בתאי P0 ו-P3, וחשף רמות ביטוי גבוהות בשניהם, מה שמרמז על כך שהמעבר לא שינה את הפנוטיפ של התאים (איור 5A,B). יתר על כן, ללא קשר לנוכחות של Y-27632, CK7 ו-GATA3 באו לידי ביטוי באופן עקבי, מה שמרמז על כך שהתוספת של Y-27632 לא השפיעה על פנוטיפ התא (איור 5C,D).
הגורם העיקרי לשיפור התרבות התאים באמצעות הגישה שלנו הוא הכללת Y-27632, אשר הוכח כבעל השפעות מועילות על הכפל וההתמחות של תאי אפיתל אנושיים19,20. צ'פמן ועמיתיו מצאו כי השימוש ב-Y-27632 שיפר משמעותית את יכולתם של תאי אפיתל להתרבות והוביל לאימורטליזציה מוצלחת של התאים ללא כל סימנים למשבר תאים21. במחקר שלנו, Y-27632 הגדיל באופן משמעותי את התפוקה של תאי אפיתל אלה על ידי שיפור ההתקשרות וההתרבות שלהם19.
אחד המאפיינים העיקריים של שיטה זו הוא שילוב dispase ו collagenase כדי להפריד רקמת אפיתל מרקמת חיבור, תוך שימוש גם טריפסין כדי לנתק תאי אפיתל מרקמת אפיתל22. דיספז הוכח כאנזים מהיר ויעיל אך עדין להפרדת האפידרמיס שלא ניזוק מהדרמיס וכן שכבות לא פגומות של תאי אפיתל בתרבית מפני השטח שמתחתיו, כל זאת תוך שמירה על יכולת הקיום של תאי אפיתל23. סוג I collagenase מאפשר בידוד של תאי אפיתל ומבטיח את החיוניות והשלמות של התאים24. מאפיין מרכזי נוסף של שיטה זו הוא שימוש בתווך הראשוני עם Y-27632 כדי לתרבית את HMECs שבודדו לאחרונה. לאחר שהתאים נצמדו לצלחת ביום השלישי, מדיום התרבית משתנה למדיום ללא סרום קרטינוציטים. גישה זו מפשטת באופן בולט את שלבי הניסוי ומפחיתה את עלות הניסוי. כתוצאה מכך, השגנו מספרי תאים משביעי רצון מאוד באמצעות נפח קטן בלבד של רקמת חלב בשיטה זו, מה שמצביע על כך שאין צורך בכמות גדולה של רקמה ראשונית. עם זאת, חסרון אחד לגישה זו הוא כי נוכחות של טריפסין אינו מגן כראוי על שלמות תאי אפיתל. היבט מגביל נוסף של השיטה הוא האפשרות של זיהום קטן (<1%) של תאי מיואפיתל במהלך התרבית הראשונית9.
השיטה שלנו מציעה גישה יעילה ויעילה לבידוד וטיפוח של קופות חולים ראשוניות שמקורן ברקמת חלב בוגרת. טכניקה זו מאופיינת בפשטותה, באופייה החוסך זמן וביכולתה לשמור על תפקודים תאיים בסיסיים. כתוצאה מכך, טכניקה זו יש יתרונות ברורים והוא מבטיח מאוד לייצור כמות משמעותית של תאי אפיתל. יתר על כן, השיטה מאפשרת בידוד ותרבית של HMECs ממגוון רחב של תורמים, מתאימה הן למחקר מעבדה והן ליישומים קליניים, מה שהופך אותה לרב-תכליתית מאוד וישימה באופן נרחב.
Disclosures
המחברים מצהירים כי אין ניגוד עניינים בנוגע לפרסום מאמר זה.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מתוכנית המדע והטכנולוגיה TCM של מחוז ג'ג'יאנג, סין (2017ZA055; 2018ZA036), ופרויקט המדע והטכנולוגיה של Zunyi, מחוז Guizhou, סין (Zunyi City Kehe Support NS (2020) No. 18) ל- X. Xu. המחברים מודים למעבדה לביולוגיה מולקולרית של חברת הטכנולוגיה הביו-רפואית Youjia (Hangzhou) על מתן הכשרה בתרביות תאים.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin | Basalmedia | K431010 | For HMECs dissociation |
| 1.5 mL microcentrifuge Tubes | NEST | 081722CK01 | For cell digestion |
| 100 µm mesh filter | Solarbio | 431752 | For HMECs filtration |
| 100 mm Cell Culture Dish | Corning | 430167 | For cell culture |
| 4% paraformaldehyde | solarbio | P1110-100ml | For immunofluorescence staining to check differentiation marker of HMECs |
| 50 mL Centrifuge Tube | Corning | 430829 | For cell centrifugation |
| Cell Strainer | Solarbio | 431752 | Cell filtration |
| Centrifuge | Eppendorf | 5404HN133048 | Cell centrifuge |
| CO2 Incubator | Thermo Scientific | 42820906 | For cell incubation |
| Collagenase Type I | Merck | SKU:SCR103 | For HMECs isolation |
| Dispase | Solarbio | CAS:42613-33-2 | For HMECs isolation |
| DMEM | Gibco | 8122622 | Component of neutralization medium |
| Fetal Bovine Serum | Gibco | 2556132P | Component of neutralization medium |
| Penicillin/Streptomycin | Thermo Scientific | 15140-122 | Antibiotics |
| Phosphate buffered solution | Tecono | 20201033 | Washing solution |
| rabbit anti CK7 | abcam | ab68459 | For immunofluorescence staining to check differentiation marker of HMECs |
| rabbit anti GATA3 | abcam | ab199428 | For immunofluorescence staining to check differentiation marker of HMECs |
| Y-27632 | Solarbio | IY0040 | ROCK inhibitor |
References
- Smolarz, B., Nowak, A. Z., Romanowicz, H. Breast cancer-epidemiology, classification, pathogenesis and treatment (review of literature). Cancers (Basel). 14 (10), 2569 (2022).
- Gudjonsson, T., Adriance, M. C., Sternlicht, M. D., Petersen, O. W., Bissell, M. J. Myoepithelial cells: Their origin and function in breast morphogenesis and neoplasia. J Mammary Gland Biol Neoplasia. 10 (3), 261-272 (2005).
- Faridi, N., et al. Isolation and characterization of the primary epithelial breast cancer cells and the adjacent normal epithelial cells from iranian women's breast cancer tumors. Cytotechnology. 70 (2), 625-639 (2018).
- Tovar, E. A., et al. Dissecting the rat mammary gland: Isolation, characterization, and culture of purified mammary epithelial cells and fibroblasts. Bio Protoc. 10 (22), e3818 (2020).
- Jiang, X., Yang, H., Jing, Q., He, X. A "selective secondary tissue attachment" method for isolation and purification of mammary epithelial cells. Acta Histochem. 124 (8), 151972 (2022).
- Bernardini, C., et al. Development of a pig mammary epithelial cell culture model as a non-clinical tool for studying epithelial barrier-a contribution from the imi-conception project. Animals (Basel). 11 (7), 2012 (2021).
- Zhang, D., et al. Transdifferentiation of goat ear fibroblasts into lactating mammary epithelial cells induced by small molecule compounds. Biochem Biophys Res Commun. 573, 55-61 (2021).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: Rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc Natl Acad Sci U S A. 81 (17), 5435-5439 (1984).
- Zubeldia-Plazaola, A., et al. Comparison of methods for the isolation of human breast epithelial and myoepithelial cells. Front Cell Dev Biol. 3, 32 (2015).
- Liu, Z., et al. A simplified and efficient method to isolate primary human keratinocytes from adult skin tissue. J Vis Exp. (138), e57784 (2018).
- Xie, Z., et al. Isolation and culture of primary human gingival epithelial cells using y-27632. J Vis Exp. (177), e62978 (2021).
- Jin, L., et al. Characterization of primary human mammary epithelial cells isolated and propagated by conditional reprogrammed cell culture. Oncotarget. 9 (14), 11503-11514 (2018).
- Böcker, W., Hungermann, D., Decker, T. Anatomy of the breast. Pathologe. 30 (1), 6-12 (2009).
- Kouros-Mehr, H., Slorach, E. M., Sternlicht, M. D., Werb, Z. Gata-3 maintains the differentiation of the luminal cell fate in the mammary gland. Cell. 127 (5), 1041-1055 (2006).
- Wang, X., Reagan, M. R., Kaplan, D. L. Synthetic adipose tissue models for studying mammary gland development and breast tissue engineering. J Mammary Gland Biol Neoplasia. 15 (3), 365-376 (2010).
- Ethier, S. P., Mahacek, M. L., Gullick, W. J., Frank, T. S., Weber, B. L. Differential isolation of normal luminal mammary epithelial cells and breast cancer cells from primary and metastatic sites using selective media. Cancer Res. 53 (3), 627-635 (1993).
- Band, V., Sager, R. Distinctive traits of normal and tumor-derived human mammary epithelial cells expressed in a medium that supports long-term growth of both cell types. Proc Natl Acad Sci U S A. 86 (4), 1249-1253 (1989).
- Taylor-Papadimitriou, J., Shearer, M., Tilly, R. Some properties of cells cultured from early-lactation human milk. J Natl Cancer Inst. 58 (6), 1563-1571 (1977).
- Wen, J., Zu, T., Zhou, Q., Leng, X., Wu, X. Y-27632 simplifies the isolation procedure of human primary epidermal cells by selectively blocking focal adhesion of dermal cells. J Tissue Eng Regen Med. 12 (2), e1251-e1255 (2018).
- Yin, J., Yu, F. S. Rho kinases regulate corneal epithelial wound healing. Am J Physiol Cell Physiol. 295 (2), C378-C387 (2008).
- Chapman, S., Liu, X., Meyers, C., Schlegel, R., Mcbride, A. A. Human keratinocytes are efficiently immortalized by a rho kinase inhibitor. J Clin Invest. 120 (7), 2619-2626 (2010).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Dermatol. 28 (2), 107-112 (2019).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. J Invest Dermatol. 93 (2), 287-290 (1989).
- Ren, H. J., et al. Primary cultures of mouse small intestinal epithelial cells using the dissociating enzyme type I collagenase and hyaluronidase. Braz J Med Biol Res. 50 (5), e5831 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved