Method Article
Isolamento e coltura di cellule epiteliali mammarie umane primarie
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il presente studio riporta un protocollo più semplice, rapido ed economico per isolare e far crescere in modo efficiente le cellule epiteliali mammarie umane primarie (HMEC) da piccole quantità di tessuto mammario. Questo protocollo è adatto per la produzione rapida di HMEC primari sia per applicazioni di laboratorio che cliniche.
Abstract
La ghiandola mammaria è una struttura fondamentale del seno e svolge un ruolo essenziale nella riproduzione. Le cellule epiteliali mammarie umane (HMEC), che sono le cellule originarie del cancro al seno e di altre malattie infiammatorie correlate al seno, hanno attirato una notevole attenzione. Tuttavia, l'isolamento e la coltura di HMEC primari in vitro per scopi di ricerca è stato impegnativo a causa della loro natura altamente differenziata e cheratinizzazione e della loro breve durata. Pertanto, lo sviluppo di un metodo semplice ed efficiente per isolare e coltivare gli HMEC è di grande valore scientifico per lo studio della biologia mammaria e delle malattie correlate al seno. In questo studio, siamo riusciti a isolare gli HMEC primari da piccole quantità di tessuto mammario mediante digestione con una miscela di enzimi combinata con una coltura iniziale in siero fetale bovino-DMEM al 5% contenente l'inibitore della chinasi associata a Rho (ROCK) Y-27632, seguita da espansione della coltura in terreno cheratinocitario privo di siero. Questo approccio promuove selettivamente la crescita delle cellule epiteliali, con conseguente resa cellulare ottimizzata. La semplicità e la convenienza di questo metodo lo rendono adatto sia per la ricerca di laboratorio che per quella clinica, che dovrebbe fornire preziose informazioni su queste importanti aree di studio.
Introduzione
Il cancro al seno è il principale tipo di cancro diagnosticato nelle donne a livello globale ed è la principale causa di morte per cancro1. La patogenesi del cancro al seno è complessa e coinvolge molteplici fattori come la genetica, l'ambiente e lo stile di vita. Le HMEC, cellule attive che producono latte, sono uno dei componenti più importanti del tessuto mammario e probabilmente sono le cellule originali coinvolte nella carcinogenesi del cancro al seno. Pertanto, gli HMEC hanno ricevuto la massima attenzione dai ricercatori per lo studio del cancro al seno2. Inoltre, le cellule primarie hanno la capacità di fornire una caratterizzazione biologicamente rilevante di processi cellulari complessi grazie al loro mantenimento della stabilità genetica, della normale morfologia e di un insieme più completo di funzioni cellulari di base che non possono essere raggiunte con linee cellulari immortalizzate3. Pertanto, l'isolamento e la coltura degli HMEC primari è un passo essenziale per lo studio della maggior parte delle malattie legate al seno come il cancro al seno e le malattie infiammatorie al seno.
Attualmente, è stato stabilito un sistema stabile e riproducibile per l'isolamento, la coltura e l'identificazione di cellule epiteliali mammarie da ratti, mucche, suini e capre 4,5,6,7. Tuttavia, l'isolamento e la coltura degli HMEC primari sono difficili a causa del complesso microambiente e della bassa resa delle cellule. Per decenni, gli scienziati hanno cercato il metodo più efficace per isolare e coltivare gli HMEC, anche se un sistema di coltura per gli HMEC è stato istituito quasi 20 anni fa. Ad esempio, Hammond et al. hanno sviluppato un terreno di coltura privo di siero in cui gli HMEC sono cresciuti in modo efficiente8. Recentemente, Zubeldia-Plazaola et al. hanno testato quattro diversi metodi di isolamento utilizzando procedure di digestione enzimatica veloce/lenta combinate con fasi di filtrazione sequenziale o centrifugazione differenziale per ottenere HMEC9. Hanno scoperto che il metodo della digestione lenta insieme alla centrifugazione differenziale è il metodo più efficiente per isolare gli HMEC dal tessuto mammario fresco. Tuttavia, questo metodo di isolamento richiede grandi pezzi di tessuto (40-75 g) e utilizza quantità maggiori di enzimi per la digestione. La loro procedura è complicata (almeno tre diverse centrifugazioni per ottenere diverse frazioni cellulari), oltre che dispendiosa in termini di tempo. Pertanto, è ancora necessario un metodo semplice e rapido per ottenere in modo efficiente popolazioni di HMEC da piccole quantità di tessuto mammario per la ricerca e le applicazioni cliniche9.
I nostri studi precedenti hanno dimostrato che l'aggiunta dell'inibitore della chinasi associata Rho (ROCK) Y-27632 nel terreno di coltura iniziale può semplificare il processo di isolamento delle cellule epidermiche della pelle umana10, che è stato utilizzato con successo anche per l'isolamento delle cellule epiteliali gengivali11. Inoltre, ricerche precedenti condotte dal gruppo di Zubeldia-Plazaola e dal gruppo di Jin hanno indicato che Y-27632 ha la capacità di stimolare la crescita rapida e illimitata in vitro di cellule epiteliali primarie derivate dal tessuto mammario 9,12. Il presente studio mirava a verificare se l'uso di Y-27632 avrebbe semplificato l'isolamento e la coltura degli HMEC e abbiamo stabilito con successo un metodo semplice e facilmente eseguibile per isolare gli HMEC da piccoli pezzi (1 g) di tessuto mammario.
Protocollo
I tessuti mammari freschi e normali utilizzati in questo protocollo vengono raccolti dalla chirurgia intorno alla lesione della mastite lobulare granulomatosa refrattaria nel primo ospedale affiliato dell'Università di medicina cinese di Zhejiang secondo le linee guida del Comitato etico medico del primo ospedale affiliato dell'Università di medicina cinese di Zhejiang (protocollo n. ChiMCTR2100005281, Data: 2017-07-17).
1. Acquisizione di tessuti
- Raccogliere tessuti mammari freschi da campioni chirurgici prelevati da donne adulte in provette sterili contenenti 10 mL di soluzione salina tamponata con fosfato (PBS) con il 3% di penicillina/streptomicina (P/S).
NOTA: I tessuti mammari devono essere maneggiati secondo i seguenti dettagli entro 24 ore dal prelievo dall'intervento.
2. Pretrattamento dei tessuti
- Rimuovere il tessuto adiposo dal tessuto mammario con due paia di pinze, assicurandosi che il tessuto mammario rimanente abbia un peso di ~1 g.
- Sciacquare il tessuto mammario in una soluzione di etanolo al 75% (5 mL) per 5 s e quindi lavare con 20 mL di soluzione di lavaggio (Tabella 1) per 2 x 5 min.
3. Digestione dei tessuti
- Tagliare il tessuto mammario in frammenti più piccoli, sminuzzando il tessuto utilizzando due lame chirurgiche per una durata di 15 minuti per ottenere l'omogeneizzato tissutale. Trasferire i pezzi di tessuto in una provetta da centrifuga da 50 ml.
- Aggiungere 10 mL di 5,0 mg/mL di dispasi + 5,0 mg/mL di soluzione di collagenasi, 3 mL di tripsina allo 0,25% e 7 mL di PBS per un totale di 20 mL di soluzione digestiva in una provetta da centrifuga da 50 mL che contiene i frammenti di tessuto mammario. Porre la provetta a bagnomaria a 37 °C e incubare per 1,5 h; Agitare il tubo ogni 20 minuti.
- Arrestare il processo di digestione iniettando 20 ml di soluzione neutralizzante. Miscelare il contenuto pipettando ~15x.
- Filtrare la miscela attraverso un filtro a maglie da 100 μm. Centrifugare a 156 × g per 5 min.
- Rimuovere il surnatante e ripetere l'incubazione del pellet con 20 mL di soluzione neutralizzante. Miscelare il contenuto pipettando 15 volte e centrifugare a 156 × g per 5 minuti.
- Rimuovere con cautela il surnatante e risospendere il pellet cellulare con 10 mL di terreno di coltura iniziale. Piastra la sospensione cellulare in una piastra per coltura cellulare da 100 mm.
- Coltivare le cellule in un incubatore al 5% di CO2 a 37 °C. Sostituire il terreno di coltura originale con un terreno di coltura epiteliale fresco ogni tre giorni. Controllare le celle e rinfrescare il terreno ogni 2 giorni.
4. Passaggio di celle
- Rimuovere la piastra da 100 mm dall'incubatore quando le cellule raggiungono l'80%-90% di confluenza, scartare il terreno utilizzato e sciacquare la piastra 2 volte con 2 mL di PBS. Rimuovere il PBS e quindi aggiungere 2 ml di tripsina allo 0,05% in ogni piatto da 100 mm.
NOTA: Agitare la pirofila per assicurarsi che la soluzione di tripsina sia a contatto sufficiente con il fondo della piastra. - Posizionare la piastra da 100 mm in un'incubatrice a 37 °C per ~7 minuti per il processo di digestione.
- Esamina le cellule con un microscopio utilizzando un obiettivo 40x per assicurarti che la maggior parte delle cellule sia stata dissociata dal fondo del piatto.
- Arrestare il processo di digestione aggiungendo 8 ml di soluzione neutralizzante e trasferire le cellule in una provetta da 15 ml. Mescolare le cellule pipettando su e giù 10-15 volte. Centrifugare le celle a 156 × g per 5 min.
- Rimuovere con cura il surnatante, risospendere le cellule con 10 ml di terreno cellulare epiteliale e contare il numero di cellule.
- Aggiungere 1 × 106 cellule in 10 mL di terreno cellulare epiteliale in un piatto da 100 mm.
- Rinfrescare il terreno cellulare epiteliale e osservare le cellule ogni 2 giorni.
5. Crioconservazione cellulare
- Ripetere i passaggi 4.1-4.4.
- Rimuovere con cura il surnatante e risospendere le cellule in 2 mL di soluzione di crioconservazione cellulare.
- Trasferire 1 mL della soluzione di crioconservazione contenente le cellule in ciascuna fiala criogenica.
- Annota i nomi delle celle crioconservate, i numeri di passaggio e le date.
- Porre i flaconcini in un contenitore di congelamento a velocità controllata a -80 °C per una notte.
- Rimuovere le fiale criogeniche dal congelatore a -80 °C e trasferirle rapidamente in azoto liquido per una conservazione a lungo termine.
Risultati
Nella Figura 1 viene illustrato uno schema della procedura. Il protocollo prevede l'uso di una combinazione di enzimi, vale a dire dispasi, collagenasi e tripsina. Questa combinazione viene utilizzata allo scopo di staccare il foglio epiteliale dallo strato di fibroblasti sottostante e successivamente utilizzare la tripsina per dissociare le cellule epiteliali mammarie in una sospensione. Inoltre, la crescita delle cellule epiteliali è stata efficacemente promossa aggiungendo Y-27632 al terreno di coltura iniziale. Di conseguenza, questo metodo produce un gran numero di HMEC, soddisfacendo i requisiti per il passaggio in una media di soli 10 giorni.
Per testare il ruolo cruciale di Y-27632 nella crescita cellulare dopo l'isolamento, abbiamo diviso le cellule appena isolate in due gruppi: un gruppo è stato placcato con il terreno iniziale contenente 10 mM di Y-27632 (Figura 2A); l'altro gruppo è stato placcato con il mezzo iniziale senza aggiungere Y-27632 come gruppo di controllo (Figura 2B). Dopo 2 giorni di coltura, le cellule di entrambi i gruppi sono state passate al terreno cellulare epidermico (Figura 1). Dalla Figura 2, possiamo osservare che, rispetto al terzo giorno, il metodo con Y-27632 ha notevolmente aumentato il numero di HMEC al nono giorno. Gli HMEC formavano un gruppo coeso simile a un'isola che aveva confini distinti e forti connessioni tra le cellule. Queste cellule si sono espanse verso l'esterno nell'ambiente circostante. Le cellule placcate con Y-27632 (Figura 2A) sono cresciute molto più velocemente delle cellule del gruppo di controllo (Figura 2B). Per confermare che l'itlo-27632 migliora la crescita dell'HMEC, le cellule P0 congelate sono state scongelate e piastrate con o senza l'aggiunta di 10 mM di Y-27632 e le cellule di passaggio 1 (P1) sono state raccolte in giorni diversi, come mostrato nella Figura 3. Le cellule sono state analizzate per la vitalità e la proliferazione utilizzando il kit per la conta cellulare-8 (CCK-8). Come mostrato nella Figura 3, il tasso di crescita delle cellule trattate con terreno contenente Y-27632 era significativamente superiore a quello delle cellule del gruppo di controllo senza Y-27632. Mettendo insieme questi dati, si può vedere che l'aggiunta di Y-27632 nel terreno iniziale migliora significativamente la crescita delle cellule attaccate dopo l'isolamento.
Per verificare che le cellule ottenute con questo metodo siano HMEC, abbiamo eseguito analisi in immunofluorescenza di PMEC P0 per due marcatori di cellule epiteliali mammarie: CK7 e GATA3. CK7, una citocheratina diagnosticamente importante, è un marcatore di differenziazione ghiandolare nell'epitelio mammario normale e nei suoi processi epiteliali proliferativi13. Inoltre, Kouros-Mehr et al. hanno riportato che GATA3 funziona come fattore di trascrizione all'interno delle cellule epiteliali mammarie ed è coinvolto nel sostenere la differenziazione epiteliale luminale nelle ghiandole mammarie completamente sviluppate14. Come mostrato nella Figura 3, le cellule che abbiamo coltivato ed espanso esprimono fortemente sia CK7 (Figura 4A) che GATA3 (Figura 4B). L'analisi di quantificazione delle cellule CK7 e GATA3-positive ha mostrato che oltre il 98% delle cellule esprimeva sia CK7 che GATA3 (Figura 4C), indicando una contaminazione limitata di altri tipi di cellule, come i fibroblasti. Occasionalmente abbiamo osservato un numero limitato di cellule simili ai fibroblasti (morfologia allungata) nella coltura iniziale (P0, Figura 2), ma raramente vediamo queste cellule apparire nelle cellule passate (P3, Figura 4D).
Per verificare se la caratteristica epiteliale degli HMEC può essere mantenuta dopo diversi passaggi, abbiamo eseguito l'analisi qRT-PCR dei marcatori delle cellule epiteliali mammarie CK7 e GATA3 nelle cellule coltivate con o senza Y-27632 (Figura 5). I livelli di espressione di CK7 e GATA3 non erano significativamente diversi nelle cellule P0 e P3, con o senza Y-27632, indicando che le loro caratteristiche fenotipiche e differenziative non cambiavano nel tempo durante l'espansione della coltura.
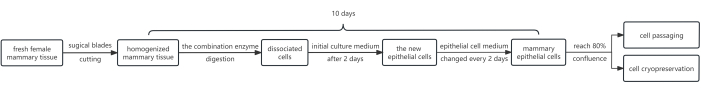
Figura 1: Diagramma di flusso del protocollo per isolare e coltivare gli HMEC. Inizialmente, i frammenti di tessuto mammario femminile sono stati tagliati con lame chirurgiche e digeriti con una combinazione di enzimi. Successivamente, i pellet cellulari ottenuti sono stati coltivati in terreno di coltura iniziale contenente 10 mM di Y-27632. Dopo 2 giorni, il terreno di coltura iniziale è stato sostituito con terreno cellulare epiteliale. Le cellule epiteliali mammarie sono state coltivate in terreno cellulare epidermico per ottenere una copertura soddisfacente dopo ~8 giorni, ora adatta per il passaggio. Se necessario, alcune cellule possono essere sottoposte a crioconservazione cellulare. Abbreviazione: HMEC = cellule epiteliali mammarie umane. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Immagini di HMEC ottenute dopo l'inoculazione iniziale. Entro 2 giorni dall'inoculazione, (A) gli HMEC primari sono stati coltivati nel terreno iniziale contenente Y-27632 e (B) gli HMEC primari sono stati coltivati nel terreno iniziale senza Y-27632. Dopo un periodo di coltura di 48 ore, il terreno di coltura dei cheratinociti privo di siero è stato sostituito in entrambi i gruppi. Sono state scattate foto per registrare lo stato di crescita delle cellule a giorni alterni. Entrambe le serie di immagini rappresentative sono state scattate utilizzando un microscopio invertito (100x) nei giorni 3, 5 e 9 dopo l'inoculazione. Barre di scala = 100 μm. Abbreviazione: HMEC = cellule epiteliali mammarie umane. Clicca qui per visualizzare una versione più grande di questa figura.
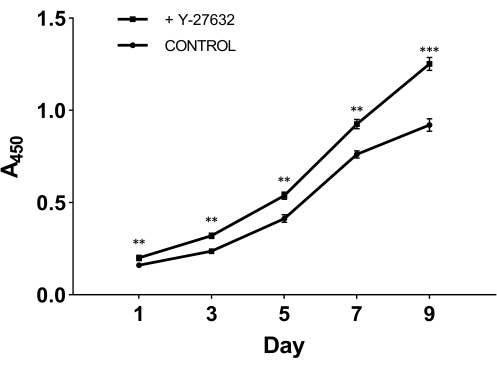
Figura 3: Crescita migliorata degli HMEC del Passaggio 1 (P1) con Y-27632. Le cellule P0 congelate sono state scongelate e coltivate con o senza Y-27632. Le cellule (P1) sono state raccolte per 1, 3, 5, 7 e 9 giorni e l'assorbanza è stata analizzata a 450 nm utilizzando il kit CCK-8. Il giorno 1, il numero di cellule vitali aderenti nel terreno iniziale contenente Y-27632 era significativamente più alto di quello senza Y-27632. Inoltre, la curva di crescita delle cellule trattate con Y-27632 ha mostrato un aumento più ripido. **p < 0,01, ***p < 0,001. Abbreviazione: HMEC = cellule epiteliali mammarie umane. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Espressione dei marcatori HMEC (P0). L'espressione di CK7 e GATA3 negli HMEC è stata analizzata mediante colorazione in immunofluorescenza. Gli HMEC sono stati colorati per (A) CK7 (rosso) e (B) GATA3 (rosso); Il DAPI (blu) è stato utilizzato per colorare i nuclei. Le immagini sono state scattate utilizzando un microscopio confocale a scansione laser (400x). Barre della scala = 20 μm. (C) La percentuale di cellule positive nella colorazione; D) l'immagine rappresentativa degli HMEC (P3). Barre di scala = 100 μm. Clicca qui per visualizzare una versione più grande di questa figura.
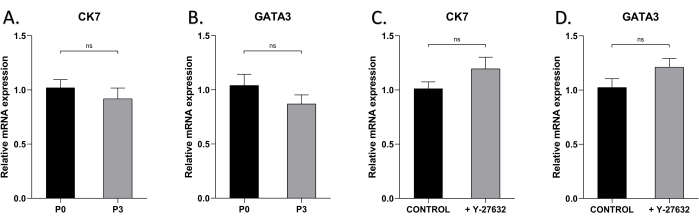
Figura 5: L'espressione di CK7 e GATA3 degli HMEC a P0 e P3. Utilizzo della qRT-PCR per rilevare l'espressione di (A) CK7 negli HMEC di P0 e P3 il giorno 7, (B) GATA3 negli HMEC di P0 e P3, (C) CK7 negli HMEC P1 coltivati con o senza Y27632 il giorno 7, (D) GATA3 negli HMEC P1 coltivati con o senza Y-27632 il giorno 7. nsp > 0,05. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Gli HMEC sono vitali per preservare l'integrità anatomica e funzionale del tessuto mammario e sono utili nelle indagini scientifiche, nelle implementazioni cliniche e nei domini associati15. Le cellule epiteliali primarie sono un tipo di cellule specializzate che hanno passaggi limitati e una durata di vita più breve. Tuttavia, la crescita degli HMEC è stata ostacolata da vincoli tecnici, che hanno di conseguenza ostacolato i progressi della ricerca sul cancro al seno e su altre malattie infiammatorie correlate al seno16.
Pertanto, vi è un urgente bisogno di sviluppare un metodo stabile, fattibile ed efficiente per ottenere HMEC da tessuti mammari freschi. Hammond et al.8 e Band and Sager17 hanno estratto e coltivato con successo cellule epiteliali mammarie. Tuttavia, la composizione del terreno di coltura richiesto era eccessivamente complessa. Precedenti studi di Taylor-Papidamitriou et al. hanno dimostrato che le cellule della cavità del latte materno potrebbero essere coltivate utilizzando un terreno integrato con fattori di crescita e siero18. Sebbene il loro metodo consenta l'estrazione diretta di HMEC dal latte materno, la presenza di cellule non epiteliali può influire sulla crescita degli HMEC, rendendo difficile determinare con precisione la conta cellulare. Jin et al. hanno sviluppato un metodo di riprogrammazione condizionale che ha permesso agli HMEC primari di avere un ciclo di vita più lungo e di mantenere l'eterogeneità cellulare rispetto ai metodi di coltura tradizionali, ma dipendeva fortemente da specifiche condizioni di coltura e limitava l'uso di questo metodo in altri laboratori e applicazioni12.
Uno studio del gruppo di Zubeldia-Plazaola ha stabilito un metodo di isolamento ottimizzato che prevedeva la digestione lenta (durante la notte) di frammenti di tessuto tritati mediante una miscela di collagenasi e ialuronidasi, seguita da tre centrifugazioni differenziali il secondo giorno per separare le frazioni stromali/epitelio. Questo metodo di isolamento, più l'aggiunta di Y-27632 nella coltura, ha prodotto un numero elevato di cellule epiteliali vitali. Tuttavia, la quantità di tessuto mammario utilizzata nel loro studio era di 40-75 g e la procedura di isolamento è durata quasi 2 giorni9. Qui, riportiamo l'uso di solo 1 g di tessuto in questo protocollo, e abbiamo testato e scoperto che questo metodo funzionava anche per un minimo di 0,25 g di tessuto. La miscela enzimatica di collagenasi, dispasi e tripsina ha digerito in modo efficiente 1 g di tessuto in 1,5 ore e l'intera procedura ha richiesto ~3 ore. L'aggiunta di Y-27632 al terreno di coltura iniziale può promuovere l'adesione e la proliferazione delle cellule epiteliali, ma anche inibire la crescita delle cellule stromali19. È importante sottolineare che in questo studio abbiamo testato i componenti del terreno iniziale e abbiamo scoperto che il 5% di FBS nel DMEM per sostituire il mezzo G utilizzato nella pubblicazione precedente era sufficiente per promuovere l'adesione e la crescita delle cellule epidermiche10.
Dopo 2 giorni di coltura nel terreno iniziale, le cellule sono state coltivate in terreno cheratinocitario privo di siero. Il modello di crescita cellulare per la coltura iniziale (P0) dopo l'inoculazione è mostrato nella Figura 2, che mostra un modello di crescita delle colonie. Questo metodo di isolamento probabilmente produce tutti i tipi di cellule epiteliali, comprese le cellule mioepiteliali dei tessuti mammari, che devono essere ulteriormente caratterizzate in futuro. Tuttavia, confrontando la crescita delle cellule in presenza di Y-27632 con il gruppo di controllo senza aggiungere Y-27632 al terreno di coltura iniziale, abbiamo potuto vedere che il metodo con Y-27632 ha migliorato significativamente la produzione cellulare e l'efficienza della coltura cellulare (Figura 2A). Di solito ~9-10 giorni di coltura dopo l'inoculazione, le cellule epidermiche potrebbero raggiungere una densità adatta al passaggio. Inoltre, abbiamo anche dimostrato che la presenza di Y-27632 potrebbe aumentare la crescita di HMEC P1 dopo aver recuperato le cellule P0 congelate alla fine della coltura iniziale (Figura 3). Nelle nostre mani, abbiamo scoperto che oltre il 90% delle cellule è stato in grado di sopravvivere dopo essere stato scongelato dalla conservazione congelata. Le cellule hanno avuto un tempo di raddoppio di circa 72 ore e gli HMEC sono stati in grado di mantenere una crescita normale fino al 7° passaggio.
In questo studio, le cellule esprimevano alti livelli di marcatori delle cellule epiteliali mammarie CK7 e GATA3 e, soprattutto, quasi il 100% delle cellule nella fase avanzata della coltura iniziale era positivo per CK7 e GATA3 (Figura 4), indicando un'elevata purezza delle cellule epiteliali ottenute con questo metodo. Infine, questo studio ha confrontato i livelli di espressione di CK7 e GATA3 nelle cellule P0 e P3, rivelando alti livelli di espressione in entrambe, suggerendo che il passaggio non ha alterato il fenotipo delle cellule (Figura 5A, B). Inoltre, indipendentemente dalla presenza di Y-27632, CK7 e GATA3 erano costantemente altamente espressi, il che implica che l'aggiunta di Y-27632 non ha influenzato il fenotipo cellulare (Figura 5C, D).
La causa principale dell'aumento della proliferazione cellulare attraverso il nostro approccio è l'inclusione di Y-27632, che ha dimostrato di avere un impatto vantaggioso sulla moltiplicazione e la specializzazione delle cellule epiteliali umane19,20. Chapman et al. hanno scoperto che l'uso di Y-27632 ha migliorato significativamente la capacità delle cellule epiteliali di moltiplicarsi e ha portato al successo dell'immortalizzazione delle cellule senza alcun segno di crisi cellulare21. Nel nostro studio, Y-27632 ha aumentato significativamente la resa di queste cellule epiteliali migliorandone l'attaccamento e la proliferazione19.
Una caratteristica chiave di questo metodo è la combinazione di dispasi e collagenasi per separare il tessuto epiteliale dal tessuto connettivo, impiegando anche la tripsina per dissociare le cellule epiteliali dal tessuto epiteliale22. La dispasi ha dimostrato di essere un enzima rapido, efficiente ma delicato, in grado di separare l'epidermide non danneggiata dal derma, nonché gli strati non danneggiati di cellule epiteliali in coltura dalla superficie sottostante, il tutto mantenendo la vitalità delle cellule epiteliali23. La collagenasi di tipo I facilita l'isolamento delle cellule epiteliali e garantisce la vitalità e l'integrità delle cellule24. Un'altra caratteristica chiave di questo metodo è l'utilizzo del terreno iniziale con Y-27632 per coltivare gli HMEC appena isolati. Dopo che le cellule hanno aderito alla piastra il terzo giorno, il terreno di coltura viene cambiato in terreno privo di siero per cheratinociti. Questo approccio semplifica notevolmente le fasi sperimentali e riduce il costo dell'esperimento. Di conseguenza, con questo metodo abbiamo ottenuto un numero di cellule molto soddisfacente utilizzando solo un piccolo volume di tessuto mammario, il che indica che non è necessaria una grande quantità di tessuto iniziale. Tuttavia, uno svantaggio di questo approccio è che la presenza di tripsina non protegge adeguatamente l'integrità delle cellule epiteliali. Un altro aspetto potenzialmente limitante del metodo è la possibilità di una piccola contaminazione (<1%) delle cellule mioepiteliali durante la coltura iniziale9.
Il nostro metodo offre un approccio semplificato ed efficiente per l'isolamento e la coltura di HMEC primari derivati da tessuto mammario adulto. Questa tecnica si caratterizza per la sua semplicità, il suo risparmio di tempo e la sua capacità di mantenere le funzioni cellulari fondamentali. Di conseguenza, questa tecnica presenta evidenti vantaggi ed è molto promettente per la generazione di una notevole quantità di cellule epiteliali. Inoltre, il metodo consente l'isolamento e la coltura di HMEC da un'ampia gamma di donatori, adatto sia per la ricerca di laboratorio che per le applicazioni cliniche, rendendolo altamente versatile e ampiamente applicabile.
Divulgazioni
Gli autori dichiarano che non vi sono conflitti di interesse in merito alla pubblicazione di questo articolo.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni del programma di scienza e tecnologia TCM della provincia di Zhejiang, Cina (2017ZA055; 2018ZA036) e il progetto scientifico e tecnologico di Zunyi, provincia di Guizhou, Cina (Zunyi City Kehe Support NS (2020) n. 18) a X. Xu. Gli autori ringraziano il Laboratorio di Biologia Molecolare della Società di Tecnologia Biomedica Youjia (Hangzhou) per aver fornito formazione sulle colture cellulari.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin | Basalmedia | K431010 | For HMECs dissociation |
| 1.5 mL microcentrifuge Tubes | NEST | 081722CK01 | For cell digestion |
| 100 µm mesh filter | Solarbio | 431752 | For HMECs filtration |
| 100 mm Cell Culture Dish | Corning | 430167 | For cell culture |
| 4% paraformaldehyde | solarbio | P1110-100ml | For immunofluorescence staining to check differentiation marker of HMECs |
| 50 mL Centrifuge Tube | Corning | 430829 | For cell centrifugation |
| Cell Strainer | Solarbio | 431752 | Cell filtration |
| Centrifuge | Eppendorf | 5404HN133048 | Cell centrifuge |
| CO2 Incubator | Thermo Scientific | 42820906 | For cell incubation |
| Collagenase Type I | Merck | SKU:SCR103 | For HMECs isolation |
| Dispase | Solarbio | CAS:42613-33-2 | For HMECs isolation |
| DMEM | Gibco | 8122622 | Component of neutralization medium |
| Fetal Bovine Serum | Gibco | 2556132P | Component of neutralization medium |
| Penicillin/Streptomycin | Thermo Scientific | 15140-122 | Antibiotics |
| Phosphate buffered solution | Tecono | 20201033 | Washing solution |
| rabbit anti CK7 | abcam | ab68459 | For immunofluorescence staining to check differentiation marker of HMECs |
| rabbit anti GATA3 | abcam | ab199428 | For immunofluorescence staining to check differentiation marker of HMECs |
| Y-27632 | Solarbio | IY0040 | ROCK inhibitor |
Riferimenti
- Smolarz, B., Nowak, A. Z., Romanowicz, H. Breast cancer-epidemiology, classification, pathogenesis and treatment (review of literature). Cancers (Basel). 14 (10), 2569 (2022).
- Gudjonsson, T., Adriance, M. C., Sternlicht, M. D., Petersen, O. W., Bissell, M. J. Myoepithelial cells: Their origin and function in breast morphogenesis and neoplasia. J Mammary Gland Biol Neoplasia. 10 (3), 261-272 (2005).
- Faridi, N., et al. Isolation and characterization of the primary epithelial breast cancer cells and the adjacent normal epithelial cells from iranian women's breast cancer tumors. Cytotechnology. 70 (2), 625-639 (2018).
- Tovar, E. A., et al. Dissecting the rat mammary gland: Isolation, characterization, and culture of purified mammary epithelial cells and fibroblasts. Bio Protoc. 10 (22), e3818 (2020).
- Jiang, X., Yang, H., Jing, Q., He, X. A "selective secondary tissue attachment" method for isolation and purification of mammary epithelial cells. Acta Histochem. 124 (8), 151972 (2022).
- Bernardini, C., et al. Development of a pig mammary epithelial cell culture model as a non-clinical tool for studying epithelial barrier-a contribution from the imi-conception project. Animals (Basel). 11 (7), 2012 (2021).
- Zhang, D., et al. Transdifferentiation of goat ear fibroblasts into lactating mammary epithelial cells induced by small molecule compounds. Biochem Biophys Res Commun. 573, 55-61 (2021).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: Rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc Natl Acad Sci U S A. 81 (17), 5435-5439 (1984).
- Zubeldia-Plazaola, A., et al. Comparison of methods for the isolation of human breast epithelial and myoepithelial cells. Front Cell Dev Biol. 3, 32 (2015).
- Liu, Z., et al. A simplified and efficient method to isolate primary human keratinocytes from adult skin tissue. J Vis Exp. (138), e57784 (2018).
- Xie, Z., et al. Isolation and culture of primary human gingival epithelial cells using y-27632. J Vis Exp. (177), e62978 (2021).
- Jin, L., et al. Characterization of primary human mammary epithelial cells isolated and propagated by conditional reprogrammed cell culture. Oncotarget. 9 (14), 11503-11514 (2018).
- Böcker, W., Hungermann, D., Decker, T. Anatomy of the breast. Pathologe. 30 (1), 6-12 (2009).
- Kouros-Mehr, H., Slorach, E. M., Sternlicht, M. D., Werb, Z. Gata-3 maintains the differentiation of the luminal cell fate in the mammary gland. Cell. 127 (5), 1041-1055 (2006).
- Wang, X., Reagan, M. R., Kaplan, D. L. Synthetic adipose tissue models for studying mammary gland development and breast tissue engineering. J Mammary Gland Biol Neoplasia. 15 (3), 365-376 (2010).
- Ethier, S. P., Mahacek, M. L., Gullick, W. J., Frank, T. S., Weber, B. L. Differential isolation of normal luminal mammary epithelial cells and breast cancer cells from primary and metastatic sites using selective media. Cancer Res. 53 (3), 627-635 (1993).
- Band, V., Sager, R. Distinctive traits of normal and tumor-derived human mammary epithelial cells expressed in a medium that supports long-term growth of both cell types. Proc Natl Acad Sci U S A. 86 (4), 1249-1253 (1989).
- Taylor-Papadimitriou, J., Shearer, M., Tilly, R. Some properties of cells cultured from early-lactation human milk. J Natl Cancer Inst. 58 (6), 1563-1571 (1977).
- Wen, J., Zu, T., Zhou, Q., Leng, X., Wu, X. Y-27632 simplifies the isolation procedure of human primary epidermal cells by selectively blocking focal adhesion of dermal cells. J Tissue Eng Regen Med. 12 (2), e1251-e1255 (2018).
- Yin, J., Yu, F. S. Rho kinases regulate corneal epithelial wound healing. Am J Physiol Cell Physiol. 295 (2), C378-C387 (2008).
- Chapman, S., Liu, X., Meyers, C., Schlegel, R., Mcbride, A. A. Human keratinocytes are efficiently immortalized by a rho kinase inhibitor. J Clin Invest. 120 (7), 2619-2626 (2010).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Dermatol. 28 (2), 107-112 (2019).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. J Invest Dermatol. 93 (2), 287-290 (1989).
- Ren, H. J., et al. Primary cultures of mouse small intestinal epithelial cells using the dissociating enzyme type I collagenase and hyaluronidase. Braz J Med Biol Res. 50 (5), e5831 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon