Method Article
Isolement et culture de cellules épithéliales mammaires humaines primaires
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La présente étude fait état d’un protocole plus facile, rapide et économique permettant d’isoler et de cultiver efficacement des cellules épithéliales mammaires primaires (HMEC) humaines à partir de petites quantités de tissu mammaire. Ce protocole est adapté à la production rapide de HMEC primaires pour des applications de laboratoire et cliniques.
Résumé
La glande mammaire est une structure fondamentale du sein et joue un rôle essentiel dans la reproduction. Les cellules épithéliales mammaires humaines (HMEC), qui sont à l’origine du cancer du sein et d’autres maladies inflammatoires liées au sein, ont suscité une attention considérable. Cependant, l’isolement et la culture d’HMEC primaires in vitro à des fins de recherche ont été difficiles en raison de leur nature kératinisée hautement différenciée et de leur courte durée de vie. Par conséquent, le développement d’une méthode simple et efficace pour isoler et cultiver les HMEC est d’une grande valeur scientifique pour l’étude de la biologie du sein et des maladies liées au sein. Dans cette étude, nous avons réussi à isoler les HMEC primaires à partir de petites quantités de tissu mammaire par digestion avec un mélange d’enzymes combiné à une culture initiale dans du sérum fœtal bovin à 5 % contenant l’inhibiteur de la kinase associée à la Rho (ROCK) Y-27632, suivie d’une expansion de la culture dans un milieu kératinocytaire sans sérum. Cette approche favorise sélectivement la croissance des cellules épithéliales, ce qui permet d’optimiser le rendement cellulaire. La simplicité et la commodité de cette méthode la rendent adaptée à la fois à la recherche en laboratoire et à la recherche clinique, ce qui devrait fournir des informations précieuses sur ces domaines d’étude importants.
Introduction
Le cancer du sein est le principal type de cancer diagnostiqué chez les femmes dans le monde et est la principale cause de décès par cancer1. La pathogenèse du cancer du sein est complexe et implique de multiples facteurs tels que la génétique, l’environnement et le mode de vie. Les HMEC, cellules actives productrices de lait, sont l’un des composants les plus importants du tissu mammaire et sont probablement les cellules d’origine impliquées dans la cancérogenèse du cancer du sein. Par conséquent, les HMEC ont reçu le plus d’attention de la part des chercheurs pour l’étude du cancer du sein2. De plus, les cellules primaires ont la capacité de fournir une caractérisation biologiquement pertinente de processus cellulaires complexes en raison de leur stabilité génétique, de leur morphologie normale et d’un ensemble plus complet de fonctions cellulaires de base qui ne peuvent pas être réalisées avec des lignées cellulaires immortalisées3. Par conséquent, l’isolement et la culture des HMEC primaires sont une étape essentielle pour l’étude de la plupart des maladies liées au sein telles que le cancer du sein et les maladies inflammatoires du sein.
À l’heure actuelle, un système stable et reproductible pour l’isolement, la culture et l’identification des cellules épithéliales mammaires de rats, de vaches, de porcs et de chèvres a été mis en place 4,5,6,7. Cependant, l’isolement et la culture des HMEC primaires sont difficiles en raison de la complexité du microenvironnement et du faible rendement des cellules. Pendant des décennies, les scientifiques ont cherché la méthode la plus efficace pour isoler et cultiver les HMEC, bien qu’un système de culture pour les HMEC ait été établi il y a près de 20 ans. Par exemple, Hammond et al. ont mis au point un milieu de culture sans sérum dans lequel les HMEC se sont développés efficacement8. Récemment, Zubeldia-Plazaola et al. ont testé quatre méthodes d’isolement différentes en utilisant des procédures de digestion enzymatique rapide/lente combinées à des étapes de filtration séquentielle ou de centrifugation différentielle pour obtenir des HMEC9. Ils ont constaté que la méthode de digestion lente associée à la centrifugation différentielle est la méthode la plus efficace pour isoler les HMEC du tissu mammaire frais. Cependant, cette méthode d’isolement nécessite de gros morceaux de tissu (40 à 75 g) et utilise de plus grandes quantités d’enzymes de digestion. Leur procédure est compliquée (au moins trois centrifugations différentes pour obtenir différentes fractions cellulaires), ainsi que chronophage. Par conséquent, une méthode simple et rapide est toujours nécessaire pour obtenir efficacement des populations de HMEC à partir de petites quantités de tissu mammaire pour la recherche et les applications cliniques9.
Nos études précédentes ont montré que l’ajout de l’inhibiteur de la kinase associée à la Rho (ROCK) Y-27632 dans le milieu de culture initial peut simplifier le processus d’isolement des cellules épidermiques de la peau humaine10, qui a également été utilisé avec succès pour l’isolement des cellules épithéliales gingivales11. De plus, des recherches antérieures menées par le groupe de Zubeldia-Plazaola et le groupe de Jin ont indiqué que le Y-27632 a la capacité de stimuler la croissance in vitro rapide et illimitée des cellules épithéliales primaires dérivées du tissu mammaire 9,12. La présente étude visait à vérifier si l’utilisation de l’Y-27632 simplifierait l’isolement et la culture des HMEC et nous avons réussi à établir une méthode simple et facile à réaliser pour isoler les HMEC à partir de petits morceaux (1 g) de tissu mammaire.
Protocole
Les tissus mammaires normaux frais utilisés dans ce protocole sont prélevés lors d’une intervention chirurgicale autour de la lésion de la mammite lobulaire granulomateuse réfractaire dans le premier hôpital affilié de l’Université de médecine chinoise du Zhejiang, conformément aux directives du Comité d’éthique médicale du premier hôpital affilié de l’Université de médecine chinoise du Zhejiang (protocole n° ChiMCTR2100005281, Date : 2017-07-17).
1. Acquisition de tissus
- Prélever des tissus mammaires frais à partir d’échantillons chirurgicaux prélevés sur des femmes adultes dans des tubes stériles contenant 10 ml de solution saline tamponnée au phosphate (PBS) avec 3 % de pénicilline/streptomycine (P/S).
REMARQUE : Les tissus mammaires doivent être manipulés conformément aux détails suivants dans les 24 heures suivant le prélèvement de la chirurgie.
2. Prétraitement des tissus
- Retirez le tissu adipeux du tissu mammaire à l’aide de deux paires de pinces, en veillant à ce que le tissu mammaire restant pèse ~1 g.
- Rincer le tissu mammaire dans une solution d’éthanol à 75 % (5 ml) pendant 5 s, puis laver avec 20 ml de solution de lavage (tableau 1) pendant 2 x 5 min.
3. Digestion des tissus
- Coupez le tissu mammaire en fragments plus petits, en déchiquetant le tissu à l’aide de deux lames chirurgicales pendant une durée de 15 min pour obtenir l’homogénat du tissu. Transférez les morceaux de tissu dans un tube à centrifuger de 50 ml.
- Ajouter 10 mL de dispase à 5,0 mg/mL + 5,0 mg/mL de solution de collagénase, 3 mL de trypsine à 0,25 % et 7 mL de PBS à un total de 20 mL de solution de digestion dans un tube à centrifuger de 50 mL contenant les fragments de tissu mammaire. Placez le tube dans un bain-marie à 37 °C et incubez pendant 1,5 h ; Agitez le tube toutes les 20 min.
- Arrêtez le processus de digestion en injectant 20 ml de la solution neutralisante. Mélangez le contenu en pipetant ~15x.
- Filtrez le mélange à travers un filtre à mailles de 100 μm. Centrifuger à 156 × g pendant 5 min.
- Retirer le surnageant et répéter l’incubation de la pastille avec 20 mL de solution neutralisante. Mélanger le contenu en pipetant 15x et centrifuger à 156 × g pendant 5 min.
- Retirer le surnageant avec précaution et remettre en suspension la pastille de cellule avec 10 mL de milieu de culture initial. Plaquez la suspension cellulaire dans une boîte de culture cellulaire de 100 mm.
- Cultivez les cellules dans un incubateur à 5 % de CO2 à 37 °C. Remplacer le milieu de culture d’origine par un milieu de cellules épithéliales frais tous les trois jours. Vérifiez les cellules et actualisez le milieu tous les 2 jours.
4. Passage cellulaire
- Retirez la boîte de 100 mm de l’incubateur lorsque les cellules atteignent une confluence de 80 à 90 %, jetez le milieu utilisé et rincez la boîte 2 fois avec 2 ml de PBS. Retirer le PBS, puis ajouter 2 ml de trypsine à 0,05 % dans chaque boîte de 100 mm.
REMARQUE : Agitez le plat pour vous assurer que la solution de trypsine a un contact suffisant avec le fond du bol. - Placez la parabole de 100 mm dans un incubateur à 37 °C pendant ~7 min pour le processus de digestion.
- Examinez les cellules au microscope à l’aide d’un objectif 40x pour vous assurer que la plupart des cellules ont été dissociées du fond de la boîte.
- Arrêtez le processus de digestion en ajoutant 8 ml de solution neutralisante et transférez les cellules dans un tube de 15 ml. Mélangez les cellules en pipetant de haut en bas 10 à 15 fois. Centrifuger les cellules à 156 × g pendant 5 min.
- Retirez le surnageant avec précaution, remettez les cellules en suspension avec 10 ml de milieu cellulaire épithélial et comptez le nombre de cellules.
- Ajouter 1 × 106 cellules dans 10 mL de milieu cellulaire épithélial dans une boîte de 100 mm.
- Rafraîchissez le milieu cellulaire épithélial et observez les cellules tous les 2 jours.
5. Cryoconservation cellulaire
- Répétez les étapes 4.1 à 4.4.
- Retirez le surnageant avec précaution et remettez les cellules en suspension dans 2 mL de solution de cryoconservation cellulaire.
- Transférez 1 mL de la solution de cryoconservation contenant les cellules dans chaque flacon cryogénique.
- Notez les noms des cellules cryoconservées, les numéros de passage et les dates.
- Placez les flacons dans un récipient de congélation à débit contrôlé à -80 °C pendant la nuit.
- Retirez les flacons cryogéniques du congélateur à -80 °C et transférez-les rapidement dans de l’azote liquide pour un stockage à long terme.
Résultats
La figure 1 montre un schéma de la procédure. Le protocole implique l’utilisation d’une combinaison d’enzymes, à savoir la dispase, la collagénase et la trypsine. Cette combinaison est utilisée dans le but de détacher la feuille épithéliale de la couche de fibroblastes située en dessous, puis d’utiliser la trypsine pour dissocier les cellules épithéliales mammaires en une suspension. De plus, la croissance des cellules épithéliales a été efficacement favorisée par l’ajout de Y-27632 au milieu de culture initial. Par conséquent, cette méthode produit un grand nombre de HMEC, répondant aux exigences de passage en seulement 10 jours en moyenne.
Pour tester le rôle crucial de l’Y-27632 dans la croissance cellulaire après isolement, nous avons divisé les cellules fraîchement isolées en deux groupes : un groupe a été plaqué avec le milieu initial contenant 10 mM d’Y-27632 (Figure 2A) ; l’autre groupe a été plaqué avec le milieu initial sans ajouter Y-27632 comme groupe témoin (Figure 2B). Après 2 jours de culture, les cellules des deux groupes ont été transférées dans un milieu cellulaire épidermique (Figure 1). À partir de la figure 2, nous pouvons observer qu’en comparaison avec le troisième jour, la méthode avec Y-27632 a sensiblement augmenté le nombre de HMEC le neuvième jour. Les HMEC ont formé un groupe cohésif ressemblant à une île qui avait des limites distinctes et des connexions fortes entre les cellules. Ces cellules se sont étendues vers l’extérieur dans l’environnement environnant. Les cellules recouvertes d’Y-27632 (Figure 2A) ont grandi beaucoup plus rapidement que les cellules du groupe témoin (Figure 2B). Pour confirmer que le Y-27632 améliore la croissance du HMEC, les cellules P0 congelées ont été décongelées et plaquées avec ou sans ajout de 10 mM de Y-27632, et les cellules du passage 1 (P1) ont été prélevées à des jours différents, comme le montre la figure 3. La viabilité et la prolifération des cellules ont été analysées à l’aide du kit de comptage cellulaire 8 (CCK-8). Comme le montre la figure 3, le taux de croissance des cellules traitées avec un milieu contenant de l’Y-27632 était significativement plus élevé que celui des cellules du groupe témoin sans Y-27632. En prenant ces données ensemble, on peut voir que l’ajout de Y-27632 dans le milieu initial améliore considérablement la croissance des cellules attachées après l’isolement.
Pour vérifier que les cellules obtenues par cette méthode sont des HMEC, nous avons effectué une analyse par immunofluorescence des HMEC P0 pour deux marqueurs de cellules épithéliales mammaires : CK7 et GATA3. CK7, une cytokératine importante sur le plan diagnostique, est un marqueur de la différenciation glandulaire dans l’épithélium mammaire normal et ses processus épithéliales prolifératifs13. De plus, Kouros-Mehr et al. ont rapporté que GATA3 fonctionne comme un facteur de transcription dans les cellules épithéliales mammaires et est impliqué dans le maintien de la différenciation épithéliale luminale dans les glandes mammaires pleinement développées14. Comme le montre la figure 3, les cellules que nous avons cultivées et développées expriment fortement CK7 (figure 4A) et GATA3 (figure 4B). L’analyse de quantification des cellules CK7 et GATA3 positives a montré que plus de 98 % des cellules exprimaient à la fois CK7 et GATA3 (Figure 4C), indiquant une contamination limitée d’autres types de cellules, telles que les fibroblastes. Nous avons parfois observé un nombre limité de cellules de type fibroblaste (morphologie allongée) dans la culture initiale (P0, Figure 2), mais nous voyons rarement ces cellules apparaître dans les cellules traversées (P3, Figure 4D).
Pour tester si la caractéristique épithéliale des HMEC peut être maintenue après plusieurs passages, nous avons effectué l’analyse qRT-PCR des marqueurs de cellules épithéliales mammaires CK7 et GATA3 dans les cellules cultivées avec ou sans Y-27632 (Figure 5). Les niveaux d’expression de CK7 et de GATA3 n’étaient pas significativement différents dans les cellules P0 et P3, avec ou sans Y-27632, ce qui indique que leurs caractéristiques phénotypiques et de différenciation n’ont pas changé au fil du temps pendant l’expansion de la culture.
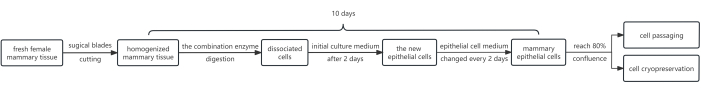
Figure 1 : Organigramme du protocole d’isolement et de culture des HMEC. Initialement, des fragments de tissu mammaire femelle ont été tranchés avec des lames chirurgicales et digérés avec une combinaison d’enzymes. Par la suite, les pastilles cellulaires obtenues ont été cultivées dans un milieu de culture initial contenant 10 mM d’Y-27632. Après 2 jours, le milieu de culture initial a été remplacé par un milieu de cellules épithéliales. Les cellules épithéliales mammaires ont été cultivées dans un milieu cellulaire épidermique pour obtenir une couverture satisfaisante après ~8 jours, maintenant aptes au passage. Si nécessaire, certaines cellules peuvent être soumises à une cryoconservation cellulaire. Abréviation : HMECs = cellules épithéliales mammaires humaines. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Images des HMEC obtenues après l’inoculation initiale. Dans les 2 jours suivant l’inoculation, (A) les HMEC primaires ont été cultivés dans un milieu initial contenant de l’Y-27632 et (B) les HMEC primaires ont été cultivés dans un milieu initial sans Y-27632. Après une période de culture de 48 h, le milieu de culture de kératinocytes exempt de sérum a été remplacé dans les deux groupes. Des photos ont été prises pour enregistrer l’état de croissance des cellules tous les deux jours. Les deux séries d’images représentatives ont été prises à l’aide d’un microscope inversé (100x) les jours 3, 5 et 9 après l’inoculation. Barres d’échelle = 100 μm. Abréviation : HMECs = cellules épithéliales mammaires humaines. Veuillez cliquer ici pour voir une version agrandie de cette figure.
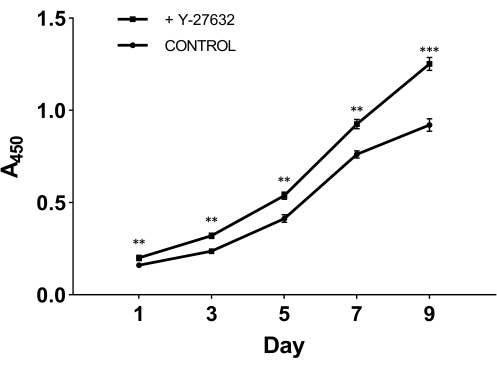
Figure 3 : Croissance accrue des HMEC du passage 1 (P1) avec Y-27632. Les cellules P0 congelées ont été décongelées et cultivées avec ou sans Y-27632. Les cellules (P1) ont été collectées pendant 1, 3, 5, 7 et 9 jours et l’absorbance a été analysée à 450 nm à l’aide du kit CCK-8. Au premier jour, le nombre de cellules viables adhérentes dans le milieu initial contenant de l’Y-27632 était significativement plus élevé que celui sans Y-27632. De plus, la courbe de croissance des cellules traitées avec l’Y-27632 a montré une augmentation plus abrupte. **p < 0,01, ***p < 0,001. Abréviation : HMECs = cellules épithéliales mammaires humaines. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Expression des marqueurs HMEC (P0). L’expression de CK7 et GATA3 dans les HMEC a été analysée par coloration par immunofluorescence. Les HMEC ont été colorés pour (A) CK7 (rouge) et (B) GATA3 (rouge) ; Le DAPI (bleu) a été utilisé pour colorer les noyaux. Les images ont été prises à l’aide d’un microscope confocal à balayage laser (400x). Barres d’échelle = 20 μm. (C) Le pourcentage de cellules positives dans la coloration ; (D) l’image représentative des HMEC (P3). Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
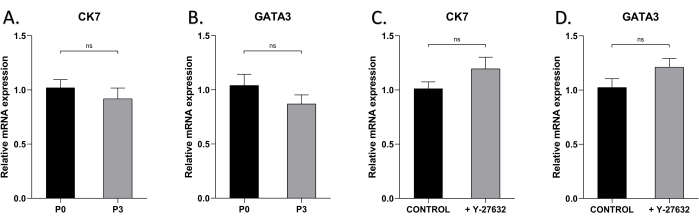
Figure 5 : L’expression de CK7 et GATA3 des HMEC à P0 et P3. Utilisation de la qRT-PCR pour détecter l’expression de (A) CK7 dans les HMEC de P0 et P3 le jour 7, (B) GATA3 dans les HMEC de P0 et P3, (C) CK7 dans les HMEC P1 cultivés avec ou sans Y27632 le jour 7, (D) GATA3 dans les HMEC P1 cultivés avec ou sans Y-27632 le jour 7. NsP > 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les HMEC sont essentiels à la préservation de l’intégrité anatomique et fonctionnelle du tissu mammaire et sont utiles dans les recherches scientifiques, les mises en œuvre cliniques et les domaines associés15. Les cellules épithéliales primaires sont un type de cellules spécialisées qui ont des passages limités et une durée de vie plus courte. Cependant, la croissance des HMEC a été entravée par des contraintes techniques, qui ont par conséquent entravé les progrès de la recherche sur le cancer du sein et d’autres maladies inflammatoires liées au sein16.
Par conséquent, il est urgent de mettre au point une méthode stable, réalisable et efficace pour obtenir des HMEC à partir de tissus mammaires frais. Hammond et al.8 et Band et Sager17 ont réussi à extraire et à cultiver des cellules épithéliales mammaires. Cependant, la composition du milieu de culture requis était trop complexe. Des études antérieures menées par Taylor-Papidamitriou et al. ont démontré que les cellules de la cavité du lait maternel pouvaient être cultivées à l’aide d’un milieu complété par des facteurs de croissance et du sérum18. Bien que leur méthode permette l’extraction directe des HMEC à partir du lait maternel, la présence de cellules non épithéliales peut avoir un impact sur la croissance des HMEC, ce qui rend difficile la détermination précise du nombre de cellules. Jin et al. ont mis au point une méthode de reprogrammation conditionnelle qui a permis aux HMEC primaires d’avoir un cycle de vie plus long et de conserver l’hétérogénéité cellulaire par rapport aux méthodes de culture traditionnelles, mais elle dépendait fortement de conditions de culture spécifiques et limitait l’utilisation de cette méthode dans d’autres laboratoires et applications12.
Une étude du groupe de Zubeldia-Plazaola a établi une méthode d’isolement optimisée qui impliquait la digestion lente (pendant la nuit) de fragments de tissu haché par un mélange de collagénase et d’hyaluronidase, suivie de trois centrifugations différentielles le deuxième jour pour séparer les fractions stromales/épithéliales. Cette méthode d’isolement, ainsi que l’ajout d’Y-27632 dans la culture, ont permis d’obtenir un grand nombre de cellules épithéliales viables. Cependant, la quantité de tissu mammaire utilisée dans leur étude était de 40 à 75 g et la procédure d’isolement a duré près de 2 jours9. Ici, nous rapportons l’utilisation de seulement 1 g de tissu dans ce protocole, et nous avons testé et constaté que cette méthode fonctionnait également pour aussi peu que 0,25 g de tissu. Le mélange enzymatique de collagénase, de dispase et de trypsine a digéré efficacement 1 g de tissu en 1,5 h, et l’ensemble de la procédure a pris ~ 3 h. L’ajout de Y-27632 au milieu de culture initial peut favoriser l’attachement et la prolifération des cellules épithéliales, mais aussi inhiber la croissance des cellules stromales19. Il est important de noter que dans cette étude, nous avons testé les composants du milieu initial et avons constaté que 5 % de FBS dans le DMEM pour remplacer le milieu G utilisé dans la publication précédente étaient suffisants pour favoriser l’attachement et la croissance des cellules épidermiques10.
Après 2 jours de culture dans le milieu initial, les cellules ont été cultivées dans un milieu kératinocytaire sans sérum. Le profil de croissance cellulaire pour la culture initiale (P0) après l’inoculation est illustré à la figure 2, qui montre un modèle de croissance des colonies. Cette méthode d’isolement produit probablement tous les types de cellules épithéliales, y compris les cellules myoépithéliales des tissus mammaires, qui devront être caractérisées davantage à l’avenir. Néanmoins, en comparant la croissance des cellules en présence de Y-27632 au groupe témoin sans ajouter de Y-27632 au milieu de culture initial, nous avons pu voir que la méthode avec Y-27632 a considérablement augmenté la production cellulaire et amélioré l’efficacité de la culture cellulaire (Figure 2A). Habituellement, ~9 à 10 jours de culture après l’inoculation, les cellules épidermiques pouvaient atteindre une densité appropriée pour le passage. De plus, nous avons également montré que la présence de Y-27632 pouvait améliorer la croissance des HMEC P1 après récupération des cellules P0 congelées à la fin de la culture initiale (Figure 3). Entre nos mains, nous avons constaté que plus de 90 % des cellules étaient capables de survivre après avoir été décongelées dans un entrepôt congelé. Les cellules avaient un temps de doublement d’environ 72 h, et les HMEC ont été capables de maintenir une croissance normale jusqu’au 7e passage.
Dans cette étude, les cellules ont exprimé des niveaux élevés de marqueurs de cellules épithéliales mammaires CK7 et GATA3, et surtout, près de 100% des cellules au stade avancé de la culture initiale étaient positives pour CK7 et GATA3 (Figure 4), indiquant une grande pureté des cellules épithéliales obtenues à partir de cette méthode. Enfin, cette étude a comparé les niveaux d’expression de CK7 et GATA3 dans les cellules P0 et P3, révélant des niveaux d’expression élevés dans les deux, suggérant que le passage n’a pas altéré le phénotype des cellules (Figure 5A,B). De plus, indépendamment de la présence de Y-27632, CK7 et GATA3 étaient constamment fortement exprimés, ce qui implique que l’ajout de Y-27632 n’a pas eu d’impact sur le phénotype cellulaire (Figure 5C,D).
La principale cause de l’amélioration de la prolifération cellulaire grâce à notre approche est l’inclusion de Y-27632, qui s’est avéré avoir des effets bénéfiques sur la multiplication et la spécialisation des cellules épithéliales humaines19,20. Chapman et al. ont constaté que l’utilisation de l’Y-27632 améliorait considérablement la capacité des cellules épithéliales à se multiplier et conduisait à l’immortalisation réussie des cellules sans aucun signe de crise cellulaire21. Dans notre étude, l’Y-27632 a significativement augmenté le rendement de ces cellules épithéliales en améliorant leur attachement et leur prolifération19.
L’une des principales caractéristiques de cette méthode est la combinaison de la dispase et de la collagénase pour séparer le tissu épithélial du tissu conjonctif, tout en utilisant la trypsine pour dissocier les cellules épithéliales du tissu épithélial22. La dispase s’est avérée être une enzyme rapide, efficace et douce pour séparer l’épiderme non endommagé du derme ainsi que les couches non endommagées de cellules épithéliales en culture de la surface sous-jacente, tout en maintenant la viabilité des cellules épithéliales23. La collagénase de type I facilite l’isolement des cellules épithéliales et assure la vitalité et l’intégrité des cellules24. Une autre caractéristique clé de cette méthode est l’utilisation du milieu initial avec l’Y-27632 pour cultiver les HMEC nouvellement isolés. Une fois que les cellules ont adhéré à la boîte le troisième jour, le milieu de culture est remplacé par un milieu sans sérum de kératinocytes. Cette approche simplifie considérablement les étapes de l’expérience et réduit le coût de l’expérience. En conséquence, nous avons obtenu des nombres cellulaires très satisfaisants en utilisant seulement un petit volume de tissu mammaire avec cette méthode, ce qui indique qu’une grande quantité de tissu initial n’est pas nécessaire. Cependant, l’un des inconvénients de cette approche est que la présence de trypsine ne protège pas adéquatement l’intégrité des cellules épithéliales. Un autre aspect potentiellement limitatif de la méthode est la possibilité d’une faible contamination (<1%) des cellules myoépithéliales lors de la culture initiale9.
Notre méthode offre une approche simplifiée et efficace pour isoler et cultiver des HMEC primaires dérivées de tissus mammaires adultes. Cette technique se caractérise par sa simplicité, son gain de temps et sa capacité à maintenir les fonctions cellulaires fondamentales. Par conséquent, cette technique présente des avantages évidents et est très prometteuse pour générer une quantité substantielle de cellules épithéliales. De plus, la méthode permet d’isoler et de cultiver des HMEC à partir d’un large éventail de donneurs, ce qui convient à la fois à la recherche en laboratoire et aux applications cliniques, ce qui la rend très polyvalente et largement applicable.
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a pas de conflit d’intérêts concernant la publication de cet article.
Remerciements
Ce travail a été soutenu par des subventions du TCM Science and Technology Program de la province du Zhejiang, en Chine (2017ZA055 ; 2018ZA036), et le Projet scientifique et technologique de Zunyi, province du Guizhou, Chine (Zunyi City Kehe Support NS (2020) n° 18) à X. Xu. Les auteurs remercient le Laboratoire de biologie moléculaire de la société de technologie biomédicale Youjia (Hangzhou) pour la formation en culture cellulaire.
matériels
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin | Basalmedia | K431010 | For HMECs dissociation |
| 1.5 mL microcentrifuge Tubes | NEST | 081722CK01 | For cell digestion |
| 100 µm mesh filter | Solarbio | 431752 | For HMECs filtration |
| 100 mm Cell Culture Dish | Corning | 430167 | For cell culture |
| 4% paraformaldehyde | solarbio | P1110-100ml | For immunofluorescence staining to check differentiation marker of HMECs |
| 50 mL Centrifuge Tube | Corning | 430829 | For cell centrifugation |
| Cell Strainer | Solarbio | 431752 | Cell filtration |
| Centrifuge | Eppendorf | 5404HN133048 | Cell centrifuge |
| CO2 Incubator | Thermo Scientific | 42820906 | For cell incubation |
| Collagenase Type I | Merck | SKU:SCR103 | For HMECs isolation |
| Dispase | Solarbio | CAS:42613-33-2 | For HMECs isolation |
| DMEM | Gibco | 8122622 | Component of neutralization medium |
| Fetal Bovine Serum | Gibco | 2556132P | Component of neutralization medium |
| Penicillin/Streptomycin | Thermo Scientific | 15140-122 | Antibiotics |
| Phosphate buffered solution | Tecono | 20201033 | Washing solution |
| rabbit anti CK7 | abcam | ab68459 | For immunofluorescence staining to check differentiation marker of HMECs |
| rabbit anti GATA3 | abcam | ab199428 | For immunofluorescence staining to check differentiation marker of HMECs |
| Y-27632 | Solarbio | IY0040 | ROCK inhibitor |
Références
- Smolarz, B., Nowak, A. Z., Romanowicz, H. Breast cancer-epidemiology, classification, pathogenesis and treatment (review of literature). Cancers (Basel). 14 (10), 2569 (2022).
- Gudjonsson, T., Adriance, M. C., Sternlicht, M. D., Petersen, O. W., Bissell, M. J. Myoepithelial cells: Their origin and function in breast morphogenesis and neoplasia. J Mammary Gland Biol Neoplasia. 10 (3), 261-272 (2005).
- Faridi, N., et al. Isolation and characterization of the primary epithelial breast cancer cells and the adjacent normal epithelial cells from iranian women's breast cancer tumors. Cytotechnology. 70 (2), 625-639 (2018).
- Tovar, E. A., et al. Dissecting the rat mammary gland: Isolation, characterization, and culture of purified mammary epithelial cells and fibroblasts. Bio Protoc. 10 (22), e3818 (2020).
- Jiang, X., Yang, H., Jing, Q., He, X. A "selective secondary tissue attachment" method for isolation and purification of mammary epithelial cells. Acta Histochem. 124 (8), 151972 (2022).
- Bernardini, C., et al. Development of a pig mammary epithelial cell culture model as a non-clinical tool for studying epithelial barrier-a contribution from the imi-conception project. Animals (Basel). 11 (7), 2012 (2021).
- Zhang, D., et al. Transdifferentiation of goat ear fibroblasts into lactating mammary epithelial cells induced by small molecule compounds. Biochem Biophys Res Commun. 573, 55-61 (2021).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: Rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc Natl Acad Sci U S A. 81 (17), 5435-5439 (1984).
- Zubeldia-Plazaola, A., et al. Comparison of methods for the isolation of human breast epithelial and myoepithelial cells. Front Cell Dev Biol. 3, 32 (2015).
- Liu, Z., et al. A simplified and efficient method to isolate primary human keratinocytes from adult skin tissue. J Vis Exp. (138), e57784 (2018).
- Xie, Z., et al. Isolation and culture of primary human gingival epithelial cells using y-27632. J Vis Exp. (177), e62978 (2021).
- Jin, L., et al. Characterization of primary human mammary epithelial cells isolated and propagated by conditional reprogrammed cell culture. Oncotarget. 9 (14), 11503-11514 (2018).
- Böcker, W., Hungermann, D., Decker, T. Anatomy of the breast. Pathologe. 30 (1), 6-12 (2009).
- Kouros-Mehr, H., Slorach, E. M., Sternlicht, M. D., Werb, Z. Gata-3 maintains the differentiation of the luminal cell fate in the mammary gland. Cell. 127 (5), 1041-1055 (2006).
- Wang, X., Reagan, M. R., Kaplan, D. L. Synthetic adipose tissue models for studying mammary gland development and breast tissue engineering. J Mammary Gland Biol Neoplasia. 15 (3), 365-376 (2010).
- Ethier, S. P., Mahacek, M. L., Gullick, W. J., Frank, T. S., Weber, B. L. Differential isolation of normal luminal mammary epithelial cells and breast cancer cells from primary and metastatic sites using selective media. Cancer Res. 53 (3), 627-635 (1993).
- Band, V., Sager, R. Distinctive traits of normal and tumor-derived human mammary epithelial cells expressed in a medium that supports long-term growth of both cell types. Proc Natl Acad Sci U S A. 86 (4), 1249-1253 (1989).
- Taylor-Papadimitriou, J., Shearer, M., Tilly, R. Some properties of cells cultured from early-lactation human milk. J Natl Cancer Inst. 58 (6), 1563-1571 (1977).
- Wen, J., Zu, T., Zhou, Q., Leng, X., Wu, X. Y-27632 simplifies the isolation procedure of human primary epidermal cells by selectively blocking focal adhesion of dermal cells. J Tissue Eng Regen Med. 12 (2), e1251-e1255 (2018).
- Yin, J., Yu, F. S. Rho kinases regulate corneal epithelial wound healing. Am J Physiol Cell Physiol. 295 (2), C378-C387 (2008).
- Chapman, S., Liu, X., Meyers, C., Schlegel, R., Mcbride, A. A. Human keratinocytes are efficiently immortalized by a rho kinase inhibitor. J Clin Invest. 120 (7), 2619-2626 (2010).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Dermatol. 28 (2), 107-112 (2019).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. J Invest Dermatol. 93 (2), 287-290 (1989).
- Ren, H. J., et al. Primary cultures of mouse small intestinal epithelial cells using the dissociating enzyme type I collagenase and hyaluronidase. Braz J Med Biol Res. 50 (5), e5831 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon