Method Article
Isolierung und Kultivierung primärer humaner Brustepithelzellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die vorliegende Studie berichtet über ein einfacheres, zeitsparendes und wirtschaftliches Protokoll zur effizienten Isolierung und Züchtung von primären humanen Brustepithelzellen (HMECs) aus kleinen Mengen von Brustgewebe. Dieses Protokoll eignet sich für die schnelle Herstellung von primären HMECs sowohl für Labor- als auch für klinische Anwendungen.
Zusammenfassung
Die Brustdrüse ist eine grundlegende Struktur der Brust und spielt eine wesentliche Rolle bei der Fortpflanzung. Menschliche Brustepithelzellen (HMECs), die Ursprungszellen von Brustkrebs und anderen entzündlichen Erkrankungen der Brust, haben große Aufmerksamkeit erregt. Die Isolierung und Kultivierung von primären HMECs in vitro zu Forschungszwecken war jedoch aufgrund ihrer hochdifferenzierten, keratinisierten Natur und ihrer kurzen Lebensdauer eine Herausforderung. Daher ist die Entwicklung einer einfachen und effizienten Methode zur Isolierung und Kultivierung von HMECs von großem wissenschaftlichem Wert für die Erforschung der Brustbiologie und brustbedingter Krankheiten. In dieser Studie isolierten wir erfolgreich primäre HMECs aus kleinen Mengen von Brustgewebe durch Verdauung mit einer Mischung von Enzymen in Kombination mit einer Anfangskultur in 5% fötalem Rinderserum-DMEM, das den Rho-assoziierten Kinase (ROCK)-Inhibitor Y-27632 enthielt, gefolgt von einer Kulturexpansion in serumfreiem Keratinozytenmedium. Dieser Ansatz fördert selektiv das Wachstum von Epithelzellen, was zu einer optimierten Zellausbeute führt. Die Einfachheit und Bequemlichkeit dieser Methode machen sie sowohl für die Labor- als auch für die klinische Forschung geeignet, was wertvolle Einblicke in diese wichtigen Studienbereiche liefern sollte.
Einleitung
Brustkrebs ist die häufigste Krebsart, die bei Frauen weltweit diagnostiziert wird, und die häufigste Todesursache durch Krebs1. Die Pathogenese von Brustkrebs ist komplex und umfasst mehrere Faktoren wie Genetik, Umwelt und Lebensstil. HMECs, aktive milchproduzierende Zellen, sind einer der wichtigsten Bestandteile des Brustgewebes und wahrscheinlich die ursprünglichen Zellen, die an der Krebsentstehung von Brustkrebs beteiligt sind. Daher haben HMECs von Forschern die meiste Aufmerksamkeit für die Erforschung von Brustkrebserhalten 2. Darüber hinaus haben Primärzellen die Fähigkeit, eine biologisch relevante Charakterisierung komplexer zellulärer Prozesse zu liefern, da sie ihre genetische Stabilität, ihre normale Morphologie und einen vollständigeren Satz grundlegender zellulärer Funktionen beibehalten, die mit immortalisierten Zelllinien nicht erreicht werden können3. Daher ist die Isolierung und Kultur von primären HMECs ein wesentlicher Schritt für die Erforschung der meisten Brusterkrankungen wie Brustkrebs und entzündliche Brusterkrankungen.
Gegenwärtig wurde ein stabiles und reproduzierbares System für die Isolierung, Kultivierung und Identifizierung von Brustepithelzellen von Ratten, Kühen, Schweinen und Ziegen etabliert 4,5,6,7. Die Isolierung und Kultivierung von primären HMECs stellt jedoch aufgrund der komplexen Mikroumgebung und der geringen Ausbeute der Zellen eine Herausforderung dar. Seit Jahrzehnten suchen Wissenschaftler nach der effektivsten Methode, um HMECs zu isolieren und zu kultivieren, obwohl bereits vor fast 20 Jahren ein Kultursystem für HMECs etabliert wurde. Zum Beispiel entwickelten Hammond et al. ein serumfreies Kulturmedium, in dem HMECs effizient wuchsen8. Kürzlich testeten Zubeldia-Plazaola et al. vier verschiedene Isolationsmethoden mit schnellen/langsamen Enzymaufschlussverfahren in Kombination mit sequentieller Filtration oder differentiellen Zentrifugationsschritten, um HMECszu erhalten 9. Sie fanden heraus, dass die Methode der langsamen Verdauung zusammen mit der differentiellen Zentrifugation die effizienteste Methode ist, um HMECs aus frischem Brustgewebe zu isolieren. Diese Isolierungsmethode erfordert jedoch große Gewebestücke (40-75 g) und verwendet größere Mengen an Verdauungsenzymen. Ihr Verfahren ist kompliziert (mindestens drei verschiedene Zentrifugen, um unterschiedliche Zellfraktionen zu erhalten) und zeitaufwändig. Daher ist nach wie vor eine einfache und schnelle Methode erforderlich, um Populationen von HMECs aus kleinen Mengen von Brustgewebe für Forschung und klinische Anwendungen effizient zu gewinnen9.
Unsere früheren Studien zeigten, dass die Zugabe des Rho-assoziierten Kinase (ROCK)-Inhibitors Y-27632 zum ursprünglichen Kulturmedium den Prozess der Isolierung menschlicher Hautepidermiszellen vereinfachen kann10, der auch erfolgreich für die Isolierung von gingivalen Epithelzellen eingesetzt wurde11. Darüber hinaus haben frühere Forschungen, die von der Gruppe von Zubeldia-Plazaola und Jin durchgeführt wurden, gezeigt, dass Y-27632 die Fähigkeit hat, ein schnelles und unbegrenztes In-vitro-Wachstum von primären Epithelzellen aus Brustgewebe zu stimulieren 9,12. In der vorliegenden Studie sollte getestet werden, ob die Verwendung von Y-27632 die Isolierung und Kultivierung von HMECs vereinfachen würde, und wir haben erfolgreich eine einfache und leicht durchzuführende Methode zur Isolierung von HMECs aus kleinen Stücken (1 g) Brustgewebe etabliert.
Protokoll
Frisches normales Brustgewebe, das in diesem Protokoll verwendet wird, wird aus der Operation um die Läsion der refraktären granulomatösen lobulären Mastitis im ersten angeschlossenen Krankenhaus der Zhejiang Chinese Medical University gemäß den Richtlinien des medizinischen Ethikkomitees des ersten angeschlossenen Krankenhauses der Zhejiang Chinese Medical University (Protokoll Nr. ChiMCTR2100005281, Datum: 17.07.2017).
1. Entnahme von Gewebe
- Sammeln Sie frisches Brustgewebe aus chirurgischen Proben, die von erwachsenen Frauen entnommen wurden, in sterile Röhrchen mit 10 ml phosphatgepufferter Kochsalzlösung (PBS) mit 3 % Penicillin/Streptomycin (P/S).
HINWEIS: Brustgewebe sollte innerhalb von 24 Stunden nach der Entnahme aus der Operation gemäß den folgenden Angaben behandelt werden.
2. Vorbehandlung des Gewebes
- Entfernen Sie das Fettgewebe mit zwei Pinzettenpaaren aus dem Brustgewebe und stellen Sie sicher, dass das verbleibende Brustgewebe ~1 g wiegt.
- Spülen Sie das Brustgewebe 5 s lang in einer 75%igen Ethanollösung (5 mL) und waschen Sie es dann 2 x 5 Minuten lang mit 20 mL Waschlösung (Tabelle 1).
3. Verdauung des Gewebes
- Schneiden Sie das Brustgewebe in kleinere Fragmente und zerkleinern Sie das Gewebe mit zwei chirurgischen Klingen für eine Dauer von 15 Minuten, um das Gewebehomogenat zu erhalten. Übertragen Sie die Gewebestücke in ein 50 mL Zentrifugenröhrchen.
- Fügen Sie 10 ml 5,0 mg/ml Dispase + 5,0 mg/ml Kollagenaselösung, 3 ml 0,25% Trypsin und 7 ml PBS zu insgesamt 20 ml Aufschlusslösung in einem 50 ml-Zentrifugenröhrchen hinzu, das die Brustgewebefragmente enthält. Stellen Sie das Röhrchen in ein Wasserbad bei 37 °C und inkubieren Sie es 1,5 h lang; Schütteln Sie die Tube alle 20 min.
- Stoppen Sie den Verdauungsprozess, indem Sie 20 ml der Neutralisationslösung injizieren. Mischen Sie den Inhalt durch Pipettieren ~15x.
- Filtrieren Sie das Gemisch durch einen 100 μm Maschenfilter. Bei 156 × g 5 min zentrifugieren.
- Entfernen Sie den Überstand und wiederholen Sie die Inkubation des Pellets mit 20 ml Neutralisationslösung. Mischen Sie den Inhalt durch 15-faches Pipettieren und zentrifugieren Sie ihn 5 Minuten lang bei 156 × g .
- Entfernen Sie vorsichtig den Überstand und resuspendieren Sie das Zellpellet mit 10 mL Anfangskulturmedium. Plattieren Sie die Zellsuspension in einer 100-mm-Zellkulturschale.
- Kultivieren Sie die Zellen in einem 5% CO2 -Inkubator bei 37 °C. Ersetzen Sie das ursprüngliche Kulturmedium jeden dritten Tag durch frisches Epithelzellmedium. Überprüfen Sie die Zellen und erneuern Sie das Medium alle 2 Tage.
4. Zell-Passaging
- Nehmen Sie die 100-mm-Schale aus dem Inkubator, wenn die Zellen eine Konfluenz von 80 % bis 90 % erreichen, entsorgen Sie das verwendete Medium und spülen Sie die Schale 2x mit 2 ml PBS aus. Entfernen Sie PBS und geben Sie dann 2 ml 0,05% Trypsin in jede 100-mm-Schale.
HINWEIS: Schwenken Sie die Schale, um sicherzustellen, dass die Trypsinlösung ausreichend Kontakt mit dem Boden der Schale hat. - Stellen Sie die 100-mm-Schale für ~7 min in einen 37 °C Inkubator für den Aufschluss.
- Untersuchen Sie die Zellen mit einem Mikroskop und einem 40-fach-Objektiv, um sicherzustellen, dass die meisten Zellen vom Boden der Schale dissoziiert wurden.
- Stoppen Sie den Verdauungsprozess, indem Sie 8 mL Neutralisationslösung hinzufügen und die Zellen in ein 15 mL Röhrchen überführen. Mischen Sie die Zellen, indem Sie 10-15x auf und ab pipettieren. Die Zellen bei 156 × g 5 min zentrifugieren.
- Entfernen Sie vorsichtig den Überstand, resuspendieren Sie die Zellen mit 10 ml Epithelzellmedium und zählen Sie die Anzahl der Zellen.
- 1 × 106 Zellen in 10 ml Epithelzellmedium in eine 100-mm-Schale geben.
- Frischen Sie das Epithelzellmedium auf und beobachten Sie die Zellen alle 2 Tage.
5. Kryokonservierung von Zellen
- Wiederholen Sie die Schritte 4.1-4.4.
- Entfernen Sie vorsichtig den Überstand und resuspendieren Sie die Zellen in 2 ml Kryokonservierungslösung.
- Übertragen Sie 1 ml der Kryokonservierungslösung, die die Zellen enthält, in jedes kryogene Fläschchen.
- Notieren Sie die Namen der kryokonservierten Zellen, die Durchgangsnummern und die Daten.
- Stellen Sie die Fläschchen über Nacht in einen Gefrierbehälter mit kontrollierter Geschwindigkeit bei -80 °C.
- Nehmen Sie die kryogenen Fläschchen aus dem -80 °C-Gefrierschrank und überführen Sie sie schnell in flüssigen Stickstoff für die Langzeitlagerung.
Ergebnisse
Abbildung 1 zeigt ein Schema des Vorgehens. Das Protokoll beinhaltet die Verwendung einer Kombination von Enzymen, nämlich Dispase, Kollagenase und Trypsin. Diese Kombination wird zu dem Zweck verwendet, die Epithelschicht von der darunter liegenden Fibroblastenschicht abzulösen und anschließend Trypsin zu verwenden, um die Brustepithelzellen in eine Suspension zu dissoziieren. Darüber hinaus wurde das Wachstum von Epithelzellen durch Zugabe von Y-27632 zum ursprünglichen Kulturmedium effektiv gefördert. Als Ergebnis liefert diese Methode eine große Anzahl von HMECs, die die Anforderungen für die Passage in nur durchschnittlich 10 Tagen erfüllen.
Um die entscheidende Rolle von Y-27632 beim Zellwachstum nach der Isolierung zu testen, teilten wir frisch isolierte Zellen in zwei Gruppen auf: Eine Gruppe wurde mit dem Ausgangsmedium plattiert, das 10 mM Y-27632 enthielt (Abbildung 2A); die andere Gruppe wurde mit dem Ausgangsmedium plattiert, ohne Y-27632 als Kontrollgruppe hinzuzufügen (Abbildung 2B). Nach 2-tägiger Kultivierung wurden die Zellen beider Gruppen auf epidermale Zellmedien umgestellt (Abbildung 1). Aus Abbildung 2 können wir erkennen, dass die Methode mit Y-27632 im Vergleich zum dritten Tag die Anzahl der HMECs am neunten Tag merklich erhöhte. Die HMECs bildeten eine zusammenhängende Gruppe, die einer Insel ähnelte, die klare Grenzen und starke Verbindungen zwischen den Zellen aufwies. Diese Zellen dehnten sich nach außen in die Umgebung aus. Die mit Y-27632 plattierten Zellen (Abbildung 2A) wuchsen viel schneller als die Zellen in der Kontrollgruppe (Abbildung 2B). Um zu bestätigen, dass Y-27632 das HMEC-Wachstum verstärkt, wurden die gefrorenen P0-Zellen aufgetaut und mit oder ohne Zugabe von 10 mM Y-27632 plattiert, und Passage 1 (P1)-Zellen wurden an verschiedenen Tagen entnommen, wie in Abbildung 3 gezeigt. Die Zellen wurden mit dem Zellzahl-Kit-8 (CCK-8) auf Lebensfähigkeit und Proliferation analysiert. Wie in Abbildung 3 gezeigt, war die Wachstumsrate von Zellen, die mit Y-27632-haltigem Medium behandelt wurden, signifikant höher als die der Zellen in der Kontrollgruppe ohne Y-27632. Nimmt man diese Daten zusammen, so zeigt sich, dass die Zugabe von Y-27632 im Ausgangsmedium das Wachstum der angehängten Zellen nach der Isolierung signifikant fördert.
Um zu überprüfen, ob es sich bei den mit dieser Methode erhaltenen Zellen um HMECs handelt, führten wir eine Immunfluoreszenzanalyse von P0-HMECs für zwei Brustepithelzellmarker durch: CK7 und GATA3. CK7, ein diagnostisch wichtiges Cytokeratin, ist ein Marker für die Drüsendifferenzierung im normalen Mammarepithel und seine proliferativen Epithelfortsätze13. Darüber hinaus haben Kouros-Mehr et al. berichtet, dass GATA3 als Transkriptionsfaktor in Brustepithelzellen fungiert und an der Aufrechterhaltung der luminalen Epitheldifferenzierung in voll entwickelten Brustdrüsen beteiligt ist14. Wie in Abbildung 3 gezeigt, exprimieren die von uns kultivierten und expandierten Zellen sowohl CK7 (Abbildung 4A) als auch GATA3 (Abbildung 4B). Die Quantifizierungsanalyse sowohl von CK7- als auch von GATA3-positiven Zellen zeigte, dass mehr als 98% der Zellen sowohl CK7 als auch GATA3 exprimierten (Abbildung 4C), was auf eine begrenzte Kontamination anderer Zelltypen, wie z.B. Fibroblasten, hinweist. Wir beobachteten gelegentlich eine begrenzte Anzahl von Fibroblasten-ähnlichen Zellen (längliche Morphologie) in der Anfangskultur (P0, Abbildung 2), aber wir sehen diese Zellen selten in den passageierten Zellen (P3, Abbildung 4D).
Um zu testen, ob die epitheliale Charakteristik von HMECs nach mehreren Passagen aufrechterhalten werden kann, führten wir die qRT-PCR-Analyse der Brustepithelzellmarker CK7 und GATA3 in den Zellen durch, die mit oder ohne Y-27632 kultiviert wurden (Abbildung 5). Die Expressionsniveaus von CK7 und GATA3 unterschieden sich sowohl in P0- als auch in P3-Zellen mit oder ohne Y-27632 nicht signifikant, was darauf hindeutet, dass sich ihre phänotypischen und Differenzierungsmerkmale im Laufe der Zeit während der Kulturexpansion nicht veränderten.
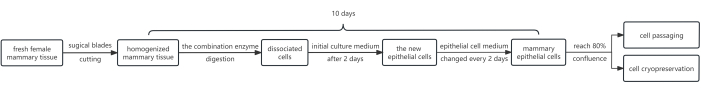
Abbildung 1: Flussdiagramm des Protokolls zur Isolierung und Kultivierung von HMECs. Zunächst wurden weibliche Brustgewebefragmente mit chirurgischen Klingen aufgeschnitten und mit einer Kombination von Enzymen verdaut. Anschließend wurden die erhaltenen Zellpellets in einem Anfangskulturmedium kultiviert, das 10 mM Y-27632 enthielt. Nach 2 Tagen wurde das ursprüngliche Kulturmedium durch Epithelzellmedium ersetzt. Die Brustepithelzellen wurden in epidermalem Zellmedium kultiviert, um nach ~8 Tagen eine zufriedenstellende Abdeckung zu erreichen, die nun für die Passage geeignet ist. Bei Bedarf können einige Zellen einer Kryokonservierung unterzogen werden. Abkürzung: HMECs = humane Brustepithelzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Bilder von HMECs, die nach der Erstimpfung aufgenommen wurden. Innerhalb von 2 Tagen nach der Inokulation wurden (A) primäre HMECs in Y-27632 enthaltendem Ausgangsmedium und (B) primäre HMECs in Ausgangsmedium ohne Y-27632 kultiviert. Nach einer 48-stündigen Kultivierungsphase wurde in beiden Gruppen das serumfreie Keratinozyten-Kulturmedium ausgetauscht. Jeden zweiten Tag wurden Fotos gemacht, um den Wachstumsstatus der Zellen aufzuzeichnen. Beide Serien repräsentativer Bilder wurden an den Tagen 3, 5 und 9 nach der Inokulation mit einem inversen Mikroskop (100x) aufgenommen. Maßstabsleisten = 100 μm. Abkürzung: HMECs = humane Brustepithelzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
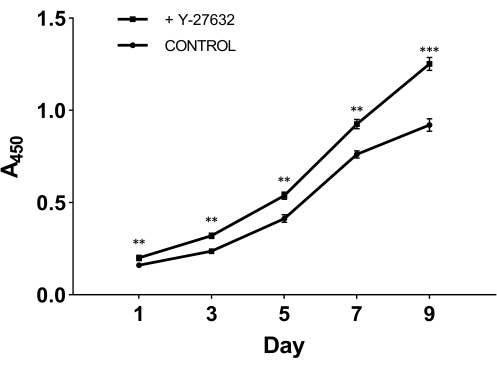
Abbildung 3: Verstärktes Wachstum von HMECs (P1) in Passage 1 mit Y-27632. Die gefrorenen P0-Zellen wurden aufgetaut und mit oder ohne Y-27632 kultiviert. Die Zellen (P1) wurden an 1, 3, 5, 7 und 9 Tagen gesammelt und die Extinktion bei 450 nm mit dem CCK-8-Kit analysiert. An Tag 1 war die Anzahl der adhärenten lebensfähigen Zellen im Ausgangsmedium, das Y-27632 enthielt, signifikant höher als ohne Y-27632. Zusätzlich zeigte die Wachstumskurve der mit Y-27632 behandelten Zellen einen steileren Anstieg. **p < 0,01, ***p < 0,001. Abkürzung: HMECs = humane Brustepithelzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Expression von HMEC-Markern (P0). Die Expression von CK7 und GATA3 in HMECs wurde mittels Immunfluoreszenzfärbung analysiert. HMECs wurden für (A) CK7 (rot) und (B) GATA3 (rot) gefärbt; DAPI (blau) wurde verwendet, um die Zellkerne zu färben. Die Bilder wurden mit einem konfokalen Laserscanning-Mikroskop (400x) aufgenommen. Maßstabsbalken = 20 μm. (C) Der Prozentsatz positiver Zellen bei der Färbung; (D) das repräsentative Bild der HMECs (P3). Maßstabsbalken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
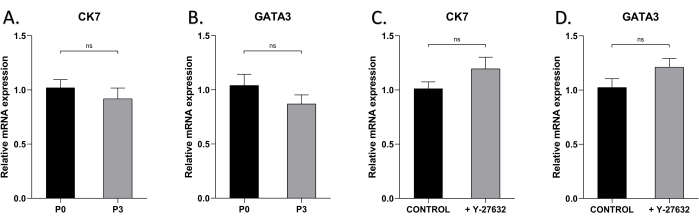
Abbildung 5: Die Expression von CK7 und GATA3 von HMECs an P0 und P3. Verwendung der qRT-PCR zum Nachweis der Expression von (A) CK7 in HMECs von P0 und P3 an Tag 7, (B) GATA3 in HMECs von P0 und P3, (C) CK7 in P1 HMECs, die mit oder ohne Y27632 an Tag 7 kultiviert wurden, (D) GATA3 in P1 HMECs, die mit oder ohne Y-27632 an Tag 7 kultiviert wurden. nsp > 0,05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
HMECs sind für die Erhaltung der anatomischen und funktionellen Integrität von Brustgewebe von entscheidender Bedeutung und sie sind nützlich in wissenschaftlichen Untersuchungen, klinischen Implementierungen und verwandten Bereichen15. Primäre Epithelzellen sind eine Art spezialisierter Zellen mit begrenzten Passagen und kürzerer Lebensdauer. Das Wachstum von HMECs wurde jedoch durch technische Einschränkungen behindert, die folglich die Fortschritte in der Forschung bei Brustkrebs und anderen entzündlichen Erkrankungen im Zusammenhang mit der Brust behindert haben16.
Daher besteht ein dringender Bedarf, eine stabile, praktikable und effiziente Methode zur Gewinnung von HMECs aus frischem Brustgewebe zu entwickeln. Hammond et al.8 und Band and Sager17 extrahierten und kultivierten erfolgreich Brustepithelzellen. Die Zusammensetzung des benötigten Nährmediums war jedoch zu komplex. Frühere Studien von Taylor-Papidamitriou et al. zeigten, dass Karieszellen aus der Muttermilch mit einem Medium kultiviert werden konnten, das mit Wachstumsfaktoren und Serum18 supplementiert war. Während ihre Methode die direkte Extraktion von HMECs aus der Muttermilch ermöglicht, kann das Vorhandensein von nicht-epithelialen Zellen das Wachstum von HMECs beeinflussen, was es schwierig macht, die Zellzahl genau zu bestimmen. Jin et al. entwickelten eine bedingte Reprogrammierungsmethode, die es primären HMECs ermöglichte, im Vergleich zu herkömmlichen Kulturmethoden einen längeren Lebenszyklus zu haben und die Zellheterogenität beizubehalten, aber sie war stark von spezifischen Kulturbedingungen abhängig und schränkte die Verwendung dieser Methode in anderen Laboratorien und Anwendungen ein12.
Eine Studie aus der Gruppe von Zubeldia-Plazaola etablierte eine optimierte Isolationsmethode, die die langsame Verdauung (über Nacht) von zerkleinerten Gewebefragmenten durch eine Mischung aus Kollagenase und Hyaluronidase beinhaltete, gefolgt von drei differentiellen Zentrifugationen am zweiten Tag, um Stroma-/Epithelfraktionen zu trennen. Diese Isolierungsmethode und die Zugabe von Y-27632 in der Kultur ergaben eine hohe Anzahl lebensfähiger Epithelzellen. Die Menge an Brustgewebe, die in ihrer Studie verwendet wurde, betrug jedoch 40-75 g und das Isolierungsverfahren dauerte fast 2 Tage9. Hier berichten wir von der Verwendung von nur 1 g Gewebe in diesem Protokoll, und wir haben getestet und festgestellt, dass diese Methode auch mit nur 0,25 g Gewebe funktioniert. Die Enzymmischung aus Kollagenase, Dispase und Trypsin verdaute effizient 1 g Gewebe in 1,5 Stunden, und der gesamte Eingriff dauerte ~3 Stunden. Die Zugabe von Y-27632 zum ursprünglichen Kulturmedium kann die Adhäsion und Proliferation von Epithelzellen fördern, aber auch das Wachstum von Stromazellen hemmen19. Wichtig in dieser Studie war, dass wir die Komponenten des ursprünglichen Mediums testeten und feststellten, dass 5 % FBS in DMEM als Ersatz für das in der vorherigen Veröffentlichung verwendete G-Medium ausreichten, um die adhäsion und das Wachstum epidermaler Zellen zu fördern10.
Nach 2-tägiger Kultivierung im Ausgangsmedium wurden die Zellen in serumfreiem Keratinozytenmedium kultiviert. Das Zellwachstumsmuster für die Anfangskultur (P0) nach der Inokulation ist in Abbildung 2 dargestellt, die ein Koloniewachstumsmuster zeigt. Diese Isolierungsmethode liefert wahrscheinlich alle Arten von Epithelzellen, einschließlich Myoepithelzellen aus Brustgewebe, die in Zukunft weiter charakterisiert werden müssen. Nichtsdestotrotz konnten wir durch den Vergleich des Wachstums von Zellen in Gegenwart von Y-27632 mit dem der Kontrollgruppe ohne Zugabe von Y-27632 zum ursprünglichen Kulturmedium feststellen, dass die Methode mit Y-27632 die Zellproduktion signifikant erhöhte und die Effizienz der Zellkultur verbesserte (Abbildung 2A). In der Regel können die Epidermiszellen nach ~9-10 Tagen Kultur nach der Inokulation eine für die Passage geeignete Dichte erreichen. Darüber hinaus zeigten wir, dass das Vorhandensein von Y-27632 das Wachstum von P1 HMEC nach der Rückgewinnung von P0-Zellen, die am Ende der Erstkultur eingefroren wurden, verstärken könnte (Abbildung 3). In unseren Händen fanden wir heraus, dass über 90% der Zellen überleben konnten, nachdem sie aus der Tiefkühllagerung aufgetaut wurden. Die Zellen hatten eine Verdopplungszeit von ca. 72 h, und HMECs waren in der Lage, ihr normales Wachstum bis zur 7. Passage aufrechtzuerhalten.
In dieser Studie exprimierten die Zellen hohe Konzentrationen der Brustepithelzellmarker CK7 und GATA3, und vor allem waren fast 100 % der Zellen im späten Stadium der Erstkultur positiv für CK7 und GATA3 (Abbildung 4), was auf eine hohe Reinheit der mit dieser Methode gewonnenen Epithelzellen hinweist. Schließlich verglich diese Studie die Expressionsniveaus von CK7 und GATA3 in P0- und P3-Zellen und zeigte hohe Expressionsniveaus in beiden, was darauf hindeutet, dass die Passage den Phänotyp der Zellen nicht veränderte (Abbildung 5A,B). Darüber hinaus wurden CK7 und GATA3 unabhängig vom Vorhandensein von Y-27632 durchweg stark exprimiert, was bedeutet, dass die Zugabe von Y-27632 den Zellphänotyp nicht beeinflusste (Abbildung 5C,D).
Die primäre Ursache für die Erhöhung der Zellproliferation durch unseren Ansatz ist der Einschluss von Y-27632, von dem gezeigt wurde, dass es vorteilhafte Auswirkungen auf die Vermehrung und Spezialisierung menschlicher Epithelzellen hat19,20. Chapman et al. fanden heraus, dass die Verwendung von Y-27632 die Fähigkeit der Epithelzellen zur Vermehrung signifikant verbesserte und zu einer erfolgreichen Immortalisierung der Zellen ohne Anzeichen einer Zellkrise führte21. In unserer Studie erhöhte Y-27632 die Ausbeute dieser Epithelzellen signifikant, indem es ihre Anheftung und Proliferation verbesserte19.
Ein wesentliches Merkmal dieses Verfahrens ist die Kombination von Dispase und Kollagenase, um Epithelgewebe vom Bindegewebe zu trennen, während gleichzeitig Trypsin verwendet wird, um Epithelzellen vom Epithelgewebe zu dissoziieren22. Dispase hat sich als schnelles und effizientes und dennoch schonendes Enzym erwiesen, um die unbeschädigte Epidermis von der Dermis sowie unbeschädigte Schichten von Epithelzellen in Kultur von der darunter liegenden Oberfläche zu trennen und gleichzeitig die Lebensfähigkeit der Epithelzellen zu erhalten23. Kollagenase Typ I erleichtert die Isolierung von Epithelzellen und sorgt für die Vitalität und Integrität der Zellen24. Ein weiteres wesentliches Merkmal dieser Methode ist die Verwendung des Ausgangsmediums mit Y-27632 zur Kultivierung der neu isolierten HMECs. Nachdem die Zellen am dritten Tag an der Schale adhäsiert haben, wird das Kulturmedium auf Keratinocyte Serum-Free Medium umgestellt. Dieser Ansatz vereinfacht die Versuchsschritte deutlich und reduziert die Kosten des Experiments. Als Ergebnis erhielten wir mit dieser Methode mit nur einem kleinen Volumen an Brustgewebe sehr zufriedenstellende Zellzahlen, was darauf hindeutet, dass eine große Menge an Anfangsgewebe nicht notwendig ist. Ein Nachteil dieses Ansatzes besteht jedoch darin, dass das Vorhandensein von Trypsin die Integrität der Epithelzellen nicht ausreichend schützt. Ein weiterer potenziell limitierender Aspekt der Methode ist die Möglichkeit einer geringen (<1%) Kontamination von Myoepithelzellen während der Erstkultur9.
Unsere Methode bietet einen optimierten und effizienten Ansatz für die Isolierung und Kultivierung von primären HMECs, die aus adultem Brustgewebe gewonnen werden. Diese Technik zeichnet sich durch ihre Einfachheit, ihre Zeitersparnis und ihre Fähigkeit aus, grundlegende zelluläre Funktionen aufrechtzuerhalten. Folglich hat diese Technik klare Vorteile und ist vielversprechend, um eine beträchtliche Menge an Epithelzellen zu erzeugen. Darüber hinaus ermöglicht die Methode die Isolierung und Kultivierung von HMECs aus einem breiten Spektrum von Spendern, die sowohl für die Laborforschung als auch für klinische Anwendungen geeignet sind, was sie äußerst vielseitig und vielseitig einsetzbar macht.
Offenlegungen
Die Autoren erklären, dass es keine Interessenkonflikte bezüglich der Veröffentlichung dieser Arbeit gibt.
Danksagungen
Diese Arbeit wurde durch Zuschüsse des TCM Science and Technology Program der Provinz Zhejiang, China, unterstützt (2017ZA055; 2018ZA036) und das Wissenschafts- und Technologieprojekt von Zunyi, Provinz Guizhou, China (Zunyi City Kehe Support NS (2020) Nr. 18) an X. Xu. Die Autoren danken dem Molecular Biology Laboratory der Youjia (Hangzhou) Biomedical Technology Company für die Bereitstellung von Zellkulturschulungen.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin | Basalmedia | K431010 | For HMECs dissociation |
| 1.5 mL microcentrifuge Tubes | NEST | 081722CK01 | For cell digestion |
| 100 µm mesh filter | Solarbio | 431752 | For HMECs filtration |
| 100 mm Cell Culture Dish | Corning | 430167 | For cell culture |
| 4% paraformaldehyde | solarbio | P1110-100ml | For immunofluorescence staining to check differentiation marker of HMECs |
| 50 mL Centrifuge Tube | Corning | 430829 | For cell centrifugation |
| Cell Strainer | Solarbio | 431752 | Cell filtration |
| Centrifuge | Eppendorf | 5404HN133048 | Cell centrifuge |
| CO2 Incubator | Thermo Scientific | 42820906 | For cell incubation |
| Collagenase Type I | Merck | SKU:SCR103 | For HMECs isolation |
| Dispase | Solarbio | CAS:42613-33-2 | For HMECs isolation |
| DMEM | Gibco | 8122622 | Component of neutralization medium |
| Fetal Bovine Serum | Gibco | 2556132P | Component of neutralization medium |
| Penicillin/Streptomycin | Thermo Scientific | 15140-122 | Antibiotics |
| Phosphate buffered solution | Tecono | 20201033 | Washing solution |
| rabbit anti CK7 | abcam | ab68459 | For immunofluorescence staining to check differentiation marker of HMECs |
| rabbit anti GATA3 | abcam | ab199428 | For immunofluorescence staining to check differentiation marker of HMECs |
| Y-27632 | Solarbio | IY0040 | ROCK inhibitor |
Referenzen
- Smolarz, B., Nowak, A. Z., Romanowicz, H. Breast cancer-epidemiology, classification, pathogenesis and treatment (review of literature). Cancers (Basel). 14 (10), 2569 (2022).
- Gudjonsson, T., Adriance, M. C., Sternlicht, M. D., Petersen, O. W., Bissell, M. J. Myoepithelial cells: Their origin and function in breast morphogenesis and neoplasia. J Mammary Gland Biol Neoplasia. 10 (3), 261-272 (2005).
- Faridi, N., et al. Isolation and characterization of the primary epithelial breast cancer cells and the adjacent normal epithelial cells from iranian women's breast cancer tumors. Cytotechnology. 70 (2), 625-639 (2018).
- Tovar, E. A., et al. Dissecting the rat mammary gland: Isolation, characterization, and culture of purified mammary epithelial cells and fibroblasts. Bio Protoc. 10 (22), e3818 (2020).
- Jiang, X., Yang, H., Jing, Q., He, X. A "selective secondary tissue attachment" method for isolation and purification of mammary epithelial cells. Acta Histochem. 124 (8), 151972 (2022).
- Bernardini, C., et al. Development of a pig mammary epithelial cell culture model as a non-clinical tool for studying epithelial barrier-a contribution from the imi-conception project. Animals (Basel). 11 (7), 2012 (2021).
- Zhang, D., et al. Transdifferentiation of goat ear fibroblasts into lactating mammary epithelial cells induced by small molecule compounds. Biochem Biophys Res Commun. 573, 55-61 (2021).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: Rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc Natl Acad Sci U S A. 81 (17), 5435-5439 (1984).
- Zubeldia-Plazaola, A., et al. Comparison of methods for the isolation of human breast epithelial and myoepithelial cells. Front Cell Dev Biol. 3, 32 (2015).
- Liu, Z., et al. A simplified and efficient method to isolate primary human keratinocytes from adult skin tissue. J Vis Exp. (138), e57784 (2018).
- Xie, Z., et al. Isolation and culture of primary human gingival epithelial cells using y-27632. J Vis Exp. (177), e62978 (2021).
- Jin, L., et al. Characterization of primary human mammary epithelial cells isolated and propagated by conditional reprogrammed cell culture. Oncotarget. 9 (14), 11503-11514 (2018).
- Böcker, W., Hungermann, D., Decker, T. Anatomy of the breast. Pathologe. 30 (1), 6-12 (2009).
- Kouros-Mehr, H., Slorach, E. M., Sternlicht, M. D., Werb, Z. Gata-3 maintains the differentiation of the luminal cell fate in the mammary gland. Cell. 127 (5), 1041-1055 (2006).
- Wang, X., Reagan, M. R., Kaplan, D. L. Synthetic adipose tissue models for studying mammary gland development and breast tissue engineering. J Mammary Gland Biol Neoplasia. 15 (3), 365-376 (2010).
- Ethier, S. P., Mahacek, M. L., Gullick, W. J., Frank, T. S., Weber, B. L. Differential isolation of normal luminal mammary epithelial cells and breast cancer cells from primary and metastatic sites using selective media. Cancer Res. 53 (3), 627-635 (1993).
- Band, V., Sager, R. Distinctive traits of normal and tumor-derived human mammary epithelial cells expressed in a medium that supports long-term growth of both cell types. Proc Natl Acad Sci U S A. 86 (4), 1249-1253 (1989).
- Taylor-Papadimitriou, J., Shearer, M., Tilly, R. Some properties of cells cultured from early-lactation human milk. J Natl Cancer Inst. 58 (6), 1563-1571 (1977).
- Wen, J., Zu, T., Zhou, Q., Leng, X., Wu, X. Y-27632 simplifies the isolation procedure of human primary epidermal cells by selectively blocking focal adhesion of dermal cells. J Tissue Eng Regen Med. 12 (2), e1251-e1255 (2018).
- Yin, J., Yu, F. S. Rho kinases regulate corneal epithelial wound healing. Am J Physiol Cell Physiol. 295 (2), C378-C387 (2008).
- Chapman, S., Liu, X., Meyers, C., Schlegel, R., Mcbride, A. A. Human keratinocytes are efficiently immortalized by a rho kinase inhibitor. J Clin Invest. 120 (7), 2619-2626 (2010).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Dermatol. 28 (2), 107-112 (2019).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. J Invest Dermatol. 93 (2), 287-290 (1989).
- Ren, H. J., et al. Primary cultures of mouse small intestinal epithelial cells using the dissociating enzyme type I collagenase and hyaluronidase. Braz J Med Biol Res. 50 (5), e5831 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten