Method Article
Выделение и культивирование первичных эпителиальных клеток молочной железы человека
* Эти авторы внесли равный вклад
В этой статье
Резюме
В настоящем исследовании сообщается о более простом, экономящем время и экономичном протоколе для эффективной изоляции и выращивания первичных эпителиальных клеток молочной железы человека (HMEC) из небольшого количества ткани молочной железы. Этот протокол подходит для быстрого производства первичных HMEC как для лабораторного, так и для клинического применения.
Аннотация
Молочная железа является основной структурой молочной железы и играет важную роль в размножении. Эпителиальные клетки молочной железы человека (HMEC), которые являются исходными клетками рака молочной железы и других воспалительных заболеваний, связанных с молочной железой, привлекли значительное внимание. Тем не менее, выделение и культивирование первичных HMEC in vitro для исследовательских целей было сложной задачей из-за их высокодифференцированной, ороговевшей природы и короткого срока жизни. Таким образом, разработка простого и эффективного метода выделения и культивирования HMECs имеет большую научную ценность для изучения биологии молочной железы и заболеваний, связанных с молочной железой. В этом исследовании мы успешно выделили первичные HMECs из небольших количеств ткани молочной железы путем переваривания смесью ферментов в сочетании с исходной культурой в 5% сыворотке плода крупного рогатого скота DMEM, содержащей ингибитор Rho-ассоциированной киназы (ROCK) Y-27632, с последующим расширением культуры в бессывороточной кератиноцитарной среде. Этот подход избирательно способствует росту эпителиальных клеток, что приводит к оптимизированному выходу клеток. Простота и удобство этого метода делают его пригодным как для лабораторных, так и для клинических исследований, которые должны дать ценную информацию об этих важных областях исследований.
Введение
Рак молочной железы является основным типом рака, диагностируемым у женщин во всем мире, и основной причиной смерти от рака1. Патогенез рака молочной железы сложен и включает в себя множество факторов, таких как генетика, окружающая среда и образ жизни. HMECs, активные молочные клетки, являются одним из наиболее важных компонентов ткани молочной железы и, вероятно, являются исходными клетками, участвующими в канцерогенезе рака молочной железы. Таким образом, HMEC привлекли наибольшее внимание исследователей для изучения рака молочной железы2. Кроме того, первичные клетки обладают способностью обеспечивать биологически значимую характеристику сложных клеточных процессов благодаря сохранению ими генетической стабильности, нормальной морфологии и более полного набора основных клеточных функций, которые не могут быть достигнуты с помощью иммортализованных клеточных линий. Таким образом, выделение и культивирование первичных HMECs является важным шагом для изучения большинства заболеваний, связанных с молочной железой, таких как рак молочной железы и воспалительные заболевания молочной железы.
В настоящее время создана стабильная и воспроизводимая система выделения, культивирования и идентификации эпителиальных клеток молочных желез крыс, коров, свиней и коз 4,5,6,7. Тем не менее, выделение и культивирование первичных ГМЭК является сложной задачей из-за сложного микроокружения и низкого выхода клеток. На протяжении десятилетий ученые искали наиболее эффективный метод выделения и культивирования HMEC, хотя система культивирования HMEC была создана почти 20 лет назад. Например, Hammond et al. разработали бессывороточную питательную среду, в которой эффективно выращивались HMEC8. Недавно Zubeldia-Plazaola et al. протестировали четыре различных метода выделения с использованием процедур быстрого/медленного расщепления ферментов в сочетании с последовательной фильтрацией или дифференциальными стадиями центрифугирования для получения HMEC9. Они обнаружили, что метод медленного разложения в сочетании с дифференциальным центрифугированием является наиболее эффективным методом выделения HMECs из свежей ткани молочной железы. Тем не менее, этот метод выделения требует больших кусочков ткани (40-75 г) и использует большее количество ферментов для пищеварения. Их процедура сложна (не менее трех разных центрифугирований для получения разных фракций клеток), а также трудоемка. Таким образом, по-прежнему необходим простой и быстрый метод для эффективного получения популяций HMECs из небольших количеств ткани молочной железы для исследований и клинического применения9.
Наши предыдущие исследования показали, что добавление ингибитора Rho-ассоциированной киназы (ROCK) Y-27632 в исходную культуральную среду может упростить процесс выделения эпидермальных клеток кожи человека10, который также был успешно использован для выделения эпителиальных клеток десны11. Кроме того, более ранние исследования, проведенные группой Зубельдии-Плазаолы и группой Джина, показали, что Y-27632 обладает способностью стимулировать быстрый и неограниченный рост in vitro первичных эпителиальных клеток, полученных из ткани молочной железы 9,12. Целью настоящего исследования было проверить, упростит ли использование Y-27632 выделение и культивирование HMECs, и мы успешно разработали простой и легко выполняемый метод выделения HMECs из небольших кусочков (1 г) молочной ткани.
протокол
Свежие нормальные ткани молочной железы, используемые в этом протоколе, собираются в результате хирургического вмешательства вокруг очага рефрактерного гранулематозного лобулярного мастита в Первой аффилированной больнице Чжэцзянского китайского медицинского университета в соответствии с рекомендациями Комитета по медицинской этике Первой аффилированной больницы Чжэцзянского китайского медицинского университета (протокол No. ChiMCTR2100005281, дата: 2017-07-17).
1. Приобретение тканей
- Соберите свежие ткани молочных желез из хирургических образцов, взятых у взрослых женщин, в стерильные пробирки, содержащие 10 мл фосфатно-солевого буфера (PBS) с 3% пенициллином/стрептомицином (P/S).
ПРИМЕЧАНИЕ: Ткани молочной железы следует обрабатывать в соответствии со следующими деталями в течение 24 часов после забора после операции.
2. Предварительная обработка тканей
- Удалите жировую ткань из ткани молочной железы с помощью двух пар щипцов, следя за тем, чтобы оставшаяся ткань молочной железы весила ~1 г.
- Промойте ткань молочной железы в 75% растворе этанола (5 мл) в течение 5 с, а затем промойте 20 мл моющего раствора (Таблица 1) в течение 2 х 5 минут.
3. Переваривание тканей
- Разрежьте ткань молочной железы на более мелкие фрагменты, измельчая ткань с помощью двух хирургических лезвий в течение 15 минут, чтобы получить гомогенат ткани. Перенесите кусочки ткани в центрифужную пробирку объемом 50 мл.
- Добавьте 10 мл раствора коллагеназы 5,0 мг/мл диспаза + 5,0 мг/мл коллагеназы, 3 мл 0,25% трипсина и 7 мл PBS в общей сложности 20 мл раствора для разложения в центрифужную пробирку объемом 50 мл, содержащую фрагменты ткани молочной железы. Поместите трубку на водяную баню при температуре 37 °C и выдерживайте в течение 1,5 ч; Встряхивайте трубку каждые 20 минут.
- Остановите процесс разложения, введя 20 мл нейтрализующего раствора. Перемешайте содержимое с помощью пипетирования ~15x.
- Отфильтруйте смесь через сетчатый фильтр 100 мкм. Центрифугировать при 156 × г в течение 5 мин.
- Удалите надосадочную жидкость и повторите инкубацию гранулы с 20 мл нейтрализующего раствора. Смешайте содержимое с помощью пипетки 15x и центрифугируйте при 156 × г в течение 5 минут.
- Осторожно удалите надосадочную жидкость и повторно суспендируйте клеточную гранулу 10 мл исходной питательной среды. Поместите клеточную суспензию в чашку для клеточных культур диаметром 100 мм.
- Культивируйте клетки в инкубаторе с 5% содержаниемCO2 при температуре 37 °C. Заменяйте исходную питательную среду свежей средой для эпителиальных клеток каждые три дня. Проверяйте клетки и обновляйте среду каждые 2 дня.
4. Пассирование клеток
- Выньте чашку диаметром 100 мм из инкубатора, когда клетки достигнут 80%-90% конфлюенции, выбросьте использованную среду и промойте чашку 2 мл PBS. Удалите PBS, а затем добавьте 2 мл 0,05% трипсина в каждую 100-миллиметровую чашку.
ПРИМЕЧАНИЕ: Поворачивайте чашку, чтобы убедиться, что раствор трипсина имеет достаточный контакт со дном чашки. - Поместите чашку диаметром 100 мм в инкубатор с температурой 37 °C на ~7 минут для процесса пищеварения.
- Исследуйте клетки с помощью микроскопа с помощью объектива с 40-кратным увеличением, чтобы убедиться, что большая часть клеток была диссоциирована от дна чашки.
- Остановите процесс пищеварения, добавив 8 мл нейтрализующего раствора, и перенесите клетки в пробирку объемом 15 мл. Перемешайте клетки, пипетируя вверх и вниз 10-15 раз. Центрифугируйте клетки при 156 × г в течение 5 минут.
- Осторожно удалите надосадочную жидкость, повторно суспендируйте клетки 10 мл эпителиальной клеточной среды и подсчитайте количество клеток.
- Добавьте 1 × 106 клеток в 10 мл эпителиальной клеточной среды в чашке диаметром 100 мм.
- Обновляйте эпителиальную клеточную среду и наблюдайте за клетками каждые 2 дня.
5. Криоконсервация клеток
- Повторите шаги 4.1-4.4.
- Осторожно удалите надосадочную жидкость и повторно суспендируйте клетки в 2 мл раствора для криоконсервации клеток.
- Перелейте 1 мл раствора для криоконсервации, содержащего клетки, в каждый криогенный флакон.
- Запишите названия криоконсервированных камер, номера проходов и даты.
- Поместите флаконы в контейнер с контролируемой скоростью заморозки при температуре -80 °C на ночь.
- Достаньте криогенные флаконы из морозильной камеры при температуре -80 °C и быстро переложите их в жидкий азот для длительного хранения.
Результаты
На рисунке 1 показана схема процедуры. Протокол предполагает использование комбинации ферментов, а именно диспазы, коллагеназы и трипсина. Эту комбинацию используют с целью отделения эпителиального листа от слоя фибробластов под ним и последующего использования трипсина для диссоциации эпителиальных клеток молочной железы в суспензию. Кроме того, рост эпителиальных клеток эффективно стимулировался путем добавления Y-27632 в исходную питательную среду. В результате, этот метод позволяет получить большое количество HMEC, удовлетворяющих требованиям по сдаче в среднем всего за 10 дней.
Чтобы проверить решающую роль Y-27632 в росте клеток после выделения, мы разделили свежевыделенные клетки на две группы: одну группу покрывали исходной средой, содержащей 10 мМ Y-27632 (рис. 2A); другая группа была покрыта исходной средой без добавления Y-27632 в качестве контрольной группы (рисунок 2B). Через 2 дня культивирования клетки из обеих групп были переведены в эпидермальную клеточную среду (рис. 1). Из рисунка 2 видно, что по сравнению с третьим днем, метод с Y-27632 заметно увеличил количество HMEC на девятый день. HMEC образовали сплоченную группу, напоминающую остров, который имел четкие границы и сильные связи между клетками. Эти клетки распространялись наружу в окружающую среду. Клетки, покрытые Y-27632 (рисунок 2A), росли намного быстрее, чем клетки контрольной группы (рисунок 2B). Чтобы подтвердить, что Y-27632 усиливает рост HMEC, замороженные P0-клетки размораживали и покрывали с добавлением 10 мМ Y-27632 или без него, а клетки пассажа 1 (P1) собирали в разные дни, как показано на рисунке 3. Клетки были проанализированы на жизнеспособность и пролиферацию с использованием набора для подсчета клеток-8 (CCK-8). Как показано на рисунке 3, скорость роста клеток, обработанных средой, содержащей Y-27632, была значительно выше, чем у клеток контрольной группы без Y-27632. Если сложить эти данные вместе, то можно увидеть, что добавление Y-27632 в исходную среду значительно усиливает рост прикрепленных клеток после выделения.
Чтобы убедиться, что клетки, полученные этим методом, являются HMECs, мы провели иммунофлуоресцентный анализ P0 HMECs на два маркера эпителиальных клеток молочной железы: CK7 и GATA3. CK7, диагностически значимый цитокератин, является маркером железистой дифференцировки в нормальном эпителии молочной железы и его пролиферативных эпителиальных процессах13. Кроме того, Kouros-Mehr et al. сообщили, что GATA3 функционирует как фактор транскрипции в эпителиальных клетках молочной железы и участвует в поддержании дифференцировки люминального эпителия в полностью развитых молочных железах14. Как показано на рисунке 3, клетки, которые мы культивировали и расширили, сильно экспрессируют как CK7 (рисунок 4A), так и GATA3 (рисунок 4B). Количественный анализ CK7- и GATA3-положительных клеток показал, что более 98% клеток экспрессировали как CK7, так и GATA3 (рисунок 4C), что указывает на ограниченную контаминацию других типов клеток, таких как фибробласты. Иногда мы наблюдали ограниченное количество фибробластоподобных клеток (удлиненная морфология) в исходной культуре (P0, рис. 2), но мы редко видим, чтобы эти клетки появлялись в пассажных клетках (P3, рис. 4D).
Чтобы проверить, может ли эпителиальная характеристика HMECs сохраняться после нескольких пассажей, мы провели qRT-ПЦР-анализ маркеров эпителиальных клеток молочной железы CK7 и GATA3 в клетках, культивируемых с Y-27632 или без него (рис. 5). Уровни экспрессии CK7 и GATA3 существенно не различались в клетках P0 и P3, с Y-27632 или без него, что указывает на то, что их фенотипические и дифференцировочные характеристики не изменялись с течением времени во время экспансии культуры.
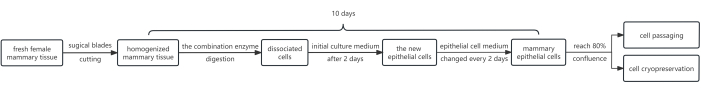
Рисунок 1: Блок-схема протокола для выделения и культивирования HMEC. Первоначально фрагменты женской молочной ткани срезали хирургическими лезвиями и переваривали с помощью комбинации ферментов. В дальнейшем полученные клеточные гранулы культивировали в исходной питательной среде, содержащей 10 мМ Y-27632. Через 2 дня исходную питательную среду заменяли эпителиальной клеточной средой. Эпителиальные клетки молочной железы культивировали в эпидермальной клеточной среде для достижения удовлетворительного покрытия через ~8 дней, теперь пригодных для пассирования. При необходимости некоторые клетки могут быть подвергнуты клеточной криоконсервации. Сокращение: HMECs = эпителиальные клетки молочной железы человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Изображения HMECs, полученные после первоначальной инокуляции. В течение 2 дней после инокуляции (А) первичные ГМЭЦ культивировали в исходной среде, содержащей Y-27632, и (В) первичные ГМЭК культивировали в исходной среде без Y-27632. После 48-часового периода культивирования в обеих группах была заменена бессывороточная среда для культивирования кератиноцитов. Были сделаны фотографии, чтобы зафиксировать состояние роста клеток через день. Обе серии репрезентативных изображений были получены с помощью инвертированного микроскопа (100x) на 3, 5 и 9 день после инокуляции. Масштабные линейки = 100 μм. Сокращение: HMECs = эпителиальные клетки молочной железы человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
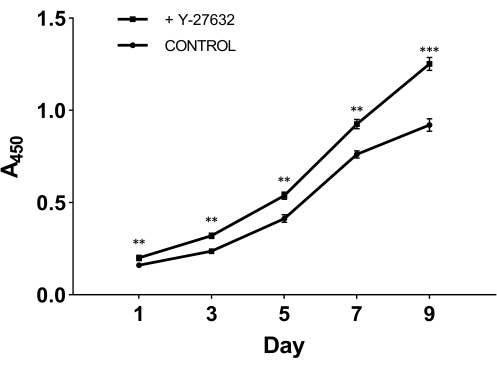
Рисунок 3: Усиленный рост HMECs Passage 1 (P1) с Y-27632. Замороженные P0-клетки размораживали и культивировали с Y-27632 или без него. Клетки (P1) собирали через 1, 3, 5, 7 и 9 дней, а абсорбцию анализировали при длине волны 450 нм с помощью набора CCK-8. В 1-й день количество адгезивных жизнеспособных клеток в исходной среде, содержащей Y-27632, было достоверно выше, чем без Y-27632. Кроме того, кривая роста клеток, обработанных Y-27632, показала более крутое увеличение. **p < 0,01, ***p < 0,001. Сокращение: HMECs = эпителиальные клетки молочной железы человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Экспрессия маркеров HMEC (P0). Экспрессию CK7 и GATA3 в HMECs анализировали методом иммунофлуоресцентного окрашивания. HMEC окрашивали на (A) CK7 (красный) и (B) GATA3 (красный); DAPI (синий) использовался для окрашивания ядер. Изображения были получены с помощью лазерного сканирующего конфокального микроскопа (400x). Масштабные линейки = 20 мкм. (C) Процент положительных клеток при окрашивании; (D) репрезентативное изображение HMECs (P3). Масштабные линейки = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
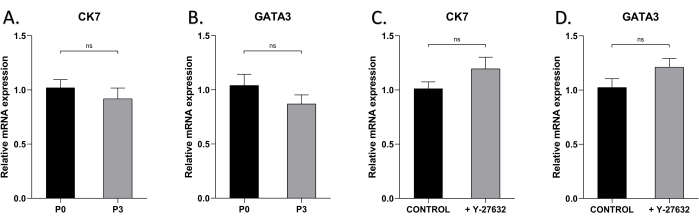
Рисунок 5: Экспрессия CK7 и GATA3 HMECs в P0 и P3. Использование qRT-PCR для определения экспрессии (A) CK7 в HMECs P0 и P3 на 7-й день, (B) GATA3 в HMECs P0 и P3, (C) CK7 в P1 HMECs, культивированных с Y27632 или без него, на 7-й день, (D) GATA3 в P1 HMECs, культивированных с Y-27632 или без него, на 7-й день. nsp > 0,05. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
HMEC жизненно важны для сохранения анатомической и функциональной целостности ткани молочной железы, а также полезны в научных исследованиях, клинических реализациях и связанных с ними областях15. Первичные эпителиальные клетки — это тип специализированных клеток, которые имеют ограниченный проход и более короткую продолжительность жизни. Тем не менее, рост HMECs был затруднен техническими ограничениями, которые, в свою очередь, препятствовали прогрессу в исследованиях рака молочной железы и других воспалительных заболеваний, связанных с молочной железой16.
В связи с этим существует острая необходимость в разработке стабильного, осуществимого и эффективного метода получения HMECs из свежих тканей молочной железы. Hammond et al.8 и Band and Sager17 успешно экстрагировали и культивировали эпителиальные клетки молочной железы. Однако состав требуемой питательной среды был чрезмерно сложным. Предыдущие исследования Taylor-Papidamitriou et al. показали, что полостные клетки из грудного молока можно культивировать с использованием среды, дополненной факторами роста и сывороткой18. В то время как их метод позволяет напрямую извлекать HMECs из грудного молока, присутствие неэпителиальных клеток может повлиять на рост HMECs, что затрудняет точное определение количества клеток. Jin et al. разработали метод условного перепрограммирования, который позволил первичным HMEC иметь более длительный жизненный цикл и сохранять гетерогенность клеток по сравнению с традиционными методами культивирования, но он сильно зависел от конкретных условий культивирования и ограничивал использование этого метода в других лабораториях иприложениях.
В исследовании, проведенном группой Zubeldia-Plazaola, был разработан оптимизированный метод выделения, который включал в себя медленное переваривание (в течение ночи) фрагментов измельченной ткани смесью коллагеназы и гиалуронидазы с последующим проведением трех дифференциальных центрифугирований на второй день для разделения фракций стромалы/эпителия. Этот метод выделения в сочетании с добавлением Y-27632 в культуру позволил получить большое количество жизнеспособных эпителиальных клеток. Тем не менее, количество ткани молочной железы, использованное в их исследовании, составило 40-75 г, а процедура изоляции длилась почти 2 дня9. Здесь мы сообщаем об использовании только 1 г ткани в этом протоколе, и мы протестировали и обнаружили, что этот метод также работает всего с 0,25 г ткани. Ферментная смесь коллагеназы, диспазы и трипсина эффективно расщепляла 1 г ткани за 1,5 ч, а вся процедура занимала ~3 ч. Добавление Y-27632 к исходной питательной среде может способствовать прикреплению и пролиферации эпителиальных клеток, а также ингибировать рост стромальныхклеток19. Важно отметить, что в этом исследовании мы протестировали компоненты исходной среды и обнаружили, что 5% FBS в DMEM для замены G-среды, использованной в предыдущей публикации, было достаточно для стимулирования прикрепленияи роста эпидермальных клеток.
После 2 суток культивирования в исходной среде клетки культивировали в бессывороточной кератиноцитарной среде. Характер роста клеток для исходной культуры (P0) после инокуляции показан на рисунке 2, где показана схема роста колоний. Этот метод выделения, вероятно, дает все типы эпителиальных клеток, включая миоэпителиальные клетки из тканей молочной железы, которые необходимо дополнительно охарактеризовать в будущем. Тем не менее, сравнивая рост клеток в присутствии Y-27632 с контрольной группой без добавления Y-27632 в исходную культуральную среду, мы смогли увидеть, что метод с Y-27632 значительно усилил производство клеток и повысил эффективность клеточной культуры (рис. 2А). Обычно через ~9-10 дней культивирования после инокуляции клетки эпидермиса могут достичь плотности, пригодной для пассирования. Кроме того, мы также показали, что присутствие Y-27632 может усиливать рост P1 HMEC после восстановления клеток P0, замороженных в конце исходной культуры (рис. 3). В наших руках мы обнаружили, что более 90% клеток смогли выжить после размораживания из замороженного хранилища. Время удвоения клеток составляло около 72 ч, и HMEC были способны поддерживать нормальный рост до 7-го пассажа.
В этом исследовании клетки экспрессировали высокие уровни эпителиальных клеточных маркеров молочной железы CK7 и GATA3, и, что важно, почти 100% клеток на поздней стадии исходной культуры были положительными на CK7 и GATA3 (рис. 4), что указывает на высокую чистоту эпителиальных клеток, полученных с помощью этого метода. Наконец, в этом исследовании сравнивались уровни экспрессии CK7 и GATA3 в клетках P0 и P3, выявляя высокие уровни экспрессии в обоих клетках, предполагая, что пассаж не изменяет фенотип клеток (рис. 5A, B). Кроме того, независимо от присутствия Y-27632, CK7 и GATA3 были стабильно высоко экспрессированы, что означает, что добавление Y-27632 не влияло на клеточный фенотип (рис. 5C, D).
Основной причиной усиления пролиферации клеток с помощью нашего подхода является включение Y-27632, который, как было показано, оказывает благотворное влияние на размножение и специализацию эпителиальных клеток человека19,20. Чепмен и др. обнаружили, что использование Y-27632 значительно повысило способность эпителиальных клеток к размножению и привело к успешной иммортизации клеток без каких-либо признаков клеточногокризиса. В нашем исследовании Y-27632 значительно увеличивал выход этих эпителиальных клеток за счет усиления их прикрепления и пролиферации.
Одной из ключевых особенностей этого метода является сочетание диспазы и коллагеназы для отделения эпителиальной ткани от соединительной, а также использование трипсина для диссоциации эпителиальных клеток от эпителиальной ткани22. Диспаза оказалась быстрым и эффективным, но щадящим ферментом для отделения неповрежденного эпидермиса от дермы, а также неповрежденных слоев эпителиальных клеток в культуре от подстилающей поверхности, сохраняя при этом жизнеспособность эпителиальных клеток23. Коллагеназа I типа способствует выделению эпителиальных клеток и обеспечивает жизнеспособность и целостность клеток24. Еще одной ключевой особенностью этого метода является использование исходной среды с Y-27632 для культивирования вновь выделенных HMEC. После того как клетки прилипнут к чашке на третий день, питательную среду меняют на среду без сыворотки кератиноцитов. Такой подход заметно упрощает этапы эксперимента и снижает стоимость эксперимента. В результате мы получили очень удовлетворительное количество клеток, используя только небольшой объем ткани молочной железы с помощью этого метода, что указывает на то, что большое количество исходной ткани не требуется. Однако одним из недостатков такого подхода является то, что присутствие трипсина не обеспечивает адекватной защиты целостности эпителиальных клеток. Другим потенциально ограничивающим аспектом метода является возможность небольшой (<1%) контаминации миоэпителиальных клеток во время исходнойкультуры9.
Наш метод предлагает оптимизированный и эффективный подход к выделению и культивированию первичных HMEC, полученных из ткани молочной железы взрослого человека. Этот метод характеризуется своей простотой, экономией времени и способностью поддерживать основные клеточные функции. Следовательно, этот метод имеет явные преимущества и является весьма перспективным для получения значительного количества эпителиальных клеток. Кроме того, метод позволяет выделять и культивировать HMECs от широкого круга доноров, подходит как для лабораторных исследований, так и для клинического применения, что делает его очень универсальным и широко применимым.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи.
Благодарности
Эта работа была поддержана грантами Научно-технической программы ТКМ провинции Чжэцзян, Китай (2017ZA055; 2018ZA036) и научно-технический проект Цзуньи, провинция Гуйчжоу, Китай (Zunyi City Kehe Support NS (2020) No. 18) X. Xu. Авторы благодарят Лабораторию молекулярной биологии компании Youjia (Hangzhou) Biomedical Technology Company за предоставление обучения клеточным культурам.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin | Basalmedia | K431010 | For HMECs dissociation |
| 1.5 mL microcentrifuge Tubes | NEST | 081722CK01 | For cell digestion |
| 100 µm mesh filter | Solarbio | 431752 | For HMECs filtration |
| 100 mm Cell Culture Dish | Corning | 430167 | For cell culture |
| 4% paraformaldehyde | solarbio | P1110-100ml | For immunofluorescence staining to check differentiation marker of HMECs |
| 50 mL Centrifuge Tube | Corning | 430829 | For cell centrifugation |
| Cell Strainer | Solarbio | 431752 | Cell filtration |
| Centrifuge | Eppendorf | 5404HN133048 | Cell centrifuge |
| CO2 Incubator | Thermo Scientific | 42820906 | For cell incubation |
| Collagenase Type I | Merck | SKU:SCR103 | For HMECs isolation |
| Dispase | Solarbio | CAS:42613-33-2 | For HMECs isolation |
| DMEM | Gibco | 8122622 | Component of neutralization medium |
| Fetal Bovine Serum | Gibco | 2556132P | Component of neutralization medium |
| Penicillin/Streptomycin | Thermo Scientific | 15140-122 | Antibiotics |
| Phosphate buffered solution | Tecono | 20201033 | Washing solution |
| rabbit anti CK7 | abcam | ab68459 | For immunofluorescence staining to check differentiation marker of HMECs |
| rabbit anti GATA3 | abcam | ab199428 | For immunofluorescence staining to check differentiation marker of HMECs |
| Y-27632 | Solarbio | IY0040 | ROCK inhibitor |
Ссылки
- Smolarz, B., Nowak, A. Z., Romanowicz, H. Breast cancer-epidemiology, classification, pathogenesis and treatment (review of literature). Cancers (Basel). 14 (10), 2569 (2022).
- Gudjonsson, T., Adriance, M. C., Sternlicht, M. D., Petersen, O. W., Bissell, M. J. Myoepithelial cells: Their origin and function in breast morphogenesis and neoplasia. J Mammary Gland Biol Neoplasia. 10 (3), 261-272 (2005).
- Faridi, N., et al. Isolation and characterization of the primary epithelial breast cancer cells and the adjacent normal epithelial cells from iranian women's breast cancer tumors. Cytotechnology. 70 (2), 625-639 (2018).
- Tovar, E. A., et al. Dissecting the rat mammary gland: Isolation, characterization, and culture of purified mammary epithelial cells and fibroblasts. Bio Protoc. 10 (22), e3818 (2020).
- Jiang, X., Yang, H., Jing, Q., He, X. A "selective secondary tissue attachment" method for isolation and purification of mammary epithelial cells. Acta Histochem. 124 (8), 151972 (2022).
- Bernardini, C., et al. Development of a pig mammary epithelial cell culture model as a non-clinical tool for studying epithelial barrier-a contribution from the imi-conception project. Animals (Basel). 11 (7), 2012 (2021).
- Zhang, D., et al. Transdifferentiation of goat ear fibroblasts into lactating mammary epithelial cells induced by small molecule compounds. Biochem Biophys Res Commun. 573, 55-61 (2021).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: Rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc Natl Acad Sci U S A. 81 (17), 5435-5439 (1984).
- Zubeldia-Plazaola, A., et al. Comparison of methods for the isolation of human breast epithelial and myoepithelial cells. Front Cell Dev Biol. 3, 32 (2015).
- Liu, Z., et al. A simplified and efficient method to isolate primary human keratinocytes from adult skin tissue. J Vis Exp. (138), e57784 (2018).
- Xie, Z., et al. Isolation and culture of primary human gingival epithelial cells using y-27632. J Vis Exp. (177), e62978 (2021).
- Jin, L., et al. Characterization of primary human mammary epithelial cells isolated and propagated by conditional reprogrammed cell culture. Oncotarget. 9 (14), 11503-11514 (2018).
- Böcker, W., Hungermann, D., Decker, T. Anatomy of the breast. Pathologe. 30 (1), 6-12 (2009).
- Kouros-Mehr, H., Slorach, E. M., Sternlicht, M. D., Werb, Z. Gata-3 maintains the differentiation of the luminal cell fate in the mammary gland. Cell. 127 (5), 1041-1055 (2006).
- Wang, X., Reagan, M. R., Kaplan, D. L. Synthetic adipose tissue models for studying mammary gland development and breast tissue engineering. J Mammary Gland Biol Neoplasia. 15 (3), 365-376 (2010).
- Ethier, S. P., Mahacek, M. L., Gullick, W. J., Frank, T. S., Weber, B. L. Differential isolation of normal luminal mammary epithelial cells and breast cancer cells from primary and metastatic sites using selective media. Cancer Res. 53 (3), 627-635 (1993).
- Band, V., Sager, R. Distinctive traits of normal and tumor-derived human mammary epithelial cells expressed in a medium that supports long-term growth of both cell types. Proc Natl Acad Sci U S A. 86 (4), 1249-1253 (1989).
- Taylor-Papadimitriou, J., Shearer, M., Tilly, R. Some properties of cells cultured from early-lactation human milk. J Natl Cancer Inst. 58 (6), 1563-1571 (1977).
- Wen, J., Zu, T., Zhou, Q., Leng, X., Wu, X. Y-27632 simplifies the isolation procedure of human primary epidermal cells by selectively blocking focal adhesion of dermal cells. J Tissue Eng Regen Med. 12 (2), e1251-e1255 (2018).
- Yin, J., Yu, F. S. Rho kinases regulate corneal epithelial wound healing. Am J Physiol Cell Physiol. 295 (2), C378-C387 (2008).
- Chapman, S., Liu, X., Meyers, C., Schlegel, R., Mcbride, A. A. Human keratinocytes are efficiently immortalized by a rho kinase inhibitor. J Clin Invest. 120 (7), 2619-2626 (2010).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Dermatol. 28 (2), 107-112 (2019).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. J Invest Dermatol. 93 (2), 287-290 (1989).
- Ren, H. J., et al. Primary cultures of mouse small intestinal epithelial cells using the dissociating enzyme type I collagenase and hyaluronidase. Braz J Med Biol Res. 50 (5), e5831 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены