Method Article
عزل وثقافة الخلايا الظهارية الثديية البشرية الأولية
* These authors contributed equally
In This Article
Summary
تشير الدراسة الحالية إلى بروتوكول أسهل وموفر للوقت واقتصادي لعزل وتنمية الخلايا الظهارية الثديية البشرية الأولية (HMECs) بكفاءة من كميات صغيرة من الأنسجة الثديية. هذا البروتوكول مناسب لإنتاج HMECs الأولية بسرعة لكل من التطبيقات المختبرية والسريرية.
Abstract
الغدة الثديية هي بنية أساسية للثدي وتلعب دورا أساسيا في التكاثر. حظيت الخلايا الظهارية الثديية البشرية (HMECs) ، وهي الخلايا الأصلية لسرطان الثدي والأمراض الالتهابية الأخرى المرتبطة بالثدي ، باهتمام كبير. ومع ذلك ، فإن عزل وزراعة HMECs الأولية في المختبر لأغراض البحث كان يمثل تحديا بسبب طبيعتها المتباينة للغاية والكيراتينية وعمرها القصير. لذلك ، فإن تطوير طريقة بسيطة وفعالة لعزل وزراعة HMECs له قيمة علمية كبيرة لدراسة بيولوجيا الثدي والأمراض المرتبطة بالثدي. في هذه الدراسة ، نجحنا في عزل HMECs الأولية من كميات صغيرة من الأنسجة الثديية عن طريق الهضم بمزيج من الإنزيمات جنبا إلى جنب مع مزرعة أولية في 5٪ مصل بقري جنيني - DMEM يحتوي على مثبط كيناز مرتبط ب Rho (ROCK) Y-27632 ، متبوعا بتوسع الثقافة في وسط الخلايا الكيراتينية الخالية من المصل. يعزز هذا النهج بشكل انتقائي نمو الخلايا الظهارية ، مما يؤدي إلى إنتاجية خلية محسنة. إن بساطة وراحة هذه الطريقة تجعلها مناسبة لكل من الأبحاث المختبرية والسريرية ، والتي يجب أن توفر رؤى قيمة في مجالات الدراسة المهمة هذه.
Introduction
سرطان الثدي هو النوع الرئيسي من السرطان الذي يتم تشخيصه لدى النساء على مستوى العالم وهو السبب الرئيسي للوفاة من السرطان1. التسبب في سرطان الثدي معقد ، وينطوي على عوامل متعددة مثل الوراثة والبيئة ونمط الحياة. HMECs ، الخلايا النشطة المنتجة للحليب ، هي واحدة من أهم مكونات الأنسجة الثديية ومن المحتمل أن تكون الخلايا الأصلية المشاركة في سرطان الثدي. لذلك ، تلقت HMECs أكبر قدر من الاهتمام من الباحثين لدراسة سرطان الثدي2. علاوة على ذلك ، تتمتع الخلايا الأولية بالقدرة على توفير توصيف ذي صلة بيولوجيا للعمليات الخلوية المعقدة بسبب احتفاظها بالاستقرار الجيني ، والتشكل الطبيعي ، ومجموعة أكثر اكتمالا من الوظائف الخلوية الأساسية التي لا يمكن تحقيقها باستخدام خطوط الخلايا الخالدة3. ومن ثم ، فإن عزل وثقافة HMECs الأولية هي خطوة أساسية لدراسة معظم الأمراض المرتبطة بالثدي مثل سرطان الثدي وأمراض التهاب الثدي.
في الوقت الحاضر ، تم إنشاء نظام مستقر وقابل للتكرار لعزل وثقافة وتحديد الخلايا الظهارية الثديية من الفئران والأبقار والخنازير والماعز4،5،6،7. ومع ذلك ، فإن عزلة وثقافة HMECs الأولية تمثل تحديا بسبب البيئة المكروية المعقدة وانخفاض إنتاجية الخلايا. على مدى عقود ، كان العلماء يبحثون عن الطريقة الأكثر فعالية لعزل وزراعة HMECs على الرغم من إنشاء نظام استزراع ل HMECs منذ ما يقرب من 20 عاما. على سبيل المثال ، طور Hammond et al. وسط استزراع خال من المصل نمت فيه HMECs بكفاءة8. في الآونة الأخيرة ، اختبر Zubeldia-Plazaola et al. أربع طرق عزل مختلفة باستخدام إجراءات هضم الإنزيم السريعة / البطيئة جنبا إلى جنب مع الترشيح المتسلسل أو خطوات الطرد المركزي التفاضلي للحصول على HMECs9. ووجدوا أن طريقة الهضم البطيء مع الطرد المركزي التفاضلي هي الطريقة الأكثر فعالية لعزل HMECs عن أنسجة الثدي الطازجة. ومع ذلك ، تتطلب طريقة العزل هذه قطعا كبيرة من الأنسجة (40-75 جم) وتستخدم كميات أكبر من إنزيمات الهضم. إجراءاتهم معقدة (على الأقل ثلاثة أجهزة طرد مركزي مختلفة للحصول على كسور خلايا مختلفة) ، فضلا عن أنها تستغرق وقتا طويلا. لذلك ، لا تزال هناك حاجة إلى طريقة بسيطة وسريعة للحصول بكفاءة على مجموعات HMECs من كميات صغيرة من الأنسجة الثديية للبحث والتطبيقات السريرية9.
أظهرت دراساتنا السابقة أن إضافة مثبط كيناز المرتبط ب Rho (ROCK) Y-27632 إلى وسط الاستزراع الأولي يمكن أن يبسط عملية عزل خلايا البشرة الجلدية البشرية10 ، والتي تم استخدامها أيضا بنجاح لعزل الخلايا الظهارية اللثوية11. بالإضافة إلى ذلك ، أشارت الأبحاث السابقة التي أجرتها مجموعة Zubeldia-Plazaola ومجموعة جين إلى أن Y-27632 لديه القدرة على تحفيز النمو السريع وغير المحدود في المختبر للخلايا الظهارية الأولية المشتقة من الأنسجة الثديية 9,12. تهدف الدراسة الحالية إلى اختبار ما إذا كان استخدام Y-27632 من شأنه تبسيط عزل وثقافة HMECs ونجحنا في إنشاء طريقة بسيطة وسهلة التنفيذ لعزل HMECs من قطع صغيرة (1 جم) من أنسجة الثدي.
Protocol
يتم جمع الأنسجة الثديية الطبيعية الطازجة المستخدمة في هذا البروتوكول من الجراحة حول آفة التهاب الضرع الفصيصي الحبيبي المقاوم للحرارة في أول مستشفى تابع لجامعة تشجيانغ الطبية الصينية وفقا للمبادئ التوجيهية للجنة الأخلاقيات الطبية في أول مستشفى تابع لجامعة تشجيانغ الطبية الصينية (البروتوكول رقم. ChiMCTR2100005281 ، التاريخ: 2017-07-17).
1. اقتناء الأنسجة
- جمع الأنسجة الثديية الطازجة من العينات الجراحية المأخوذة من النساء البالغات في أنابيب معقمة تحتوي على 10 مل من محلول ملحي مخزن بالفوسفات (PBS) مع 3٪ بنسلين / ستربتومايسين (P / S).
ملاحظة: يجب التعامل مع الأنسجة الثديية وفقا للتفاصيل التالية في غضون 24 ساعة بعد جمعها من الجراحة.
2. المعالجة المسبقة للأنسجة
- قم بإزالة الأنسجة الدهنية من الأنسجة الثديية باستخدام زوجين من الملقط ، مع التأكد من أن الأنسجة الثديية المتبقية ~ 1 غرام في الوزن.
- اشطف الأنسجة الثديية في محلول إيثانول 75٪ (5 مل) لمدة 5 ثوان ثم اغسلها ب 20 مل من محلول الغسيل (الجدول 1) لمدة 2 × 5 دقائق.
3. هضم الأنسجة
- قم بتقطيع الأنسجة الثديية إلى أجزاء أصغر ، وقم بتمزيق الأنسجة باستخدام شفرتين جراحيتين لمدة 15 دقيقة للحصول على تجانس الأنسجة. نقل قطع الأنسجة إلى أنبوب طرد مركزي 50 مل.
- أضف 10 مل من 5.0 مجم / مل ديسباز + 5.0 مجم / مل محلول كولاجيناز ، و 3 مل من 0.25٪ تربسين ، و 7 مل من PBS إلى إجمالي 20 مل من محلول الهضم في أنبوب طرد مركزي سعة 50 مل يحتوي على شظايا الأنسجة الثديية. ضع الأنبوب في حمام مائي عند 37 درجة مئوية واحتضانه لمدة 1.5 ساعة ؛ هز الأنبوب كل 20 دقيقة.
- أوقف عملية الهضم عن طريق حقن 20 مل من محلول التحييد. امزج المحتويات عن طريق سحب ~ 15x.
- قم بتصفية الخليط من خلال مرشح شبكي 100 ميكرومتر. أجهزة الطرد المركزي في 156 × غرام لمدة 5 دقائق.
- قم بإزالة المادة الطافية وكرر حضانة الحبيبات ب 20 مل من محلول التحييد. امزج المحتويات عن طريق سحب 15x وأجهزة الطرد المركزي عند 156 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية بعناية وأعد تعليق حبيبات الخلية ب 10 مل من وسط الاستزراع الأولي. لوحة تعليق الخلية في طبق ثقافة الخلية 100 ملم.
- زراعة الخلايا في حاضنة CO2 5٪ عند 37 درجة مئوية. استبدل وسط الاستزراع الأصلي بوسط خلية ظهارية جديد كل يوم ثالث. تحقق من الخلايا وتحديث الوسيط كل 2 أيام.
4. تمرير الخلية
- قم بإزالة الطبق مقاس 100 مم من الحاضنة عندما تصل الخلايا إلى التقاء 80٪ -90٪ ، وتجاهل الوسط المستخدم ، وشطف الطبق 2x مع 2 مل من PBS. قم بإزالة برنامج تلفزيوني ثم أضف 2 مل من 0.05٪ تربسين في كل طبق 100 مم.
ملاحظة: قم بتدوير الطبق للتأكد من أن محلول التربسين ملامس بشكل كاف لقاع الطبق. - ضع طبق 100 مم في حاضنة 37 درجة مئوية لمدة ~ 7 دقائق لعملية الهضم.
- افحص الخلايا باستخدام المجهر باستخدام هدف 40x للتأكد من أن معظم الخلايا قد تم فصلها عن قاع الطبق.
- أوقف عملية الهضم بإضافة 8 مل من محلول معادلة ونقل الخلايا إلى أنبوب سعة 15 مل. امزج الخلايا عن طريق السحب لأعلى ولأسفل 10-15x. أجهزة الطرد المركزي الخلايا في 156 × غرام لمدة 5 دقائق.
- قم بإزالة المادة الطافية بعناية ، وأعد تعليق الخلايا ب 10 مل من وسط الخلية الظهارية ، واحسب عدد الخلايا.
- أضف 1 × 106 خلايا في 10 مل من وسط الخلية الظهارية في طبق 100 مم.
- تحديث وسط الخلية الظهارية ومراقبة الخلايا كل 2 أيام.
5. الحفظ بالتبريد للخلايا
- كرر الخطوات 4.1-4.4.
- قم بإزالة المادة الطافية بعناية وأعد تعليق الخلايا في 2 مل من محلول الحفظ بالتبريد للخلية.
- نقل 1 مل من محلول الحفظ بالتبريد الذي يحتوي على الخلايا إلى كل قارورة مبردة.
- سجل أسماء الخلايا المحفوظة بالتبريد وأرقام المقاطع والتواريخ.
- ضع القوارير في حاوية تجميد ذات معدل متحكم فيه عند -80 درجة مئوية طوال الليل.
- قم بإزالة القوارير المبردة من الفريزر -80 درجة مئوية وانقلها بسرعة إلى النيتروجين السائل للتخزين طويل الأجل.
النتائج
يوضح الشكل 1 مخططا للإجراء. يتضمن البروتوكول استخدام مزيج من الإنزيمات ، وهي dispase و collagenase و trypsin. يستخدم هذا المزيج لغرض فصل الصفيحة الظهارية عن طبقة الخلايا الليفية تحتها ثم استخدام التربسين لفصل الخلايا الظهارية الثديية إلى معلق. بالإضافة إلى ذلك ، تم تعزيز نمو الخلايا الظهارية بشكل فعال عن طريق إضافة Y-27632 إلى وسط الثقافة الأولي. نتيجة لذلك ، تنتج هذه الطريقة عددا كبيرا من HMECs ، وتفي بمتطلبات المرور في متوسط 10 أيام فقط.
لاختبار الدور الحاسم ل Y-27632 في نمو الخلايا بعد العزلة ، قمنا بتقسيم الخلايا المعزولة حديثا إلى مجموعتين: تم طلاء مجموعة واحدة بالوسط الأولي الذي يحتوي على 10 mM Y-27632 (الشكل 2A) ؛ تم طلاء مجموعة واحدة بالوسط الأولي الذي يحتوي على 10 mM Y-27632 (الشكل 2A) ؛ تم طلاء مجموعة واحدة بالوسط الأولي الذي يحتوي على 10 mM Y-27632 (الشكل 2A) ؛ تم طلاء مجموعة واحدة بالوسط الأولي الذي يحتوي على 10 mM Y-27632 (الشكل 2A) ؛ تم طلاء مجموعة واحدة بالوسط الأولي الذي يحتوي على 10 mM Y-27632 (الشكل 2A) ؛ تم طلاء المجموعة الأخرى بالوسط الأولي دون إضافة Y-27632 كمجموعة تحكم (الشكل 2B). بعد يومين من الثقافة ، تم تحويل الخلايا من كلا المجموعتين إلى وسط خلايا البشرة (الشكل 1). من الشكل 2 ، يمكننا ملاحظة أنه بالمقارنة مع اليوم الثالث ، فإن الطريقة مع Y-27632 عززت بشكل ملحوظ عدد HMECs في اليوم التاسع. شكلت HMECs مجموعة متماسكة تشبه جزيرة لها حدود مميزة وروابط قوية بين الخلايا. توسعت هذه الخلايا إلى الخارج في البيئة المحيطة. نمت الخلايا المطلية ب Y-27632 (الشكل 2A) بشكل أسرع بكثير من الخلايا في المجموعة الضابطة (الشكل 2B). للتأكد من أن Y-27632 يعزز نمو HMEC ، تم إذابة خلايا P0 المجمدة وطلائها بإضافة أو بدون إضافة 10 mM Y-27632 ، وتم جمع خلايا المرور 1 (P1) في أيام مختلفة كما هو موضح في الشكل 3. تم تحليل الخلايا للتأكد من صلاحيتها وانتشارها باستخدام مجموعة عدد الخلايا -8 (CCK-8). كما هو موضح في الشكل 3 ، كان معدل نمو الخلايا المعالجة بالوسط المحتوي على Y-27632 أعلى بكثير من معدل نمو الخلايا في المجموعة الضابطة بدون Y-27632. بأخذ هذه البيانات معا ، يمكن ملاحظة أن إضافة Y-27632 في الوسط الأولي يعزز بشكل كبير نمو الخلايا المرفقة بعد العزل.
للتحقق من أن الخلايا التي تم الحصول عليها بهذه الطريقة هي HMECs ، أجرينا تحليلا مناعيا ل P0 HMECs لعلامتين للخلايا الظهارية الثديية: CK7 و GATA3. CK7 ، وهو سيتوكيراتين مهم تشخيصيا ، هو علامة على التمايز الغدي في ظهارة الثدي الطبيعية وعملياتها الظهارية التكاثرية13. بالإضافة إلى ذلك ، أفاد Kouros-Mehr et al. أن GATA3 يعمل كعامل نسخ داخل الخلايا الظهارية الثديية ويشارك في الحفاظ على التمايز الظهاري اللمعي في الغدد الثديية المطورةبالكامل 14. كما هو موضح في الشكل 3 ، فإن الخلايا التي قمنا بزراعتها وتوسيعها تعبر بقوة عن كل من CK7 (الشكل 4A) و GATA3 (الشكل 4B). أظهر التحليل الكمي لكل من الخلايا الإيجابية CK7 و GATA3 أن أكثر من 98٪ من الخلايا عبرت عن كل من CK7 و GATA3 (الشكل 4C) ، مما يشير إلى تلوث محدود لأنواع أخرى من الخلايا ، مثل الخلايا الليفية. لاحظنا أحيانا عددا محدودا من الخلايا الشبيهة بالخلايا الليفية (مورفولوجيا ممدودة) في الثقافة الأولية (P0 ، الشكل 2) ، لكننا نادرا ما نرى هذه الخلايا تظهر في الخلايا المارة (P3 ، الشكل 4D).
لاختبار ما إذا كان يمكن الحفاظ على الخاصية الظهارية ل HMECs بعد عدة مقاطع ، أجرينا تحليل qRT-PCR لعلامات الخلايا الظهارية الثديية CK7 و GATA3 في الخلايا المزروعة مع أو بدون Y-27632 (الشكل 5). لم تكن مستويات التعبير لكل من CK7 و GATA3 مختلفة بشكل كبير في كل من خلايا P0 و P3 ، مع أو بدون Y-27632 ، مما يشير إلى أن خصائص النمط الظاهري والتمايز لم تتغير بمرور الوقت أثناء توسع الثقافة.
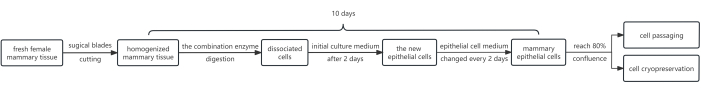
الشكل 1: مخطط انسيابي لبروتوكول عزل وزراعة HMECs. في البداية ، تم تقطيع شظايا الأنسجة الثديية الأنثوية بشفرات جراحية وهضمها بمزيج من الإنزيمات. بعد ذلك ، تم استزراع كريات الخلايا التي تم الحصول عليها في وسط استزراع أولي يحتوي على 10 mM Y-27632. بعد 2 أيام ، تم استبدال وسط الثقافة الأولي بوسط الخلية الظهارية. تم استزراع الخلايا الظهارية الثديية في وسط خلايا البشرة لتحقيق تغطية مرضية بعد ~ 8 أيام ، وهي الآن مناسبة للمرور. إذا لزم الأمر ، يمكن أن تخضع بعض الخلايا للحفظ بالتبريد للخلية. اختصار: HMECs = الخلايا الظهارية الثديية البشرية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: صور HMECs التي تم الحصول عليها بعد التلقيح الأولي. في غضون يومين بعد التلقيح ، (أ) تم استزراع HMECs الأولية في وسط أولي يحتوي على Y-27632 و (B) تم استزراع HMECs الأولية في الوسط الأولي بدون Y-27632. بعد فترة استزراع لمدة 48 ساعة ، تم استبدال وسط زراعة الخلايا الكيراتينية الخالية من المصل في كلا المجموعتين. تم التقاط الصور لتسجيل حالة نمو الخلايا كل يوم. تم التقاط كلتا السلسلتين من الصور التمثيلية باستخدام مجهر مقلوب (100x) في الأيام 3 و 5 و 9 بعد التلقيح. قضبان المقياس = 100 ميكرومتر. اختصار: HMECs = الخلايا الظهارية الثديية البشرية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
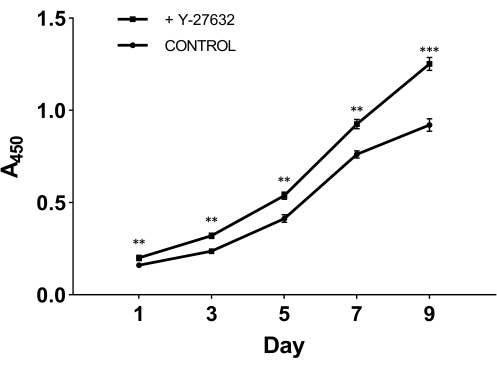
الشكل 3: النمو المعزز للممر 1 HMECs (P1) مع Y-27632. تم إذابة خلايا P0 المجمدة واستزراعها مع أو بدون Y-27632. تم جمع الخلايا (P1) في 1 و 3 و 5 و 7 و 9 أيام وتم تحليل الامتصاص عند 450 نانومتر باستخدام مجموعة CCK-8. في اليوم 1 ، كان عدد الخلايا القابلة للحياة الملتصقة في الوسط الأولي الذي يحتوي على Y-27632 أعلى بكثير من ذلك بدون Y-27632. بالإضافة إلى ذلك ، أظهر منحنى نمو الخلايا المعالجة ب Y-27632 زيادة أكثر حدة. ** ف < 0.01 ، ***ع < 0.001. اختصار: HMECs = الخلايا الظهارية الثديية البشرية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التعبير عن علامات HMEC (P0). تم تحليل تعبير CK7 و GATA3 في HMECs عن طريق تلطيخ التألق المناعي. تم تلطيخ HMECs ب (A) CK7 (أحمر) و (B) GATA3 (أحمر) ؛ تم استخدام DAPI (الأزرق) لتلطيخ النوى. تم التقاط الصور باستخدام مجهر المسح الضوئي بالليزر (400x). قضبان المقياس = 20 ميكرومتر. (ج) النسبة المئوية للخلايا الموجبة في التلطيخ؛ (د) الصورة التمثيلية ل HMECs (P3). قضبان المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
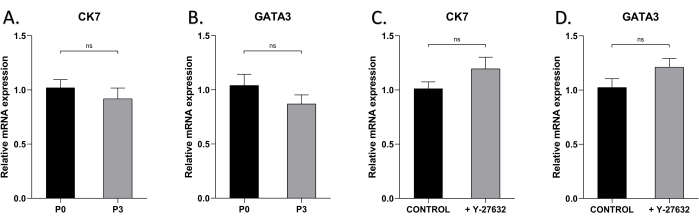
الشكل 5: التعبير عن CK7 و GATA3 من HMECs في P0 و P3. استخدام qRT-PCR للكشف عن تعبير (A) CK7 في HMECs من P0 و P3 في اليوم 7 ، (B) GATA3 في HMECs من P0 و P3 ، (C) CK7 في P1 HMECs المستزرعة مع أو بدون Y27632 في اليوم 7 ، (D) GATA3 في P1 HMECs المستزرعة مع أو بدون Y-27632 في اليوم 7. NSP > 0.05. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تعتبر HMECs حيوية في الحفاظ على السلامة التشريحية والوظيفية للأنسجة الثديية وهي مفيدة في التحقيقات العلمية والتطبيقات السريرية والمجالات المرتبطةبها 15. الخلايا الطلائية الأولية هي نوع من الخلايا المتخصصة التي لها ممرات محدودة وعمر أقصر. ومع ذلك ، فقد أعيقت نمو HMECs بسبب القيود التقنية ، والتي أعاقت بالتالي التقدم البحثي في سرطان الثدي والأمراض الالتهابية الأخرى المتعلقة بالثدي16.
لذلك ، هناك حاجة ملحة لتطوير طريقة مستقرة ومجدية وفعالة للحصول على HMECs من أنسجة الثدي الطازجة. نجح Hammond et al.8 و Band and Sager17 في استخراج وزراعة الخلايا الظهارية للثدي. ومع ذلك ، فإن تكوين وسيط الاستزراع المطلوب كان معقدا للغاية. أظهرت الدراسات السابقة التي أجراها Taylor-Papidamitriou et al. أنه يمكن زراعة خلايا تجويف حليب الثدي باستخدام وسيط مكمل بعوامل النمو والمصل18. في حين أن طريقتهم تسمح بالاستخراج المباشر ل HMECs من حليب الثدي ، فإن وجود الخلايا غير الظهارية يمكن أن يؤثر على نمو HMECs ، مما يجعل من الصعب تحديد عدد الخلايا بدقة. طور Jin et al. طريقة إعادة برمجة مشروطة مكنت HMECs الأولية من الحصول على دورة حياة أطول والاحتفاظ بعدم تجانس الخلايا مقارنة بطرق الاستزراع التقليدية ، لكنها كانت تعتمد بشكل كبير على ظروف استزراع محددة وقيدت استخدام هذه الطريقة في المختبرات والتطبيقات الأخرى12.
أنشأت دراسة من مجموعة Zubeldia-Plazaola طريقة عزل محسنة تضمنت الهضم البطيء (بين عشية وضحاها) لشظايا الأنسجة المفرومة بمزيج من الكولاجيناز والهيالورونيداز ، تليها ثلاث عمليات طرد مركزي تفاضلية في اليوم الثاني لفصل الكسور اللحمية / الظهارة. أسفرت طريقة العزل هذه بالإضافة إلى إضافة Y-27632 في المزرعة عن أعداد كبيرة من الخلايا الظهارية القابلة للحياة. ومع ذلك ، كانت كمية الأنسجة الثديية المستخدمة في دراستهم 40-75 جم واستمر إجراء العزل ما يقرب من 2 أيام9. هنا ، أبلغنا عن استخدام 1 غرام فقط من الأنسجة في هذا البروتوكول ، واختبرنا ووجدنا أن هذه الطريقة عملت أيضا مع أقل من 0.25 غرام من الأنسجة. هضم خليط الإنزيم من كولاجيناز وديسباز والتربسين بكفاءة 1 غرام من الأنسجة في 1.5 ساعة ، واستغرق الإجراء بأكمله ~ 3 ساعات. يمكن أن تؤدي إضافة Y-27632 إلى وسط الاستزراع الأولي إلى تعزيز ارتباط الخلايا الظهارية وتكاثرها ولكنها تمنع أيضا نمو الخلايا اللحمية19. الأهم من ذلك في هذه الدراسة ، اختبرنا مكونات الوسط الأولي ووجدنا أن 5٪ FBS في DMEM لتحل محل وسيط G المستخدم في المنشور السابق كان كافيا لتعزيز ارتباط خلايا البشرة ونموها10.
بعد 2 أيام من الثقافة في الوسط الأولي ، تم استزراع الخلايا في وسط الخلايا الكيراتينية الخالية من المصل. يوضح الشكل 2 نمط نمو الخلايا للمزرعة الأولية (P0) بعد التلقيح ، والذي يوضح نمط نمو المستعمرة. من المحتمل أن تنتج طريقة العزل هذه جميع أنواع الخلايا الطلائية ، بما في ذلك الخلايا الظهارية العضلية من الأنسجة الثديية ، والتي تحتاج إلى مزيد من التوصيف في المستقبل. ومع ذلك ، من خلال مقارنة نمو الخلايا في وجود Y-27632 إلى المجموعة الضابطة دون إضافة Y-27632 إلى وسط الثقافة الأولي ، يمكننا أن نرى أن الطريقة مع Y-27632 عززت بشكل كبير إنتاج الخلايا وحسنت كفاءة زراعة الخلايا (الشكل 2A). عادة ~ 9-10 أيام من الثقافة بعد التلقيح ، يمكن لخلايا البشرة تحقيق كثافة مناسبة للمرور. بالإضافة إلى ذلك ، أظهرنا أيضا أن وجود Y-27632 يمكن أن يعزز نمو P1 HMEC بعد استعادة خلايا P0 المجمدة في نهاية الثقافة الأولية (الشكل 3). في أيدينا ، وجدنا أن أكثر من 90٪ من الخلايا كانت قادرة على البقاء على قيد الحياة بعد إذابتها من التخزين المجمد. كان للخلايا وقت مضاعف يبلغ حوالي 72 ساعة ، وتمكنت HMECs من الحفاظ على النمو الطبيعي حتى الممر السابع.
في هذه الدراسة ، أعربت الخلايا عن مستويات عالية من علامات الخلايا الظهارية الثديية CK7 و GATA3 ، والأهم من ذلك ، أن ما يقرب من 100٪ من الخلايا في المرحلة المتأخرة من الثقافة الأولية كانت إيجابية ل CK7 و GATA3 (الشكل 4) ، مما يشير إلى نقاء عال للخلايا الظهارية التي تم الحصول عليها من هذه الطريقة. أخيرا ، قارنت هذه الدراسة مستويات التعبير عن CK7 و GATA3 في خلايا P0 و P3 ، وكشفت عن مستويات تعبير عالية في كليهما ، مما يشير إلى أن المرور لم يغير النمط الظاهري للخلايا (الشكل 5A ، B). علاوة على ذلك ، بغض النظر عن وجود Y-27632 ، تم التعبير عن CK7 و GATA3 بشكل كبير باستمرار ، مما يعني أن إضافة Y-27632 لم تؤثر على النمط الظاهري للخلية (الشكل 5C ، D).
السبب الرئيسي لتعزيز تكاثر الخلايا من خلال نهجنا هو إدراج Y-27632 ، والذي ثبت أن له تأثيرات مفيدة على تكاثر وتخصص الخلايا الظهارية البشرية19,20. وجد تشابمان وآخرون أن استخدام Y-27632 عزز بشكل كبير قدرة الخلايا الظهارية على التكاثر وأدى إلى تخليد الخلايا بنجاح دون أي علامات على أزمة الخلية21. في دراستنا ، زاد Y-27632 بشكل كبير من إنتاجية هذه الخلايا الظهارية من خلال تعزيز ارتباطها وتكاثرها19.
تتمثل إحدى السمات الرئيسية لهذه الطريقة في الجمع بين dispase و collagenase لفصل الأنسجة الظهارية عن النسيج الضام ، مع استخدام التربسين أيضا لفصل الخلايا الظهارية عن الأنسجة الظهارية22. أثبت Dispase أنه إنزيم سريع وفعال ولكنه لطيف لفصل البشرة غير التالفة عن الأدمة وكذلك الطبقات غير التالفة من الخلايا الظهارية في الثقافة عن السطح الأساسي ، كل ذلك مع الحفاظ على صلاحية الخلايا الظهارية23. النوع الأول كولاجيناز يسهل عزل الخلايا الظهارية ويضمن حيوية وسلامة الخلايا24. ميزة رئيسية أخرى لهذه الطريقة هي استخدام الوسيط الأولي مع Y-27632 لاستزراع HMECs المعزولة حديثا. بعد التصاق الخلايا بالطبق في اليوم الثالث ، يتم تغيير وسط المزرعة إلى وسط خال من مصل الخلايا الكيراتينية. هذا النهج يبسط بشكل واضح الخطوات التجريبية ويقلل من تكلفة التجربة. نتيجة لذلك ، حصلنا على أرقام خلايا مرضية للغاية باستخدام كمية صغيرة فقط من الأنسجة الثديية بهذه الطريقة ، مما يشير إلى أن كمية كبيرة من الأنسجة الأولية ليست ضرورية. ومع ذلك ، فإن أحد عيوب هذا النهج هو أن وجود التربسين لا يحمي بشكل كاف سلامة الخلايا الظهارية. جانب آخر يحتمل أن يحد من الطريقة هو إمكانية تلوث صغير (<1٪) للخلايا الظهارية العضلية خلال الثقافة الأولية9.
تقدم طريقتنا نهجا مبسطا وفعالا لعزل وزراعة HMECs الأولية المشتقة من أنسجة الثدي البالغة. تتميز هذه التقنية ببساطتها وطبيعتها الموفرة للوقت وقدرتها على الحفاظ على الوظائف الخلوية الأساسية. وبالتالي ، فإن هذه التقنية لها مزايا واضحة وواعدة للغاية لتوليد كمية كبيرة من الخلايا الظهارية. علاوة على ذلك ، تسمح الطريقة بعزل وثقافة HMECs من مجموعة واسعة من الجهات المانحة ، وهي مناسبة لكل من الأبحاث المختبرية والتطبيقات السريرية ، مما يجعلها متعددة الاستخدامات وقابلة للتطبيق على نطاق واسع.
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح فيما يتعلق بنشر هذه الورقة.
Acknowledgements
تم دعم هذا العمل بمنح من برنامج الطب الصيني التقليدي للعلوم والتكنولوجيا في مقاطعة تشجيانغ ، الصين (2017ZA055; 2018ZA036) ، ومشروع العلوم والتكنولوجيا في Zunyi ، مقاطعة Guizhou ، الصين (Zunyi City Kehe Support NS (2020) رقم 18) إلى X. Xu. يشكر المؤلفون مختبر البيولوجيا الجزيئية التابع لشركة Youjia (Hangzhou) للتكنولوجيا الطبية الحيوية لتوفير التدريب على زراعة الخلايا.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin | Basalmedia | K431010 | For HMECs dissociation |
| 1.5 mL microcentrifuge Tubes | NEST | 081722CK01 | For cell digestion |
| 100 µm mesh filter | Solarbio | 431752 | For HMECs filtration |
| 100 mm Cell Culture Dish | Corning | 430167 | For cell culture |
| 4% paraformaldehyde | solarbio | P1110-100ml | For immunofluorescence staining to check differentiation marker of HMECs |
| 50 mL Centrifuge Tube | Corning | 430829 | For cell centrifugation |
| Cell Strainer | Solarbio | 431752 | Cell filtration |
| Centrifuge | Eppendorf | 5404HN133048 | Cell centrifuge |
| CO2 Incubator | Thermo Scientific | 42820906 | For cell incubation |
| Collagenase Type I | Merck | SKU:SCR103 | For HMECs isolation |
| Dispase | Solarbio | CAS:42613-33-2 | For HMECs isolation |
| DMEM | Gibco | 8122622 | Component of neutralization medium |
| Fetal Bovine Serum | Gibco | 2556132P | Component of neutralization medium |
| Penicillin/Streptomycin | Thermo Scientific | 15140-122 | Antibiotics |
| Phosphate buffered solution | Tecono | 20201033 | Washing solution |
| rabbit anti CK7 | abcam | ab68459 | For immunofluorescence staining to check differentiation marker of HMECs |
| rabbit anti GATA3 | abcam | ab199428 | For immunofluorescence staining to check differentiation marker of HMECs |
| Y-27632 | Solarbio | IY0040 | ROCK inhibitor |
References
- Smolarz, B., Nowak, A. Z., Romanowicz, H. Breast cancer-epidemiology, classification, pathogenesis and treatment (review of literature). Cancers (Basel). 14 (10), 2569 (2022).
- Gudjonsson, T., Adriance, M. C., Sternlicht, M. D., Petersen, O. W., Bissell, M. J. Myoepithelial cells: Their origin and function in breast morphogenesis and neoplasia. J Mammary Gland Biol Neoplasia. 10 (3), 261-272 (2005).
- Faridi, N., et al. Isolation and characterization of the primary epithelial breast cancer cells and the adjacent normal epithelial cells from iranian women's breast cancer tumors. Cytotechnology. 70 (2), 625-639 (2018).
- Tovar, E. A., et al. Dissecting the rat mammary gland: Isolation, characterization, and culture of purified mammary epithelial cells and fibroblasts. Bio Protoc. 10 (22), e3818 (2020).
- Jiang, X., Yang, H., Jing, Q., He, X. A "selective secondary tissue attachment" method for isolation and purification of mammary epithelial cells. Acta Histochem. 124 (8), 151972 (2022).
- Bernardini, C., et al. Development of a pig mammary epithelial cell culture model as a non-clinical tool for studying epithelial barrier-a contribution from the imi-conception project. Animals (Basel). 11 (7), 2012 (2021).
- Zhang, D., et al. Transdifferentiation of goat ear fibroblasts into lactating mammary epithelial cells induced by small molecule compounds. Biochem Biophys Res Commun. 573, 55-61 (2021).
- Hammond, S. L., Ham, R. G., Stampfer, M. R. Serum-free growth of human mammary epithelial cells: Rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc Natl Acad Sci U S A. 81 (17), 5435-5439 (1984).
- Zubeldia-Plazaola, A., et al. Comparison of methods for the isolation of human breast epithelial and myoepithelial cells. Front Cell Dev Biol. 3, 32 (2015).
- Liu, Z., et al. A simplified and efficient method to isolate primary human keratinocytes from adult skin tissue. J Vis Exp. (138), e57784 (2018).
- Xie, Z., et al. Isolation and culture of primary human gingival epithelial cells using y-27632. J Vis Exp. (177), e62978 (2021).
- Jin, L., et al. Characterization of primary human mammary epithelial cells isolated and propagated by conditional reprogrammed cell culture. Oncotarget. 9 (14), 11503-11514 (2018).
- Böcker, W., Hungermann, D., Decker, T. Anatomy of the breast. Pathologe. 30 (1), 6-12 (2009).
- Kouros-Mehr, H., Slorach, E. M., Sternlicht, M. D., Werb, Z. Gata-3 maintains the differentiation of the luminal cell fate in the mammary gland. Cell. 127 (5), 1041-1055 (2006).
- Wang, X., Reagan, M. R., Kaplan, D. L. Synthetic adipose tissue models for studying mammary gland development and breast tissue engineering. J Mammary Gland Biol Neoplasia. 15 (3), 365-376 (2010).
- Ethier, S. P., Mahacek, M. L., Gullick, W. J., Frank, T. S., Weber, B. L. Differential isolation of normal luminal mammary epithelial cells and breast cancer cells from primary and metastatic sites using selective media. Cancer Res. 53 (3), 627-635 (1993).
- Band, V., Sager, R. Distinctive traits of normal and tumor-derived human mammary epithelial cells expressed in a medium that supports long-term growth of both cell types. Proc Natl Acad Sci U S A. 86 (4), 1249-1253 (1989).
- Taylor-Papadimitriou, J., Shearer, M., Tilly, R. Some properties of cells cultured from early-lactation human milk. J Natl Cancer Inst. 58 (6), 1563-1571 (1977).
- Wen, J., Zu, T., Zhou, Q., Leng, X., Wu, X. Y-27632 simplifies the isolation procedure of human primary epidermal cells by selectively blocking focal adhesion of dermal cells. J Tissue Eng Regen Med. 12 (2), e1251-e1255 (2018).
- Yin, J., Yu, F. S. Rho kinases regulate corneal epithelial wound healing. Am J Physiol Cell Physiol. 295 (2), C378-C387 (2008).
- Chapman, S., Liu, X., Meyers, C., Schlegel, R., Mcbride, A. A. Human keratinocytes are efficiently immortalized by a rho kinase inhibitor. J Clin Invest. 120 (7), 2619-2626 (2010).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Dermatol. 28 (2), 107-112 (2019).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. J Invest Dermatol. 93 (2), 287-290 (1989).
- Ren, H. J., et al. Primary cultures of mouse small intestinal epithelial cells using the dissociating enzyme type I collagenase and hyaluronidase. Braz J Med Biol Res. 50 (5), e5831 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved