Method Article
İmmünoelektron Mikroskobunun Önceden Gömülmesi ile Retina Devrelerinin ve Moleküler Lokalizasyonun İncelenmesi
Bu Makalede
Özet
Bu protokol, retinadaki sinaptik devreleri ve protein lokalizasyonunu keşfetmeye odaklanarak, önceden gömülü immünoelektron mikroskobunun ayrıntılı adımlarını ana hatlarıyla belirtir.
Özet
Retina, görme yolunun ilk aşamasını oluşturan çeşitli nöronal devreler oluşturan çok sayıda hücreden oluşur. Her devre, rolünü ve işlevsel önemini belirleyen benzersiz özellikler ve farklı nörotransmiterler ile karakterize edilir. Yapısındaki karmaşık hücre tipleri göz önüne alındığında, retinadaki nöronal devrelerin karmaşıklığı keşif için zorluklar doğurur. Koni ve çubuk yolları arasındaki bağlantı gibi retina devrelerini ve çapraz konuşmayı ve fare retinasında P benzeri immünoreaktivite maddesinin varlığı gibi kesin moleküler lokalizasyonu (nörotransmiterler veya nöropeptitler) daha iyi araştırmak için, sinaptik bağlantıları ve organizasyonu keşfetmek için önceden gömülü bir immünoelektron mikroskobu (immüno-EM) yöntemi kullandık. Bu yaklaşım, spesifik hücreler arası sinaptik bağlantıları ve kesin moleküler lokalizasyonu belirlememizi sağlar ve işlevini keşfetmede yol gösterici bir rol oynayabilir. Bu makale, (1) retina fiksasyon hazırlığı, (2) ön gömme immün boyama ve (3) sabitleme sonrası ve gömme dahil olmak üzere protokolü, kullanılan reaktifleri ve ayrıntılı adımları açıklamaktadır.
Giriş
Retinadaki nöronal devrelerin karmaşıklığı, yapısındaki çeşitli hücre tipleri göz önüne alındığında, keşif için zorluklar ortaya çıkarmaktadır 1,2. İlk adım, farklı hücreler arasındaki sinaptik bağlantıların tanımlanmasını ve spesifik nörotransmiterlerin veya nöropeptitlerin hücresel lokalizasyonunun belirlenmesini içerir. Moleküler biyolojideki ilerlemeler yeni proteinleri tanıttıkça, retinadaki hassas lokalizasyon, işlevlerini anlamak ve retina devrelerini ve sinaptik bağlantıları analiz etmek için çok önemli hale gelir 3,4,5.
Işık mikroskobunun sınırlı çözünürlüğü nedeniyle, elektron mikroskobu (EM), sinir hücrelerinin hücre altı yapılarını tespit etmek için yaygın olarak kullanılır. EM, hücre ultrayapılarınıgözlemlemek için kullanılan geleneksel transmisyon elektron mikroskobu (TEM) ile çeşitli sınıflandırmalara sahiptir 6,7,8,9. EM'nin uzamsal çözünürlüğünü, spesifik olarak proteinlere10 bağlanan antikorların kimyasal tanımlama yeteneği ile birleştiren immünoelektron mikroskobu (immüno-EM), retinadaki sinaptik bağlantıları ve hücre altı protein lokalizasyonunu araştırmak için en uygun ve özel yöntem olarak öne çıkmaktadır11,12.
İmmüno-EM teknikleri, gömme ve antikor inkübasyon sırasına bağlı olarak gömme öncesi ve sonrası gömme yöntemlerine ayrılabilir. Gömme sonrası yöntemle karşılaştırıldığında, ön gömme yaklaşımı, aksonlar ve dendritler gibi hücre süreçlerini incelemek için en uygun yaklaşımı sunan büyük ölçekli ve uzun mesafeli tanımlama 13,14,15 yeteneğine sahiptir. Ek olarak, bu teknik, güçlü bir sinyal ve geniş bir görüş alanı sağlayarak, sitoplazmada protein ekspresyonu ve moleküler lokalizasyonun kapsamlı araştırmaları için avantajlı hale getirir. Bu yöntem, tüm sitoplazma, hücreler veya retina boyunca görülebilen kimyasal olarak tanımlanmış yapıların sağlanmasında özellikle değerli olduğunu kanıtlamaktadır.
Bununla birlikte, gömme sonrası yöntem, gömme öncesi yönteme kıyasla daha düşük penetrasyon veya difüzyona sahip olsa da, o kadar hassas değildir16,17. Basit bir ifadeyle, amaç sitoplazma veya sinaptik terminallerdeki spesifik nörotransmiterlerin lokalizasyonunu araştırmaksa, önceden gömülü immüno-EM tercih edilen yöntemdir. Tersine, membran reseptörlerinin lokalizasyonunu tanımlamak için, gömme sonrası immünogold EM'nin kullanılması daha fazla tavsiye edilir.
Bu hususlar göz önüne alındığında, koni ve çubuk yolları arasındaki etkileşim ve fare retinasındaki P benzeri immünoreaktivitenin (SP-IR) dağılımı ve sinaptik organizasyonu gibi moleküler lokalizasyon dahil olmak üzere retina devrelerini araştırmak için önceden gömme immüno-EM yöntemini tercih ediyoruz.
Protokol
Hayvanların bakımı ve idaresi, ARVO yönergelerine uygun olarak Wenzhou Tıp Üniversitesi Etik Kurul Yönetmeliği tarafından onaylanmıştır. Bu araştırmada yetişkin fareler (C57BL / 6J, erkek ve dişi, 8 ila 12 haftalık) kullanılmıştır. Çalışma için gerekli ekipman ve reaktifler Malzeme Tablosunda listelenmiştir.
1. Retina fiksasyonu için hazırlık
- Aşağıdaki malzemeleri ve aletleri birleştirin: bir diseksiyon mikroskobu, çok ince uçlu iki forseps, makas, 1 mL şırınga iğnesi (iğne boyutu: G26) ve filtre kağıdı.
- 0.25 mg / g vücut ağırlığında 2,2,2-tribromoetanolün intraperitoneal enjeksiyonu ile fareleri derinlemesine uyuşturun. Daha sonra, farelerin kafasını kesin ve kafalarınıkesin 16.
- Gözlerini dirsek makasıyla enüklee edin ve 0,1 M fosfat tamponunda (PB; pH 7,4) %4 paraformaldehit-%0,2 pikrik asit içeren bir cam kaba koyun.
- Diseksiyon mikroskobu altında, 1 mL'lik bir şırınga iğnesi kullanarak kornea limpusuna bir delik açın ve deliği takip ederek ön segmenti makasla kesin. Daha sonra lensi forseps ile retina iç yüzeyinden çıkarın.
- Retina göz kabından tamamen izole edilene kadar sklerayı dikkatlice soymak için iki forseps kullanın (cuppy retina dokusu koroidden tamamen ayrılır). Daha sonra, retinayı dört parçaya bölün.
- Bu bölümleri oda sıcaklığında (RT) 2 saat boyunca 0.1 M PB'de (pH 7.4) %4 paraformaldehit-%0.2 pikrik asit içinde sabitleyin ve ardından dokuyu gece boyunca 4 °C'de 0.1 M PB'de (pH 10.4) %4 paraformaldehite aktarın.
2. Ön gömme immün boyama
- 0.01 M PBS'de (pH 7.4) her biri 10 dakika boyunca altı kez yıkadıktan sonra, retina dokularını 30 dakika boyunca 0.01 M PBS'de (pH 7.4) %1 sodyum borohidrür (NaBH4) içinde inkübe edin.
- Retina bölümlerini 0.01 M PBS'de (pH 7.4) en az altı kez yıkayın. Bu arada, vitreusu filtre kağıdı ile çıkarın ve ardından retinayı çift kenarlı bir tıraş bıçağı kullanarak 100-300 μm arasında küçük dilimler halinde kesin.
- RT'de 1 saat boyunca 0.1 M PB'de (pH 7.4) %5 normal keçi serumu (NGS) ile bloke ettikten sonra, retina dilimlerini birincil antikorlarla inkübe edin (Anti-tavşan PKCα, 1:80; Anti-Rabbit SP, 1:100), bir çalkalayıcı üzerinde RT'de 2 saat boyunca 0.01 M PBS'de (pH 7.4) %2 NGS ile birlikte. Daha sonra, bir çalkalayıcı üzerinde 4 ° C'de 96 saat (5 gün) inkübe edin.
- 0.01 M PBS'de (pH 7.4) her biri 10 dakika boyunca altı kez yıkadıktan sonra, retina dilimlerini keçi anti-tavşan IgG gibi 1: 200'de ikincil antikor ile birlikte 0.01 M PBS'de% 2 NGS ile birlikte inkübe edin (pH 7.4) bir çalkalayıcı üzerinde RT'de 2 saat boyunca. Daha sonra, bir çalkalayıcı üzerinde 4 ° C'de 48 saat (2 gün) inkübe edin.
NOT: İkincil antikorlar kontrol deneylerinde tek başına uygulanmıştır. - Retina şeritlerini 0.01 M PBS'de (pH 7.4) 0.01M PBS'de (pH 7.4) 1: 100'de 0.01M PBS'de (pH 7.4) 4 ° C'de 2 gün boyunca ABC kitinden reaktif A ve reaktif B ile inkübe etmeden önce altı kez 10 dakika boyunca yıkayın. (Hem reaktif A hem de reaktif B, 0.01 M PBS ile seyreltildi. Örneğin: Bir çözelti: 6 μl; B çözeltisi: 6 μl; 0,01 M PBS: 588 μl, toplam 600 μl).
- Retina şeritlerini 0.05 M Tris tamponunda (pH 7.2) her biri 10 dakika boyunca üç kez yıkayın. Ardından, retina şeritlerini DAB kitinden %5 reaktif 1 ve %5 reaktif 3 ile damıtılmış suda oda sıcaklığında 1 saat önceden inkübe edin. (Örneğin oran: reaktif 1: 50 μl; reaktif 3: 50 μl; damıtılmış su: 900 μl, toplam 1000 μl).
- Retina çizgilerini DAB ile boyayın. DAB kitindeki üç tüpten sırayla aynı hacimde çözelti ekleyin (reaktif 1-reaktif 2-reaktif 3). Diseksiyon mikroskobunu kullanarak lekelenme durumunu gözlemleyin. Hücreler kahverengileştiğinde lekelenmeyi durdurun; Bu işlem 10-20 dk sürer.
- Retina şeritlerini 0.05 M Tris tamponu (pH 7.2) ile her biri 10 dakika boyunca üç kez yıkayın ve ardından her biri 10 dakika boyunca altı kez 0.01 M PBS'de yıkayın.
3. Sabitleme sonrası ve gömme
- Retina şeritlerini oda sıcaklığında (RT) 1-2 saat boyunca% 2 glutaraldehit içinde sabitleyin ve ardından her biri 10 dakika boyunca altı kez 0.01 M PBS'de (pH 7.4) yıkayın.
- Retina şeritlerini RT'de 1 saat boyunca 0.1 M PB'de% 1 osmiyum tetroksit (OsO4) ile inkübe edin ve karanlık bir yerde tutun.
- Damıtılmış suda (ddH2O) her biri 10 dakika boyunca altı kez yıkadıktan sonra, retina dokularını RT'de 1 saat uranil asetat ile inkübe edin ve bu dokuları lekelemek için karanlık bir yerde tutun.
- Retina dokularını her biri 10 dakika boyunca aseton solüsyonlarına (%50, %70, %80 ve %90), ardından her biri 10 dakika boyunca iki kez %100 koyun.
- Retina dokularını aynı hacimde uranil asetat ve epoksi reçine içeren bir karışıma 37 °C kurutma fırınında 1 saat daldırın, ardından uranil asetat ve reçine (1:4) içeren bir karışım gece boyunca 37 °C kurutma fırınında bekletin.
- Retina dokularını bir kürdan kullanarak bir kurutma fırınında 45 °C'de 1 saat boyunca yeni reçineye nazikçe aktarın ve ardından yönlendirilmiş retina şeridi reçine ile gömme plakasına gömülür.
- Numuneyi 45 °C'lik bir kurutma fırınına 3 saat ve 65 °C'lik bir kurutma fırınına 48 saat koyun.
- Gömme bloklarını yamuk şeklinde şekillendirin ve bloğu bir ultramikrotom ile 1 μm kalınlığında bölümler halinde kesin, bu bölümleri toluidin mavisi ile boyayın ve ilgilenilen bölgeleri ışık mikroskobu altında önceden eleyin.
- Bakır ızgaralarda ultra ince kesitler (70-90 nm) toplayın ve bunları elektron mikroskobu altında görüntüleyin.
Sonuçlar
Şekil 1 , protein kinaz C alfa (PKCα) veya SP'ye karşı primer antikorların inkübasyonu olmadan, immünoreaktivite (IR) bulunmayan kontrol deneylerinin örneklerini göstermektedir.
Şekil 2 , fare retinasındaki PKCα-IR'yi göstermektedir. PKCα, retina18'deki tüm çubuk bipolar hücreler (RBC) için bir belirteç görevi görür. Elektron mikroskobu (EM) seviyesinde, RBC, yüksek elektron yoğunluğuna sahip diaminobenzidin (DAB) reaksiyon ürünü tarafından görselleştirilen PKCα-IR aracılığıyla tanımlanabilir. Şekil 2A , dış pleksiform katmanda (OPL) bir çubuk terminali ile bir sinaps oluşturan bir PKCα-pozitif RBC dendritini gösterirken, Şekil 2B , bir PKCα-pozitif RBC dendritinin bir koni terminaline post-sinaptik olduğu bir koni-RBC sinapsını göstermektedir. Ek olarak, DAB reaksiyon ürünü, iç pleksiform katmandaki (IPL) RBC terminallerinin (Şekil 2C) ve aksonal süreçlerin (Şekil 2D) tanımlanmasına yardımcı olur.
Şekil 3, fare retinasının IPL'sindeki hem ön hem de sinaptik sonrası bağlantılarda P (SP) maddesinin ekspresyonunu göstermektedir. SP-IR amakrin hücreleri, SP-negatif amakrin hücrelere (Şekil 3A) ve ayrıca SP-IR amakrin süreçlerine (veriler gösterilmemiştir) presinaptiktir. Ayrıca, SP-IR amakrin hücreleri, IPL'nin sırasıyla alt katman 3 (S3) ve alt katman 5 (S5) seviyelerinde post-sinaptik ila bipolar terminallerdir (Şekil 3B,C). Önceki araştırmamız, SP-IR amakrin hücre süreçlerinin IPL19'daki diğer süreçlere sinaptik çıktılar oluşturduğu sinapsların analizini detaylandırmaktadır. Özellikle, SP'nin hücre altı lokalizasyonu çoğunlukla presinaptik terminallerdeki sinaptik veziküllerde bulunur (Şekil 3).
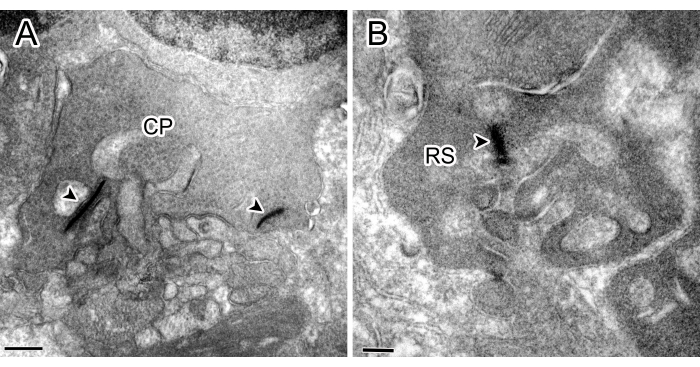
Şekil 1: Kontrol deneylerinden elde edilen immüno-elektron mikrografları. Hem iki şeritli koni pedikülü (CP) (ok ucu) (A) hem de OPL'de (B) bir kurdeleli çubuk küresi (RS) lekelenme göstermedi. Ölçek çubukları: 500 nm (A), 200 nm (B). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Fare retinasında PKCα antikoru ile işaretlenmiş immüno-elektron mikrografları. (A) RS, OPL'deki bir PKCα pozitif RBC (oklar immünoreaktiviteyi gösterir) ve iki yatay hücre (H) ile bağlanır. (B) CP, OPL'deki PKCα pozitif RBC ile bağlanır. (C) ve (D) sırasıyla IPL'de PKCα pozitif RBC terminalini ve aksonal süreci gösterir. Ölçek çubukları: 200 nm (A), 500 nm (B), 500 nm (C), 500 nm (D). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Fare retinasının IPL'sinde SP antikoru ile işaretlenmiş immüno-elektron mikrografları. (A) SP-IR amakrin hücresi (A +), bir SP negatif amakrin hücresine (A-) presinaptiktir. SP-IR amakrin hücreleri, IPL'nin sırasıyla S3 (B) ve S5 (C) seviyelerinde bipolar terminallerden girdiler aldı. Ölçek çubukları: 200 nm (A), 200 nm (B), 200 nm (C). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu makale, sinaptik devrelerin ve protein lokalizasyonunun başarılı bir şekilde gözlemlenmesi için üç kritik adımı tanımlamıştır: (1) hızlı ve zayıf fiksasyon, (2) ön gömme immün boyama ve (3) fiksasyon sonrası ve gömme.
Fiksasyonun, başarılı bir pre-embedding immüno-EM yaklaşımı için anahtar adım olduğunu öneriyoruz. Bu nedenle, burada taze fiksatif ve hızlı fiksasyonun önemi vurgulanmakta ve bu ilkeye doku hazırlığında çok önemli olan "4F prensibi" adı verilmektedir. Bununla birlikte, hem gelişmiş antikor penetrasyonu hem de etkili fiksasyon elde etmek bir zorluk teşkil etmektedir20. Bunu ele almak için, glutaraldehit antijenik belirleyicileri bozabileceğinden ve immün boyamayı etkileyebileceğinden, antikor penetrasyonunu iyileştirmek için ilk fiksasyon sırasında glutaraldehit pikrik asit ile değiştirildi21. Pikrik asit, aksine, fiksasyon etkinliğinde bir uzlaşma olmasına rağmen, membran yapısını ve doku bütünlüğünü22 daha iyi korur. Üçüncü aşamada, doku fiksasyonunu optimize etmek için post-fiksasyon için %2 glutaraldehit kullanıldı.
Burada sunulan protokolün kilit noktaları beş adımı içerir: (1) Erken fiksasyon: Antijenik belirleyicilerdeki bozulmayı en aza indirirken daha iyi antikor penetrasyonu için erken aşamada pikrik asit kullanmak. (2) Fiksasyon sonrası: İmmün boyamadan sonra doku fiksasyonunu arttırmak için% 2 glutaraldehit kullanılması. (3) Redüksiyon tedavisi: İmmünoreaktivitenin çoğunu geri kazanmak ve antijenlerin ve antikorların bağışıklık reaktivitesini iyileştirmek için 30 dakika boyunca% 1 NaBH4'te 0.1 M PB'de (pH 7.4) dokunun inkübe edilmesi, pozitif sinyallerin yoğunlaştırılması23. (4) Doku hazırlığı: Etkili antikor inkübasyonunu kolaylaştırmak ve düzgün sinyaller sağlamak için vitreusun çıkarılması ve retina dokusunun küçük şeritler halinde kesilmesi. (5) Ayrıca, retina dokusunun azami özen gösterilerek ele alınması ve tüm prosedür boyunca sonraki gözlemleri tehlikeye atabilecek herhangi bir hasardan kaçınılması zorunludur. Bu ölçümler toplu olarak önceden gömme immüno-EM yönteminin başarısına katkıda bulunur ve koni-RBC sinapsları24, SP-IR moleküler lokalizasyonu19 ve fare retinasında α-Syn'in kesin ekspresyonu25 gibi çeşitli yönlerin incelenmesine olanak tanır.
İlk antikoru inkübe etmeden önce, spesifik olmayan sinyal girişimini ortadan kaldırmak için retina şeritlerini %2 NGS ile bloke etmek önemlidir. İlk antikorun konsantrasyonu, antikorun kendisine dayanarak, tipik olarak donmuş bölüm boyaması için kullanılandan daha yüksek olarak belirlenmeli ve önceden optimize edilmelidir. Birincil antikor inkübasyon periyodu sırasında, yığılmış retina şeritlerinin antikor ile tam temasını sağlamak ve istiflenmiş parçaların eksik penetrasyonunu önlemek için mikrosantrifüj tüpünün sürekli rotasyonu gereklidir. Sinyali yükseltmek için, DAB, standart DAB boyamadan önce önceden inkübe edildi ve spesifik boyama süresi tipik olarak 10-20 dakika arasında değişiyordu. Zaman çok kısaysa, sinyal gözlem için çok zayıf olabilir ve çok uzunsa, doğru yargıyı etkileyen yanlış pozitif sinyallere yol açabilir. Genel olarak, boyaların inkübasyon süresi doğrudan dokunun yüzey rengine (kahverengiden koyu kahverengiye) bağlıdır.
Daha önce belirtildiği gibi, sinyali arttırmak için sıvı nitrojen içinde donma dokusu ile deneyler yapılırken, 18,26,27, bu yöntem pozitif sinyalleri yükseltti, ancak retina hücrelerinin zayıf zar yapısı ile sonuçlandı (veriler gösterilmedi). Bu yapısal bozulma, hücre tiplerini doğru bir şekilde tanımlamayı zorlaştırdı. Bu göz önüne alındığında, retina dokusu tekrar tekrar dondurulmadı. Pozitif sinyali arttırmak için, antikorların kuluçka süresi uygun şekilde uzatıldı. Önerilen protokol, agar gömmeye kıyasla adımları basitleştirerek önceki avantajları birleştirir. Bu sadece proteinlerin antijenik belirleyicilerini korumakla kalmaz, aynı zamanda hücre zarlarının bütünlüğünü de korur. Kapsayıcı amaç, tüm yol boyunca sinaptik bağlantıları ve nörotransmiterlerin hücresel lokalizasyonunu araştırmaktır. Bu nedenle, protokoldeki DAB reaksiyon ürünleri gümüş yoğunlaştırma işlemine tabi tutulmamıştır, bu da onu nörotransmitere özgü sinaptik bağlantıların ve yolakların araştırılması için daha uygun hale getirir28.
Şu anda, ultrastrüktürel düzeyde yolakların veya nörotransmiterlerin kimyasal olarak tanımlanması için sınırlı yöntemler bulunmaktadır. Böyle bir yöntem, ilişkili ışık ve elektron mikroskobudur (CLEM)29,30, ancak bu, çok küçük bir alanla sınırlıdır ve tüm yol boyunca bağlantıları tanımlama yeteneğinden yoksundur. Önceden gömülü immüno-EM'nin güçlü yönleri, sağlam sinyali, geniş aralığı ve uzun mesafeli analitik konumlandırma ve izleme yeteneğinde yatmaktadır 13,14,15. Bununla birlikte, bu yöntemin aynı zamanda dağınık sinyaller gibi sınırlamaları vardır ve bu da onları daha az spesifik hale getirir. Membran reseptörlerinin, özellikle membran üzerindekilerin kesin lokalizasyonu için, gömme sonrası immünogold EM'nin kullanılması daha uygun olabilir. Bu teknik, altın parçacıklarının doğrudan sayılmasını sağlayarak, bu zar reseptörlerinin sayısının ve değişkenliğinin analizini kolaylaştırır16.
Gelecekte, önceden gömme immüno-EM'nin hacim EM ile entegrasyonu, bu yöntemin daha da geliştirilmesi için gelecek perspektiflerini temsil eden, tanımlanmış nöral devrelerin uzun vadeli araştırılması için etkili bir yöntem olarak umut vaat etmektedir. Hacim EM, belirli yapıların tanımlanması için morfolojiye dayanan, kesin kimyasal tanımlamadan yoksun, yapının yeniden yapılandırılmasına odaklanır31,32. Önceden gömme immüno-EM'yi hacim EM ile birleştirerek, üç boyutlu rekonstrüksiyon sırasında spesifik yapılar veya maddeler tanımlanabilir ve bu da nöral devrelerin tanımlanmasına daha kapsamlı ve görsel olarak sezgisel bir yaklaşım sağlar.
Açıklamalar
Yazarların herhangi bir açıklaması yoktur.
Teşekkürler
Bu çalışma kısmen Çin Ulusal Anahtar Araştırma ve Geliştirme Programı (2022YFA1105503), Devlet Nörobilim Anahtar Laboratuvarı (SKLN-202103), Çin Zhejiang Doğa Bilimleri Vakfı (Y21H120019) Hibeleri ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringe needle | kangdelai | ||
| 1% OsO4 | Electron Microscopy Science | 19100 | |
| 2,2,2-Tribromoethanol | Sigma-Aldrich | T48402 | |
| 8% Glutaraldehyde | Electron Microscopy Science | 16020 | |
| 8% Paraformaldehyde | Electron Microscopy Science | 157-8 | |
| Acetone | Electron Microscopy Science | 10000 | |
| Anti-rabbit PKC | Sigma-Aldrich | P4334 | |
| Anti-Rabbit SP | Abcam | ab67006 | |
| DAB Substrate kit | MXB Biotechnologies | KIT-9701/9702/9703 | |
| Elbow scissors | Suzhou66 vision company | 54010 | |
| Electron microscope | Phillips | CM120 | |
| Epon resin | Electron Microscopy Science | 14910 | |
| forcep | Suzhou66 vision company | S101A | |
| Millipore filter paper | Merck Millipore | PR05538 | |
| Na2HPO4· 12H2O | Sigma | 71650 | A component of phosphate buffer |
| NaH2PO4· H2O | Sigma | 71507 | A component of phosphate buffer |
| Picric acid | Electron Microscopy Science | 19550 | |
| Sodium borohydride (NaBH4) | Sigma | 215511 | |
| Tris | Solarbio | 917R071 | |
| Ultramicrotome | Leica | ||
| Uranyl acetate | Electron Microscopy Science | 22400 | |
| VACTASTAIN ABC kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-4001 |
Referanslar
- Chua, N. J., et al. A complete reconstruction of the early visual system of an adult insect. Curr Biol. 33 (21), 4611-4623.e4614 (2023).
- Ravi Chander, P., Hanson, L., Chundekkad, L., Awatramani, G. B. Neural circuits underlying multi-feature extraction in the retina. J Neurosci. , JN-RM-0910-23 (2023).
- Sirivisoot, S., et al. Development and characterization of mouse anti-canine PD-L1 monoclonal antibodies and their expression in canine tumors by immunohistochemistry in vitro. Vet Q. 43 (1), 1-9 (2023).
- Raeisi, H., et al. Development and characterization of phage display-derived anti-toxin antibodies neutralizing TcdA and TcdB of Clostridioides difficile. Microbiol Spectr. 11 (5), e0531022(2023).
- Ryschich, A., Dong, Y., Schäfer, M., Ryschich, E., Karakhanova, S. DWH24: A new antibody for fluorescence-based cell death analysis. Methods Appl Fluoresc. 11 (4), (2023).
- Jastrzebska, B., et al. Functional characterization of rhodopsin monomers and dimers in detergents. J Biol Chem. 279 (52), 54663-54675 (2004).
- Huang, P., et al. Mechanism of Shenfu injection in suppressing inflammation and preventing sepsis-induced apoptosis in murine cardiomyocytes based on network pharmacology and experimental validation. J Ethnopharmacol. 322, 117599(2024).
- Maheshwari, U., et al. Inorganic phosphate exporter heterozygosity in mice leads to brain vascular calcification, microangiopathy, and microgliosis. Brain Pathol. 33 (6), e13189(2023).
- Mackiewicz, J., et al. Effect of gravity in long-term vitreous tamponade: In vivo investigation using perfluorocarbon liquids and semi-fluorinated alkanes. Graefes Arch Clin Exp Ophthalmol. 245 (5), 665-675 (2007).
- Luján, R., Rubio, M. E. Editorial: Immunoelectron microscopy: Placing molecular functions within a neuronal context. Front Neuroanat. 16, 1043371(2022).
- Xu, S., et al. Synaptic changes and the response of microglia in a light-induced photoreceptor degeneration model. Mol Vis. 27, 206-220 (2021).
- Chadha, A., Volland, S., Baliaouri, N. V., Tran, E. M., Williams, D. S. The route of the visual receptor rhodopsin along the cilium. J Cell Sci. 132 (10), jcs.229526(2019).
- Huang, H. J., et al. Multiple nucleocapsid structural forms of shrimp white spot syndrome virus suggests a novel viral morphogenetic pathway. Int J Mol Sci. 24 (8), 7525(2023).
- Tissarinen, P., et al. Elevated human placental heat shock protein 5 is associated with spontaneous preterm birth. Pediatr Res. 94 (2), 520-529 (2023).
- Huang, Z., et al. A neural tract tracing study on synaptic connections for cortical glutamatergic terminals and cervical spinal calretinin neurons in rats. Front Neural Circuits. 17, 1086873(2023).
- Zhang, J., Petralia, R. S., Wang, Y. X., Diamond, J. S. High-resolution quantitative immunogold analysis of membrane receptors at retinal ribbon synapses. J Vis Exp. 108, e53547(2016).
- Ottersen, O. P., Landsend, A. S. Organization of glutamate receptors at the synapse. Eur J Neurosci. 9 (11), 2219-2224 (1997).
- Greferath, U., Grünert, U., Wässle, H. Rod bipolar cells in the mammalian retina show protein kinase C-like immunoreactivity. J Comp Neurol. 301 (3), 433-442 (1990).
- Wang, F., et al. Distribution and synaptic organization of substance P-like immunoreactive neurons in the mouse retina. Brain Struct Funct. 228 (7), 1703-1724 (2023).
- van Opbergen, C. J. M., et al. 34;Orphan" Connexin43 in Plakophilin-2 deficient hearts revealed by volume electron microscopy. Front Cell Dev Biol. 10, 843687(2022).
- Li, S., et al. Safe and efficient oral allergy immunotherapy using one-pot-prepared mannan-coated allergen nanoparticles. Biomaterials. 303, 122381(2023).
- Yamashita, K., Kusakabe, M., Sano, M. A simple and rapid method of dissociating hepatocytes from fixed liver of the mouse. Stain Technol. 56 (1), 29-33 (1981).
- Tanabe, T., Shin, M., Fujiwara, K. Immunoelectron microscopy study of polyamines using a newly prepared monoclonal antibody against spermidine: use of a mixture of glutaraldehyde and paraformaldehyde as a cross-linking agent in the preparation of the antigen. J Biochem. 135 (4), 501-507 (2004).
- Xiao, J., et al. Rod bipolar cells receive cone photoreceptor inputs through both invaginating synapses and flat contacts in the mouse and guinea pig retinas. J Comp Neurol. 531 (11), 1184-1197 (2023).
- Yang, Q., et al. Expression of α-Synuclein in the mouse retina is confined to inhibitory presynaptic elements. J Comp Neurol. 531 (10), 1057-1079 (2023).
- Yazulla, S., Studholme, K. M., Zucker, C. L. Synaptic organization of substance P-like immunoreactive amacrine cells in goldfish retina. J Comp Neurol. 231 (2), 232-238 (1985).
- Sassoè-Pognetto, M., Wässle, H., Grünert, U. Glycinergic synapses in the rod pathway of the rat retina: cone bipolar cells express the alpha 1 subunit of the glycine receptor. J Neurosci. 14 (8), 5131-5146 (1994).
- Hartveit, E., et al. Localization and developmental expression of the NMDA receptor subunit NR2A in the mammalian retina. J Comp Neurol. 348 (4), 570-582 (1994).
- Perkins, G. A. The use of miniSOG in the localization of mitochondrial proteins. Methods Enzymol. 547, 165-179 (2014).
- Shu, X., et al. A genetically encoded tag for correlated light and electron microscopy of intact cells, tissues, and organisms. PLoS Biol. 9 (4), e1001041(2011).
- Kar, D., et al. Volume electron microscopy reveals human retinal mitochondria that align with reflective bands in optical coherence tomography [Invited]. Biomed Opt Express. 14 (10), 5512-5527 (2023).
- Johnson, J. E. Jr, et al. Spatiotemporal regulation of ATP and Ca2+ dynamics in vertebrate rod and cone ribbon synapses. Mol Vis. 13, 887-919 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır