Method Article
Investigación de circuitos retinianos y localización molecular mediante microscopía inmunoelectrónica previa a la inclusión
En este artículo
Resumen
Este protocolo describe los pasos detallados de la microscopía inmunoelectrónica previa a la incorporación, con un enfoque en la exploración de los circuitos sinápticos y la localización de proteínas en la retina.
Resumen
La retina está formada por numerosas células que forman diversos circuitos neuronales, que constituyen la primera etapa de la vía visual. Cada circuito se caracteriza por características únicas y neurotransmisores distintos, lo que determina su papel e importancia funcional. Dados los intrincados tipos de células dentro de su estructura, la complejidad de los circuitos neuronales en la retina plantea desafíos para la exploración. Para investigar mejor los circuitos de la retina y la diafonía, como el enlace entre las vías del cono y el bastón, y la localización molecular precisa (neurotransmisores o neuropéptidos), como la presencia de inmunorreactividad similar a la sustancia P en la retina del ratón, empleamos un método de microscopía inmunoelectrónica previa a la inclusión (immuno-EM) para explorar las conexiones sinápticas y la organización. Este enfoque nos permite identificar conexiones sinápticas intercelulares específicas y una localización molecular precisa, y podría desempeñar un papel guía en la exploración de su función. En este artículo se describe el protocolo, los reactivos utilizados y los pasos detallados, que incluyen (1) la preparación de la fijación de la retina, (2) la inmunotinción previa a la inserción y (3) la posfijación y la inclusión.
Introducción
La complejidad de los circuitos neuronales en la retina presenta desafíos para la exploración, considerando los diversos tipos de células dentro de su estructura 1,2. El paso inicial consiste en identificar las conexiones sinápticas entre diferentes células y determinar la localización celular de neurotransmisores o neuropéptidos específicos. A medida que los avances de la biología molecular introducen nuevas proteínas, la localización precisa en la retina se vuelve crucial para comprender sus funciones y analizar los circuitos retinianos y las conexiones sinápticas 3,4,5.
Debido a la resolución limitada de la microscopía óptica, la microscopía electrónica (EM) se usa comúnmente para detectar las estructuras subcelulares de las células nerviosas. La EM tiene varias clasificaciones, con la microscopía electrónica de transmisión convencional (TEM) utilizada para observar las ultraestructuras celulares 6,7,8,9. La inmunomicroscopía electrónica (immuno-EM), que combina la resolución espacial de la EM con la capacidad de identificación química de los anticuerpos que se unen específicamente a las proteínas10, se destaca como el método óptimo y exclusivo para investigar las conexiones sinápticas y la localización de proteínas subcelulares en la retina11,12.
Las técnicas de inmuno-EM se pueden dividir en métodos de pre-inclusión y post-incrustación basados en el orden de inclusión y la incubación de anticuerpos. En comparación con el método de post-incrustación, el enfoque de pre-incrustación es capaz de identificar a gran escala y a larga distancia 13,14,15, ofreciendo un enfoque óptimo para el estudio de procesos celulares como axones y dendritas. Además, esta técnica proporciona una señal fuerte y un amplio campo de visión, lo que la hace ventajosa para investigaciones exhaustivas de la expresión de proteínas y la localización molecular en el citoplasma. Este método resulta particularmente valioso para garantizar estructuras identificadas químicamente que son visibles en todo el citoplasma, las células o la retina.
Sin embargo, el método de post-incrustación, a pesar de tener menor penetración o difusión en comparación con el método de pre-incrustación, no es tan sensible16,17. En términos simples, si el objetivo es explorar la localización de neurotransmisores específicos en el citoplasma o en las terminales sinápticas, el inmuno-EM previo a la inclusión es el método preferido. Por el contrario, para identificar la localización de los receptores de membrana, se recomienda utilizar inmunogold EM posterior a la incrustación.
Teniendo en cuenta estas consideraciones, optamos por el método inmuno-EM pre-incrustación para profundizar en los circuitos retinianos, incluyendo la interacción entre las vías del cono y el bastón, y la localización molecular, como la distribución y organización sináptica de la inmunorreactividad tipo sustancia P (SP-IR) en la retina del ratón.
Protocolo
El cuidado y manejo de los animales fueron aprobados por el Reglamento del Comité de Ética de la Universidad Médica de Wenzhou de acuerdo con las directrices de ARVO. En esta investigación se utilizaron ratones adultos (C57BL/6J, macho y hembra, de 8 a 12 semanas de edad). El equipo y los reactivos necesarios para el estudio se enumeran en la Tabla de Materiales.
1. Preparación para la fijación de la retina
- Reúna los siguientes materiales y herramientas: un microscopio de disección, dos pinzas con puntas muy finas, tijeras, una aguja de jeringa de 1 ml (tamaño de aguja: G26) y papel de filtro.
- Anestesiar profundamente ratones mediante inyección intraperitoneal de 2,2,2-tribromoetanol a 0,25 mg/g de peso corporal. Posteriormente, decapitar a los ratones y cortarles la cabeza16.
- Enuclear sus ojos con unas tijeras de codo y colocarlos en un plato de vidrio que contenga 4% de paraformaldehído-0,2% de ácido pícrico en tampón de fosfato 0,1 M (PB; pH 7,4).
- Bajo el microscopio de disección, perfore un orificio en el limbo corneal con una aguja de jeringa de 1 ml y corte el segmento anterior con unas tijeras, siguiendo el orificio. Luego, retire el cristalino de la superficie interna de la retina con fórceps.
- Use dos pinzas para pelar cuidadosamente la esclerótica hasta que la retina quede completamente aislada de la copa ocular (el tejido de la retina en forma de copa se separó completamente de la coroides). Posteriormente, corta la retina en cuatro trozos.
- Fijar estas secciones en paraformaldehído al 4%-ácido pícrico al 0,2% en PB 0,1 M (pH 7,4) durante 2 h a temperatura ambiente (RT) y, a continuación, transferir el tejido a paraformaldehído al 4% en PB 0,1 M (pH 10,4) durante la noche a 4 °C.
2. Inmunotinción previa a la inclusión
- Después de lavar en 0,01 M PBS (pH 7,4) seis veces durante 10 min cada una, incubar los tejidos de la retina en borohidruro de sodio al 1% (NaBH4) en PBS 0,01 M (pH 7,4) durante 30 min.
- Lave las secciones de la retina con 0,01 M PBS (pH 7,4) al menos seis veces. Mientras tanto, retire el vítreo con papel de filtro y luego corte la retina en rodajas pequeñas de entre 100 y 300 μm con una cuchilla de afeitar de doble filo.
- Después de bloquear con suero de cabra normal (NGS) al 5% en 0,1 M PB (pH 7,4) durante 1 h en RT, incubar los cortes de retina con anticuerpos primarios (Anti-rabbit PKCα, 1:80; Anti-Rabbit SP, 1:100) junto con un 2% de NGS en 0,01 M PBS (pH 7,4) durante 2 h a RT en un agitador. Posteriormente, incubar durante 96 h (5 días) a 4 °C en un agitador.
- Después de lavar seis veces durante 10 min cada una en 0,01 M PBS (pH 7,4), incubar los cortes de retina con el anticuerpo secundario a 1:200, como IgG anti-conejo de cabra, junto con NGS al 2% en 0,01 M PBS (pH 7,4) durante 2 h a RT en un agitador. A continuación, incubar durante 48 h (2 días) a 4 °C en un agitador.
NOTA: Los anticuerpos secundarios se aplicaron solos en los experimentos de control. - Lave las franjas retinianas en 0,01 M PBS (pH 7,4) seis veces durante 10 min cada una antes de incubar con el reactivo A y el reactivo B del kit ABC a 1:100 en 0,01M PBS (pH 7,4) durante 2 días a 4 °C. (Tanto el reactivo A como el reactivo B se diluyeron con 0,01 M de PBS. Por ejemplo: Una solución: 6 μl; Solución B: 6 μl; 0,01 M PBS: 588 μl, total de 600 μl).
- Lave las rayas de la retina con tampón Tris de 0,05 M (pH 7,2) tres veces durante 10 minutos cada una. A continuación, preincube las rayas de retina con un 5 % de reactivo 1 y un 5 % de reactivo 3 del kit DAB en agua destilada durante 1 hora a temperatura ambiente. (La proporción, por ejemplo: reactivo 1: 50 μl; reactivo 3: 50 μl; agua destilada: 900 μl, total de 1000 μl).
- Tiñe las rayas de la retina con DAB. Añada el mismo volumen de solución de tres tubos en el kit DAB en secuencia (reactivo 1-reactivo 2-reactivo 3). Observe la condición de tinción con el microscopio de disección. Detenga la tinción cuando las células se vuelvan marrones; Este proceso tarda entre 10 y 20 minutos.
- Lave las rayas de la retina con tampón Tris 0,05 M (pH 7,2) tres veces durante 10 minutos cada una y luego lávelas con 0,01 M PBS seis veces durante 10 minutos cada una.
3. Post-fijación e inclusión
- Fije las rayas de la retina en glutaraldehído al 2% durante 1-2 h a temperatura ambiente (RT), y luego lave en 0,01 M PBS (pH 7,4) seis veces durante 10 min cada una.
- Incubar las franjas retinianas con tetróxido de osmio al 1% (OsO4) en PB 0,1 M durante 1 h en RT y mantenerlas en un lugar oscuro.
- Después de lavar en agua destilada (ddH2O) seis veces durante 10 min cada una, incubar los tejidos de la retina con acetato de uranilo durante 1 h a RT y mantenerlos en un lugar oscuro para teñir estos tejidos.
- Coloque los tejidos de la retina en soluciones de acetona (50%, 70%, 80% y 90%) durante 10 minutos cada uno, luego al 100% dos veces durante 10 minutos cada uno.
- Sumerja los tejidos de la retina en una mezcla que contenga el mismo volumen de acetato de uranilo y una resina epoxi durante 1 h a 37 °C en el horno de secado, seguido de una mezcla que contenga acetato de uranilo y la resina (1:4) durante la noche a 37 °C en el horno de secado.
- Transfiera los tejidos de la retina suavemente con un palillo de dientes a la nueva resina durante 1 h a 45 °C en un horno de secado, y luego la franja de la retina orientada se incrusta en la placa de inclusión con la resina.
- Introducir la muestra en un horno de secado a 45 °C durante 3 h y en un horno de secado a 65 °C durante 48 h.
- Forme trapezoides, forme los bloques de inclusión y corte el bloque en secciones de 1 μm de grosor con un ultramicrótomo, tiña estas secciones con azul de toluidina y precribó las regiones de interés con un microscopio óptico.
- Recoja secciones ultrafinas (70-90 nm) en rejillas de cobre y obsérvelas bajo un microscopio electrónico.
Resultados
La Figura 1 muestra ejemplos de experimentos de control sin incubación de anticuerpos primarios contra la proteína quinasa C alfa (PKCα) o SP, en los que no se encontró inmunorreactividad (IR).
La figura 2 muestra la PKCα-IR en la retina del ratón. PKCα sirve como marcador para todas las células bipolares de bastones (RBC) en la retina18. A nivel de microscopía electrónica (EM), los glóbulos rojos se pueden identificar a través de PKCα-IR, visualizados por el producto de reacción de diaminobenzidina (DAB) con alta densidad de electrones. La Figura 2A ilustra una dendrita RBC PKCα positiva que forma una sinapsis con un terminal de varilla en la capa plexiforme externa (OPL), mientras que la Figura 2B muestra una sinapsis cono-RBC donde una dendrita RBC PKCα positiva es postsináptica a un terminal de cono. Además, el producto de reacción DAB ayuda a identificar los terminales de los glóbulos rojos (Figura 2C) y los procesos axonales (Figura 2D) en la capa plexiforme interna (IPL).
La figura 3 muestra la expresión de la sustancia P (SP) en las conexiones pre y postsinápticas en la IPL de la retina del ratón. Las células amacrinas SP-IR son presinápticas a las células amacrinas SP-negativas (Figura 3A), así como los procesos amacrinos SP-IR (datos no mostrados). Además, las células amacrinas SP-IR son terminales postsinápticas a bipolares en los niveles de subcapa 3 (S3) y subcapa 5 (S5) de IPL, respectivamente (Figura 3B, C). Nuestra investigación previa detalla el análisis de las sinapsis donde los procesos de las células amacrinas SP-IR forman salidas sinápticas en otros procesos en la IPL19. En particular, la localización subcelular de SP se encuentra principalmente en vesículas sinápticas en las terminales presinápticas (Figura 3).
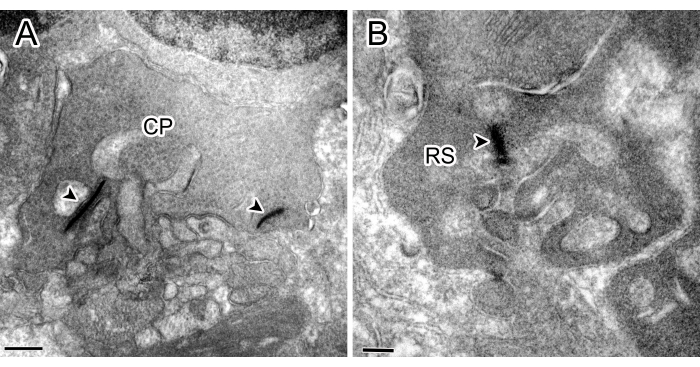
Figura 1: Micrografías inmunoelectrónicas de experimentos de control. Tanto el pedículo cónico (CP) con dos cintas (punta de flecha) (A) como la esférula de la varilla (RS) con una cinta en el OPL (B) no mostraron manchas. Barras de escala: 500 nm (A), 200 nm (B). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Micrografías inmunoelectrónicas marcadas con el anticuerpo PKCα en la retina del ratón. (A) RS se conecta con un RBC PKCα positivo (las flechas indican inmunorreactividad) y dos células horizontales (H) en la OPL. (B) CP se conecta con RBC PKCα positivo en el OPL. (C) y (D) muestran el terminal de RBC PKCα positivo y el proceso axonal en la IPL, respectivamente. Barras de escala: 200 nm (A), 500 nm (B), 500 nm (C), 500 nm (D). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Micrografías inmunoelectrónicas marcadas con el anticuerpo SP en la IPL de la retina del ratón. (A) La célula amacrina SP-IR (A+) es presináptica a una célula amacrina SP-negativa (A-). Las células amacrinas SP-IR recibieron entradas de terminales bipolares en los niveles S3 (B) y S5 (C) de IPL, respectivamente. Barras de escala: 200 nm (A), 200 nm (B), 200 nm (C). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este artículo ha descrito tres pasos críticos para la observación exitosa de los circuitos sinápticos y la localización de proteínas: (1) fijación rápida y débil, (2) inmunotinción previa a la inclusión y (3) postfijación e incrustación.
Proponemos que la fijación es el paso clave para el éxito de un enfoque inmuno-EM previo a la incorporación. Por lo tanto, aquí se enfatiza la importancia de un fijador fresco y una fijación rápida, denominando a este principio el "principio de las 4F", que es crucial en la preparación de tejidos. Sin embargo, lograr tanto una mayor penetración de anticuerpos como una fijación efectiva plantea un desafío20. Para abordar esto, el glutaraldehído se reemplazó con ácido pícrico durante la fijación inicial para mejorar la penetración del anticuerpo, ya que el glutaraldehído puede alterar los determinantes antigénicos y afectar la inmunotinción21. El ácido pícrico, por el contrario, preserva mejor la estructura de la membrana y la integridad de los tejidos22, aunque con un compromiso en la eficacia de la fijación. En el tercer paso, se utilizó glutaraldehído al 2% para la posfijación con el fin de optimizar la fijación de los tejidos.
Los puntos clave del protocolo presentado aquí incluyen cinco pasos: (1) Fijación temprana: Utilizar ácido pícrico en la etapa temprana para una mejor penetración de los anticuerpos y minimizar la interrupción de los determinantes antigénicos. (2) Postfijación: Uso de glutaraldehído al 2% para mejorar la fijación de tejidos después de la inmunotinción. (3) Tratamiento de reducción: Incubación de tejido en NaBH4 al 1% en PB 0,1 M (pH 7,4) durante 30 min para restaurar gran parte de la inmunorreactividad y mejorar la reactividad inmune de antígenos y anticuerpos, intensificando las señales positivas23. (4) Preparación de tejidos: Extracción de vítreo y corte de tejido retiniano en pequeñas tiras para facilitar la incubación efectiva de anticuerpos y garantizar señales uniformes. (5) Además, es imperativo manipular el tejido de la retina con el máximo cuidado, evitando cualquier daño que pueda comprometer las observaciones posteriores a lo largo de todo el procedimiento. Estas medidas contribuyen colectivamente al éxito del método inmuno-EM pre-incrustado, permitiendo estudiar diversos aspectos como las sinapsis cono-RBC24, la localización molecular SP-IR19 y la expresión precisa de α-Syn en la retina del ratón25.
Antes de incubar el primer anticuerpo, es esencial bloquear las tiras de retina con un 2% de NGS para eliminar las interferencias de señal inespecíficas. La concentración del primer anticuerpo debe determinarse en función del propio anticuerpo, normalmente más alta que la utilizada para la tinción de secciones congeladas, y debe optimizarse de antemano. Durante el período de incubación primario de anticuerpos, es necesaria una rotación continua del tubo de microcentrífuga para garantizar el contacto completo de las tiras de retina apiladas con el anticuerpo, evitando la penetración incompleta de las piezas apiladas. Para amplificar la señal, se preincubó DAB antes de la tinción estándar de DAB, con un tiempo de tinción específico que suele oscilar entre 10 y 20 min. Si el tiempo es demasiado corto, la señal puede ser demasiado débil para la observación, y si es demasiado larga, puede dar lugar a señales falsas positivas, lo que afecta al juicio preciso. Generalmente, el tiempo de incubación de los tintes depende directamente del color de la superficie del tejido (marrón a marrón oscuro).
Si bien se realizaron experimentos con la congelación de tejido en nitrógeno líquido para mejorar la señal, como se mencionó anteriormente 18,26,27, este método amplificó las señales positivas, pero resultó en una estructura de membrana deficiente de las células de la retina (datos no mostrados). Esta degradación estructural dificultó la identificación precisa de los tipos de células. Teniendo en cuenta esto, el tejido de la retina no se congeló repetidamente. Para mejorar la señal positiva, el tiempo de incubación de los anticuerpos se extendió adecuadamente. El protocolo propuesto combina las ventajas anteriores, simplificando los pasos en comparación con la inclusión en agar. Esto no solo salvaguarda los determinantes antigénicos de las proteínas, sino que también preserva la integridad de las membranas celulares. El objetivo general es explorar las conexiones sinápticas y la localización celular de los neurotransmisores a lo largo de toda la vía. Por lo tanto, los productos de reacción DAB en el protocolo no se han sometido a un tratamiento de intensificación de plata, lo que lo hace más adecuado para investigar las conexiones y vías sinápticas específicas de neurotransmisores28.
En la actualidad, existen métodos limitados para la identificación química de vías o neurotransmisores a nivel ultraestructural. Uno de estos métodos es la microscopía óptica y electrónica correlacionada (CLEM)29,30, que, sin embargo, se limita a un área muy pequeña y carece de la capacidad de identificar conexiones a lo largo de toda la vía. Las fortalezas de la inmuno-EM pre-incorporada radican en su señal robusta, amplio alcance y capacidad para el posicionamiento analítico a larga distancia y el seguimiento 13,14,15. Sin embargo, este método también tiene sus limitaciones, como las señales difusas, lo que los hace menos específicos. Para la localización precisa de los receptores de membrana, especialmente los de la membrana, puede ser más adecuado utilizar inmunogold EM posterior a la incrustación. Esta técnica permite el recuento directo de partículas de oro, facilitando el análisis del número y variabilidad de estos receptores de membrana16.
En el futuro, la integración de la inmuno-EM preincrustada con la EM de volumen es prometedora como un método eficaz para la exploración a largo plazo de los circuitos neuronales identificados, lo que representa las perspectivas futuras para un mayor desarrollo de este método. El volumen EM se centra en la reconstrucción de estructuras, apoyándose en la morfología para la identificación de estructuras específicas, careciendo de una identificación química precisa31,32. Mediante la combinación de inmuno-EM preincrustado con EM de volumen, se pueden identificar estructuras o sustancias específicas durante la reconstrucción tridimensional, lo que proporciona un enfoque más completo y visualmente intuitivo para la identificación de circuitos neuronales.
Divulgaciones
Los autores no tienen divulgaciones.
Agradecimientos
Este trabajo fue financiado en parte por subvenciones del Programa Nacional de Investigación y Desarrollo Clave de China (2022YFA1105503), el Laboratorio Estatal Clave de Neurociencia (SKLN-202103), la Fundación de Ciencias Naturales de Zhejiang de China (Y21H120019).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL syringe needle | kangdelai | ||
| 1% OsO4 | Electron Microscopy Science | 19100 | |
| 2,2,2-Tribromoethanol | Sigma-Aldrich | T48402 | |
| 8% Glutaraldehyde | Electron Microscopy Science | 16020 | |
| 8% Paraformaldehyde | Electron Microscopy Science | 157-8 | |
| Acetone | Electron Microscopy Science | 10000 | |
| Anti-rabbit PKC | Sigma-Aldrich | P4334 | |
| Anti-Rabbit SP | Abcam | ab67006 | |
| DAB Substrate kit | MXB Biotechnologies | KIT-9701/9702/9703 | |
| Elbow scissors | Suzhou66 vision company | 54010 | |
| Electron microscope | Phillips | CM120 | |
| Epon resin | Electron Microscopy Science | 14910 | |
| forcep | Suzhou66 vision company | S101A | |
| Millipore filter paper | Merck Millipore | PR05538 | |
| Na2HPO4· 12H2O | Sigma | 71650 | A component of phosphate buffer |
| NaH2PO4· H2O | Sigma | 71507 | A component of phosphate buffer |
| Picric acid | Electron Microscopy Science | 19550 | |
| Sodium borohydride (NaBH4) | Sigma | 215511 | |
| Tris | Solarbio | 917R071 | |
| Ultramicrotome | Leica | ||
| Uranyl acetate | Electron Microscopy Science | 22400 | |
| VACTASTAIN ABC kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-4001 |
Referencias
- Chua, N. J., et al. A complete reconstruction of the early visual system of an adult insect. Curr Biol. 33 (21), 4611-4623.e4614 (2023).
- Ravi Chander, P., Hanson, L., Chundekkad, L., Awatramani, G. B. Neural circuits underlying multi-feature extraction in the retina. J Neurosci. , JN-RM-0910-23 (2023).
- Sirivisoot, S., et al. Development and characterization of mouse anti-canine PD-L1 monoclonal antibodies and their expression in canine tumors by immunohistochemistry in vitro. Vet Q. 43 (1), 1-9 (2023).
- Raeisi, H., et al. Development and characterization of phage display-derived anti-toxin antibodies neutralizing TcdA and TcdB of Clostridioides difficile. Microbiol Spectr. 11 (5), e0531022(2023).
- Ryschich, A., Dong, Y., Schäfer, M., Ryschich, E., Karakhanova, S. DWH24: A new antibody for fluorescence-based cell death analysis. Methods Appl Fluoresc. 11 (4), (2023).
- Jastrzebska, B., et al. Functional characterization of rhodopsin monomers and dimers in detergents. J Biol Chem. 279 (52), 54663-54675 (2004).
- Huang, P., et al. Mechanism of Shenfu injection in suppressing inflammation and preventing sepsis-induced apoptosis in murine cardiomyocytes based on network pharmacology and experimental validation. J Ethnopharmacol. 322, 117599(2024).
- Maheshwari, U., et al. Inorganic phosphate exporter heterozygosity in mice leads to brain vascular calcification, microangiopathy, and microgliosis. Brain Pathol. 33 (6), e13189(2023).
- Mackiewicz, J., et al. Effect of gravity in long-term vitreous tamponade: In vivo investigation using perfluorocarbon liquids and semi-fluorinated alkanes. Graefes Arch Clin Exp Ophthalmol. 245 (5), 665-675 (2007).
- Luján, R., Rubio, M. E. Editorial: Immunoelectron microscopy: Placing molecular functions within a neuronal context. Front Neuroanat. 16, 1043371(2022).
- Xu, S., et al. Synaptic changes and the response of microglia in a light-induced photoreceptor degeneration model. Mol Vis. 27, 206-220 (2021).
- Chadha, A., Volland, S., Baliaouri, N. V., Tran, E. M., Williams, D. S. The route of the visual receptor rhodopsin along the cilium. J Cell Sci. 132 (10), jcs.229526(2019).
- Huang, H. J., et al. Multiple nucleocapsid structural forms of shrimp white spot syndrome virus suggests a novel viral morphogenetic pathway. Int J Mol Sci. 24 (8), 7525(2023).
- Tissarinen, P., et al. Elevated human placental heat shock protein 5 is associated with spontaneous preterm birth. Pediatr Res. 94 (2), 520-529 (2023).
- Huang, Z., et al. A neural tract tracing study on synaptic connections for cortical glutamatergic terminals and cervical spinal calretinin neurons in rats. Front Neural Circuits. 17, 1086873(2023).
- Zhang, J., Petralia, R. S., Wang, Y. X., Diamond, J. S. High-resolution quantitative immunogold analysis of membrane receptors at retinal ribbon synapses. J Vis Exp. 108, e53547(2016).
- Ottersen, O. P., Landsend, A. S. Organization of glutamate receptors at the synapse. Eur J Neurosci. 9 (11), 2219-2224 (1997).
- Greferath, U., Grünert, U., Wässle, H. Rod bipolar cells in the mammalian retina show protein kinase C-like immunoreactivity. J Comp Neurol. 301 (3), 433-442 (1990).
- Wang, F., et al. Distribution and synaptic organization of substance P-like immunoreactive neurons in the mouse retina. Brain Struct Funct. 228 (7), 1703-1724 (2023).
- van Opbergen, C. J. M., et al. 34;Orphan" Connexin43 in Plakophilin-2 deficient hearts revealed by volume electron microscopy. Front Cell Dev Biol. 10, 843687(2022).
- Li, S., et al. Safe and efficient oral allergy immunotherapy using one-pot-prepared mannan-coated allergen nanoparticles. Biomaterials. 303, 122381(2023).
- Yamashita, K., Kusakabe, M., Sano, M. A simple and rapid method of dissociating hepatocytes from fixed liver of the mouse. Stain Technol. 56 (1), 29-33 (1981).
- Tanabe, T., Shin, M., Fujiwara, K. Immunoelectron microscopy study of polyamines using a newly prepared monoclonal antibody against spermidine: use of a mixture of glutaraldehyde and paraformaldehyde as a cross-linking agent in the preparation of the antigen. J Biochem. 135 (4), 501-507 (2004).
- Xiao, J., et al. Rod bipolar cells receive cone photoreceptor inputs through both invaginating synapses and flat contacts in the mouse and guinea pig retinas. J Comp Neurol. 531 (11), 1184-1197 (2023).
- Yang, Q., et al. Expression of α-Synuclein in the mouse retina is confined to inhibitory presynaptic elements. J Comp Neurol. 531 (10), 1057-1079 (2023).
- Yazulla, S., Studholme, K. M., Zucker, C. L. Synaptic organization of substance P-like immunoreactive amacrine cells in goldfish retina. J Comp Neurol. 231 (2), 232-238 (1985).
- Sassoè-Pognetto, M., Wässle, H., Grünert, U. Glycinergic synapses in the rod pathway of the rat retina: cone bipolar cells express the alpha 1 subunit of the glycine receptor. J Neurosci. 14 (8), 5131-5146 (1994).
- Hartveit, E., et al. Localization and developmental expression of the NMDA receptor subunit NR2A in the mammalian retina. J Comp Neurol. 348 (4), 570-582 (1994).
- Perkins, G. A. The use of miniSOG in the localization of mitochondrial proteins. Methods Enzymol. 547, 165-179 (2014).
- Shu, X., et al. A genetically encoded tag for correlated light and electron microscopy of intact cells, tissues, and organisms. PLoS Biol. 9 (4), e1001041(2011).
- Kar, D., et al. Volume electron microscopy reveals human retinal mitochondria that align with reflective bands in optical coherence tomography [Invited]. Biomed Opt Express. 14 (10), 5512-5527 (2023).
- Johnson, J. E. Jr, et al. Spatiotemporal regulation of ATP and Ca2+ dynamics in vertebrate rod and cone ribbon synapses. Mol Vis. 13, 887-919 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados