Method Article
Untersuchung von retinalen Schaltkreisen und molekularer Lokalisierung durch Voreinbettung der Immunelektronenmikroskopie
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die detaillierten Schritte der Immunelektronenmikroskopie vor der Einbettung, wobei der Schwerpunkt auf der Erforschung synaptischer Schaltkreise und der Proteinlokalisierung in der Netzhaut liegt.
Zusammenfassung
Die Netzhaut besteht aus zahlreichen Zellen, die verschiedene neuronale Schaltkreise bilden, die die erste Stufe der Sehbahn bilden. Jeder Schaltkreis zeichnet sich durch einzigartige Merkmale und unterschiedliche Neurotransmitter aus, die seine Rolle und funktionelle Bedeutung bestimmen. Angesichts der komplizierten Zelltypen innerhalb ihrer Struktur stellt die Komplexität der neuronalen Schaltkreise in der Netzhaut eine Herausforderung für die Erforschung dar. Um retinale Schaltkreise und Cross-Talks, wie z.B. die Verbindung zwischen Zapfen- und Stäbchenwegen, und die genaue molekulare Lokalisierung (Neurotransmitter oder Neuropeptide), wie z.B. das Vorhandensein von Substanz P-ähnlicher Immunreaktivität in der Netzhaut der Maus, besser untersuchen zu können, haben wir eine Pre-Embedding-Immunelektronenmikroskopie (Immuno-EM) Methode eingesetzt, um synaptische Verbindungen und Organisation zu untersuchen. Dieser Ansatz ermöglicht es uns, spezifische interzelluläre synaptische Verbindungen und eine präzise molekulare Lokalisierung zu lokalisieren und könnte eine richtungsweisende Rolle bei der Erforschung seiner Funktion spielen. Dieser Artikel beschreibt das Protokoll, die verwendeten Reagenzien und detaillierte Schritte, einschließlich (1) Vorbereitung der Netzhautfixierung, (2) Immunfärbung vor der Einbettung und (3) Nachfixierung und Einbettung.
Einleitung
Die Komplexität der neuronalen Schaltkreise in der Netzhaut stellt eine Herausforderung für die Erforschung dar, wenn man die unterschiedlichen Zelltypen innerhalb ihrer Struktur berücksichtigt 1,2. In einem ersten Schritt geht es darum, synaptische Verbindungen zwischen verschiedenen Zellen zu identifizieren und die zelluläre Lokalisation bestimmter Neurotransmitter oder Neuropeptide zu bestimmen. Mit den Fortschritten in der Molekularbiologie und der Einführung neuer Proteine wird die präzise Lokalisierung in der Netzhaut entscheidend für das Verständnis ihrer Funktionen und die Analyse von retinalen Schaltkreisen und synaptischen Verbindungen 3,4,5.
Aufgrund der begrenzten Auflösung der Lichtmikroskopie wird die Elektronenmikroskopie (EM) häufig eingesetzt, um die subzellulären Strukturen von Nervenzellen zu detektieren. EM hat verschiedene Klassifikationen, wobei die konventionelle Transmissionselektronenmikroskopie (TEM) zur Beobachtung von Zellultrastrukturen verwendet wird 6,7,8,9. Die Immunelektronenmikroskopie (Immuno-EM), die die räumliche Auflösung der EM mit der chemischen Identifizierungsfähigkeit von Antikörpern kombiniert, die spezifisch an Proteinebinden 10, erweist sich als die optimale und exklusive Methode zur Untersuchung synaptischer Verbindungen und der subzellulären Proteinlokalisation in der Netzhaut11,12.
Immun-EM-Techniken können in Prä-Embedding- und Post-Embedding-Methoden unterteilt werden, basierend auf der Reihenfolge der Einbettung und der Antikörperinkubation. Im Vergleich zur Post-Embedding-Methode ist der Pre-Embedding-Ansatz in der Lage, großflächig und über große Entfernungen zu identifizieren 13,14,15 und bietet einen optimalen Ansatz für die Untersuchung von Zellprozessen wie Axonen und Dendriten. Darüber hinaus bietet diese Technik ein starkes Signal und ein breites Sichtfeld, was sie für umfassende Untersuchungen der Proteinexpression und der molekularen Lokalisation im Zytoplasma vorteilhaft macht. Diese Methode erweist sich als besonders wertvoll, um chemisch identifizierte Strukturen zu gewährleisten, die im gesamten Zytoplasma, in den Zellen oder in der Netzhaut sichtbar sind.
Die Post-Embedding-Methode weist zwar eine geringere Penetration oder Diffusion im Vergleich zur Pre-Embedding-Methode auf, ist jedoch nicht so empfindlich16,17. Einfach ausgedrückt: Wenn das Ziel darin besteht, die Lokalisation spezifischer Neurotransmitter im Zytoplasma oder in den synaptischen Endungen zu untersuchen, ist die Pre-Embedding-Immuno-EM die bevorzugte Methode. Umgekehrt wird zur Identifizierung der Lokalisation von Membranrezeptoren eher empfohlen, Immunogold-EM nach der Einbettung zu verwenden.
Vor diesem Hintergrund entscheiden wir uns für die Pre-Embedding-Immuno-EM-Methode, um in retinale Schaltkreise einzutauchen, einschließlich der Interaktion zwischen Zapfen- und Stäbchenwegen, und der molekularen Lokalisation, wie z. B. der Verteilung und synaptischen Organisation der Substanz P-like Immunoreactivity (SP-IR) in der Netzhaut der Maus.
Protokoll
Die Pflege und der Umgang mit den Tieren wurden durch die Verordnung der Ethikkommission der Medizinischen Universität Wenzhou in Übereinstimmung mit den ARVO-Richtlinien genehmigt. In dieser Studie wurden adulte Mäuse (C57BL/6J, männlich und weiblich, 8 bis 12 Wochen alt) verwendet. Die für die Studie benötigten Geräte und Reagenzien sind in der Materialtabelle aufgeführt.
1. Vorbereitung für die Netzhautfixierung
- Stellen Sie folgende Materialien und Werkzeuge zusammen: ein Präpariermikroskop, zwei Pinzetten mit sehr feinen Spitzen, eine Schere, eine 1 mL Spritzennadel (Nadelstärke: G26) und Filterpapier.
- Mäuse durch intraperitoneale Injektion von 2,2,2-Tribromethanol bei 0,25 mg/g Körpergewicht tief anästhesieren. Enthaupte anschließend die Mäuse und schneide ihnen die Köpfe ab16.
- Entkernen Sie die Augen mit einer Ellbogenschere und legen Sie sie in eine Glasschale, die 4 % Paraformaldehyd-0,2 % Pikrinsäure in 0,1 M Phosphatpuffer (PB; pH 7,4) enthält.
- Stanzen Sie unter dem Präpariermikroskop mit einer 1-ml-Spritzennadel ein Loch in den Hornhautlimbus und schneiden Sie den vorderen Abschnitt mit einer Schere ab, indem Sie dem Loch folgen. Entfernen Sie dann die Linse mit einer Pinzette von der inneren Netzhautoberfläche.
- Schäle die Sklera mit zwei Pinzetten vorsichtig, bis die Netzhaut vollständig von der Augenmuschel isoliert ist (das kuschelige Netzhautgewebe löst sich vollständig von der Aderhaut). Schneide anschließend die Netzhaut in vier Stücke.
- Fixieren Sie diese Abschnitte 2 h lang bei Raumtemperatur (RT) in 4 % Paraformaldehyd-0,2 % Pikrinsäure in 0,1 M PB (pH 7,4) und übertragen Sie das Gewebe dann über Nacht bei 4 °C auf 4 % Paraformaldehyd in 0,1 M PB (pH 10,4).
2. Immunfärbung vor der Einbettung
- Nach sechsmaligem Waschen in 0,01 M PBS (pH 7,4) für jeweils 10 min inkubieren Sie das Netzhautgewebe in 1 % Natriumborhydrid (NaBH4) in 0,01 M PBS (pH 7,4) für 30 min.
- Waschen Sie die Netzhautschnitte mindestens sechsmal in 0,01 M PBS (pH 7,4). In der Zwischenzeit den Glaskörper mit Filterpapier entfernen und anschließend die Netzhaut mit einer zweischneidigen Rasierklinge in kleine Scheiben zwischen 100-300 μm schneiden.
- Nach Blockierung mit 5 % normalem Ziegenserum (NGS) in 0,1 M PB (pH 7,4) für 1 h bei RT inkubieren Sie die Netzhautschnitte mit primären Antikörpern (Anti-Kaninchen-PKCα, 1:80; Anti-Kaninchen-SP, 1:100) zusammen mit 2 % NGS in 0,01 M PBS (pH 7,4) für 2 h bei RT auf einem Shaker. Anschließend 96 h (5 Tage) bei 4 °C auf einem Shaker inkubieren.
- Nach sechsmaligem Waschen für jeweils 10 Minuten in 0,01 M PBS (pH 7,4) inkubieren Sie die Netzhautscheiben mit dem Sekundärantikörper bei 1:200, wie z. B. Ziegen-Anti-Kaninchen-IgG, zusammen mit 2 % NGS in 0,01 M PBS (pH 7,4) für 2 h bei RT auf einem Shaker. Anschließend 48 h (2 Tage) bei 4 °C auf einem Shaker inkubieren.
HINWEIS: Sekundärantikörper wurden in Kontrollexperimenten allein appliziert. - Waschen Sie die Netzhautstreifen sechsmal in 0,01 M PBS (pH 7,4) für jeweils 10 Minuten, bevor Sie sie mit Reagenz A und Reagenz B aus dem ABC-Kit bei 1:100 in 0,01 M PBS (pH 7,4) für 2 Tage bei 4 °C inkubieren. (Sowohl Reagenz A als auch Reagenz B wurden mit 0,01 M PBS verdünnt. Zum Beispiel: Eine Lösung: 6 μl; B-Lösung: 6 μl; 0,01 M PBS: 588 μl, insgesamt 600 μl).
- Waschen Sie die Netzhautstreifen dreimal für jeweils 10 min in 0,05 M Tris-Puffer (pH 7,2). Dann inkubieren Sie die Netzhautstreifen mit 5 % Reagenz 1 und 5 % Reagenz 3 aus dem DAB-Kit 1 Stunde lang bei Raumtemperatur in destilliertem Wasser. (Das Verhältnis zum Beispiel: Reagenz 1: 50 μl; Reagenz 3: 50 μl; destilliertes Wasser: 900 μl, insgesamt 1000 μl).
- Färben Sie die Netzhautstreifen mit DAB. Geben Sie nacheinander das gleiche Volumen der Lösung aus drei Röhrchen des DAB-Kits hinzu (Reagenz 1-Reagenz 2-Reagenz 3). Beobachten Sie den Färbezustand mit dem Präpariermikroskop. Stoppen Sie die Färbung, wenn die Zellen braun werden; Dieser Vorgang dauert 10-20 Minuten.
- Waschen Sie die Netzhautstreifen dreimal für jeweils 10 min mit 0,05 M Tris-Puffer (pH 7,2) und waschen Sie sie dann sechsmal für jeweils 10 min in 0,01 M PBS.
3. Nachfixierung und Einbettung
- Fixieren Sie die Netzhautstreifen 1-2 h lang bei Raumtemperatur (RT) in 2% Glutaraldehyd und waschen Sie sie dann sechsmal für jeweils 10 min in 0,01 M PBS (pH 7,4).
- Inkubieren Sie die Netzhautstreifen mit 1% Osmiumtetroxid (OsO4) in 0,1 M PB für 1 h bei RT und bewahren Sie sie an einem dunklen Ort auf.
- Nach sechsmaligem Waschen in destilliertem Wasser (ddH2O) für jeweils 10 min inkubieren Sie das Netzhautgewebe 1 h lang bei RT mit Uranylacetat und bewahren Sie es an einem dunklen Ort auf, um dieses Gewebe zu färben.
- Legen Sie das Netzhautgewebe jeweils 10 Minuten lang in Acetonlösungen (50%, 70%, 80% und 90%) und dann zweimal für jeweils 10 Minuten in 100% ein.
- Tauchen Sie das Netzhautgewebe 1 h lang bei 37 °C Trockenschrank in eine Mischung mit dem gleichen Volumen Uranylacetat und einem Epoxidharz, gefolgt von einer Mischung aus Uranylacetat und dem Harz (1:4) über Nacht bei 37 °C Trockenschrank.
- Das Netzhautgewebe wird mit einem Zahnstocher für 1 h bei 45 °C in einem Trockenschrank vorsichtig in das neue Harz überführt, dann wird der orientierte Netzhautstreifen mit dem Harz in die Einbettungsplatte eingebettet.
- Die Probe 3 h lang in einen 45 °C Trockenschrank und 48 h in einen 65 °C Trockenschrank geben.
- Formen Sie die Einbettungsblöcke zu Trapezen und schneiden Sie den Block mit einem Ultramikrotom in 1 μm dicke Abschnitte, färben Sie diese Abschnitte mit Toluidinblau und screenen Sie die interessierenden Bereiche unter einem Lichtmikroskop.
- Sammeln Sie ultradünne Schnitte (70-90 nm) auf Kupfergittern und betrachten Sie sie unter einem Elektronenmikroskop.
Ergebnisse
Abbildung 1 zeigt Beispiele für Kontrollexperimente ohne Inkubation von Primärantikörpern gegen Proteinkinase C alpha (PKCα) oder SP, in denen keine Immunreaktivität (IR) gefunden wurde.
Abbildung 2 zeigt das PKCα-IR in der Netzhaut der Maus. PKCα dient als Marker für alle Stäbchen-Bipolarzellen (RBC) in der Netzhaut18. Auf der Ebene der Elektronenmikroskopie (EM) können Erythrozyten durch PKCα-IR identifiziert werden, sichtbar gemacht durch das Reaktionsprodukt Diaminobenzidin (DAB) mit hoher Elektronendichte. Abbildung 2A zeigt einen PKCα-positiven RBC-Dendriten, der eine Synapse mit einem Stäbchenanschluss in der äußeren plexiformen Schicht (OPL) bildet, während Abbildung 2B eine Kegel-Erythrozyten-Synapse zeigt, bei der ein PKCα-positiver Erythrozyten-Dendrit postsynaptisch zu einem Kegelterminal ist. Darüber hinaus hilft das DAB-Reaktionsprodukt bei der Identifizierung von Erythrozytenterminals (Abbildung 2C) und axonalen Prozessen (Abbildung 2D) in der inneren plexiformen Schicht (IPL).
Abbildung 3 zeigt die Expression der Substanz P (SP) sowohl in prä- als auch in postsynaptischen Verbindungen im IPL der Netzhaut der Maus. SP-IR-Amakrinzellen sind präsynaptisch zu SP-negativen Amakrinzellen (Abbildung 3A) sowie SP-IR-Amakrinprozesse (Daten nicht gezeigt). Darüber hinaus sind SP-IR-Amakrinzellen postsynaptische bis bipolare Terminals in den Ebenen der Subschicht 3 (S3) bzw. der Unterschicht 5 (S5) des IPL (Abbildung 3B,C). Unsere bisherige Forschung befasst sich mit der Analyse von Synapsen, bei denen SP-IR-Amakrinzellprozesse synaptische Ausgänge für andere Prozesse im IPL19 bilden. Bemerkenswert ist, dass die subzelluläre Lokalisation von SP hauptsächlich in synaptischen Vesikeln in den präsynaptischen Enden zu finden ist (Abbildung 3).
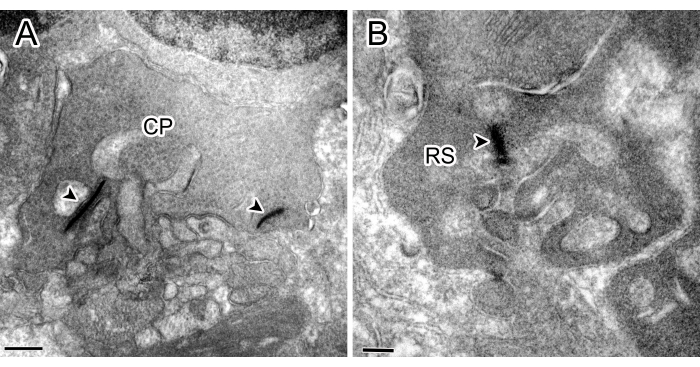
Abbildung 1: Immunelektronenmikroskopische Aufnahmen aus Kontrollexperimenten. Sowohl der Zapfenstiel (CP) mit zwei Bändern (Pfeilspitze) (A) als auch die Stabshülse (RS) mit einem Band im OPL (B) zeigten keine Färbung. Maßstabsleisten: 500 nm (A), 200 nm (B). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Immunelektronenmikroskopische Aufnahmen, die mit PKCα-Antikörpern in der Netzhaut der Maus markiert sind. (A) RS verbindet sich mit einer PKCα-positiven Erythrozyten (Pfeile zeigen Immunreaktivität) und zwei horizontalen Zellen (H) in der OPL. (B) CP verbindet sich mit PKCα-positivem RBC im OPL. (C) und (D) zeigen den PKCα-positiven RBC-terminalen bzw. axonalen Prozess im IPL. Maßstabsleisten: 200 nm (A), 500 nm (B), 500 nm (C), 500 nm (D). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Mit SP-Antikörper markierte Immunelektronenmikroskopische Aufnahmen im IPL der Netzhaut der Maus. (A) Die SP-IR-Amakrinzelle (A+) ist präsynaptisch zu einer SP-negativen Amakrinzelle (A-). SP-IR-Amakrinzellen erhielten Eingaben von bipolaren Terminals in den Stufen S3 (B) bzw. S5 (C) des IPL. Maßstabsleisten: 200 nm (A), 200 nm (B), 200 nm (C). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Artikel wurden drei kritische Schritte für die erfolgreiche Beobachtung synaptischer Schaltkreise und der Proteinlokalisierung beschrieben: (1) schnelle und schwache Fixierung, (2) Immunfärbung vor der Einbettung und (3) Nachfixierung und Einbettung.
Wir gehen davon aus, dass die Fixierung der Schlüsselschritt für einen erfolgreichen Ansatz vor der Einbettung von Immuno-EM ist. Daher wird hier die Bedeutung von frischem Fixiermittel und schneller Fixierung betont und dieses Prinzip als "4F-Prinzip" bezeichnet, das bei der Gewebepräparation von entscheidender Bedeutung ist. Es stellt jedoch eine Herausforderung dar, sowohl eine verbesserte Antikörperpenetration als auch eine effektive Fixierung zu erreichen20. Um dies zu beheben, wurde Glutaraldehyd während der anfänglichen Fixierung durch Pikrinsäure ersetzt, um die Antikörperpenetration zu verbessern, da Glutaraldehyd antigene Determinanten stören und die Immunfärbung beeinflussen kann21. Im Gegensatz dazu bewahrt Pikrinsäure die Membranstruktur und die Gewebeintegrität besser22, wenn auch mit einem Kompromiss bei der Fixierungswirksamkeit. Im dritten Schritt wurde 2% Glutaraldehyd für die Nachfixierung verwendet, um die Gewebefixierung zu optimieren.
Zu den wichtigsten Punkten des hier vorgestellten Protokolls gehören fünf Schritte: (1) Frühe Fixierung: Verwendung von Pikrinsäure im Frühstadium für eine bessere Antikörperpenetration bei gleichzeitiger Minimierung der Störung der antigenen Determinanten. (2) Nach der Fixierung: Verwendung von 2 % Glutaraldehyd zur Verbesserung der Gewebefixierung nach der Immunfärbung. (3) Reduktionsbehandlung: Inkubation von Gewebe in 1 % NaBH4 in 0,1 M PB (pH 7,4) für 30 Minuten, um einen Großteil der Immunreaktivität wiederherzustellen und die Immunreaktivität von Antigenen und Antikörpern zu verbessern, wobei positive Signale intensiviertwerden 23. (4) Gewebevorbereitung: Entnahme von Glaskörper und Schneiden von Netzhautgewebe in kleine Streifen, um eine effektive Antikörperinkubation zu erleichtern und einheitliche Signale zu gewährleisten. (5) Darüber hinaus ist es unerlässlich, das Netzhautgewebe mit äußerster Sorgfalt zu behandeln und Schäden zu vermeiden, die die nachfolgenden Beobachtungen während des gesamten Eingriffs beeinträchtigen könnten. Diese Messungen tragen zusammen zum Erfolg der Pre-Embedding-Immuno-EM-Methode bei und ermöglichen es, verschiedene Aspekte wie die Zapfen-Erythrozyten-Synapsen24, die molekulare SP-IR-Lokalisation19 und die genaue Expression von α-Syn in der Netzhaut der Maus25 zu untersuchen.
Vor der Inkubation des ersten Antikörpers ist es wichtig, Netzhautstreifen mit 2% NGS zu blockieren, um unspezifische Signalstörungen zu eliminieren. Die Konzentration des ersten Antikörpers muss auf der Grundlage des Antikörpers selbst bestimmt werden, in der Regel höher als die für die Intensivschnittfärbung verwendete, und muss zuvor optimiert werden. Während der Inkubationszeit des primären Antikörpers ist eine kontinuierliche Drehung des Mikrozentrifugenröhrchens erforderlich, um einen vollständigen Kontakt der gestapelten Netzhautstreifen mit dem Antikörper zu gewährleisten und eine unvollständige Penetration der gestapelten Teile zu verhindern. Um das Signal zu verstärken, wurde DAB vor der Standard-DAB-Färbung vorinkubiert, wobei die spezifische Färbezeit typischerweise zwischen 10 und 20 Minuten lag. Wenn die Zeit zu kurz ist, kann das Signal zu schwach für die Beobachtung sein, und wenn es zu lang ist, kann es zu falsch positiven Signalen führen, die das genaue Urteilsvermögen beeinträchtigen. Im Allgemeinen ist die Inkubationszeit von Farbstoffen direkt von der Oberflächenfarbe des Gewebes (braun bis dunkelbraun) abhängig.
Während Experimente mit dem Einfrieren von Gewebe in flüssigem Stickstoff durchgeführt wurden, um das Signal zu verstärken, wie bereits erwähnt 18,26,27, verstärkte diese Methode zwar positive Signale, führte aber zu einer schlechten Membranstruktur der Netzhautzellen (Daten nicht gezeigt). Dieser strukturelle Abbau machte es schwierig, die Zelltypen genau zu identifizieren. Vor diesem Hintergrund wurde das Netzhautgewebe nicht immer wieder eingefroren. Um das positive Signal zu verstärken, wurde die Inkubationszeit der Antikörper entsprechend verlängert. Das vorgeschlagene Protokoll kombiniert frühere Vorteile und vereinfacht die Schritte im Vergleich zur Agar-Einbettung. Dies sichert nicht nur die antigenen Determinanten von Proteinen, sondern bewahrt auch die Integrität der Zellmembranen. Das übergeordnete Ziel ist es, synaptische Verbindungen und die zelluläre Lokalisierung von Neurotransmittern über den gesamten Signalweg hinweg zu erforschen. Daher wurden die DAB-Reaktionsprodukte in dem Protokoll keiner Silberintensivierungsbehandlung unterzogen, wodurch es für die Untersuchung neurotransmitterspezifischer synaptischer Verbindungen und Signalwege besser geeignet ist28.
Derzeit gibt es nur begrenzte Methoden zur chemischen Identifizierung von Signalwegen oder Neurotransmittern auf ultrastruktureller Ebene. Eine solche Methode ist die korrelierte Licht- und Elektronenmikroskopie (CLEM)29,30, die jedoch auf einen sehr kleinen Bereich beschränkt ist und nicht in der Lage ist, Verbindungen über den gesamten Signalweg hinweg zu identifizieren. Die Stärken der Pre-Embedding-Immuno-EM liegen in ihrem robusten Signal, ihrer großen Reichweite und ihrer Fähigkeit zur analytischen Positionierung und Verfolgung über große Entfernungen 13,14,15. Diese Methode hat jedoch auch ihre Grenzen, wie z. B. diffuse Signale, die sie weniger spezifisch machen. Für die präzise Lokalisierung von Membranrezeptoren, insbesondere solchen auf der Membran, kann es besser geeignet sein, Immunogold EM nach der Einbettung zu verwenden. Diese Technik ermöglicht die direkte Zählung von Goldpartikeln und erleichtert die Analyse der Anzahl und Variabilität dieser Membranrezeptoren16.
Für die Zukunft ist die Integration von Pre-Embedding Immuno-EM mit Volumen-EM eine vielversprechende Methode für die langfristige Erforschung identifizierter neuronaler Schaltkreise und stellt die Zukunftsperspektiven für die weitere Entwicklung dieser Methode dar. Volume EM konzentriert sich auf die Strukturrekonstruktion und stützt sich bei der Identifizierung spezifischer Strukturen auf die Morphologie, da eine genaue chemische Identifizierung fehlt31,32. Durch die Kombination von Pre-Embedding-Immuno-EM mit Volumen-EM können spezifische Strukturen oder Substanzen während der dreidimensionalen Rekonstruktion identifiziert werden, was einen umfassenderen und visuell intuitiveren Ansatz zur Identifizierung neuronaler Schaltkreise ermöglicht.
Offenlegungen
Die Autoren machen keine Angaben.
Danksagungen
Diese Arbeit wurde teilweise durch Zuschüsse des National Key Research and Development Program of China (2022YFA1105503), des State Key Laboratory of Neuroscience (SKLN-202103) und der Zhejiang Natural Science Foundation of China (Y21H120019) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL syringe needle | kangdelai | ||
| 1% OsO4 | Electron Microscopy Science | 19100 | |
| 2,2,2-Tribromoethanol | Sigma-Aldrich | T48402 | |
| 8% Glutaraldehyde | Electron Microscopy Science | 16020 | |
| 8% Paraformaldehyde | Electron Microscopy Science | 157-8 | |
| Acetone | Electron Microscopy Science | 10000 | |
| Anti-rabbit PKC | Sigma-Aldrich | P4334 | |
| Anti-Rabbit SP | Abcam | ab67006 | |
| DAB Substrate kit | MXB Biotechnologies | KIT-9701/9702/9703 | |
| Elbow scissors | Suzhou66 vision company | 54010 | |
| Electron microscope | Phillips | CM120 | |
| Epon resin | Electron Microscopy Science | 14910 | |
| forcep | Suzhou66 vision company | S101A | |
| Millipore filter paper | Merck Millipore | PR05538 | |
| Na2HPO4· 12H2O | Sigma | 71650 | A component of phosphate buffer |
| NaH2PO4· H2O | Sigma | 71507 | A component of phosphate buffer |
| Picric acid | Electron Microscopy Science | 19550 | |
| Sodium borohydride (NaBH4) | Sigma | 215511 | |
| Tris | Solarbio | 917R071 | |
| Ultramicrotome | Leica | ||
| Uranyl acetate | Electron Microscopy Science | 22400 | |
| VACTASTAIN ABC kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-4001 |
Referenzen
- Chua, N. J., et al. A complete reconstruction of the early visual system of an adult insect. Curr Biol. 33 (21), 4611-4623.e4614 (2023).
- Ravi Chander, P., Hanson, L., Chundekkad, L., Awatramani, G. B. Neural circuits underlying multi-feature extraction in the retina. J Neurosci. , (2023).
- Sirivisoot, S., et al. Development and characterization of mouse anti-canine PD-L1 monoclonal antibodies and their expression in canine tumors by immunohistochemistry in vitro. Vet Q. 43 (1), 1-9 (2023).
- Raeisi, H., et al. Development and characterization of phage display-derived anti-toxin antibodies neutralizing TcdA and TcdB of Clostridioides difficile. Microbiol Spectr. 11 (5), e0531022 (2023).
- Ryschich, A., Dong, Y., Schäfer, M., Ryschich, E., Karakhanova, S. DWH24: A new antibody for fluorescence-based cell death analysis. Methods Appl Fluoresc. 11 (4), (2023).
- Jastrzebska, B., et al. Functional characterization of rhodopsin monomers and dimers in detergents. J Biol Chem. 279 (52), 54663-54675 (2004).
- Huang, P., et al. Mechanism of Shenfu injection in suppressing inflammation and preventing sepsis-induced apoptosis in murine cardiomyocytes based on network pharmacology and experimental validation. J Ethnopharmacol. 322, 117599 (2024).
- Maheshwari, U., et al. Inorganic phosphate exporter heterozygosity in mice leads to brain vascular calcification, microangiopathy, and microgliosis. Brain Pathol. 33 (6), e13189 (2023).
- Mackiewicz, J., et al. Effect of gravity in long-term vitreous tamponade: In vivo investigation using perfluorocarbon liquids and semi-fluorinated alkanes. Graefes Arch Clin Exp Ophthalmol. 245 (5), 665-675 (2007).
- Luján, R., Rubio, M. E. Editorial: Immunoelectron microscopy: Placing molecular functions within a neuronal context. Front Neuroanat. 16, 1043371 (2022).
- Xu, S., et al. Synaptic changes and the response of microglia in a light-induced photoreceptor degeneration model. Mol Vis. 27, 206-220 (2021).
- Chadha, A., Volland, S., Baliaouri, N. V., Tran, E. M., Williams, D. S. The route of the visual receptor rhodopsin along the cilium. J Cell Sci. 132 (10), jcs.229526 (2019).
- Huang, H. J., et al. Multiple nucleocapsid structural forms of shrimp white spot syndrome virus suggests a novel viral morphogenetic pathway. Int J Mol Sci. 24 (8), 7525 (2023).
- Tissarinen, P., et al. Elevated human placental heat shock protein 5 is associated with spontaneous preterm birth. Pediatr Res. 94 (2), 520-529 (2023).
- Huang, Z., et al. A neural tract tracing study on synaptic connections for cortical glutamatergic terminals and cervical spinal calretinin neurons in rats. Front Neural Circuits. 17, 1086873 (2023).
- Zhang, J., Petralia, R. S., Wang, Y. X., Diamond, J. S. High-resolution quantitative immunogold analysis of membrane receptors at retinal ribbon synapses. J Vis Exp. 108, e53547 (2016).
- Ottersen, O. P., Landsend, A. S. Organization of glutamate receptors at the synapse. Eur J Neurosci. 9 (11), 2219-2224 (1997).
- Greferath, U., Grünert, U., Wässle, H. Rod bipolar cells in the mammalian retina show protein kinase C-like immunoreactivity. J Comp Neurol. 301 (3), 433-442 (1990).
- Wang, F., et al. Distribution and synaptic organization of substance P-like immunoreactive neurons in the mouse retina. Brain Struct Funct. 228 (7), 1703-1724 (2023).
- van Opbergen, C. J. M., et al. 34;Orphan" Connexin43 in Plakophilin-2 deficient hearts revealed by volume electron microscopy. Front Cell Dev Biol. 10, 843687 (2022).
- Li, S., et al. Safe and efficient oral allergy immunotherapy using one-pot-prepared mannan-coated allergen nanoparticles. Biomaterials. 303, 122381 (2023).
- Yamashita, K., Kusakabe, M., Sano, M. A simple and rapid method of dissociating hepatocytes from fixed liver of the mouse. Stain Technol. 56 (1), 29-33 (1981).
- Tanabe, T., Shin, M., Fujiwara, K. Immunoelectron microscopy study of polyamines using a newly prepared monoclonal antibody against spermidine: use of a mixture of glutaraldehyde and paraformaldehyde as a cross-linking agent in the preparation of the antigen. J Biochem. 135 (4), 501-507 (2004).
- Xiao, J., et al. Rod bipolar cells receive cone photoreceptor inputs through both invaginating synapses and flat contacts in the mouse and guinea pig retinas. J Comp Neurol. 531 (11), 1184-1197 (2023).
- Yang, Q., et al. Expression of α-Synuclein in the mouse retina is confined to inhibitory presynaptic elements. J Comp Neurol. 531 (10), 1057-1079 (2023).
- Yazulla, S., Studholme, K. M., Zucker, C. L. Synaptic organization of substance P-like immunoreactive amacrine cells in goldfish retina. J Comp Neurol. 231 (2), 232-238 (1985).
- Sassoè-Pognetto, M., Wässle, H., Grünert, U. Glycinergic synapses in the rod pathway of the rat retina: cone bipolar cells express the alpha 1 subunit of the glycine receptor. J Neurosci. 14 (8), 5131-5146 (1994).
- Hartveit, E., et al. Localization and developmental expression of the NMDA receptor subunit NR2A in the mammalian retina. J Comp Neurol. 348 (4), 570-582 (1994).
- Perkins, G. A. The use of miniSOG in the localization of mitochondrial proteins. Methods Enzymol. 547, 165-179 (2014).
- Shu, X., et al. A genetically encoded tag for correlated light and electron microscopy of intact cells, tissues, and organisms. PLoS Biol. 9 (4), e1001041 (2011).
- Kar, D., et al. Volume electron microscopy reveals human retinal mitochondria that align with reflective bands in optical coherence tomography [Invited]. Biomed Opt Express. 14 (10), 5512-5527 (2023).
- Johnson, J. E., et al. Spatiotemporal regulation of ATP and Ca2+ dynamics in vertebrate rod and cone ribbon synapses. Mol Vis. 13, 887-919 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten