Method Article
Studio dei circuiti retinici e della localizzazione molecolare mediante microscopia immunoelettronica pre-incorporata
In questo articolo
Riepilogo
Questo protocollo delinea le fasi dettagliate della microscopia immunoelettronica pre-incorporamento, con particolare attenzione all'esplorazione dei circuiti sinaptici e della localizzazione delle proteine nella retina.
Abstract
La retina comprende numerose cellule che formano diversi circuiti neuronali, che costituiscono il primo stadio del percorso visivo. Ogni circuito è caratterizzato da caratteristiche uniche e neurotrasmettitori distinti, che ne determinano il ruolo e il significato funzionale. Dati gli intricati tipi di cellule all'interno della sua struttura, la complessità dei circuiti neuronali nella retina pone sfide per l'esplorazione. Per studiare meglio i circuiti retinici e il cross-talk, come il legame tra le vie del cono e dei bastoncelli, e la precisa localizzazione molecolare (neurotrasmettitori o neuropeptidi), come la presenza di immunoreattività P-like nella retina del topo, abbiamo impiegato un metodo di microscopia immunoelettronica pre-incorporante (immuno-EM) per esplorare le connessioni sinaptiche e l'organizzazione. Questo approccio ci consente di individuare specifiche connessioni sinaptiche intercellulari e una precisa localizzazione molecolare e potrebbe svolgere un ruolo guida nell'esplorazione della sua funzione. Questo articolo descrive il protocollo, i reagenti utilizzati e i passaggi dettagliati, tra cui (1) preparazione della fissazione della retina, (2) immunocolorazione pre-inclusione e (3) post-fissazione e inclusione.
Introduzione
La complessità dei circuiti neuronali nella retina presenta sfide per l'esplorazione, considerando i diversi tipi di cellule all'interno della sua struttura 1,2. La fase iniziale prevede l'identificazione delle connessioni sinaptiche tra le diverse cellule e la determinazione della localizzazione cellulare di specifici neurotrasmettitori o neuropeptidi. Con l'avanzare della biologia molecolare che introduce nuove proteine, la localizzazione precisa nella retina diventa fondamentale per comprendere le loro funzioni e analizzare i circuiti retinici e le connessioni sinaptiche 3,4,5.
A causa della risoluzione limitata della microscopia ottica, la microscopia elettronica (EM) è comunemente usata per rilevare le strutture subcellulari delle cellule nervose. EM ha varie classificazioni, con la microscopia elettronica a trasmissione convenzionale (TEM) utilizzata per l'osservazione delle ultrastrutture cellulari 6,7,8,9. La microscopia immunoelettronica (immuno-EM), che combina la risoluzione spaziale dell'EM con la capacità di identificazione chimica degli anticorpi che si legano specificamente alle proteine10, si distingue come il metodo ottimale ed esclusivo per studiare le connessioni sinaptiche e la localizzazione delle proteine subcellulari nella retina11,12.
Le tecniche immuno-EM possono essere suddivise in metodi pre-embedding e post-embedding in base all'ordine di inclusione e incubazione degli anticorpi. Rispetto al metodo post-embedding, l'approccio pre-embedding è in grado di identificare su larga scala e a lunga distanza 13,14,15, offrendo un approccio ottimale per lo studio dei processi cellulari come assoni e dendriti. Inoltre, questa tecnica fornisce un segnale forte e un ampio campo visivo, rendendola vantaggiosa per indagini complete sull'espressione proteica e sulla localizzazione molecolare nel citoplasma. Questo metodo si rivela particolarmente prezioso per garantire strutture chimicamente identificate che siano visibili in tutto il citoplasma, nelle cellule o nella retina.
Tuttavia, il metodo post-embedding, pur avendo una penetrazione o una diffusione inferiore rispetto al metodo pre-embedding, non è così sensibile16,17. In parole povere, se l'obiettivo è quello di esplorare la localizzazione di specifici neurotrasmettitori nel citoplasma o nei terminali sinaptici, l'immuno-EM pre-embedding è il metodo preferito. Al contrario, per identificare la localizzazione dei recettori di membrana, è più raccomandato utilizzare l'immunogold EM post-incorporazione.
Alla luce di queste considerazioni, optiamo per il metodo immuno-EM pre-embedding per approfondire i circuiti retinici, compresa l'interazione tra le vie del cono e dei bastoncelli, e la localizzazione molecolare, come la distribuzione e l'organizzazione sinaptica della sostanza immunoreattività P-like (SP-IR) nella retina del topo.
Protocollo
La cura e la gestione degli animali sono state approvate dal regolamento del Comitato etico dell'Università di medicina di Wenzhou in conformità con le linee guida ARVO. In questa ricerca sono stati utilizzati topi adulti (C57BL/6J, maschio e femmina, da 8 a 12 settimane di età). L'attrezzatura e i reagenti necessari per lo studio sono elencati nella tabella dei materiali.
1. Preparazione per la fissazione della retina
- Assembla i seguenti materiali e strumenti: un microscopio da dissezione, due pinze con punte molto sottili, forbici, un ago per siringa da 1 ml (misura dell'ago: G26) e carta da filtro.
- Anestetizzare profondamente i topi mediante iniezione intraperitoneale di 2,2,2-tribromoetanolo a 0,25 mg/g di peso corporeo. Successivamente, decapitare i topi e tagliare loro la testa16.
- Enucleare i loro occhi con le forbici del gomito e metterli in un piatto di vetro contenente il 4% di paraformaldeide-0,2% di acido picrico in tampone fosfato 0,1 M (PB; pH 7,4).
- Al microscopio da dissezione, praticare un foro nel limbus corneale utilizzando un ago da siringa da 1 ml e tagliare il segmento anteriore con le forbici, seguendo il foro. Quindi, rimuovere la lente dalla superficie retinica interna con una pinza.
- Utilizzare due pinze per staccare con cura la sclera fino a quando la retina non è completamente isolata dall'oculare (il tessuto della retina coppuscolare si è separato completamente dalla coroide). Successivamente, tagliare la retina in quattro pezzi.
- Fissare queste sezioni in paraformaldeide al 4% e acido picrico allo 0,2% in 0,1 M PB (pH 7,4) per 2 ore a temperatura ambiente (RT), quindi trasferire il tessuto in paraformaldeide al 4% in 0,1 M PB (pH 10,4) per una notte a 4 °C.
2. Immunocolorazione pre-inclusione
- Dopo il lavaggio in PBS 0,01 M (pH 7,4) sei volte per 10 minuti ciascuna, incubare i tessuti retinici in boroidruro di sodio all'1% (NaBH4) in PBS 0,01 M (pH 7,4) per 30 minuti.
- Lavare le sezioni retiniche con 0,01 M PBS (pH 7,4) almeno sei volte. Nel frattempo, rimuovere il vitreo con carta da filtro e poi tagliare la retina a fette piccole tra 100-300 μm utilizzando una lametta a doppio taglio.
- Dopo il blocco con siero di capra normale al 5% (NGS) a 0,1 M PB (pH 7,4) per 1 ora a RT, incubare le fette di retina con anticorpi primari (Anti-rabbit PKCα, 1:80; Anti-Rabbit SP, 1:100) insieme al 2% di NGS in 0,01 M PBS (pH 7,4) per 2 ore a RT su un agitatore. Successivamente, incubare per 96 ore (5 giorni) a 4 °C su un agitatore.
- Dopo aver lavato sei volte per 10 minuti ciascuna in 0,01 M PBS (pH 7,4), incubare le fette di retina con l'anticorpo secondario a 1:200, come IgG anti-coniglio di capra, insieme al 2% di NGS in 0,01 M PBS (pH 7,4) per 2 ore a RT su uno shaker. Quindi, incubare per 48 ore (2 giorni) a 4 °C su uno shaker.
NOTA: Gli anticorpi secondari sono stati applicati da soli negli esperimenti di controllo. - Lavare le strisce retiniche in 0,01 M PBS (pH 7,4) sei volte per 10 minuti ciascuna prima di incubare con il reagente A e il reagente B del kit ABC a 1:100 in 0,01 M PBS (pH 7,4) per 2 giorni a 4°C. (Sia il reagente A che il reagente B sono stati diluiti con 0,01 M di PBS. Ad esempio: Una soluzione: 6 μl; Soluzione B: 6 μl; 0,01 M PBS: 588 μl, totale 600 μl).
- Lavare le strisce retiniche in tampone Tris 0,05 M (pH 7,2) tre volte per 10 minuti ciascuna. Quindi, pre-incubare le strisce retiniche con il 5% di reagente 1 e il 5% di reagente 3 del kit DAB in acqua distillata per 1 ora a temperatura ambiente. (Il rapporto ad esempio: reagente 1: 50 μl; reagente 3: 50 μl; acqua distillata: 900 μl, totale di 1000 μl).
- Colorare le strisce retiniche con DAB. Aggiungere in sequenza lo stesso volume di soluzione da tre provette del kit DAB (reagente 1-reagente 2-reagente 3). Osservare lo stato di colorazione utilizzando il microscopio di dissezione. Fermare la colorazione quando le cellule diventano marroni; Questo processo richiede 10-20 minuti.
- Lavare le strisce retiniche con tampone Tris 0,05 M (pH 7,2) tre volte per 10 minuti ciascuna e quindi lavare con PBS 0,01 M sei volte per 10 minuti ciascuna.
3. Post-fissazione e inclusione
- Fissare le strisce retiniche in glutaraldeide al 2% per 1-2 ore a temperatura ambiente (RT), quindi lavare con 0,01 M PBS (pH 7,4) sei volte per 10 minuti ciascuna.
- Incubare le strisce retiniche con tetrossido di osmio all'1% (OsO4) in 0,1 M PB per 1 ora a RT e conservarle in un luogo buio.
- Dopo il lavaggio in acqua distillata (ddH2O) sei volte per 10 minuti ciascuna, incubare i tessuti retinici con acetato di uranile per 1 ora a RT e tenerli in un luogo buio per colorare questi tessuti.
- Mettere i tessuti retinici in soluzioni di acetone (50%, 70%, 80% e 90%) per 10 minuti ciascuna, quindi al 100% due volte per 10 minuti ciascuna.
- Immergere i tessuti retinici in una miscela contenente lo stesso volume di acetato di uranile e una resina epossidica per 1 ora in forno di essiccazione a 37 °C, seguita da una miscela contenente acetato di uranile e resina (1:4) per una notte in forno di essiccazione a 37 °C.
- Trasferire delicatamente i tessuti retinici con uno stuzzicadenti nella nuova resina per 1 ora a 45 °C in un forno di essiccazione, quindi la striscia retinica orientata viene incorporata nella piastra di inclusione con la resina.
- Mettere il campione in una stufa di essiccazione a 45 °C per 3 ore e in una stufa a 65 °C per 48 ore.
- Modellare i blocchi di inclusione in trapezi e tagliare il blocco in sezioni spesse 1 μm con un ultramicrotomo, colorare queste sezioni con blu di toluidina e preselezionare le regioni di interesse al microscopio ottico.
- Raccogli sezioni ultrasottili (70-90 nm) su griglie di rame e visualizzale al microscopio elettronico.
Risultati
La Figura 1 mostra esempi di esperimenti di controllo senza l'incubazione di anticorpi primari contro la proteina chinasi C alfa (PKCα) o SP, in cui non è stata trovata alcuna immunoreattività (IR).
La Figura 2 illustra la PKCα-IR nella retina del topo. PKCα funge da marcatore per tutte le cellule bipolari dei bastoncelli (RBC) nella retina18. A livello di microscopia elettronica (EM), i globuli rossi possono essere identificati attraverso PKCα-IR, visualizzati dal prodotto di reazione della diaminobenzidina (DAB) ad alta densità elettronica. La Figura 2A illustra un dendrite di globuli rossi PKCα-positivo che forma una sinapsi con un terminale a bastoncello nello strato plessiforme esterno (OPL), mentre la Figura 2B mostra una sinapsi cono-globuli rossi in cui un dendrite di globuli rossi PKCα-positivo è post-sinaptico a un terminale a cono. Inoltre, il prodotto di reazione DAB aiuta a identificare i terminali dei globuli rossi (Figura 2C) e i processi assonali (Figura 2D) nello strato plessiforme interno (IPL).
La Figura 3 mostra l'espressione della sostanza P (SP) nelle connessioni pre e post-sinaptiche nell'IPL della retina del topo. Le cellule amacrine SP-IR sono presinaptiche alle cellule amacrine SP-negative (Figura 3A) così come i processi amacrini SP-IR (dati non mostrati). Inoltre, le cellule amacrine SP-IR sono terminali post-sinaptici-bipolari rispettivamente nei livelli di IPL del sottostrato 3 (S3) e del sottostrato 5 (S5) (Figura 3B, C). La nostra ricerca precedente descrive in dettaglio l'analisi delle sinapsi in cui i processi delle cellule amacrine SP-IR formano output sinaptici su altri processi nell'IPL19. In particolare, la localizzazione subcellulare di SP si trova principalmente nelle vescicole sinaptiche nei terminali presinaptici (Figura 3).
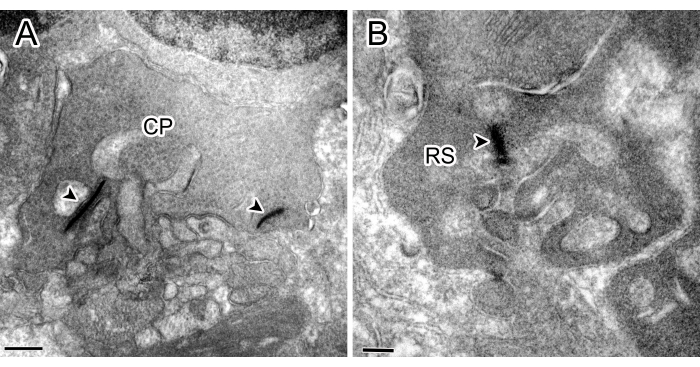
Figura 1: Micrografie immunoelettroniche da esperimenti di controllo. Sia il peduncolo conico (CP) con due nastri (punta di freccia) (A) che la sferule dell'asta (RS) con un nastro nell'OPL (B) non hanno mostrato macchie. Barre della scala: 500 nm (A), 200 nm (B). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Micrografie immunoelettroniche marcate con l'anticorpo PKCα nella retina del topo. (A) RS si connette con un RBC PKCα-positivo (le frecce indicano immunoreattività) e due cellule orizzontali (H) nell'OPL. (B) CP si connette con i globuli rossi PKCα-positivi nell'OPL. (C) e (D) mostrano rispettivamente il processo terminale e assonale dei globuli rossi PKCα-positivo nell'IPL. Barre della scala: 200 nm (A), 500 nm (B), 500 nm (C), 500 nm (D). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Micrografie immunoelettroniche marcate con anticorpi SP nell'IPL della retina di topo. (A) La cellula amacrina SP-IR (A+) è presinaptica a una cellula amacrina SP-negativa (A-). Le cellule amacrine SP-IR hanno ricevuto input dai terminali bipolari rispettivamente nei livelli S3 (B) e S5 (C) di IPL. Barre della scala: 200 nm (A), 200 nm (B), 200 nm (C). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo articolo ha descritto tre passaggi critici per il successo dell'osservazione dei circuiti sinaptici e della localizzazione delle proteine: (1) fissazione rapida e debole, (2) immunocolorazione pre-inclusione e (3) post-fissazione e inclusione.
Proponiamo che la fissazione sia il passo chiave per un approccio immuno-EM pre-incorporamento di successo. Pertanto, qui viene sottolineata l'importanza del fissativo fresco e della fissazione rapida, denominando questo principio "principio 4F", che è fondamentale nella preparazione dei tessuti. Tuttavia, ottenere sia una maggiore penetrazione degli anticorpi che una fissazione efficace rappresenta una sfida20. Per risolvere questo problema, la glutaraldeide è stata sostituita con acido picrico durante la fissazione iniziale per migliorare la penetrazione degli anticorpi, poiché la glutaraldeide può interrompere i determinanti antigenici e influenzare l'immunocolorazione21. L'acido picrico, al contrario, preserva meglio la struttura della membrana e l'integrità dei tessuti22, anche se con un compromesso nell'efficacia della fissazione. Nella terza fase, è stata utilizzata una glutaraldeide al 2% per la post-fissazione per ottimizzare la fissazione dei tessuti.
I punti chiave del protocollo qui presentato includono cinque fasi: (1) Fissazione precoce: utilizzo dell'acido picrico nella fase iniziale per una migliore penetrazione degli anticorpi, riducendo al minimo l'interruzione dei determinanti antigenici. (2) Post-fissazione: utilizzo di glutaraldeide al 2% per migliorare la fissazione dei tessuti dopo l'immunocolorazione. (3) Trattamento di riduzione: incubazione di tessuto in NaBHall'1% 4 in 0,1 M PB (pH 7,4) per 30 minuti per ripristinare gran parte dell'immunoreattività e migliorare la reattività immunitaria di antigeni e anticorpi, intensificando i segnali positivi23. (4) Preparazione del tessuto: rimozione del vitreo e taglio del tessuto retinico in piccole strisce per facilitare un'efficace incubazione degli anticorpi e garantire segnali uniformi. (5) Inoltre, è imperativo maneggiare il tessuto retinico con la massima cura, evitando danni che potrebbero compromettere le osservazioni successive durante l'intera procedura. Queste misure contribuiscono collettivamente al successo del metodo immuno-EM pre-embedding, consentendo di studiare diversi aspetti come le sinapsi cono-globuli rossi24, la localizzazione molecolare SP-IR19 e l'espressione precisa di α-Syn nella retina del topo25.
Prima di incubare il primo anticorpo, è essenziale bloccare le strisce retiniche con il 2% di NGS per eliminare l'interferenza del segnale non specifica. La concentrazione del primo anticorpo deve essere determinata in base all'anticorpo stesso, in genere superiore a quella utilizzata per la colorazione della sezione congelata, e deve essere ottimizzata in anticipo. Durante il periodo di incubazione dell'anticorpo primario, è necessaria una rotazione continua della provetta per microcentrifuga per garantire il pieno contatto delle strisce retiniche impilate con l'anticorpo, impedendo la penetrazione incompleta delle parti impilate. Per amplificare il segnale, il DAB è stato pre-incubato prima della colorazione DAB standard, con un tempo di colorazione specifico che variava tipicamente da 10 a 20 minuti. Se il tempo è troppo breve, il segnale potrebbe essere troppo debole per l'osservazione e, se è troppo lungo, può portare a falsi segnali positivi, influenzando l'accuratezza del giudizio. Generalmente, il tempo di incubazione dei coloranti dipende direttamente dal colore della superficie del tessuto (dal marrone al marrone scuro).
Mentre gli esperimenti sono stati eseguiti con il congelamento del tessuto in azoto liquido per migliorare il segnale, come menzionato in precedenza 18,26,27, questo metodo ha amplificato i segnali positivi ma ha portato a una scarsa struttura della membrana delle cellule retiniche (dati non mostrati). Questo degrado strutturale ha reso difficile identificare con precisione i tipi di cellule. Considerando ciò, il tessuto retinico non è stato congelato ripetutamente. Per migliorare il segnale positivo, il tempo di incubazione degli anticorpi è stato opportunamente esteso. Il protocollo proposto combina i vantaggi precedenti, semplificando i passaggi rispetto all'inclusione in agar. Questo non solo salvaguarda i determinanti antigenici delle proteine, ma preserva anche l'integrità delle membrane cellulari. L'obiettivo generale è quello di esplorare le connessioni sinaptiche e la localizzazione cellulare dei neurotrasmettitori lungo l'intero percorso. Pertanto, i prodotti di reazione DAB nel protocollo non sono stati sottoposti a trattamento di intensificazione dell'argento, il che lo rende più adatto per studiare le connessioni e le vie sinaptiche specifiche del neurotrasmettitore28.
Attualmente, esistono metodi limitati per l'identificazione chimica di percorsi o neurotrasmettitori a livello ultrastrutturale. Uno di questi metodi è la microscopia elettronica e ottica correlata (CLEM)29,30, che, tuttavia, è confinata in un'area molto piccola e manca della capacità di identificare le connessioni lungo l'intero percorso. I punti di forza dell'immuno-EM pre-incorporato risiedono nel suo segnale robusto, nell'ampia portata e nella capacità di posizionamento e tracciamento analitico a lunga distanza 13,14,15. Tuttavia, questo metodo ha anche i suoi limiti, come i segnali diffusi, che li rendono meno specifici. Per la localizzazione precisa dei recettori di membrana, in particolare quelli sulla membrana, può essere più adatto utilizzare immunogold EM post-incorporazione. Questa tecnica consente il conteggio diretto delle particelle d'oro, facilitando l'analisi del numero e della variabilità di questi recettori di membrana16.
In futuro, l'integrazione dell'immuno-EM pre-incorporante con l'EM di volume è un metodo efficace per l'esplorazione a lungo termine di circuiti neurali identificati, rappresentando le prospettive future per un ulteriore sviluppo di questo metodo. Volume EM si concentra sulla ricostruzione della struttura, basandosi sulla morfologia per l'identificazione di strutture specifiche, prive di un'identificazione chimica precisa31,32. Combinando l'immuno-EM pre-incorporante con l'EM volumetrico, è possibile identificare strutture o sostanze specifiche durante la ricostruzione tridimensionale, fornendo un approccio più completo e visivamente intuitivo all'identificazione dei circuiti neurali.
Divulgazioni
Gli autori non hanno divulgazioni.
Riconoscimenti
Questo lavoro è stato sostenuto in parte da sovvenzioni del National Key Research and Development Program of China (2022YFA1105503), dello State Key Laboratory of Neuroscience (SKLN-202103), della Zhejiang Natural Science Foundation of China (Y21H120019).
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL syringe needle | kangdelai | ||
| 1% OsO4 | Electron Microscopy Science | 19100 | |
| 2,2,2-Tribromoethanol | Sigma-Aldrich | T48402 | |
| 8% Glutaraldehyde | Electron Microscopy Science | 16020 | |
| 8% Paraformaldehyde | Electron Microscopy Science | 157-8 | |
| Acetone | Electron Microscopy Science | 10000 | |
| Anti-rabbit PKC | Sigma-Aldrich | P4334 | |
| Anti-Rabbit SP | Abcam | ab67006 | |
| DAB Substrate kit | MXB Biotechnologies | KIT-9701/9702/9703 | |
| Elbow scissors | Suzhou66 vision company | 54010 | |
| Electron microscope | Phillips | CM120 | |
| Epon resin | Electron Microscopy Science | 14910 | |
| forcep | Suzhou66 vision company | S101A | |
| Millipore filter paper | Merck Millipore | PR05538 | |
| Na2HPO4· 12H2O | Sigma | 71650 | A component of phosphate buffer |
| NaH2PO4· H2O | Sigma | 71507 | A component of phosphate buffer |
| Picric acid | Electron Microscopy Science | 19550 | |
| Sodium borohydride (NaBH4) | Sigma | 215511 | |
| Tris | Solarbio | 917R071 | |
| Ultramicrotome | Leica | ||
| Uranyl acetate | Electron Microscopy Science | 22400 | |
| VACTASTAIN ABC kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-4001 |
Riferimenti
- Chua, N. J., et al. A complete reconstruction of the early visual system of an adult insect. Curr Biol. 33 (21), 4611-4623.e4614 (2023).
- Ravi Chander, P., Hanson, L., Chundekkad, L., Awatramani, G. B. Neural circuits underlying multi-feature extraction in the retina. J Neurosci. , (2023).
- Sirivisoot, S., et al. Development and characterization of mouse anti-canine PD-L1 monoclonal antibodies and their expression in canine tumors by immunohistochemistry in vitro. Vet Q. 43 (1), 1-9 (2023).
- Raeisi, H., et al. Development and characterization of phage display-derived anti-toxin antibodies neutralizing TcdA and TcdB of Clostridioides difficile. Microbiol Spectr. 11 (5), e0531022 (2023).
- Ryschich, A., Dong, Y., Schäfer, M., Ryschich, E., Karakhanova, S. DWH24: A new antibody for fluorescence-based cell death analysis. Methods Appl Fluoresc. 11 (4), (2023).
- Jastrzebska, B., et al. Functional characterization of rhodopsin monomers and dimers in detergents. J Biol Chem. 279 (52), 54663-54675 (2004).
- Huang, P., et al. Mechanism of Shenfu injection in suppressing inflammation and preventing sepsis-induced apoptosis in murine cardiomyocytes based on network pharmacology and experimental validation. J Ethnopharmacol. 322, 117599 (2024).
- Maheshwari, U., et al. Inorganic phosphate exporter heterozygosity in mice leads to brain vascular calcification, microangiopathy, and microgliosis. Brain Pathol. 33 (6), e13189 (2023).
- Mackiewicz, J., et al. Effect of gravity in long-term vitreous tamponade: In vivo investigation using perfluorocarbon liquids and semi-fluorinated alkanes. Graefes Arch Clin Exp Ophthalmol. 245 (5), 665-675 (2007).
- Luján, R., Rubio, M. E. Editorial: Immunoelectron microscopy: Placing molecular functions within a neuronal context. Front Neuroanat. 16, 1043371 (2022).
- Xu, S., et al. Synaptic changes and the response of microglia in a light-induced photoreceptor degeneration model. Mol Vis. 27, 206-220 (2021).
- Chadha, A., Volland, S., Baliaouri, N. V., Tran, E. M., Williams, D. S. The route of the visual receptor rhodopsin along the cilium. J Cell Sci. 132 (10), jcs.229526 (2019).
- Huang, H. J., et al. Multiple nucleocapsid structural forms of shrimp white spot syndrome virus suggests a novel viral morphogenetic pathway. Int J Mol Sci. 24 (8), 7525 (2023).
- Tissarinen, P., et al. Elevated human placental heat shock protein 5 is associated with spontaneous preterm birth. Pediatr Res. 94 (2), 520-529 (2023).
- Huang, Z., et al. A neural tract tracing study on synaptic connections for cortical glutamatergic terminals and cervical spinal calretinin neurons in rats. Front Neural Circuits. 17, 1086873 (2023).
- Zhang, J., Petralia, R. S., Wang, Y. X., Diamond, J. S. High-resolution quantitative immunogold analysis of membrane receptors at retinal ribbon synapses. J Vis Exp. 108, e53547 (2016).
- Ottersen, O. P., Landsend, A. S. Organization of glutamate receptors at the synapse. Eur J Neurosci. 9 (11), 2219-2224 (1997).
- Greferath, U., Grünert, U., Wässle, H. Rod bipolar cells in the mammalian retina show protein kinase C-like immunoreactivity. J Comp Neurol. 301 (3), 433-442 (1990).
- Wang, F., et al. Distribution and synaptic organization of substance P-like immunoreactive neurons in the mouse retina. Brain Struct Funct. 228 (7), 1703-1724 (2023).
- van Opbergen, C. J. M., et al. 34;Orphan" Connexin43 in Plakophilin-2 deficient hearts revealed by volume electron microscopy. Front Cell Dev Biol. 10, 843687 (2022).
- Li, S., et al. Safe and efficient oral allergy immunotherapy using one-pot-prepared mannan-coated allergen nanoparticles. Biomaterials. 303, 122381 (2023).
- Yamashita, K., Kusakabe, M., Sano, M. A simple and rapid method of dissociating hepatocytes from fixed liver of the mouse. Stain Technol. 56 (1), 29-33 (1981).
- Tanabe, T., Shin, M., Fujiwara, K. Immunoelectron microscopy study of polyamines using a newly prepared monoclonal antibody against spermidine: use of a mixture of glutaraldehyde and paraformaldehyde as a cross-linking agent in the preparation of the antigen. J Biochem. 135 (4), 501-507 (2004).
- Xiao, J., et al. Rod bipolar cells receive cone photoreceptor inputs through both invaginating synapses and flat contacts in the mouse and guinea pig retinas. J Comp Neurol. 531 (11), 1184-1197 (2023).
- Yang, Q., et al. Expression of α-Synuclein in the mouse retina is confined to inhibitory presynaptic elements. J Comp Neurol. 531 (10), 1057-1079 (2023).
- Yazulla, S., Studholme, K. M., Zucker, C. L. Synaptic organization of substance P-like immunoreactive amacrine cells in goldfish retina. J Comp Neurol. 231 (2), 232-238 (1985).
- Sassoè-Pognetto, M., Wässle, H., Grünert, U. Glycinergic synapses in the rod pathway of the rat retina: cone bipolar cells express the alpha 1 subunit of the glycine receptor. J Neurosci. 14 (8), 5131-5146 (1994).
- Hartveit, E., et al. Localization and developmental expression of the NMDA receptor subunit NR2A in the mammalian retina. J Comp Neurol. 348 (4), 570-582 (1994).
- Perkins, G. A. The use of miniSOG in the localization of mitochondrial proteins. Methods Enzymol. 547, 165-179 (2014).
- Shu, X., et al. A genetically encoded tag for correlated light and electron microscopy of intact cells, tissues, and organisms. PLoS Biol. 9 (4), e1001041 (2011).
- Kar, D., et al. Volume electron microscopy reveals human retinal mitochondria that align with reflective bands in optical coherence tomography [Invited]. Biomed Opt Express. 14 (10), 5512-5527 (2023).
- Johnson, J. E., et al. Spatiotemporal regulation of ATP and Ca2+ dynamics in vertebrate rod and cone ribbon synapses. Mol Vis. 13, 887-919 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon