Method Article
通过预包埋免疫电子显微镜研究视网膜回路和分子定位
摘要
该协议概述了预嵌入免疫电子显微镜检查的详细步骤,重点是探索视网膜中的突触回路和蛋白质定位。
摘要
视网膜由许多细胞组成,形成不同的神经元回路,构成视觉通路的第一阶段。每个回路都具有独特的特征和不同的神经递质,决定了它的作用和功能意义。鉴于其结构内错综复杂的细胞类型,视网膜中神经元回路的复杂性为探索带来了挑战。为了更好地研究视网膜回路和串扰,例如视锥细胞和视杆通路之间的联系,以及精确的分子定位(神经递质或神经肽),例如小鼠视网膜中存在 P 物质样免疫反应性,我们采用了预嵌入免疫电子显微镜 (immuno-EM) 方法来探索突触连接和组织。这种方法使我们能够确定特定的细胞间突触连接和精确的分子定位,并且可以在探索其功能方面发挥指导作用。本文介绍了实验步骤、使用的试剂和详细步骤,包括 (1) 视网膜固定准备,(2) 包埋前免疫染色,以及 (3) 固定后和包埋。
引言
考虑到其结构中的多种细胞类型,视网膜中神经元回路的复杂性为探索带来了挑战 1,2。第一步包括识别不同细胞之间的突触连接并确定特定神经递质或神经肽的细胞定位。随着分子生物学的进步引入新的蛋白质,在视网膜中的精确定位对于了解其功能以及分析视网膜回路和突触连接变得至关重要 3,4,5。
由于光学显微镜的分辨率有限,电子显微镜 (EM) 通常用于检测神经细胞的亚细胞结构。EM 有多种分类,传统的透射电子显微镜 (TEM) 用于观察细胞超微结构 6,7,8,9。免疫电子显微镜 (immuno-EM) 将 EM 的空间分辨率与特异性结合蛋白质的抗体的化学鉴定能力相结合10,是研究视网膜中突触连接和亚细胞蛋白定位的最佳和唯一方法11,12。
免疫电镜技术根据包埋和抗体孵育的顺序可分为预包埋和后包埋方法。与后嵌入方法相比,预嵌入方法能够进行大规模和远距离识别 13,14,15,为研究轴突和树突等细胞过程提供了最佳方法。此外,该技术提供了强信号和宽视野,使其有利于全面研究细胞质中的蛋白质表达和分子定位。事实证明,这种方法在确保化学鉴定结构在整个细胞质、细胞或视网膜中可见方面特别有价值。
然而,后嵌入方法虽然与预嵌入方法相比具有较低的渗透或扩散,但不那么敏感16,17。简单来说,如果目标是探索特定神经递质在细胞质或突触末梢中的定位,则预嵌入免疫电镜是首选方法。相反,为了鉴定膜受体的定位,更建议使用包埋后免疫金 EM。
鉴于这些考虑,我们选择预嵌入免疫电镜方法来深入研究视网膜回路,包括视锥细胞和视杆细胞通路之间的相互作用,以及分子定位,例如 P 物质免疫反应性 (SP-IR) 在小鼠视网膜中的分布和突触组织。
研究方案
根据 ARVO 指南,温州医科大学伦理委员会法规批准了动物的护理和处理。本研究使用成年小鼠 (C57BL/6J,雄性和雌性,8 至 12 周龄)。研究所需的设备和试剂列在 材料表中。
1. 视网膜固定的准备
- 组装以下材料和工具:解剖显微镜、两个带有非常细尖端的镊子、剪刀、1 mL 注射器针头(针头尺寸:G26)和滤纸。
- 通过腹膜内注射 0.25 mg/g 体重的 2,2,2-三溴乙醇对小鼠进行深度麻醉。随后,将老鼠斩首并切开它们的头16.
- 用肘部剪刀摘除眼睛,并将其放入含有 4% 多聚甲醛-0.2% 苦味酸和 0.1 M 磷酸盐缓冲液 (PB;pH 7.4) 的玻璃皿中。
- 在解剖显微镜下,使用 1 mL 注射器针头在角膜缘上打一个孔,然后用剪刀沿着孔切掉眼前段。然后,用镊子从视网膜内表面取下晶状体。
- 用两把镊子小心地剥开巩膜,直到视网膜与眼罩完全分离(丘比视网膜组织与脉络膜完全分离)。随后,将视网膜切成四块。
- 在室温 (RT) 下将这些切片在 0.1 M PB (pH 7.4) 中的 4% 多聚甲醛-0.2% 苦味酸中固定 2 小时,然后将组织转移到 0.1 M PB (pH 10.4) 中的 4% 多聚甲醛中过夜。
2. 预包埋免疫染色
- 在 0.01 M PBS (pH 7.4) 中洗涤 6 次,每次 10 分钟后,将视网膜组织在 1% 硼氢化钠 (NaBH4) 中在 0.01 M PBS (pH 7.4) 中孵育 30 分钟。
- 在 0.01 M PBS (pH 7.4) 中洗涤视网膜切片至少六次。同时,用滤纸去除玻璃体,然后使用双刃剃须刀片将视网膜切成 100-300 μm 之间的小片。
- 在 RT 下用 0.1 M PB (pH 7.4) 中的 5% 正常山羊血清 (NGS) 封闭 1 小时后,将视网膜切片与一抗(抗兔 PKCα,1:80;抗兔 SP,1:100)以及 2% NGS 的 0.01 M PBS (pH 7.4) 溶液,在摇床上室温下放置 2 小时。随后,在 4 °C 下在摇床上孵育 96 小时(5 天)。
- 在 0.01 M PBS(pH 7.4)中洗涤 6 次,每次 10 分钟后,将视网膜切片与 1:200 的二抗(例如山羊抗兔 IgG)以及 2% NGS 在 0.01 M PBS(pH 7.4)中孵育 2 小时在室温下在摇床上。接下来,在 4 °C 下在摇床上孵育 48 小时(2 天)。
注:在对照实验中单独使用二抗。 - 在 0.01 M PBS (pH 7.4) 中洗涤视黄醛条纹 6 次,每次 10 分钟,然后与 ABC 试剂盒中的试剂 A 和试剂 B 在 0.01M PBS (pH 7.4) 中以 1:100 的比例在 4°C 下孵育 2 天。 (试剂 A 和试剂 B 均用 0.01 M PBS 稀释。例如:A 溶液:6 μl;B 溶液:6 μl;0.01 M PBS:588 μl,共 600 μl)。
- 在 0.05 M Tris 缓冲液 (pH 7.2) 中洗涤视网膜条纹 3 次,每次 10 分钟。然后,将视网膜条纹与 DAB 试剂盒中的 5% 试剂 1 和 5% 试剂 3 在蒸馏水中在室温下预孵育 1 小时。(比例例如:试剂 1:50 μl;试剂 3:50 μl;蒸馏水:900 μl,总共 1000 μl)。
- 用 DAB 对视网膜条纹进行染色。依次从 DAB 试剂盒中的三个试管中加入相同体积的溶液(试剂 1-试剂 2-试剂 3)。使用解剖显微镜观察染色情况。当细胞变成棕色时停止染色;此过程需要 10-20 分钟。
- 用 0.05 M Tris 缓冲液 (pH 7.2) 洗涤视网膜条纹 3 次,每次 10 分钟,然后在 0.01 M PBS 中洗涤 6 次,每次 10 分钟。
3. 固定后和包埋
- 在室温 (RT) 下将视网膜条纹在 2% 戊二醛中固定 1-2 小时,然后在 0.01 M PBS (pH 7.4) 中洗涤 6 次,每次 10 分钟。
- 将视网膜条纹与 1% 四氧化锇 (OsO4) 在 0.1 M PB 中在 RT 下孵育 1 小时,并将它们保存在黑暗处。
- 在蒸馏水 (ddH2O) 中洗涤 6 次,每次 10 分钟后,将视网膜组织与乙酸铀酰在 RT 下孵育 1 小时,并将它们保存在黑暗处以染色这些组织。
- 将视黄醛组织放入丙酮溶液(50%、70%、80% 和 90%)中,每次 10 分钟,然后放入 100% 中两次,每次 10 分钟。
- 将视网膜组织在含有相同体积的乙酸铀酰和环氧树脂的混合物中,在37°C干燥箱中浸泡1小时,然后将含有乙酸铀酰和树脂(1:4)的混合物在37°C干燥箱中浸泡过夜。
- 用牙签将视网膜组织在干燥箱中于 45 °C 轻轻转移到新树脂中 1 小时,然后将定向的视网膜条纹与树脂一起嵌入包埋板中。
- 将样品放入 45 °C 干燥箱中 3 小时,在 65 °C 干燥箱中放置 48 小时。
- 将包埋块塑造成梯形,用超薄切片机将块切成 1 μm 厚的切片,用甲苯胺蓝染色这些切片,并在光学显微镜下预筛选感兴趣的区域。
- 在铜网格上收集超薄切片 (70-90 nm) 并在电子显微镜下观察它们。
结果
图 1 显示了未孵育针对蛋白激酶 C α (PKCα) 或 SP 的一抗的对照实验示例,其中未发现免疫反应性 (IR)。
图 2 描绘了小鼠视网膜中的 PKCα-IR。PKCα 是视网膜中所有杆状双极细胞 (RBC) 的标志物18。在电子显微镜 (EM) 水平上,可以通过 PKCα-IR 识别 RBC,并通过具有高电子密度的二氨基联苯胺 (DAB) 反应产物进行可视化。 图 2A 显示了 PKCα 阳性 RBC 树突与外丛状层 (OPL) 中的杆状末端形成突触,而 图 2B 显示了一个锥形 RBC 突触,其中 PKCα 阳性 RBC 树突在突触后到锥形末端。此外,DAB 反应产物有助于识别内丛状层 (IPL) 中的 RBC 末端(图 2C)和轴突过程(图 2D)。
图 3 显示了小鼠视网膜 IPL 中突触前和突触后连接中 P 物质 (SP) 的表达。SP-IR 无长突细胞是 SP 阴性无长突细胞的突触前(图 3A)以及 SP-IR 无长突过程(数据未显示)。此外,SP-IR 无长突细胞分别在 IPL 的亚层 3 (S3) 和亚层 5 (S5) 水平中处于突触后至双极末端(图 3B、C)。我们之前的研究详细介绍了 SP-IR 无长突细胞过程形成突触输出到 IPL19 中其他过程的突触分析。值得注意的是,SP 的亚细胞定位主要存在于突触前末梢的突触小泡中(图 3)。
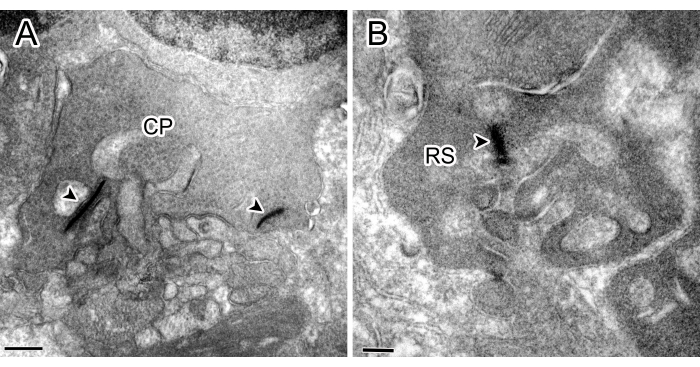
图 1:来自对照实验的免疫电子显微镜照片。OPL (B) 中带有两条带状物的锥形椎弓根 (CP) (CP) 和带有一条条带状物的杆状球状体 (RS) 均未显示染色。比例尺:500 nm (A)、200 nm (B)。请单击此处查看此图的较大版本。

图 2:小鼠视网膜中用 PKCα 抗体标记的免疫电子显微照片。 (A) RS 与 OPL 中的一个 PKCα 阳性红细胞(箭头表示免疫反应性)和两个水平细胞 (H) 相连。(B) CP 与 OPL 中的 PKCα 阳性 RBC 连接。(C) 和 (D) 分别显示了 IPL 中 PKCα 阳性的 RBC 末端和轴突过程。比例尺:200 nm (A)、500 nm (B)、500 nm (C)、500 nm (D)。 请单击此处查看此图的较大版本。

图 3:在小鼠视网膜的 IPL 中用 SP 抗体标记的免疫电子显微照片。 (A) SP-IR 无长突细胞 (A+) 与 SP 阴性无长突细胞 (A-) 处于突触前。SP-IR 无长突细胞分别在 IPL 的 S3 (B) 和 S5 (C) 水平接收来自双极末端的输入。比例尺:200 nm (A)、200 nm (B)、200 nm (C)。 请单击此处查看此图的较大版本。
讨论
本文描述了成功观察突触回路和蛋白质定位的三个关键步骤:(1) 快速和弱固定,(2) 包埋前免疫染色,以及 (3) 固定后和包埋。
我们提出固定是成功的预嵌入免疫 EM 方法的关键步骤。因此,这里强调了新鲜固定剂和快速固定的重要性,并将该原理命名为“4F 原则”,这在组织制备中至关重要。然而,同时实现增强的抗体渗透和有效固定是一项挑战20。为了解决这个问题,在初始固定期间用苦味酸代替戊二醛以提高抗体渗透性,因为戊二醛会破坏抗原决定簇并影响免疫染色21。相比之下,苦味酸更好地保持膜结构和组织完整性22,尽管在固定功效方面有所妥协。第三步,使用 2% 戊二醛进行固定后,以优化组织固定。
此处介绍的方案的要点包括五个步骤:(1) 早期固定:在早期利用苦味酸以获得更好的抗体渗透,同时最大限度地减少对抗原决定簇的破坏。(2) 固定后:免疫染色后使用 2% 戊二醛增强组织固定。(3) 还原处理:将组织在 0.1 M PB (pH 7.4) 中的 1% NaBH4 中孵育 30 分钟,以恢复大部分免疫反应性并提高抗原和抗体的免疫反应性,增强阳性信号23。(4) 组织制备:去除玻璃体并将视网膜组织切割成小条,以促进有效的抗体孵育并确保信号均匀。(5) 此外,必须非常小心地处理视网膜组织,避免任何可能影响整个过程中后续观察的损伤。这些措施共同促进了预嵌入免疫电镜方法的成功,使人们能够研究不同方面,例如视锥红细胞突触24、SP-IR 分子定位19 和 α-Syn 在小鼠视网膜中的精确表达25。
在孵育第一抗体之前,必须用 2% NGS 封闭视网膜条带,以消除非特异性信号干扰。第一抗体的浓度必须根据抗体本身来确定,通常高于用于冰冻切片染色的浓度,并且必须事先进行优化。在一抗孵育期间,微量离心管必须连续旋转,以确保堆叠的视黄醛条带与抗体完全接触,防止堆叠部分不完全渗透。为了扩增信号,在标准 DAB 染色之前将 DAB 预孵育,特定染色时间通常为 10-20 分钟。如果时间太短,信号可能太弱而无法观察,如果时间太长,则会导致假阳性信号,影响准确判断。通常,染料的孵育时间直接取决于组织的表面颜色(棕色到深棕色)。
如前所述,虽然在液氮中冷冻组织以增强信号(18,26,27)进行了实验,但这种方法确实放大了阳性信号,但导致视网膜细胞的膜结构不良(数据未显示)。这种结构降解使得准确识别细胞类型变得具有挑战性。考虑到这一点,视网膜组织没有被反复冻结。为了增强阳性信号,适当延长了抗体的孵育时间。拟议的方案结合了以前的优点,与琼脂包埋相比简化了步骤。这不仅可以保护蛋白质的抗原决定簇,还可以保持细胞膜的完整性。总体目标是探索整个通路中神经递质的突触连接和细胞定位。因此,方案中的 DAB 反应产物未经过银强化处理,使其更适合研究神经递质特异性突触连接和通路28。
目前,在超微结构水平上对通路或神经递质进行化学鉴定的方法有限。其中一种方法是光电联用显微镜 (CLEM)29,30,然而,该方法仅限于非常小的区域,并且无法识别整个通路中的连接。预嵌入 immuno-EM 的优势在于其信号稳健、范围广以及长距离分析定位和跟踪的能力 13,14,15。但是,此方法也有其局限性,例如漫射信号,使其特异性较低。对于膜受体的精确定位,尤其是膜上的受体,使用包埋后 immunogold EM 可能更合适。该技术能够直接计数金颗粒,便于分析这些膜受体的数量和变异性16。
未来,预嵌入免疫 EM 与体积 EM 的整合有望成为长期探索已识别神经回路的有效方法,代表了该方法进一步发展的未来前景。Volume EM 侧重于结构重建,依靠形态学来识别特定结构,缺乏精确的化学鉴定31,32。通过将预嵌入免疫电镜与体积电镜相结合,可以在三维重建过程中识别特定结构或物质,为识别神经回路提供更全面、更直观的方法。
披露声明
作者没有披露。
致谢
这项工作部分得到了中国国家重点研发计划 (2022YFA1105503)、神经科学国家重点实验室 (SKLN-202103)、中国浙江省自然科学基金 (Y21H120019) 的资助。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe needle | kangdelai | ||
| 1% OsO4 | Electron Microscopy Science | 19100 | |
| 2,2,2-Tribromoethanol | Sigma-Aldrich | T48402 | |
| 8% Glutaraldehyde | Electron Microscopy Science | 16020 | |
| 8% Paraformaldehyde | Electron Microscopy Science | 157-8 | |
| Acetone | Electron Microscopy Science | 10000 | |
| Anti-rabbit PKC | Sigma-Aldrich | P4334 | |
| Anti-Rabbit SP | Abcam | ab67006 | |
| DAB Substrate kit | MXB Biotechnologies | KIT-9701/9702/9703 | |
| Elbow scissors | Suzhou66 vision company | 54010 | |
| Electron microscope | Phillips | CM120 | |
| Epon resin | Electron Microscopy Science | 14910 | |
| forcep | Suzhou66 vision company | S101A | |
| Millipore filter paper | Merck Millipore | PR05538 | |
| Na2HPO4· 12H2O | Sigma | 71650 | A component of phosphate buffer |
| NaH2PO4· H2O | Sigma | 71507 | A component of phosphate buffer |
| Picric acid | Electron Microscopy Science | 19550 | |
| Sodium borohydride (NaBH4) | Sigma | 215511 | |
| Tris | Solarbio | 917R071 | |
| Ultramicrotome | Leica | ||
| Uranyl acetate | Electron Microscopy Science | 22400 | |
| VACTASTAIN ABC kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-4001 |
参考文献
- Chua, N. J., et al. A complete reconstruction of the early visual system of an adult insect. Curr Biol. 33 (21), 4611-4623.e4614 (2023).
- Ravi Chander, P., Hanson, L., Chundekkad, L., Awatramani, G. B. Neural circuits underlying multi-feature extraction in the retina. J Neurosci. , JN-RM-0910-23 (2023).
- Sirivisoot, S., et al. Development and characterization of mouse anti-canine PD-L1 monoclonal antibodies and their expression in canine tumors by immunohistochemistry in vitro. Vet Q. 43 (1), 1-9 (2023).
- Raeisi, H., et al. Development and characterization of phage display-derived anti-toxin antibodies neutralizing TcdA and TcdB of Clostridioides difficile. Microbiol Spectr. 11 (5), e0531022(2023).
- Ryschich, A., Dong, Y., Schäfer, M., Ryschich, E., Karakhanova, S. DWH24: A new antibody for fluorescence-based cell death analysis. Methods Appl Fluoresc. 11 (4), (2023).
- Jastrzebska, B., et al. Functional characterization of rhodopsin monomers and dimers in detergents. J Biol Chem. 279 (52), 54663-54675 (2004).
- Huang, P., et al. Mechanism of Shenfu injection in suppressing inflammation and preventing sepsis-induced apoptosis in murine cardiomyocytes based on network pharmacology and experimental validation. J Ethnopharmacol. 322, 117599(2024).
- Maheshwari, U., et al. Inorganic phosphate exporter heterozygosity in mice leads to brain vascular calcification, microangiopathy, and microgliosis. Brain Pathol. 33 (6), e13189(2023).
- Mackiewicz, J., et al. Effect of gravity in long-term vitreous tamponade: In vivo investigation using perfluorocarbon liquids and semi-fluorinated alkanes. Graefes Arch Clin Exp Ophthalmol. 245 (5), 665-675 (2007).
- Luján, R., Rubio, M. E. Editorial: Immunoelectron microscopy: Placing molecular functions within a neuronal context. Front Neuroanat. 16, 1043371(2022).
- Xu, S., et al. Synaptic changes and the response of microglia in a light-induced photoreceptor degeneration model. Mol Vis. 27, 206-220 (2021).
- Chadha, A., Volland, S., Baliaouri, N. V., Tran, E. M., Williams, D. S. The route of the visual receptor rhodopsin along the cilium. J Cell Sci. 132 (10), jcs.229526(2019).
- Huang, H. J., et al. Multiple nucleocapsid structural forms of shrimp white spot syndrome virus suggests a novel viral morphogenetic pathway. Int J Mol Sci. 24 (8), 7525(2023).
- Tissarinen, P., et al. Elevated human placental heat shock protein 5 is associated with spontaneous preterm birth. Pediatr Res. 94 (2), 520-529 (2023).
- Huang, Z., et al. A neural tract tracing study on synaptic connections for cortical glutamatergic terminals and cervical spinal calretinin neurons in rats. Front Neural Circuits. 17, 1086873(2023).
- Zhang, J., Petralia, R. S., Wang, Y. X., Diamond, J. S. High-resolution quantitative immunogold analysis of membrane receptors at retinal ribbon synapses. J Vis Exp. 108, e53547(2016).
- Ottersen, O. P., Landsend, A. S. Organization of glutamate receptors at the synapse. Eur J Neurosci. 9 (11), 2219-2224 (1997).
- Greferath, U., Grünert, U., Wässle, H. Rod bipolar cells in the mammalian retina show protein kinase C-like immunoreactivity. J Comp Neurol. 301 (3), 433-442 (1990).
- Wang, F., et al. Distribution and synaptic organization of substance P-like immunoreactive neurons in the mouse retina. Brain Struct Funct. 228 (7), 1703-1724 (2023).
- van Opbergen, C. J. M., et al. 34;Orphan" Connexin43 in Plakophilin-2 deficient hearts revealed by volume electron microscopy. Front Cell Dev Biol. 10, 843687(2022).
- Li, S., et al. Safe and efficient oral allergy immunotherapy using one-pot-prepared mannan-coated allergen nanoparticles. Biomaterials. 303, 122381(2023).
- Yamashita, K., Kusakabe, M., Sano, M. A simple and rapid method of dissociating hepatocytes from fixed liver of the mouse. Stain Technol. 56 (1), 29-33 (1981).
- Tanabe, T., Shin, M., Fujiwara, K. Immunoelectron microscopy study of polyamines using a newly prepared monoclonal antibody against spermidine: use of a mixture of glutaraldehyde and paraformaldehyde as a cross-linking agent in the preparation of the antigen. J Biochem. 135 (4), 501-507 (2004).
- Xiao, J., et al. Rod bipolar cells receive cone photoreceptor inputs through both invaginating synapses and flat contacts in the mouse and guinea pig retinas. J Comp Neurol. 531 (11), 1184-1197 (2023).
- Yang, Q., et al. Expression of α-Synuclein in the mouse retina is confined to inhibitory presynaptic elements. J Comp Neurol. 531 (10), 1057-1079 (2023).
- Yazulla, S., Studholme, K. M., Zucker, C. L. Synaptic organization of substance P-like immunoreactive amacrine cells in goldfish retina. J Comp Neurol. 231 (2), 232-238 (1985).
- Sassoè-Pognetto, M., Wässle, H., Grünert, U. Glycinergic synapses in the rod pathway of the rat retina: cone bipolar cells express the alpha 1 subunit of the glycine receptor. J Neurosci. 14 (8), 5131-5146 (1994).
- Hartveit, E., et al. Localization and developmental expression of the NMDA receptor subunit NR2A in the mammalian retina. J Comp Neurol. 348 (4), 570-582 (1994).
- Perkins, G. A. The use of miniSOG in the localization of mitochondrial proteins. Methods Enzymol. 547, 165-179 (2014).
- Shu, X., et al. A genetically encoded tag for correlated light and electron microscopy of intact cells, tissues, and organisms. PLoS Biol. 9 (4), e1001041(2011).
- Kar, D., et al. Volume electron microscopy reveals human retinal mitochondria that align with reflective bands in optical coherence tomography [Invited]. Biomed Opt Express. 14 (10), 5512-5527 (2023).
- Johnson, J. E. Jr, et al. Spatiotemporal regulation of ATP and Ca2+ dynamics in vertebrate rod and cone ribbon synapses. Mol Vis. 13, 887-919 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
ISSN 1940-087X
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
我们使用 cookie 来增强您在我们网站上的体验。
继续使用我们的网站或单击“继续”,即表示您同意接受我们的 cookie。