Method Article
חקירת מעגלי רשתית ולוקליזציה מולקולרית על ידי הטבעה מראש של מיקרוסקופ אימונואלקטרונים
In This Article
Summary
פרוטוקול זה מתאר את השלבים המפורטים של הטמעה מראש של מיקרוסקופ אימונואלקטרונים, תוך התמקדות בחקר מעגלים סינפטיים ולוקליזציה של חלבונים ברשתית.
Abstract
הרשתית מורכבת מתאים רבים היוצרים מעגלים עצביים מגוונים, המהווים את השלב הראשון של מסלול הראייה. כל מעגל מאופיין בתכונות ייחודיות ובמוליכים עצביים מובחנים, הקובעים את תפקידו ואת משמעותו התפקודית. בהתחשב בסוגי התאים המורכבים בתוך המבנה שלה, המורכבות של מעגלים עצביים ברשתית מציבה אתגרים לחקירה. כדי לחקור טוב יותר מעגלי רשתית ודיבור צולב, כגון הקשר בין מסלולי חרוט ומוט, ולוקליזציה מולקולרית מדויקת (מוליכים עצביים או נוירופפטידים), כגון נוכחות של חומר דמוי תגובתיות חיסונית דמוית P ברשתית העכבר, השתמשנו בשיטת מיקרוסקופ אימונואלקטרונים (immuno-EM) להטמעה מראש (immuno-EM) כדי לחקור קשרים סינפטיים וארגון. גישה זו מאפשרת לנו לאתר קשרים סינפטיים בין-תאיים ספציפיים ולוקליזציה מולקולרית מדויקת, ויכולה למלא תפקיד מנחה בחקר תפקידה. מאמר זה מתאר את הפרוטוקול, ריאגנטים שבהם נעשה שימוש ושלבים מפורטים, כולל (1) הכנת קיבוע רשתית, (2) הטבעה מראש של אימונוסטיין, ו-(3) לאחר קיבוע והטבעה.
Introduction
המורכבות של מעגלים עצביים ברשתית מציבה אתגרים לחקירה, בהתחשב בסוגי התאים המגוונים בתוך המבנה שלה 1,2. השלב הראשוני כולל זיהוי קשרים סינפטיים בין תאים שונים וקביעת הלוקליזציה התאית של נוירוטרנסמיטורים או נוירופפטידים ספציפיים. ככל שהביולוגיה המולקולרית מתקדמת מציגה חלבונים חדשים, לוקליזציה מדויקת ברשתית הופכת חיונית להבנת תפקודיהם ולניתוח מעגלי הרשתית והקשרים הסינפטיים 3,4,5.
בשל הרזולוציה המוגבלת של מיקרוסקופ אור, מיקרוסקופ אלקטרונים (EM) משמש בדרך כלל כדי לזהות את המבנים התת-תאיים של תאי עצב. EM יש סיווגים שונים, עם מיקרוסקופ אלקטרונים שידור קונבנציונאלי (TEM) המשמש לצפייה אולטרה מבנים התא 6,7,8,9. מיקרוסקופ אימונואלקטרונים (immuno-EM), המשלב את הרזולוציה המרחבית של EM עם יכולת הזיהוי הכימית של נוגדנים הנקשרים באופן ספציפי לחלבונים10, בולט כשיטה האופטימלית והבלעדית לחקר קשרים סינפטיים ולוקליזציה של חלבונים תת-תאיים ברשתית 11,12.
ניתן לחלק את טכניקות האימונו-EM לשיטות קדם-הטבעה ופוסט-הטבעה המבוססות על סדר ההטבעה והדגירה של נוגדנים. בהשוואה לשיטת ההטבעה שלאחר ההטבעה, גישת קדם-הטבעה מסוגלת לזיהוי בקנה מידה גדול ולמרחקים ארוכים 13,14,15, ומציעה גישה אופטימלית לחקר תהליכים תאיים כמו אקסונים ודנדריטים. בנוסף, טכניקה זו מספקת אות חזק ושדה ראייה רחב, מה שהופך אותה ליתרון לחקירות מקיפות של ביטוי חלבונים ולוקליזציה מולקולרית בציטופלסמה. שיטה זו מוכיחה את עצמה כבעלת ערך רב במיוחד בהבטחת מבנים מזוהים כימית הנראים לאורך כל הציטופלסמה, התאים או הרשתית.
עם זאת, שיטת ההטבעה שלאחר ההטבעה, אף שהיא בעלת חדירה או דיפוזיה נמוכה יותר בהשוואה לשיטת ההטבעה המוקדמת, אינה רגישה כל כך16,17. במילים פשוטות, אם המטרה היא לחקור את הלוקליזציה של נוירוטרנסמיטורים ספציפיים בציטופלסמה או במסופים סינפטיים, ההטבעה מראש של immuno-EM היא השיטה המועדפת. לעומת זאת, לצורך זיהוי לוקליזציה של קולטני ממברנה, מומלץ יותר להשתמש ב- EM אימונוגולד לאחר הטבעה.
בהתחשב בשיקולים אלה, אנו בוחרים בשיטת ההטבעה מראש של immuno-EM כדי להתעמק במעגלי הרשתית, כולל האינטראקציה בין מסלולי חרוט ומוט, ולוקליזציה מולקולרית, כגון התפלגות וארגון סינפטי של תגובתיות חיסונית דמוית P (SP-IR) ברשתית העכבר.
Protocol
הטיפול והטיפול בבעלי חיים אושרו על ידי תקנה של ועדת האתיקה של האוניברסיטה הרפואית וונג'ואו בהתאם להנחיות ARVO. במחקר זה נעשה שימוש בעכברים בוגרים (C57BL/6J, זכר ונקבה, בני 8 עד 12 שבועות). הציוד והריאגנטים הדרושים למחקר מפורטים בטבלת החומרים.
1. הכנה לקיבוע הרשתית
- הרכיבו את החומרים והכלים הבאים: מיקרוסקופ נתיחה, שני מלקחיים עם קצוות עדינים מאוד, מספריים, מחט מזרק 1 מ"ל (גודל מחט: G26) ונייר סינון.
- הרדמה עמוקה של עכברים על ידי הזרקה תוך צפקית של 2,2,2-tribromoethanol במשקל גוף של 0.25 מ"ג/גרם. לאחר מכן, ערפו את ראשיהם של העכברים וחתכו את ראשיהם16.
- חנכו את עיניהם במספריים למרפק והניחו אותן בכלי זכוכית המכיל 4% פרפורמלדהיד-0.2% חומצה פיקרית בחיץ פוספט 0.1M (PB; pH 7.4).
- תחת המיקרוסקופ המנתח מנקבים חור בלימבוס הקרנית באמצעות מחט מזרק 1 מ"ל וחותכים את המקטע הקדמי במספריים, בעקבות החור. לאחר מכן, הסר את העדשה משטח הרשתית הפנימית באמצעות מלקחיים.
- השתמשו בשתי מלקחיים כדי לקלף בזהירות את לובן העין עד שהרשתית מבודדת לחלוטין מהעין (רקמת הרשתית המופרדת לחלוטין מהכורואידים). לאחר מכן, לחתוך את הרשתית לארבעה חלקים.
- תקן חלקים אלה ב-4% paraformaldehyde-0.2% picric acid ב-0.1 M PB (pH 7.4) למשך שעתיים בטמפרטורת החדר (RT), ולאחר מכן העבר את הרקמה ל-4% paraformaldehyde ב-0.1 M PB (pH 10.4) למשך הלילה ב-4°C.
2. הטמעה מוקדמת של אימונוסטיישן
- לאחר שטיפה של 0.01 M PBS (pH 7.4) שש פעמים במשך 10 דקות כל אחת, יש לדגור על רקמות הרשתית בנתרן בורוהידריד 1% (NaBH4) ב-0.01 M PBS (pH 7.4) למשך 30 דקות.
- יש לשטוף את מקטעי הרשתית ב-0.01 M PBS (pH 7.4) לפחות שש פעמים. בינתיים, להסיר את הזגוגית עם נייר סינון ולאחר מכן לחתוך את הרשתית לפרוסות קטנות בין 100-300 מיקרומטר באמצעות סכין גילוח פיפיות.
- לאחר חסימה עם 5% סרום עיזים תקין (NGS) ב 0.1 M PB (pH 7.4) במשך 1 שעה ב RT, לדגור את פרוסות הרשתית עם נוגדנים ראשוניים (נגד ארנב PKCα, 1:80; Anti-Rabbit SP, 1:100) יחד עם 2% NGS ב-0.01 M PBS (pH 7.4) למשך שעתיים ב-RT על שייקר. לאחר מכן, לדגור במשך 96 שעות (5 ימים) ב 4 °C על שייקר.
- לאחר שטיפה שש פעמים במשך 10 דקות כל אחת ב-0.01 M PBS (pH 7.4), יש לדגור על פרוסות הרשתית עם הנוגדן המשני ב-1:200, כגון IgG נגד ארנב עיזים, יחד עם 2% NGS ב-0.01 M PBS (pH 7.4) למשך שעתיים ב-RT על שייקר. לאחר מכן, לדגור במשך 48 שעות (2 ימים) ב 4 ° C על שייקר.
הערה: נוגדנים משניים יושמו לבד בניסויי ביקורת. - יש לשטוף את פסי הרשתית ב-0.01 M PBS (pH 7.4) שש פעמים במשך 10 דקות כל אחד לפני הדגירה עם מגיב A וריאגנט B מערכת ABC ב-1:100 ב-0.01M PBS (pH 7.4) למשך יומיים ב-4°C. (גם מגיב A וגם מגיב B דוללו ב-0.01 M PBS. לדוגמה: פתרון: 6 μl; תמיסת B: 6 מיקרוליטר; 0.01 M PBS: 588 μl, סה"כ 600 μl).
- יש לשטוף את פסי הרשתית בחיץ טריס של 0.05 מטר (pH 7.2) שלוש פעמים למשך 10 דקות כל אחד. לאחר מכן, יש לדגור מראש על פסי הרשתית עם מגיב 5% 1 ו-5% מגיב 3 מערכת DAB במים מזוקקים למשך שעה אחת בטמפרטורת החדר. (היחס לדוגמה: מגיב 1: 50 μl; מגיב 3: 50 μl; מים מזוקקים: 900 μl, סך של 1000 μl).
- מכתימים את פסי הרשתית עם DAB. הוסף את אותו נפח תמיסה משלושה צינורות בערכת DAB ברצף (מגיב 1-מגיב 2-מגיב 3). שימו לב למצב הצביעה באמצעות מיקרוסקופ הדיסקציה. עצור את הכתמים כאשר התאים הופכים חומים; תהליך זה אורך 10-20 דקות.
- שטפו את פסי הרשתית עם חיץ 0.05 M Tris (pH 7.2) שלוש פעמים במשך 10 דקות כל אחד ולאחר מכן שטפו ב-0.01 M PBS שש פעמים במשך 10 דקות כל אחת.
3. לאחר קיבוע והטבעה
- תקן את פסי הרשתית ב-2% גלוטראלדהיד למשך 1-2 שעות בטמפרטורת החדר (RT), ולאחר מכן שטוף ב-0.01 M PBS (pH 7.4) שש פעמים במשך 10 דקות כל אחד.
- דגרו על פסי הרשתית עם 1% אוסמיום טטרוקסיד (OsO4) ב-0.1 M PB למשך שעה אחת ב-RT ושמרו אותם במקום חשוך.
- לאחר שטיפה במים מזוקקים (ddH2O) שש פעמים במשך 10 דקות כל אחת, לדגור על רקמות הרשתית עם אורניל אצטט במשך שעה אחת ב- RT ולשמור אותם במקום חשוך כדי להכתים רקמות אלה.
- שים את רקמות הרשתית בתמיסות אצטון (50%, 70%, 80% ו- 90%) למשך 10 דקות כל אחת, ולאחר מכן ב- 100% פעמיים למשך 10 דקות כל אחת.
- טבלו את רקמות הרשתית בתערובת המכילה את אותו נפח של אורניל אצטט ושרף אפוקסי למשך שעה אחת בתנור ייבוש של 37°C, ולאחר מכן תערובת המכילה אורניל אצטט ואת השרף (1:4) למשך הלילה בתנור ייבוש של 37°C.
- מעבירים את רקמות הרשתית בעדינות באמצעות קיסם לתוך השרף החדש למשך שעה אחת בטמפרטורה של 45°C בתנור ייבוש, ולאחר מכן פס הרשתית המכוון מוטבע בצלחת ההטבעה עם השרף.
- הכניסו את הדגימה לתנור ייבוש בטמפרטורה של 45 מעלות למשך 3 שעות ולתנור ייבוש בטמפרטורה של 65 מעלות למשך 48 שעות.
- עצבו את קוביות ההטבעה לטרפזים וחתכו את הבלוק למקטעים בעובי 1 מיקרומטר עם אולטרה-מיקרוטום, צבעו חלקים אלה בכחול טולוידין, והקרינו מראש אזורים מעניינים תחת מיקרוסקופ אור.
- אספו מקטעים דקים במיוחד (70-90 ננומטר) על רשתות נחושת וצפו בהם תחת מיקרוסקופ אלקטרונים.
תוצאות
איור 1 מראה דוגמאות לניסויי בקרה ללא דגירה של נוגדנים ראשוניים כנגד חלבון קינאז C אלפא (PKCα) או SP, שבהם לא נמצאה תגובתיות חיסונית (IR).
איור 2 מתאר את PKCα-IR ברשתית העכבר. PKCα משמש כסמן לכל תאי המוט הדו-קוטבי (RBC) ברשתית18. ברמת מיקרוסקופ האלקטרונים (EM), ניתן לזהות RBC באמצעות PKCα-IR, המודגם על ידי תוצר התגובה דיאמינובנזידין (DAB) עם צפיפות אלקטרונים גבוהה. איור 2A מדגים דנדריט RBC חיובי ל-PKCα שיוצר סינפסה עם מסוף מוט בשכבת הפרספקס החיצונית (OPL), ואילו איור 2B מראה סינפסת חרוט-RBC שבה דנדריט RBC חיובי ל-PKCα הוא פוסט-סינפטי למסוף חרוט. בנוסף, מוצר תגובת DAB מסייע בזיהוי הדקי RBC (איור 2C) ותהליכים אקסונליים (איור 2D) בשכבת הפרספקס הפנימית (IPL).
איור 3 מציג את הביטוי של חומר P (SP) בקשרים קדם-סינפטיים ופוסט-סינפטיים ב-IPL של רשתית העכבר. תאים אמקריניים SP-IR הם קדם-סינפטיים לתאים אמקריניים שליליים SP-שליליים (איור 3A), כמו גם תהליכים אמקריניים SP-IR (הנתונים אינם מוצגים). יתר על כן, תאי SP-IR amacrine הם פוסט-סינפטיים עד טרמינלים דו-קוטביים ברמות תת-שכבה 3 (S3) ותת-שכבה 5 (S5) של IPL, בהתאמה (איור 3B,C). המחקר הקודם שלנו מפרט את ניתוח הסינפסות שבהן תהליכים של תאים אמקריניים SP-IR יוצרים פלטים סינפטיים על תהליכים אחרים ב- IPL19. יש לציין כי הלוקליזציה התת-תאית של SP נמצאת בעיקר בשלפוחיות סינפטיות במסופים הקדם-סינפטיים (איור 3).
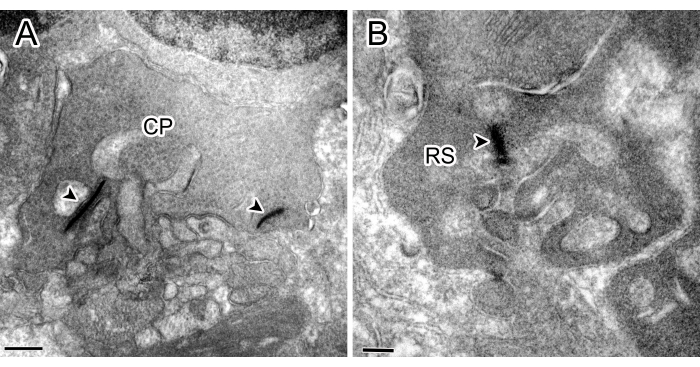
איור 1: מיקרוגרפים של אלקטרונים חיסוניים מניסויי בקרה. גם פדיקור חרוט (CP) עם שני סרטים (ראש חץ) (A) וגם מוט ספרול (RS) עם סרט אחד ב-OPL (B) לא הראו שום צביעה. פסי קנה מידה: 500 ננומטר (A), 200 ננומטר (B). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: מיקרוגרפים של אלקטרונים אימונו-אלקטרונים המסומנים בנוגדן PKCα ברשתית העכבר. (A) RS מתחבר עם RBC חיובי אחד ל-PKCα (חיצים מציינים תגובתיות חיסונית) ושני תאים אופקיים (H) ב-OPL. (B) CP מתחבר עם RBC חיובי PKCα ב-OPL. (C) ו-(D) מציגים את מסוף RBC חיובי PKCα ואת התהליך האקסונלי ב-IPL, בהתאמה. פסי קנה מידה: 200 ננומטר (A), 500 ננומטר (B), 500 ננומטר (C), 500 ננומטר (D). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: מיקרוגרפים של אלקטרונים אימונו-אלקטרונים המסומנים עם נוגדן SP ב-IPL של רשתית העכבר. (A) תא אמקריני SP-IR (A+) הוא קדם-סינפטי לתא אמקריני שלילי SP (A-). תאי SP-IR amacrine קיבלו קלט ממסופים דו-קוטביים ברמות S3 (B) ו-S5 (C) של IPL, בהתאמה. פסי קנה מידה: 200 ננומטר (A), 200 ננומטר (B), 200 ננומטר (C). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
מאמר זה תיאר שלושה שלבים קריטיים לתצפית מוצלחת של מעגלים סינפטיים ולוקליזציה של חלבונים: (1) קיבוע מהיר וחלש, (2) הטבעה מוקדמת של אימונוסטיין, ו-(3) קיבוע והטבעה לאחר קיבוע.
אנו מציעים כי קיבוע הוא שלב המפתח לגישה מוצלחת של הטמעה מראש של immuno-EM. לפיכך, מודגשת כאן חשיבותו של קיבוע טרי ומהיר, המכנה עיקרון זה "עקרון 4F", שהוא חיוני להכנת רקמות. עם זאת, השגת חדירת נוגדנים משופרת וקיבוע יעיל מציבה אתגר20. כדי לטפל בכך, גלוטראלדהיד הוחלף בחומצה פיקרית במהלך הקיבוע הראשוני כדי לשפר את חדירת הנוגדנים, שכן גלוטראלדהיד יכול לשבש גורמים אנטיגניים ולהשפיע על צביעה חיסונית21. חומצה פיקרית, לעומת זאת, שומרת טוב יותר על מבנה הממברנה ושלמות הרקמה22, אם כי עם פשרה ביעילות הקיבוע. בשלב השלישי, 2% גלוטראלדהיד שימש לאחר קיבוע כדי לייעל את קיבוע הרקמות.
עיקרי הפרוטוקול המוצג כאן כוללים חמישה שלבים: (1) קיבוע מוקדם: שימוש בחומצה פיקרית בשלב המוקדם לחדירת נוגדנים טובה יותר תוך מזעור ההפרעה לדטרמיננטים אנטיגניים. (2) לאחר קיבוע: שימוש ב-2% גלוטראלדהיד כדי לשפר את קיבוע הרקמה לאחר צביעה חיסונית. (3) טיפול בהפחתה: דגירה על רקמה ב-1% NaBH4 ב-0.1 M PB (pH 7.4) למשך 30 דקות כדי לשחזר חלק גדול מהתגובתיות החיסונית ולשפר את התגובה החיסונית של אנטיגנים ונוגדנים, תוך הגברת אותות חיוביים23. (4) הכנת רקמות: הסרת זגוגית וחיתוך רקמת רשתית לרצועות קטנות כדי להקל על דגירה יעילה של נוגדנים ולהבטיח אותות אחידים. (5) יתר על כן, הכרחי לטפל ברקמת הרשתית בזהירות מירבית, תוך הימנעות מכל נזק שעלול לסכן את התצפיות הבאות לאורך כל ההליך. מדדים אלה תורמים באופן קולקטיבי להצלחת שיטת ההטמעה מראש של immuno-EM, ומאפשרים לחקור היבטים מגוונים כגון סינפסות חרוט-RBC24, לוקליזציה מולקולרית SP-IR19, והביטוי המדויק של α-Syn ברשתית העכבר25.
לפני הדגירה על הנוגדן הראשון, חיוני לחסום רצועות רשתית עם 2% NGS כדי למנוע הפרעות אות לא ספציפיות. ריכוז הנוגדן הראשון חייב להיקבע על סמך הנוגדן עצמו, בדרך כלל גבוה יותר מזה המשמש להכתמת חתך קפוא, ויש לייעל אותו מראש. במהלך תקופת הדגירה הראשונית של הנוגדנים, יש צורך בסיבוב רציף של צינור המיקרוצנטריפוגה כדי להבטיח מגע מלא של רצועות הרשתית המוערמות עם הנוגדן, ולמנוע חדירה חלקית של חלקים מוערמים. כדי להגביר את האות, DAB הודגר מראש לפני צביעת DAB סטנדרטית, כאשר זמן הצביעה הספציפי נע בדרך כלל בין 10-20 דקות. אם הזמן קצר מדי, האות עשוי להיות חלש מדי לתצפית, ואם הוא ארוך מדי, זה יכול להוביל לאותות חיוביים כוזבים, המשפיעים על שיפוט מדויק. בדרך כלל, זמן הדגירה של הצבעים תלוי ישירות בצבע פני השטח של הרקמה (חום עד חום כהה).
בעוד ניסויים בוצעו עם רקמה קפואה בחנקן נוזלי כדי להגביר את האות, כאמור 18,26,27, שיטה זו אכן הגבירה אותות חיוביים אך הביאה למבנה קרום לקוי של תאי רשתית (נתונים לא מוצגים). השפלה מבנית זו הקשתה על זיהוי מדויק של סוגי התאים. בהתחשב בכך, רקמת הרשתית לא הוקפאה שוב ושוב. כדי לשפר את האות החיובי, זמן הדגירה של נוגדנים הוארך כראוי. הפרוטוקול המוצע משלב יתרונות קודמים, ומפשט שלבים בהשוואה להטמעת אגר. זה לא רק מגן על הגורמים האנטיגניים של חלבונים, אלא גם שומר על שלמות קרום התא. מטרת העל היא לחקור קשרים סינפטיים ולוקליזציה תאית של מוליכים עצביים לאורך כל המסלול. לכן, תוצרי תגובת DAB בפרוטוקול לא עברו טיפול בהגברת כסף, מה שהופך אותו מתאים יותר לחקר קשרים סינפטיים ספציפיים למוליכים עצביים ומסלולים28.
נכון לעכשיו, ישנן שיטות מוגבלות לזיהוי כימי של מסלולים או נוירוטרנסמיטורים ברמה ultrastructural. שיטה אחת כזו היא מיקרוסקופ אור ואלקטרונים מתואם (CLEM)29,30, אשר מוגבל לשטח קטן מאוד וחסר את היכולת לזהות קשרים לאורך כל המסלול. נקודות החוזק של הטמעה מראש של immuno-EM טמונות באות החזק, בטווח הרחב וביכולת שלו למיקום אנליטי למרחקים ארוכים ומעקב 13,14,15. עם זאת, שיטה זו יש גם מגבלות שלה, כגון אותות מפוזרים, מה שהופך אותם פחות ספציפיים. עבור לוקליזציה מדויקת של קולטני הממברנה, במיוחד אלה על הממברנה, זה עשוי להיות מתאים יותר להשתמש EM אימונוגולד לאחר הטבעה. טכניקה זו מאפשרת ספירה ישירה של חלקיקי זהב, ומקלה על ניתוח מספרם והשתנותם של קולטני ממברנה אלה16.
בעתיד, השילוב של טרום הטבעה של immuno-EM עם נפח EM טומן בחובו הבטחה כשיטה יעילה לחקר ארוך טווח של מעגלים עצביים מזוהים, המייצגים את נקודות המבט העתידיות לפיתוח נוסף של שיטה זו. נפח EM מתמקד בשחזור מבנים, תוך הסתמכות על מורפולוגיה לזיהוי מבנים ספציפיים, ללא זיהוי כימי מדויק31,32. על ידי שילוב של הטבעה מראש של immuno-EM עם EM נפח, ניתן לזהות מבנים או חומרים ספציפיים במהלך שחזור תלת ממדי, מה שמספק גישה מקיפה יותר ואינטואיטיבית יותר מבחינה חזותית לזיהוי מעגלים עצביים.
Disclosures
למחברים אין גילויים.
Acknowledgements
עבודה זו נתמכה בחלקה על ידי מענקים מהתוכנית הלאומית למחקר ופיתוח מפתח של סין (2022YFA1105503), מעבדת המפתח הממלכתית למדעי המוח (SKLN-202103), קרן ג'ג'יאנג למדעי הטבע של סין (Y21H120019).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe needle | kangdelai | ||
| 1% OsO4 | Electron Microscopy Science | 19100 | |
| 2,2,2-Tribromoethanol | Sigma-Aldrich | T48402 | |
| 8% Glutaraldehyde | Electron Microscopy Science | 16020 | |
| 8% Paraformaldehyde | Electron Microscopy Science | 157-8 | |
| Acetone | Electron Microscopy Science | 10000 | |
| Anti-rabbit PKC | Sigma-Aldrich | P4334 | |
| Anti-Rabbit SP | Abcam | ab67006 | |
| DAB Substrate kit | MXB Biotechnologies | KIT-9701/9702/9703 | |
| Elbow scissors | Suzhou66 vision company | 54010 | |
| Electron microscope | Phillips | CM120 | |
| Epon resin | Electron Microscopy Science | 14910 | |
| forcep | Suzhou66 vision company | S101A | |
| Millipore filter paper | Merck Millipore | PR05538 | |
| Na2HPO4· 12H2O | Sigma | 71650 | A component of phosphate buffer |
| NaH2PO4· H2O | Sigma | 71507 | A component of phosphate buffer |
| Picric acid | Electron Microscopy Science | 19550 | |
| Sodium borohydride (NaBH4) | Sigma | 215511 | |
| Tris | Solarbio | 917R071 | |
| Ultramicrotome | Leica | ||
| Uranyl acetate | Electron Microscopy Science | 22400 | |
| VACTASTAIN ABC kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-4001 |
References
- Chua, N. J., et al. A complete reconstruction of the early visual system of an adult insect. Curr Biol. 33 (21), 4611-4623.e4614 (2023).
- Ravi Chander, P., Hanson, L., Chundekkad, L., Awatramani, G. B. Neural circuits underlying multi-feature extraction in the retina. J Neurosci. , JN-RM-0910-23 (2023).
- Sirivisoot, S., et al. Development and characterization of mouse anti-canine PD-L1 monoclonal antibodies and their expression in canine tumors by immunohistochemistry in vitro. Vet Q. 43 (1), 1-9 (2023).
- Raeisi, H., et al. Development and characterization of phage display-derived anti-toxin antibodies neutralizing TcdA and TcdB of Clostridioides difficile. Microbiol Spectr. 11 (5), e0531022(2023).
- Ryschich, A., Dong, Y., Schäfer, M., Ryschich, E., Karakhanova, S. DWH24: A new antibody for fluorescence-based cell death analysis. Methods Appl Fluoresc. 11 (4), (2023).
- Jastrzebska, B., et al. Functional characterization of rhodopsin monomers and dimers in detergents. J Biol Chem. 279 (52), 54663-54675 (2004).
- Huang, P., et al. Mechanism of Shenfu injection in suppressing inflammation and preventing sepsis-induced apoptosis in murine cardiomyocytes based on network pharmacology and experimental validation. J Ethnopharmacol. 322, 117599(2024).
- Maheshwari, U., et al. Inorganic phosphate exporter heterozygosity in mice leads to brain vascular calcification, microangiopathy, and microgliosis. Brain Pathol. 33 (6), e13189(2023).
- Mackiewicz, J., et al. Effect of gravity in long-term vitreous tamponade: In vivo investigation using perfluorocarbon liquids and semi-fluorinated alkanes. Graefes Arch Clin Exp Ophthalmol. 245 (5), 665-675 (2007).
- Luján, R., Rubio, M. E. Editorial: Immunoelectron microscopy: Placing molecular functions within a neuronal context. Front Neuroanat. 16, 1043371(2022).
- Xu, S., et al. Synaptic changes and the response of microglia in a light-induced photoreceptor degeneration model. Mol Vis. 27, 206-220 (2021).
- Chadha, A., Volland, S., Baliaouri, N. V., Tran, E. M., Williams, D. S. The route of the visual receptor rhodopsin along the cilium. J Cell Sci. 132 (10), jcs.229526(2019).
- Huang, H. J., et al. Multiple nucleocapsid structural forms of shrimp white spot syndrome virus suggests a novel viral morphogenetic pathway. Int J Mol Sci. 24 (8), 7525(2023).
- Tissarinen, P., et al. Elevated human placental heat shock protein 5 is associated with spontaneous preterm birth. Pediatr Res. 94 (2), 520-529 (2023).
- Huang, Z., et al. A neural tract tracing study on synaptic connections for cortical glutamatergic terminals and cervical spinal calretinin neurons in rats. Front Neural Circuits. 17, 1086873(2023).
- Zhang, J., Petralia, R. S., Wang, Y. X., Diamond, J. S. High-resolution quantitative immunogold analysis of membrane receptors at retinal ribbon synapses. J Vis Exp. 108, e53547(2016).
- Ottersen, O. P., Landsend, A. S. Organization of glutamate receptors at the synapse. Eur J Neurosci. 9 (11), 2219-2224 (1997).
- Greferath, U., Grünert, U., Wässle, H. Rod bipolar cells in the mammalian retina show protein kinase C-like immunoreactivity. J Comp Neurol. 301 (3), 433-442 (1990).
- Wang, F., et al. Distribution and synaptic organization of substance P-like immunoreactive neurons in the mouse retina. Brain Struct Funct. 228 (7), 1703-1724 (2023).
- van Opbergen, C. J. M., et al. 34;Orphan" Connexin43 in Plakophilin-2 deficient hearts revealed by volume electron microscopy. Front Cell Dev Biol. 10, 843687(2022).
- Li, S., et al. Safe and efficient oral allergy immunotherapy using one-pot-prepared mannan-coated allergen nanoparticles. Biomaterials. 303, 122381(2023).
- Yamashita, K., Kusakabe, M., Sano, M. A simple and rapid method of dissociating hepatocytes from fixed liver of the mouse. Stain Technol. 56 (1), 29-33 (1981).
- Tanabe, T., Shin, M., Fujiwara, K. Immunoelectron microscopy study of polyamines using a newly prepared monoclonal antibody against spermidine: use of a mixture of glutaraldehyde and paraformaldehyde as a cross-linking agent in the preparation of the antigen. J Biochem. 135 (4), 501-507 (2004).
- Xiao, J., et al. Rod bipolar cells receive cone photoreceptor inputs through both invaginating synapses and flat contacts in the mouse and guinea pig retinas. J Comp Neurol. 531 (11), 1184-1197 (2023).
- Yang, Q., et al. Expression of α-Synuclein in the mouse retina is confined to inhibitory presynaptic elements. J Comp Neurol. 531 (10), 1057-1079 (2023).
- Yazulla, S., Studholme, K. M., Zucker, C. L. Synaptic organization of substance P-like immunoreactive amacrine cells in goldfish retina. J Comp Neurol. 231 (2), 232-238 (1985).
- Sassoè-Pognetto, M., Wässle, H., Grünert, U. Glycinergic synapses in the rod pathway of the rat retina: cone bipolar cells express the alpha 1 subunit of the glycine receptor. J Neurosci. 14 (8), 5131-5146 (1994).
- Hartveit, E., et al. Localization and developmental expression of the NMDA receptor subunit NR2A in the mammalian retina. J Comp Neurol. 348 (4), 570-582 (1994).
- Perkins, G. A. The use of miniSOG in the localization of mitochondrial proteins. Methods Enzymol. 547, 165-179 (2014).
- Shu, X., et al. A genetically encoded tag for correlated light and electron microscopy of intact cells, tissues, and organisms. PLoS Biol. 9 (4), e1001041(2011).
- Kar, D., et al. Volume electron microscopy reveals human retinal mitochondria that align with reflective bands in optical coherence tomography [Invited]. Biomed Opt Express. 14 (10), 5512-5527 (2023).
- Johnson, J. E. Jr, et al. Spatiotemporal regulation of ATP and Ca2+ dynamics in vertebrate rod and cone ribbon synapses. Mol Vis. 13, 887-919 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ISSN 1940-087X
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.