Method Article
免疫電子顕微鏡のプレ埋め込みによる網膜回路と分子局在の研究
要約
このプロトコルでは、網膜のシナプス回路とタンパク質の局在の探索に焦点を当てて、免疫電子顕微鏡のプレ埋め込みの詳細な手順を概説しています。
要約
網膜は、視覚経路の第一段階を構成する多様なニューロン回路を形成する多数の細胞から構成されています。各回路は、独自の機能と異なる神経伝達物質によって特徴付けられ、その役割と機能的意義を決定します。その構造内には複雑な細胞タイプがあるため、網膜のニューロン回路の複雑さは、探索に課題をもたらします。網膜回路とクロストーク(錐体経路と桿体経路のリンクなど)、およびマウス網膜におけるサブスタンスP様免疫反応性の存在などの正確な分子局在(神経伝達物質または神経ペプチド)をより詳細に調査するために、シナプスの結合と組織化を探索するために、プレエンベッド免疫電子顕微鏡(免疫電子顕微鏡)法を採用しました。このアプローチにより、特定の細胞間シナプス結合と正確な分子局在を特定することができ、その機能を探求する上での指針となる可能性があります。この記事では、(1)網膜固定の準備、(2)包埋前の免疫染色、(3)固定後の包埋など、プロトコール、使用する試薬、および詳細な手順について説明します。
概要
網膜の神経回路の複雑さは、その構造内の多様な細胞タイプを考慮すると、探索の課題を提示します1,2。最初のステップでは、異なる細胞間のシナプス結合を特定し、特定の神経伝達物質または神経ペプチドの細胞局在を決定します。分子生物学の進歩により新しいタンパク質が導入されるにつれて、網膜における正確な局在化は、その機能を理解し、網膜回路とシナプス結合を解析するために重要になる3,4,5。
光学顕微鏡の分解能には限界があるため、神経細胞の細胞内構造を検出するために電子顕微鏡(EM)が一般的に使用されます。電磁界には様々な分類があり、従来の透過型電子顕微鏡(TEM)は細胞の超微細構造の観察に利用されていました6,7,8,9。免疫電子顕微鏡(immuno-EM)は、EMの空間分解能とタンパク質10に特異的に結合する抗体の化学的同定能力を兼ね備えており、網膜11,12におけるシナプス結合および細胞内タンパク質局在を調査するための最適かつ排他的な方法として際立っている。
Immuno-EM技術は、エンベッドと抗体インキュベーションの順序に基づいて、プレエンベッド法とポストエンベッド法に分けることができます。ポストエンベッド法と比較して、プレエンベッド法は、大規模かつ長距離の同定が可能であり13,14,15、軸索や樹状突起などの細胞プロセスを研究するための最適なアプローチを提供する。さらに、この手法は強力なシグナルと広い視野を提供するため、細胞質内のタンパク質発現と分子局在の包括的な研究に有利です。この方法は、細胞質、細胞、または網膜全体にわたって見える化学的に同定された構造を確保するのに特に価値があることが証明されています。
しかし、ポストエンベッディング法は、プレエンベッド法に比べて浸透または拡散が小さい一方で、感度はそれほど高くない16,17。簡単に言えば、細胞質またはシナプス末端における特定の神経伝達物質の局在を探求することが目標である場合、プレエンベッド免疫EMが好ましい方法です。逆に、膜受容体の局在を特定するには、埋め込み後のイムノゴールドEMを利用することがより推奨されます。
これらのことを考慮して、錐体経路と桿体経路の間の相互作用を含む網膜回路と、マウス網膜における物質P様免疫反応性(SP-IR)の分布やシナプス組織化などの分子局在を解明するために、プレエンベッド免疫電子顕微鏡法を選択します。
プロトコル
動物の世話と取り扱いは、ARVOガイドラインに従って、温州医科大学の倫理委員会の規則によって承認されました。本研究では、成体マウス(C57BL/6J、雌雄、8週齢から12週齢)を用いた。本試験に必要な機器および試薬は、 資料表に記載されています。
1. 網膜固定の準備
- 解剖顕微鏡、先端が非常に細い鉗子2本、はさみ、1mLシリンジ針(針サイズ:G26)、濾紙の材料と道具を組み立てます。
- 体重0.25 mg / gで2,2,2-トリブロモエタノールの腹腔内注射によりマウスに深く麻酔をかけます。その後、ネズミの首を切り落とし、頭を切断します16。
- 肘ハサミで眼球を摘出し、0.1 M リン酸緩衝液 (PB; pH 7.4) に 4% パラホルムアルデヒド-0.2% ピクリン酸 4% を含有するガラス皿に入れます。
- 解剖顕微鏡下で、1mLのシリンジ針を使用して角膜リンバスに穴を開け、穴をたどってハサミで前部を切り取ります。次に、鉗子で内側の網膜表面からレンズを取り外します。
- 2つの鉗子を使用して、網膜がアイカップから完全に分離されるまで(カップ状の網膜組織が脈絡膜から完全に分離された)まで強膜を慎重に剥がします。続いて、網膜を4つに切ります。
- これらの切片を0.1 M PB(pH 7.4)中の4%パラホルムアルデヒド-0.2%ピクリン酸に室温(RT)で2時間固定し、次に組織を0.1 M PB(pH 10.4)の4%パラホルムアルデヒドに4°Cで一晩移します。
2. 免疫染色のプレエンベッド
- 0.01 M PBS(pH 7.4)で6回、各10分間洗浄した後、網膜組織を1%水素化ホウ素ナトリウム(NaBH4)と0.01 M PBS(pH 7.4)で30分間インキュベートします。
- 網膜切片を0.01 M PBS(pH 7.4)で少なくとも6回洗浄します。.その間、濾紙で硝子体を取り除き、両刃のカミソリの刃を使用して網膜を100〜300μmの小さなスライスに切断します。
- 0.1 M PB(pH 7.4)中の5%正常ヤギ血清(NGS)でRTで1時間ブロッキングした後、網膜スライスを一次抗体(抗ウサギPKCα、1:80;抗ウサギSP、1:100)と0.01 M PBS(pH 7.4)中の2% NGSを、シェーカー上のRTで2時間。その後、シェーカーで4°Cで96時間(5日間)インキュベートします。
- 0.01 M PBS(pH 7.4)で各10分間6回洗浄した後、網膜スライスをヤギ抗ウサギIgGなどの二次抗体と1:200でインキュベートし、0.01 M PBS(pH 7.4)中の2% NGSとともに、シェーカーでRTで2時間インキュベートします。次に、シェーカーで4°Cで48時間(2日間)インキュベートします。
注:二次抗体は、対照実験で単独で適用されました。 - 網膜縞を0.01 M PBS(pH 7.4)でそれぞれ10分間6回洗浄した後、ABCキットの試薬Aおよび試薬Bと1:100で0.01M PBS(pH 7.4)で4°Cで2日間インキュベートします。 (試薬Aと試薬Bの両方を0.01 M PBSで希釈しました。例:溶液:6μl;B溶液:6μl;0.01 M PBS:588 μl、合計600 μl)。
- 網膜縞を0.05 M Tris緩衝液(pH 7.2)でそれぞれ10分間、3回洗浄します。次に、DABキットの5%試薬1および5%試薬3とレチナールストライプを蒸留水で室温で1時間事前にインキュベートします。(例:試薬1:50μl、試薬3:50μl、蒸留水:900μl、合計1000μl)。
- 網膜縞をDABで染色します。DABキットの3本のチューブから同量の溶液を順番に添加します(試薬1-試薬2-試薬3)。解剖顕微鏡を用いて染色状態を観察します。細胞が茶色になったら染色を止めます。このプロセスには10〜20分かかります。
- 網膜縞を0.05 M Tris緩衝液(pH 7.2)で各10分間3回洗浄し、次に0.01 M PBSで各10分間6回洗浄します。
3. ポスト固定と埋め込み
- レチナールストライプを2%グルタルアルデヒドに室温(RT)で1〜2時間固定し、0.01 M PBS(pH 7.4)でそれぞれ10分間6回洗浄します。
- 網膜縞を0.1 M PB中の1%四酸化オスミウム(OsO4)と共に室温で1時間インキュベートし、暗所に保管します。
- 蒸留水(ddH2O)でそれぞれ10分間6回洗浄した後、網膜組織を酢酸ウラニルと室温で1時間インキュベートし、これらの組織を染色するために暗い場所に保管します。
- 網膜組織をアセトン溶液(50%、70%、80%、90%)にそれぞれ10分間入れ、次に100%に2回10分間入れます。
- 網膜組織を同量の酢酸ウラニルとエポキシ樹脂を含む混合物に37°C乾燥オーブンで1時間浸し、続いて酢酸ウラニルと樹脂(1:4)を含む混合物を37°C乾燥オーブンで一晩浸します。
- 爪楊枝を使用して網膜組織を新しい樹脂に静かに移し、乾燥オーブンで45°Cで1時間、次に配向した網膜ストライプを樹脂と一緒に埋め込みプレートに埋め込みます。
- サンプルを45°C乾燥オーブンに3時間、65°C乾燥オーブンに48時間入れます。
- 埋め込みブロックを台形に成形し、ウルトラミクロトームでブロックを厚さ1 μmの切片に切断し、これらの切片をトルイジンブルーで染色し、光学顕微鏡で関心領域を事前にスクリーニングします。
- 銅格子上の極薄切片(70-90 nm)を収集し、電子顕微鏡で観察します。
結果
図1 は、プロテインキナーゼCα(PKCα)またはSPに対する一次抗体をインキュベートせずに、免疫反応性(IR)が認められなかった対照実験の例を示しています。
図2 は、マウス網膜のPKCα-IRを示しています。PKCαは、網膜18のすべての桿体双極細胞(RBC)のマーカーとして機能します。電子顕微鏡(EM)レベルでは、赤血球はPKCα-IRによって同定でき、高電子密度のジアミノベンジジン(DAB)反応生成物によって可視化されます。 図2A は、外網状層(OPL)のロッド末端とシナプスを形成するPKCα陽性RBC樹状突起を示し、 図2B は、PKCα陽性RBC樹状突起が錐体末端にシナプス後である錐体RBCシナプスを示しています。さらに、DAB反応生成物は、内側の網状層(IPL)のRBC末端(図2C)および軸索突起(図2D)の同定に役立ちます。
図3 は、マウス網膜のIPLにおけるシナプス前およびシナプス後結合の両方でのサブスタンスP(SP)の発現を示しています。SP-IRアマクリン細胞は、SP陰性アマクリン細胞(図3A)およびSP-IRアマクリンプロセス(データは示さず)に対してシナプス前です。さらに、SP-IRアマクリン細胞は、IPLのサブレイヤー3(S3)およびサブレイヤー5(S5)レベルでそれぞれシナプス後からバイポーラ末端にあります(図3B、C)。私たちの以前の研究では、SP-IRアマクリン細胞プロセスがIPLの他のプロセスにシナプス出力を形成するシナプスの解析について詳しく説明しています19。特に、SPの細胞内局在は、主にシナプス前末端のシナプス小胞に見られます(図3)。
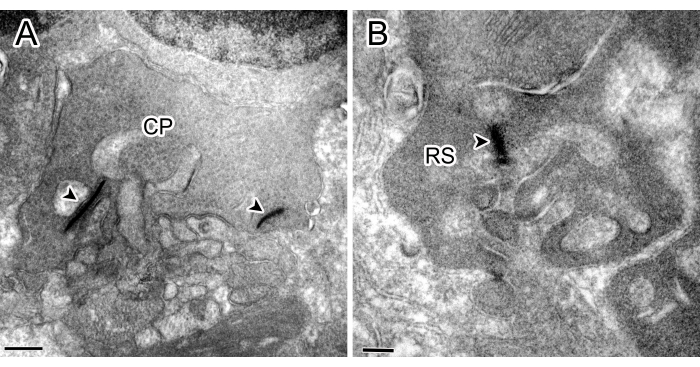
図1:対照実験の免疫電子顕微鏡写真。 OPLに2本のリボン(矢じり)(A)と1本のリボンを持つロッドスフェルール(RS)(B)は、いずれも染色を示さなかった。スケールバー:500 nm(A)、200 nm(B)。 この図の拡大版を表示するには、ここをクリックしてください。

図2:マウス網膜のPKCα抗体で標識した免疫電子顕微鏡写真(A)RSは、OPL中の1つのPKCα陽性RBC(矢印は免疫反応性を示す)および2つの水平細胞(H)と結合します。(B)CPはOPLのPKCα陽性RBCと結合します。(C)および(D)は、それぞれIPLにおけるPKCα陽性RBC末端および軸索突起を示す。スケールバー:200 nm(A)、500 nm(B)、500 nm(C)、500 nm(D)。この図の拡大版を表示するには、ここをクリックしてください。

図3:マウス網膜のIPLでSP抗体で標識した免疫電子顕微鏡写真( A)(A)SP-IRアマクリン細胞(A+)は、SP陰性アマクリン細胞(A-)に対してシナプス前です。SP-IRアマクリン細胞は、IPLのS3(B)およびS5(C)レベルでそれぞれバイポーラ端末から入力を受け取りました。スケールバー:200 nm(A)、200 nm(B)、200 nm(C)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この記事では、シナプス回路とタンパク質の局在をうまく観察するための3つの重要なステップ、(1)迅速および弱い固定、(2)免疫染色のプレエンベッド、および(3)ポスト固定とインベッドについて説明しました。
私たちは、固定化がプレエンベッド免疫EMアプローチを成功させるための重要なステップであることを提案します。したがって、ここでは新鮮な固定剤と迅速な固定の重要性が強調され、この原理を「4F原理」と名付け、組織調製において重要です。しかし、抗体の浸透性の向上と効果的な固定化の両方を達成することは課題である20。これに対処するために、グルタルアルデヒドは、グルタルアルデヒドが抗原決定因子を破壊し、免疫染色に影響を与える可能性があるため、抗体の浸透を改善するために、初期固定中にピクリン酸に置き換えられた21。対照的に、ピクリン酸は、固定効果が損なわれるものの、膜構造および組織完全性22をよりよく保存する。第3ステップでは、組織固定を最適化するために、2%グルタルアルデヒドを固定後治療に使用しました。
ここで紹介するプロトコルの要点は、5つのステップです: (1)早期固定:初期段階でピクリン酸を利用することで、抗原決定因子の混乱を最小限に抑えながら、抗体の浸透を改善します。(2)固定後:免疫染色後の組織固定を強化するために2%グルタルアルデヒドを使用します。(3)還元処理:0.1M PB(pH 7.4)中の1%NaBH4に組織を30分間インキュベートして免疫反応性の多くを回復させ、抗原と抗体の免疫反応性を改善し、陽性シグナルを強化します23。(4)組織調製:硝子体を切除し、網膜組織を小さなストリップに切断して、効果的な抗体インキュベーションを促進し、シグナルを均一にします。(5)さらに、網膜組織を細心の注意を払って取り扱い、手順全体を通じてその後の観察を損なう可能性のある損傷を回避することが不可欠です。これらの測定は、集合的にプレエンベッド免疫電子顕微鏡法の成功に貢献し、cone-RBCシナプス24、SP-IR分子局在19、マウス網膜25におけるα-Synの精密発現などの多様な側面を研究することを可能にする。
最初の抗体をインキュベートする前に、非特異的なシグナル干渉を排除するために、2% NGSで網膜ストリップをブロックすることが不可欠です。最初の抗体の濃度は、抗体自体に基づいて決定する必要があり、通常は凍結切片染色に使用される濃度よりも高く、事前に最適化する必要があります。一次抗体のインキュベーション期間中は、積み重ねられた網膜ストリップが抗体と完全に接触し、積み重ねられた部分の不完全な浸透を防ぐために、微量遠心チューブを連続的に回転させる必要があります。シグナルを増幅するために、DABを標準的なDAB染色の前に事前にインキュベートし、特異的染色時間は通常10〜20分の範囲でした。時間が短すぎると、信号が観測するには弱すぎる可能性があり、長すぎると偽陽性の信号が発生し、正確な判断に影響を与える可能性があります。一般に、色素のインキュベーション時間は、組織の表面色(茶色から暗褐色)に直接依存します。
実験は、シグナルを増強するために液体窒素中で組織を凍結して行われたが、前述のように18,26,27、この方法は正のシグナルを増幅したが、網膜細胞の膜構造が不良になる結果となった(データは示さず)。この構造劣化により、細胞の種類を正確に特定することが困難になりました。これを考慮すると、網膜組織は繰り返し凍結されませんでした。陽性シグナルを増強するために、抗体のインキュベーション時間を適切に延長しました。提案されたプロトコルは、以前の利点を組み合わせて、寒天埋め込みと比較して手順を簡素化します。これにより、タンパク質の抗原決定因子が保護されるだけでなく、細胞膜の完全性も維持されます。包括的な目標は、経路全体にわたる神経伝達物質のシナプス結合と細胞局在を探求することです。したがって、プロトコール中のDAB反応生成物は銀強化処理を受けておらず、神経伝達物質特異的なシナプス結合および経路28の調査により適している。
現在、超微細構造レベルで経路や神経伝達物質を化学的に同定する方法は限られています。そのような方法の一つが、相関光電子顕微鏡法(CLEM)29,30であるが、これは非常に狭い領域に限定されており、経路全体を通して接続を特定する能力を欠いている。プリエンベッド型免疫電子顕微鏡の強みは、その堅牢なシグナル、広い範囲、および長距離分析の位置決めと追跡のための能力にあります 13,14,15。ただし、この方法には、拡散信号などの制限もあり、特異性が低くなります。膜受容体、特に膜上の受容体の正確な局在化には、ポストエンベッドイムノゴールドEMを使用する方が適している場合があります。この技術により、金粒子の直接計数が可能になり、これらの膜受容体16の数および変動性の分析が容易になる。
将来的には、プレ埋め込み免疫EMとボリュームEMの統合は、同定された神経回路の長期的な探索に有効な方法として有望であり、この方法のさらなる開発のための将来の展望を表しています。ボリュームEMは、特定の構造の同定のために形態学に依存して、構造の再構築に焦点を当てており、正確な化学的同定を欠いています31,32。プレエンベッド免疫電子顕微鏡とボリューム電子顕微鏡を組み合わせることで、三次元再構成中に特定の構造や物質を同定することができ、神経回路の同定に対するより包括的で視覚的に直感的なアプローチが可能になります。
開示事項
著者は開示していません。
謝辞
この研究は、National Key Research and Development Program of China(2022YFA1105503)、State Key Laboratory of Neuroscience(SKLN-202103)、Zhejiang Natural Science Foundation of China(Y21H120019)からの助成金によって部分的に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe needle | kangdelai | ||
| 1% OsO4 | Electron Microscopy Science | 19100 | |
| 2,2,2-Tribromoethanol | Sigma-Aldrich | T48402 | |
| 8% Glutaraldehyde | Electron Microscopy Science | 16020 | |
| 8% Paraformaldehyde | Electron Microscopy Science | 157-8 | |
| Acetone | Electron Microscopy Science | 10000 | |
| Anti-rabbit PKC | Sigma-Aldrich | P4334 | |
| Anti-Rabbit SP | Abcam | ab67006 | |
| DAB Substrate kit | MXB Biotechnologies | KIT-9701/9702/9703 | |
| Elbow scissors | Suzhou66 vision company | 54010 | |
| Electron microscope | Phillips | CM120 | |
| Epon resin | Electron Microscopy Science | 14910 | |
| forcep | Suzhou66 vision company | S101A | |
| Millipore filter paper | Merck Millipore | PR05538 | |
| Na2HPO4· 12H2O | Sigma | 71650 | A component of phosphate buffer |
| NaH2PO4· H2O | Sigma | 71507 | A component of phosphate buffer |
| Picric acid | Electron Microscopy Science | 19550 | |
| Sodium borohydride (NaBH4) | Sigma | 215511 | |
| Tris | Solarbio | 917R071 | |
| Ultramicrotome | Leica | ||
| Uranyl acetate | Electron Microscopy Science | 22400 | |
| VACTASTAIN ABC kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-4001 |
参考文献
- Chua, N. J., et al. A complete reconstruction of the early visual system of an adult insect. Curr Biol. 33 (21), 4611-4623.e4614 (2023).
- Ravi Chander, P., Hanson, L., Chundekkad, L., Awatramani, G. B. Neural circuits underlying multi-feature extraction in the retina. J Neurosci. , (2023).
- Sirivisoot, S., et al. Development and characterization of mouse anti-canine PD-L1 monoclonal antibodies and their expression in canine tumors by immunohistochemistry in vitro. Vet Q. 43 (1), 1-9 (2023).
- Raeisi, H., et al. Development and characterization of phage display-derived anti-toxin antibodies neutralizing TcdA and TcdB of Clostridioides difficile. Microbiol Spectr. 11 (5), e0531022 (2023).
- Ryschich, A., Dong, Y., Schäfer, M., Ryschich, E., Karakhanova, S. DWH24: A new antibody for fluorescence-based cell death analysis. Methods Appl Fluoresc. 11 (4), (2023).
- Jastrzebska, B., et al. Functional characterization of rhodopsin monomers and dimers in detergents. J Biol Chem. 279 (52), 54663-54675 (2004).
- Huang, P., et al. Mechanism of Shenfu injection in suppressing inflammation and preventing sepsis-induced apoptosis in murine cardiomyocytes based on network pharmacology and experimental validation. J Ethnopharmacol. 322, 117599 (2024).
- Maheshwari, U., et al. Inorganic phosphate exporter heterozygosity in mice leads to brain vascular calcification, microangiopathy, and microgliosis. Brain Pathol. 33 (6), e13189 (2023).
- Mackiewicz, J., et al. Effect of gravity in long-term vitreous tamponade: In vivo investigation using perfluorocarbon liquids and semi-fluorinated alkanes. Graefes Arch Clin Exp Ophthalmol. 245 (5), 665-675 (2007).
- Luján, R., Rubio, M. E. Editorial: Immunoelectron microscopy: Placing molecular functions within a neuronal context. Front Neuroanat. 16, 1043371 (2022).
- Xu, S., et al. Synaptic changes and the response of microglia in a light-induced photoreceptor degeneration model. Mol Vis. 27, 206-220 (2021).
- Chadha, A., Volland, S., Baliaouri, N. V., Tran, E. M., Williams, D. S. The route of the visual receptor rhodopsin along the cilium. J Cell Sci. 132 (10), jcs.229526 (2019).
- Huang, H. J., et al. Multiple nucleocapsid structural forms of shrimp white spot syndrome virus suggests a novel viral morphogenetic pathway. Int J Mol Sci. 24 (8), 7525 (2023).
- Tissarinen, P., et al. Elevated human placental heat shock protein 5 is associated with spontaneous preterm birth. Pediatr Res. 94 (2), 520-529 (2023).
- Huang, Z., et al. A neural tract tracing study on synaptic connections for cortical glutamatergic terminals and cervical spinal calretinin neurons in rats. Front Neural Circuits. 17, 1086873 (2023).
- Zhang, J., Petralia, R. S., Wang, Y. X., Diamond, J. S. High-resolution quantitative immunogold analysis of membrane receptors at retinal ribbon synapses. J Vis Exp. 108, e53547 (2016).
- Ottersen, O. P., Landsend, A. S. Organization of glutamate receptors at the synapse. Eur J Neurosci. 9 (11), 2219-2224 (1997).
- Greferath, U., Grünert, U., Wässle, H. Rod bipolar cells in the mammalian retina show protein kinase C-like immunoreactivity. J Comp Neurol. 301 (3), 433-442 (1990).
- Wang, F., et al. Distribution and synaptic organization of substance P-like immunoreactive neurons in the mouse retina. Brain Struct Funct. 228 (7), 1703-1724 (2023).
- van Opbergen, C. J. M., et al. 34;Orphan" Connexin43 in Plakophilin-2 deficient hearts revealed by volume electron microscopy. Front Cell Dev Biol. 10, 843687 (2022).
- Li, S., et al. Safe and efficient oral allergy immunotherapy using one-pot-prepared mannan-coated allergen nanoparticles. Biomaterials. 303, 122381 (2023).
- Yamashita, K., Kusakabe, M., Sano, M. A simple and rapid method of dissociating hepatocytes from fixed liver of the mouse. Stain Technol. 56 (1), 29-33 (1981).
- Tanabe, T., Shin, M., Fujiwara, K. Immunoelectron microscopy study of polyamines using a newly prepared monoclonal antibody against spermidine: use of a mixture of glutaraldehyde and paraformaldehyde as a cross-linking agent in the preparation of the antigen. J Biochem. 135 (4), 501-507 (2004).
- Xiao, J., et al. Rod bipolar cells receive cone photoreceptor inputs through both invaginating synapses and flat contacts in the mouse and guinea pig retinas. J Comp Neurol. 531 (11), 1184-1197 (2023).
- Yang, Q., et al. Expression of α-Synuclein in the mouse retina is confined to inhibitory presynaptic elements. J Comp Neurol. 531 (10), 1057-1079 (2023).
- Yazulla, S., Studholme, K. M., Zucker, C. L. Synaptic organization of substance P-like immunoreactive amacrine cells in goldfish retina. J Comp Neurol. 231 (2), 232-238 (1985).
- Sassoè-Pognetto, M., Wässle, H., Grünert, U. Glycinergic synapses in the rod pathway of the rat retina: cone bipolar cells express the alpha 1 subunit of the glycine receptor. J Neurosci. 14 (8), 5131-5146 (1994).
- Hartveit, E., et al. Localization and developmental expression of the NMDA receptor subunit NR2A in the mammalian retina. J Comp Neurol. 348 (4), 570-582 (1994).
- Perkins, G. A. The use of miniSOG in the localization of mitochondrial proteins. Methods Enzymol. 547, 165-179 (2014).
- Shu, X., et al. A genetically encoded tag for correlated light and electron microscopy of intact cells, tissues, and organisms. PLoS Biol. 9 (4), e1001041 (2011).
- Kar, D., et al. Volume electron microscopy reveals human retinal mitochondria that align with reflective bands in optical coherence tomography [Invited]. Biomed Opt Express. 14 (10), 5512-5527 (2023).
- Johnson, J. E., et al. Spatiotemporal regulation of ATP and Ca2+ dynamics in vertebrate rod and cone ribbon synapses. Mol Vis. 13, 887-919 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved