Method Article
Fare Yuvarlak Spermatid Enjeksiyonu
Bu Makalede
Özet
Burada, farelerde yuvarlak spermatid enjeksiyonu (ROSI) gerçekleştirmek için bir yöntem sunuyoruz, umut verici klinik uygulamaları olan ve embriyonik gelişimin altında yatan mekanizmaları araştırmak için faydalı bir teknik.
Özet
Haploid genetik içerikleri ile karakterize edilen yuvarlak spermatidler, olgun spermatozoanın öncü hücrelerini temsil eder. Yenilikçi yuvarlak spermatid enjeksiyonu (ROSI) tekniği sayesinde, oositler başarılı bir şekilde döllenebilir ve canlı fetüslere dönüştürülebilir. 1995 yılında ulaşılan çığır açan bir dönüm noktasında, ROSI teknolojisi ile ilk fare fetüsü doğdu. ROSI o zamandan beri embriyonik gelişimi yöneten karmaşık mekanizmaları çözmek için çok önemli bir araç olarak ortaya çıkmıştır ve fare neslinin hızlandırılması ve genetiği değiştirilmiş farelerin üretimi de dahil olmak üzere çeşitli uygulamalarda önemli bir potansiyele sahiptir. 1996 yılında, ROSI teknolojisi ile ilk insan fetüsü doğduğunda bir dönüm noktasına ulaşıldı. Bununla birlikte, bu yöntemin klinik uygulamaları dalgalı bir başarı ve başarısızlık modeli göstermiştir. Bugüne kadar, ROSI teknolojisi, öncelikle düşük doğum verimliliği ve fetal güvenliğin yetersiz doğrulanması nedeniyle klinik uygulamada yaygın bir uygulama bulamamıştır. Bu makale, temel araştırmalara ve potansiyel klinik uygulamalarına yeni bir ışık tutmayı amaçlayan, farelerde ROSI gerçekleştirmenin kesin yöntemlerinin kapsamlı bir açıklamasını sunmaktadır.
Giriş
Spermatogenezin son aşaması, yuvarlak bir spermatidin, farklı baş, boyun ve uzun kuyruk yapıları ile karakterize edilen tam gelişmiş bir spermatozoona dönüşümünü içerir1. Bu dönüşüm, çekirdekte kromatinin yoğunlaşması, histonların protamin ile yer değiştirmesi, akrozom oluşumu, mitokondriyal kılıf gelişimi, sentriol göçü ve kaybı, kuyruk yapısı oluşumu ve hücresel kalıntıların uzaklaştırılması gibi hücre morfolojisindeki önemli değişiklikleri kapsar2.
1992 yılında, ilk insan fetüsü intrasitoplazmik sperm enjeksiyonu (ICSI) teknolojisi ile başarıyla doğdu3. O zamandan beri araştırmacılar, oositleri döllemek ve canlı gebelikleri sürdürmek için olgun spermatozoa ile aynı haploid genetik bileşimi paylaşan yuvarlak spermatidleri kullanma potansiyelini araştırıyorlar 2,4. Daha sonra, 1996 yılında, yuvarlak spermatid enjeksiyonu (ROSI) teknolojisi ile gebe kalan ilk insan fetüsü teslim edildi 5,6. Farelerde ICSI ve ROSI içeren çalışmaların, fare oosit zarının enjeksiyon işlemi sırasında hasara yatkınlığı nedeniyle insanlardakilerin gerisinde kaldığını belirtmekte fayda var. Bu sorun, Piezo membran kırma cihazının piyasaya sürülmesiyle başarıyla çözüldü. Sonuç olarak, 1995 yılında ROSI teknolojisi ile tasarlanan ilk fare doğdu. Ek olarak, diğer çeşitli hayvanlarda ROSI ile ilgili araştırmalar da devam etmektedir 7,8.
Şu anda, ROSI ile ilgili araştırmalar temel olarak aşağıdaki hususlar etrafında yoğunlaşmaktadır: klinik uygulama, mekanizma açıklaması ve ROSI teknolojisinin daha geniş uygulamaları ile birlikte gelişimsel verimliliği artırmaya yönelik stratejiler. Klinik uygulamalar bağlamında, 1996 yılında ROSI aracılığıyla ilk ROSI insan fetüsünün doğumuna rağmen, ilerleme bir dizi başarı ve başarısızlıkla işaretlenmiştir 9,10,11,12. Bugüne kadar, ROSI teknolojisi, büyük ölçüde düşük verimliliği ve ROSI teknolojisi ile tasarlanan fetüslerin güvenliği ile ilgili daha fazla doğrulama ihtiyacı nedeniyle yaygın bir klinik uygulama elde edememiştir. Eksik istatistikler, küresel olarak, 200'den az insan ROSI ile gebe kalmış fetüsün teslim edildiğini göstermektedir. ROSI teknolojisinin potansiyelini anlamada bir dönüm noktası, 2015 yılında Tanaka ve meslektaşlarının ROSI teknolojisi aracılığıyla 14 fetüsün başarılı bir şekilde doğduğunu bildirdiklerinde meydana geldi ve klinik uygulamasına ve uygulanabilirliğine yeniden güven aşıladı13,14. ROSI teknolojisi, özellikle obstrüktif olmayan azospermi hastalarında üreme biyolojisi zorluklarını ele almak için önemli bir umut vaat etmektedir. Klinik uygulamalarına ek olarak, ROSI, embriyonik gelişimin karmaşık mekanizmalarını incelemek için değerli bir araç olarak hizmet eder 15,16,17.
Tam embriyonik gelişimin sağlanmasında ROSI'nin düşük verimliliğine katkıda bulunan altta yatan faktörleri araştırmak için çok sayıda hayvan çalışması yapılmıştır. Bu faktörler, yardımlı oosit aktivasyonu (AOA) yöntemlerinin seçimini ve zamanlamalarını, genomik stabilitedeki anormallikleri ve özellikle epigenetik modifikasyonlardaki anormallikleri kapsar. Yuvarlak spermatidlerin, çeşitli fizyolojik yönlerden olgun spermatozoadan önemli ölçüde farklı olan olgunlaşmamış germ hücreleri olduğunu bilmek önemlidir. Mizuki Sakamoto ve meslektaşları, yuvarlak spermatidlerden türetilen H3K27me3'ün, daha az erişilebilir olan ve ROSI embriyolarında bozulmuş gen ekspresyonuna yol açan kromatin ile ilişkili olduğunu belirtti18. Jing Wang ve meslektaşları tarafından yapılan ilgili bir çalışmada, pronükleer aşamalarda ROSI embriyolarındaki yeniden programlama kusurları, ağırlıklı olarak minör zigotik genom aktivasyonundan sorumlu genlerin bir kohortunun yanlış ekspresyonu ile ilişkilendirilmiştir19. Ayrıca, seçici bir ökromatik histon lizin metiltransferaz 2 inhibitörü olan A366'nın eklenmesinin, genel gelişim oranını potansiyel olarak yaklaşık iki kat artırabileceğini buldular.
Fare, embriyonik gelişimi incelemek için en değerli model hayvanlardan biri olarak duruyor. Bu makale, fareler üzerinde ROSI'nin nasıl gerçekleştirileceğini detaylandırmaktadır. Bu kapsamlı protokol, uygun farelerin seçimini, ayrıntılı yumurtlama indüksiyon prosedürlerini, AOA tekniklerini, enjeksiyon tekniklerini ve vekil farelerin hazırlanmasını kapsar. Ayrıca, iki enjeksiyon rejiminin doğum verimliliği üzerindeki etkilerinin karşılaştırmalı bir analizini sunuyoruz: AOA'yı takiben ROSI (A-ROSI; birinci rejim) ve ROSI'yi takiben AOA (ROSI-A; ikinci rejim). Araştırmacıları, fare ROSI deneylerini daha hassas bir şekilde yürütmeye teşvik etmeyi, klinik uygulamaları ve embriyonik gelişim mekanizmalarının temel araştırmaları için daha sağlam destek sunmayı amaçlıyoruz.
Protokol
Bu deneyde kullanılan B6D2F1 (C57BL/6 x DBA/2), C57BL/6 ve ICR fareleri Beijing Vital River Laboratory Animal Technologies Co. Ltd.'den (Pekin, Çin) satın alındı. Tüm hayvan tedavileri, Jilin Üniversitesi Birinci Hastanesi Deney Hayvanları Etik Kurulu tarafından onaylanan deneysel prosedürlere ve standartlara bağlı kalmıştır (onay numarası: 20200435).
1. İlgili reaktiflerin hazırlanması
- Bazı reaktifleri ticari olarak edinin ve kalan reaktifleri kendiniz hazırlayın.
- Tedarikçiden yuvarlak spermatidlerin (RS), spermatozoaların ve oositlerin in vitro işlenmesi için bir tampon sistem olanM2'yi edinin.
- Daha önce yayınlanan protokol20'yi izleyerek AOA için Ca2+ içermeyen CL Chatot, CA Ziomek ve BD Bavister (CZB) ortamını hazırlayın.
- Embriyo kültürü için amino asitler (KSOMaa) çözeltisi ile desteklenmiş potasyum simpleks optimize edilmiş ortamı tedarikçiden temin edin.
- 0.1 g hyaluronidazı 1 mL embriyo suyunda çözerek% 0.1 (1 g / L) çalışma konsantrasyonuna sahip hyaluronidaz hazırlayın. 10 μL konsantre depolama çözeltisi alın ve 1 hafta boyunca 4 ° C'de saklanabilen 990 mLM2 içinde çözün.
- Ortalama moleküler ağırlığı 360.000 ve kütle konsantrasyonu %12 olan polivinilpirolidonu (PVP), 1.2 g PVP'yi 10 mLM2'de çözerek hazırlayın. Elde edilen çözelti 1 hafta boyunca 4 ° C'de saklanabilir.
- -20 ° C'de 18 μL DMSO içinde çözünür sitokalasin B (CB) stok çözeltisini (2 μL) saklayın. 5 μL konsantre depolama çözeltisi alın ve 995 mLM2 içinde çözün. Elde edilen çözelti 1 hafta boyunca 4 ° C'de saklanabilir.
2. Oositlerin hazırlanması
- 6-8 haftalık dişi B6D2F1 farelerini en az 1 hafta boyunca yeni ortamlarına alıştırın. Öğleden sonra 5'te 7.5 IU hamile kısrak serum gonadotropini (PMSG) ile intraperitoneal olarak enjekte edin, ardından 48 saat sonra 7.5 IU insan koryonik gonadotropini (HCG) izleyin. Enjeksiyondan sonra erkek farelerle temas olmadığından emin olun.
NOT: Belirtilen saat (17:00) zorunlu değildir. Sadece iş rahatlığı içindir. Saat 17:00'den sonraki 14 saat, oositlerin hazır olduğu ve enjeksiyonun yapıldığı sabah 7'dir, bu nedenle enjeksiyon zamanı sabah için planlanır. Enjeksiyonun başlama zamanı laboratuvarın günlük programına göre ayarlanabilir. - 14 saatlik HCG enjeksiyonundan sonra, servikal dislokasyon yöntemini kullanarak fareleri ötenazi yapın. Karın boşluğunu açın ve uterusu bulun. Rahim boyunca yumurtalıkları tanımlayın ve yumurtalıkların yakınındaki fallop tüplerini makas kullanarak kesin. Aynı işlemi diğer tarafta da tekrarlayın ve fallop tüplerini önceden 37 °C'de önceden ısıtılmış olan M2'ye yerleştirin.
- Dik bir mikroskop (10x) altında, fallop tüpünün şeffaf ve şişmiş bir görünüm gösteren genişlemiş kısmını bulun. Fallop tüpünü sabitlemek için 1 mL'lik bir şırınga kullanın, genişlemiş kısmı keserek oosit koronal kümülüs komplekslerini (OCCC'ler) toplayın.
- OCCC'leri %0.1 hyaluronidaz içeren önceden ısıtılmış M2 çalışma solüsyonuna yerleştirin ve oral bir pipetten hafifçe üfleyerek granüloza hücrelerini çıkarın.
NOT: OCCC'leri kısa bir süre, gerekirse yaklaşık 2 dakika% 0.1 hyaluronidaz içinde tutun. - Granüloza hücrelerini çıkardıktan sonra, oositi KSOMaa'ya aktarın, 3 kez durulayın ve daha sonra kullanmak üzere bir karbondioksit inkübatörüne yerleştirin (37 ° C,% 5 CO2).
3. Yuvarlak spermatidlerin ve spermatozoaların hazırlanması
- Sırasıyla erkek C57BL / 6 farelerinin (8-10 hafta) testis ve epididiminden yuvarlak spermatidleri ve spermatozoaları toplayın.
- Spermatozoa için, fareleri servikal çıkık ile ötenazi yapın. Karın boşluğunu açın, epididimi testisin yanına yerleştirin ve makasla nazikçe çıkarın.
- EpididimiM2 ortamına yerleştirin ve spermatozoanın dik mikroskop altında (10x) dışarı akmasına izin vermek için 1 mL'lik bir şırınga kullanarak hafifçe eksize edin.
- Akan spermatozoa veM2 süspansiyonunu 0.5 mLM2 içeren bir tüpün dibine sifonlayın ve spermatozoanın doğal olarak yukarı akışa akmasına izin verin. Bunları daha sonra kullanmak üzere bir kenara koyun.
- Yuvarlak spermatidler için, testisleri karın boşluğundan çıkarın veM2'ye yerleştirin. Beyaz zarı 1 mL'lik bir şırınga kullanarak nazikçe kesin ve kıvrımlı seminifer tübülleri dik bir mikroskop (10x) altında sıkın.
- İki adet 1 mL şırınga kullanarak seminifer tübülleri dikkatlice çıkarın. Süspansiyonu ve filtreyi 400 gözenekli bir elek (38 μm) ile çıkarın.
- Filtrelenmiş hücreleri santrifüjleyin, süpernatanı atın ve boyama için 200 μL Hoechst 33342 ekleyin, ardından 37 ° C'de 10 dakika inkübe edin.
- Yuvarlak spermatidleri diğer hücre tiplerinden ayırt etmek için floresanla aktive edilen hücre sıralaması (FACS) yapın. Lekeli hücreleri bir akış sitometri tüpüne yerleştirin ve yuvarlak bir spermatid taraması yapın.
- Akış sitometri makinelerinin farklı modelleri farklı düzenleyici parametrelere sahiptir ve çalışma sırasında teknik destek ile iletişim kurabilir. İlk adım olarak, voltajı ayarlayın ve hücre popülasyonunu ileri saçılmaya (FSS) ve yan saçılmaya göre seçin (SSC; Ek Tablo 1'e bakınız).
- İkinci adım için, FSC'ye göre hücre yapışıklıklarını çıkarın ve darbe genişliğini tetikleyin.
- Üçüncü adım olarak, hedef haploid yuvarlak spermatidleri seçin. Hoechst 33342 DNA'ya bağlanır ve farklı ploidiye sahip hücreler farklı floresan yoğunlukları sergiler. Uyarma dalga boyunu 355 olarak ayarlayın. Yuvarlak spermatidleri sıralamak için 355 dalga boyu lazer altında 460/50 ve 670/30 olmak üzere iki algılama kanalı seçin. Daha sonra, sıralanan yuvarlak spermatidleri daha sonra kullanmak üzere 4 ° C'lik bir buzdolabında saklayın.
NOT: Mikroskop altında morfolojilerine göre yuvarlak spermatidleri doğrudan seçmek de mümkündür, ancak seçim doğruluğunu sağlamak için eğitim gereklidir.
4. Yuvarlak spermatid enjeksiyonu (ROSI)
- ROSI prosedürünü bir mikromanipülasyon sistemi ile ters çevrilmiş bir mikroskop kullanarak gerçekleştirin.
- İlk hazırlık adımında, daha önce açıklanan prosedüre21 göre tutma ve enjeksiyon iğneleri yapın. Enjeksiyon iğnesinin iç çapını, yuvarlak spermatidlerin çıkarılması için tasarlanmış 6-7 μm arasında tutun ve tutma iğnesi için, oositi sabitlemek için 20 μm'lik bir iç çapa sahip olun.
- Sonraki hazırlık adımında, oositleri yumuşatmak için CB içeren 10 μLM2 damlacıkları ve yuvarlak spermatidleri depolamak için 10 μLM2 damlacıkları yerleştirerek bir enjeksiyon kabı oluşturun. Enjeksiyon iğnelerini nemlendirmek ve temizlemek için PVP damlacıkları kullanın.
NOT: Buraya CB eklemek gerekli bir adım değildir, ancak CB eklemek enjeksiyondan sonra hayatta kalma oranını büyük ölçüde artırabilir. - Bir enjeksiyon iğnesi kullanarak yuvarlak spermatidleri çıkarın.
- Oositin polar gövdesini saat 12 veya saat 6 konumuna getirerek oositi bir tutma iğnesi ile döndürün.
- Enjeksiyon iğnesini, zona pellucida'ya sıkıca yapışarak oosit üzerindeki saat 3 konumuna dikkatlice yerleştirin. Zona pellucida'da bir delik oluşturmak için bir PiezoXpert cihazı kullanın. Gücü küçükten büyüğe ayarlayın, bu yaklaşık olarak yoğunluk = 5 ve burada hız = 15'tir.
- Enjeksiyon iğnesini zona pellucida'dan yavaşça ilerletin ve oositi yatay olarak girin. Oositin merkezini geçtiğinde, bir piezo uygulayın (yoğunluk = 1 ve hız = 1), bu da oosit zarının yırtılmasına ve yuvarlak spermatidin oositin sitoplazmasına kademeli olarak enjekte edilmesine neden olur.
- Enjeksiyon iğnesini geri çekin ve kapatmak için açıklığın yakınında küçük bir miktar oosit zarını aspire edin. Bu adım çok önemlidir, çünkü sızdırmazlığın yapılmaması sitoplazmik sızıntıya ve oosit ölümüne neden olur.
NOT: ROSI'nin, sonraki bölümlerde tartıştığımız yuvarlak spermatidlerin enjeksiyonundan önce veya sonra AOA'ya ihtiyaç duyduğunu belirtmekte fayda var.
5. İntrasitoplazmik sperm enjeksiyonu (ICSI)
- ICSI için ROSI ile aynı adımları uygulayın, tek fark 9-10 μm ölçen ICSI enjeksiyon iğnesinin çapıdır.
- Yüzme hızlarını azaltmak ve sperm ekstraksiyonunu kolaylaştırmak için spermatozoaları bir PVP pistine yerleştirin.
- ICSI için spermatozoa başının ve kuyruğunun ayrılmasını gerçekleştirin. Spermatozoayı kuyruktan aspire edin ve spermatozoanın boynunu tam olarak enjeksiyon iğnesinin ağzına yerleştirin. Spermatozoanın başını ve kuyruğunu ayırmak için bir piezo (gerektiğinde birden fazla piezo kullanılabilir, yoğunluk = 5 ve hız = 15) uygulayın.
6. Yardımlı oosit aktivasyonu (AOA)
- Protokole göre, kalsiyum ve magnezyum içermeyen bir CZB ortamı hazırlayın.
- 10 mM konsantrasyonda moleküler ağırlığı 266.62 olan stronsiyum klorür hekzahidrat (SrCl26H2O) kullanın. Hazırlamak için 0.26662 g SrCl26H2O'yu 1 mL embriyo suyunda çözün. Kullanım sırasında, 990 μL Ca2+ içermeyen CZB ortamına 10 μL konsantre depolama solüsyonu ekleyin ve hemen kullanın.
- Oositleri aktivasyon için SrCl 26H 2Oiçeren Ca2+ içermeyen CZB ortamına yerleştirin; her damlacık 20 μL'lik bir hacme sahiptir ve her seferinde 20 oosit yerleştirilir. 20 dakika inkübe edin.
- Eşzamanlı olarak, yuvarlak spermatidler veya spermatozoa enjekte etmeden partenogenez aktivasyonu için bir grup oluşturun. Partenogenez aktivasyon grubunun istatistiksel analiz yapılmadan gösterildiğine ve kontrol grubunun ICSI olduğuna dikkat edilmelidir.
7. Embriyo transferi
- Bağlanmış ICR erkek ve dişi fareleri 1: 2 oranında barındırın. Ertesi sabah, dişi fareleri vajinal tıkaç varlığı açısından inceleyin ve nakil için vajinal tıkaç olanları seçin.
- 2 hücreli embriyolardan oluşan transfer edilen embriyoları önceki sabah enjekte edin ve ertesi öğleden sonra transfer edin.
- Dişi farenin sırtında bir kesi yapın, beyaz yağı ve yumurtalıkları ortaya çıkarın ve fallop tüpünün genişlemiş kısmını dik bir mikroskop altında (10x) bulun.
- Fallop tüpünün genişlemiş kısmında bir açıklık oluşturmak için 1 mL'lik bir şırınga kullanın ve embriyoları oral bir pipet ile aspire edin. Embriyoları nazikçe uterus yönünde yerleştirin. 5-0 (0.09-0.11 mm) kalınlığında, 4 x 10 model kavisli iğne kullanarak yarayı dikin. Sütür, karın zarı için bir katman ve dış deri için bir katman olmak üzere iki katman halinde yapılır.
- Taşıyıcı fareler için, deney programına göre sezaryen yapın. Fareleri servikal dislokasyon yöntemiyle ötenazi yapın, alkolle dezenfekte edin ve karın boşluğunu açın. Uterusu nazikçe ve hızlı bir şekilde kesin ve fetüsü ve plasentayı göstermek için amniyotik boşluğu açın. Göbek kordonunu çıkarın ve fetüse yakın taraftan kesin; Fetüs, aynı dönem emziren fareler tarafından beslendi.
NOT: Doğum oranlarının hesaplanması ihtiyacı nedeniyle, sezaryen üretim kapasitesi açısından daha doğrudur. Doğal doğumda, yavrular anne tarafından yenebilir ve bu da yanlış istatistiklere neden olabilir. Erken evrede nakledilen vekil farelere sezaryen yapılır ve doğumdan önce ötenazi sezaryen yapılır.
8. İstatistiksel analiz
- Analiz etmek için GraphPad Prism 5'i kullanın. Veriler ortalama ± SD cinsinden ifade edilir; P < 0.05 istatistiksel bir farkı gösterir ve P < 0.01 anlamlı bir istatistiksel farkı gösterir.
Sonuçlar
Araştırmamıza, AOA'nın embriyoların gelişim yetenekleri üzerindeki etkisini inceleyerek başladık. Deney tasarımının şematik bir gösterimi Şekil 1A'da gösterilmiştir. Spermatozoon enjeksiyonundan önce, oositlere AOA (A-ICSI) uygulandı veya tedavi edilmedi (ICSI) kaldı. Embriyonik gelişim ile ilgili detaylı veriler Tablo 1'de sunulmuştur. Sonuçlar, A-ICSI ve ICSI grupları arasında bölünme, blastosist veya doğum oranlarında anlamlı bir fark olmadığını gösterdi (P > 0.05; Şekil 1B). Bu bulgular, AOA'nın 20 dakika boyunca 10 mM SrCl2 kullanılmasının embriyoların gelişim potansiyelini etkilemediğini göstermektedir.
Daha önce, FACS veya mikroskop altında doğrudan görsel inceleme ile seçilen ROSI embriyolarının gelişimsel etkinliğinde belirgin bir fark olmadığı bildirilmişti22. Deneylerimizde RS'yi tanımlamak için FACS teknolojisi kullanılmıştır (Şekil 2A,B). Mikroskop altında, fare yuvarlak spermatidleri yaklaşık 10 μm çapındaydı ve ortada çıkıntı benzeri bir nükleolus yapısı sergiliyordu (Şekil 2C). FACS yoluyla seçimin, mikroskop altında doğrudan görsel incelemeden daha doğru olduğunu varsayıyoruz. Ek olarak, literatür RS'nin morfolojik farklılıklar yoluyla doğrudan araştırılmasını desteklemektedir. ROSI embriyoları iki farklı yöntem kullanılarak üretildi: Yuvarlak spermatid enjeksiyonundan önce oositlerin AOA'ya tabi tutulduğu A-ROSI grubu ve yuvarlak spermatid enjeksiyonundan sonra oositlerin AOA'ya tabi tutulduğu ROSI-A grubu. Deney tasarımının şematik diyagramı Şekil 1C'de gösterilmiştir. Özellikle, A-ROSI, ROSI-A ve ICSI grupları arasında bölünme ve blastosist oranlarında anlamlı bir fark bulunmadı (P > 0.05; Şekil 1D). A-ROSI, ROSI-A ve ICSI gruplarının blastosist oranları aktivasyon grubundan anlamlı olarak yüksekti (P < 0.05; Şekil 1D). Bununla birlikte, ROSI grubunun doğum oranı, oositlerin enjeksiyondan önce veya sonra aktive edilip edilmediğine bakılmaksızın ICSI grubundan daha düşüktü (P < 0.05; Şekil 1D). Daha da önemlisi, A-ROSI grubunun doğum oranı ROSI-A grubununkinden biraz daha yüksekti (Şekil 1D). Embriyo gelişim verileri ile ilgili daha fazla ayrıntı Tablo 1'de sunulmaktadır.
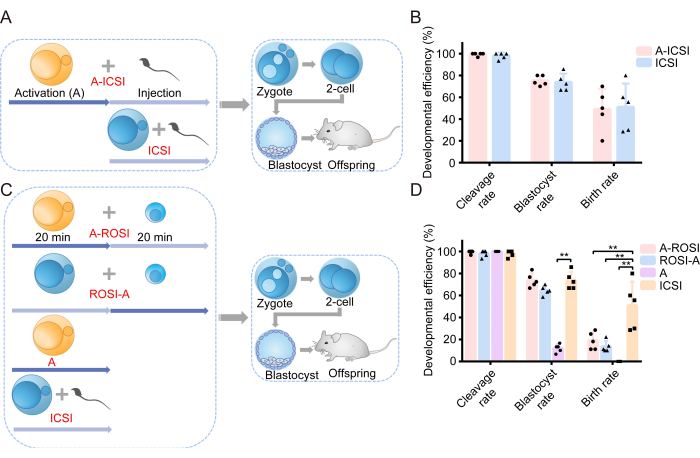
Şekil 1: ROSI embriyoları, ICSI embriyolarına kıyasla düşük gelişimsel verimlilik göstermiştir. (A) Aktivasyonun ICSI embriyonik gelişimi üzerindeki etkisini değerlendiren deneysel protokolün şematik gösterimi. Mavi = Oositler aktive edilmedi; Sarı = Oositler aktive edildi. (B) A-ICSI ve ICSI'den türetilen embriyoların gelişimsel etkinliği. (C) Farklı tipte embriyolar oluşturmak için deney protokolünün şematik gösterimi. (D) A-ROSI, ROSI-A, A ve ICSI'den türetilen embriyoların gelişimsel etkinliği. **, P < 0.01. Kısaltmalar: A= Aktivasyon E= Embriyonik gün; ROSI= Yuvarlak spermatid enjeksiyonu; ICSI= İntrasitoplazmik sperm enjeksiyonu. Hata çubukları standart sapmayı gösterir. Oranların karşılaştırılması ki-kare testi kullanılarak yapılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Yuvarlak spermatidler akım sitometrik sıralama ile seçildi. (A) Yuvarlak spermatidlerin seçimi için bir akış sitometrik sıralama diyagramı kullanıldı. (B) Yuvarlak spermatidlerin seçimini gösteren temsili resimler. Ölçek çubuğu: 10 μm. Kısaltmalar: FSC = İleri dağılım; SSC = yan saçılma; 355 uyarma dalga boyudur; 460/50 ve 670/30, 355 dalga boylu lazer altında iki algılama kanalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Grup | İmplantasyon öncesi geliştirme | İmplantasyon sonrası gelişim | |||
| Çoğaltır | Bölünme oranı (%) | Blastokist oranı (%) | 2 hücreli embriyo transfer edildi / Hayır. Alıcıların sayısı | Doğum oranı (%) | |
| A-ICSI | 5 | 99.33 (149/150) | 75.17 (112/149) | 49/5 | 48.98 (24/49) |
| A-ROSI | 5 | 99.33 (149/150) | 73.83 (110/149) | 44/5 | 18.18 (8/44) ** |
| ROSI-A | 5 | 98.00 (147/150) | 64.63 (95/147) | 45/5 | 13.33 (6/45) ** |
| Etkinleştirme | 5 | 100.00 (150/150) | 12.00 (18/150) ** | 51/5 | 0.00 (0/51) ** |
| ICSI (Uluslararası Bilişim T | 5 | 98.00 (147/150) | 73.47 (108/147) | 46/5 | 52.17 (24/46) |
Tablo 1. Farklı gruplardan elde edilen embriyoların gelişimsel etkinliği.
Ek Tablo 1. Akış sitometrisine göre sıralanan farklı hücre popülasyonlarının oranı. P3 kısmı yuvarlak spermatidlerdir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Yardımlı oosit aktivasyonu
ROSI için kritik bir ön koşul AOA'dır, çünkü yuvarlak spermatidler tek başına oosit aktivasyonunu başlatamaz. Şu anda, farelerde en yaygın yöntem stronsiyum klorür 23,24 kullanımını içerirken, en gelişmiş insan uygulaması elektriksel aktivasyonukullanır 13,14. Oosit aktivasyonunun zamanlaması da büyük önem taşır. Literatürde bildirildiği gibi, farelerde en optimal aktivasyon yaklaşımı, başlangıçta oositin aktive edilmesini ve daha sonra yuvarlak spermatid25'in enjekte edilmesini içerir. Bu, spermin başlangıçta oositlere girdiği ve daha sonra oosit26'yı aktive etmek için fosfolipaz C ζ saldığı geleneksel döllenme işlemiyle çelişir. Satoshi Kishigami ve meslektaşları tarafından yürütülen özel araştırmalar, ROSI'nin aktive edilmiş oositlerde veya sonra bir erkek çekirdeği oluşturma konusundaki diferansiyel yeteneğini vurgulamaktadır. Verimli bir yavru üretim hızı elde etmek için, her iki enjeksiyon tipi de oositler G1 faz25'e girmeden önce gerçekleştirilmelidir.
Enjeksiyon iğnesinin çapı
ROSI bağlamında, enjeksiyon iğnesinin daha büyük bir çapının mutlaka daha iyi sonuçlara dönüşmediğine dikkat etmek önemlidir. Kullanılan enjeksiyon iğnesi, yuvarlak bir spermatidden biraz daha küçük olan 6-7 μm çapa sahiptir. Bu nedenle, yuvarlak bir spermatid aspire edildiğinde, hücre zarı bir sıkıştırma etkisine maruz kalır ve bu da potansiyel olarak çekirdeğin doğrudan maruz kalmasına yol açar. Bu doğrudan maruz kalma, depolimerizasyona ve ardından erkek pronükleus27'nin oluşumuna elverişli olabilir.
Sızdırmazlık tedavisi
Fare oositleri, diğer türlere kıyasla daha az sitoplazmik viskozite sergiler. Hücre zarındaki küçük bir çatlak bile sitoplazmanın kolayca dışarı akmasına neden olarak oosit dejenerasyonuna neden olabilir28. Riski azaltmak için, yuvarlak spermatidin oosit sitoplazmasına enjekte edilmesinden ve enjeksiyon iğnesinin geri çekilmesinden sonra, ICSI21'deki prosedüre benzer şekilde, boşluğu kapatmak için oosit hücre zarının açıklığına yakın hücre zarının küçük bir bölümünü aspire etmek zorunludur. Bu mühürleme işlemi, oosit dejenerasyonu riskini önemli ölçüde azaltır.
ROSI'nin bir model olarak uygulanması
Klinik uygulamaların ötesinde, ROSI teknolojisinin model olarak çeşitli başka uygulamaları da vardır. Fare üretim sürelerini29 hızlandırabilir, farelerde baba tarafından kalıtılan bir Xist delesyonundan kaynaklanan dişi ölümcüllüğükurtarabilir 17, haploid partenogenetik iki hücreli blastomerlere15 yuvarlak spermatid enjeksiyonundan sonra fareler üretebilir, transgenik fare yavrularıüretebilir 16 ve kanser tedavisinden önce ergen çocuklarda doğurganlığı koruyabilir30,31. Fare ROSI ile ilgili titiz araştırmalar, üreme sağlığı araştırmalarındaki ilerlemelere önemli ölçüde katkıda bulunabilir.
Makalenin sınırlamaları
Bu makale, enjeksiyon için mikroskop altında doğrudan karşılaştırmalı bir RS seçiminin olmaması ve algılanan yenilik eksikliği de dahil olmak üzere çeşitli sınırlamaları olan metodolojik bir kılavuz görevi görmektedir.
Açıklamalar
Yazarlar herhangi bir mali veya diğer çıkar çatışması beyan etmezler.
Teşekkürler
Wenjie Zhao'ya akış sitometrisi yoluyla yuvarlak spermatidleri ayırmadaki paha biçilmez yardımı için ve fare embriyo transferi konusundaki uzmanlığı için Fang Wang'a şükranlarımızı sunuyoruz. Bu çalışma, Jilin Eyaleti Doğa Bilimleri Vakfı'ndan kısmi destek aldı (No. YDZJ202301ZYTS461). El yazmasının dilsel düzenlemesi ve redaksiyonu için Bullet Edits Limited'e teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| CaCl22H2O | Sigma | C7902 | Preparation of CZB |
| Glucose | Sigma | G6152 | Preparation of CZB |
| HEPES-Na (basic) | Sigma | H3784 | Preparation of CZB |
| Hoechst 33342 | Beyotime | C1025 | FACS |
| human chorionic gonadotropin (HCG) | Ningbo Second Hormone Company | HCG | Ovulation promoting drugs |
| Hyaluronidase | Sigma | H3506 | Removing granulosa cells around the oocyte |
| KCl | Sigma | P5405 | Preparation of CZB |
| KH2PO4 | Sigma | P5655 | Preparation of CZB |
| KSOMaa | Caisson Labs | IVL04-100ML | Potassium simplex optimized medium supplemented with amino acids |
| L-glutamine | Sigma | G8540 | Preparation of CZB |
| M2 | Sigma | M7167-50ML | Operating fluid |
| MgSO47H2O | Sigma | M1880 | Preparation of CZB |
| Na2-EDTA2H2O | Sigma | E5134 | Preparation of CZB |
| NaCl | Sigma | S5886 | Preparation of CZB |
| NaHCO3 | Sigma | S5761 | Preparation of CZB |
| Na-lactate 60% syrup d = 1.32 g/L | Sigma | L7900 | Preparation of CZB |
| Na-pyruvate | Sigma | P4562 | Preparation of CZB |
| Piezo drill tips (ICSI) | Eppendorf | piezoXpert | Piezoelectric membrane rupture |
| pregnant mare serum gonadotropin (PMSG) | Ningbo Second Hormone Company | PMSG | Ovulation promoting drugs |
| PVA | Sigma | P8136 | Preparation of CZB |
Referanslar
- Redgrove, K. A., McLaughlin, E. A. The role of the immune response in Chlamydia trachomatis infection of the male genital tract: A double-edged sword. Front Immunol. 5, 534(2014).
- Yanagimachi, R. Intracytoplasmic injection of spermatozoa and spermatogenic cells: Its biology and applications in humans and animals. Reprod Biomed Online. 10 (2), 247-288 (2005).
- Palermo, G., Joris, H., Devroey, P., Van Steirteghem, A. C. Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte. Lancet. 340 (8810), 17-18 (1992).
- Kimura, Y., Yanagimachi, R. Mouse oocytes injected with testicular spermatozoa or round spermatids can develop into normal offspring. Development. 121 (8), 2397-2405 (1995).
- Tesarik, J., et al. Spermatid injection into human oocytes. II. Clinical application in the treatment of infertility due to non-obstructive azoospermia. Human Reprod. 11 (4), 780-783 (1996).
- Tesarik, J., Mendoza, C. Spermatid injection into human oocytes. I. Laboratory techniques and special features of zygote development. Human Reprod. 11 (4), 772-779 (1996).
- Hirabayashi, M., et al. Activation regimens for full-term development of rabbit oocytes injected with round spermatids. Mol Reprod Dev. 76 (6), 573-579 (2009).
- Ogonuki, N., et al. Birth of a marmoset following injection of elongated spermatid from a prepubertal male. Mol Reprod Dev. 86 (8), 928-930 (2019).
- Niederberger, C., et al. Forty years of IVF. Fertil Steril. 110 (2), 185(2018).
- Gross, K. X., Hanson, B. M., Hotaling, J. M. Round spermatid injection. Urol Clin North Am. 47 (2), 175-183 (2020).
- Hanson, B. M., et al. Round spermatid injection into human oocytes: a systematic review and meta-analysis. Asian J Androl. 23 (4), 363-369 (2021).
- Tekayev, M., Vuruskan, A. K. Clinical values and advances in round spermatid injection (ROSI). Reprod Biol. 21 (3), 100530(2021).
- Tanaka, A., et al. Fourteen babies born after round spermatid injection into human oocytes. Proc Natl Acad Sci U S A. 112 (47), 14629-14634 (2015).
- Tanaka, A., et al. Ninety babies born after round spermatid injection into oocytes: survey of their development from fertilization to 2 years of age. Fertil Steril. 110 (3), 443-451 (2018).
- Yang, H., Shi, L., Chen, C. D., Li, J. Mice generated after round spermatid injection into haploid two-cell blastomeres. Cell Res. 21 (5), 854-858 (2011).
- Moreira, P., et al. Transgenic mouse offspring generated by ROSI. J Reprod Dev. 62 (1), 37-42 (2016).
- Federici, F., et al. Round spermatid injection rescues female lethality of a paternally inherited Xist deletion in mouse. PLoS Genet. 12 (10), e1006358(2016).
- Sakamoto, M., et al. Paternally inherited H3K27me3 affects chromatin accessibility in mouse embryos produced by round spermatid injection. Development. 149 (18), 200696(2022).
- Wang, J., et al. Single-cell multiomics sequencing reveals the reprogramming defects in embryos generated by round spermatid injection. Sci Adv. 8, (2022).
- Ward, M. A., Yanagimachi, R. Intracytoplasmic sperm injection in mice. Cold Spring Harb Protoc. 2018 (1), (2018).
- Yoshida, N., Perry, A. C. Piezo-actuated mouse intracytoplasmic sperm injection (ICSI). Nat Protoc. 2 (2), 296-304 (2007).
- Zhu, L., et al. FACS selection of valuable mutant mouse round spermatids and strain rescue via round spermatid injection. Zygote. 23 (3), 336-341 (2013).
- Kong, P., et al. Effects of the histone deacetylase inhibitor 'Scriptaid' on the developmental competence of mouse embryos generated through round spermatid injection. Hum Reprod. 32 (1), 76-87 (2017).
- Hosseini, S., Salehi, M. Tricostatin A-treated round spermatid enhances preimplantation embryo developmental competency following round spermatid injection in mice. Zygote. 30 (3), 373-379 (2022).
- Kishigami, S., Wakayama, S., Nguyen, V. T., Wakayama, T. Similar time restriction for intracytoplasmic sperm injection and round spermatid injection into activated oocytes for efficient offspring production. Biol Reprod. 70 (6), 1863-1869 (2004).
- Tao, Y. Oocyte activation during round spermatid injection: state of the art. Reprod Biomed Online. 45 (2), 211-218 (2022).
- Ogura, A., Ogonuki, N., Miki, H., Inoue, K. Microinsemination and nuclear transfer using male germ cells. Int Rev Cytol. 246, 189-229 (2005).
- Kimura, Y., Yanagimachi, R. Intracytoplasmic sperm injection in the mouse. Biol Reprod. 52 (4), 709-720 (1995).
- Ogonuki, N., et al. A high-speed congenic strategy using first-wave male germ cells. PLoS One. 4 (3), e4943(2009).
- Abdelaal, O., et al. Fertility preservation for pediatric male cancer patients: illustrating contemporary and future options; a case report. Transl Androl Urol. 10 (1), 520-526 (2021).
- Eyni, H., et al. Advanced bioengineering of male germ stem cells to preserve fertility. J Tissue Eng. 12, (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır