Method Article
Iniezione di spermatide rotondo di topo
In questo articolo
Riepilogo
Qui, introduciamo un metodo per eseguire l'iniezione di spermatide rotondo (ROSI) nei topi, una tecnica con promettenti applicazioni cliniche e utilità per studiare i meccanismi alla base dello sviluppo embrionale.
Abstract
Gli spermatidi rotondi, caratterizzati dal loro contenuto genetico aploide, rappresentano le cellule precursori degli spermatozoi maturi. Attraverso l'innovativa tecnica dell'iniezione di spermatidi rotondi (ROSI), gli ovociti possono essere fecondati con successo e sviluppati in feti vitali. Con un traguardo rivoluzionario raggiunto nel 1995, è nato il primo feto di topo attraverso la tecnologia ROSI. Da allora ROSI è emerso come uno strumento fondamentale per svelare gli intricati meccanismi che regolano lo sviluppo embrionale e ha un potenziale significativo in varie applicazioni, tra cui l'accelerazione della generazione di topi e la produzione di topi geneticamente modificati. Nel 1996 è stata raggiunta una pietra miliare quando è nato il primo feto umano attraverso la tecnologia ROSI. Tuttavia, le applicazioni cliniche di questo metodo hanno mostrato un modello fluttuante di successo e fallimento. Ad oggi, la tecnologia ROSI non ha trovato un'applicazione diffusa nella pratica clinica, principalmente a causa della sua bassa efficienza alla nascita e dell'insufficiente convalida della sicurezza fetale. Questo articolo fornisce un resoconto completo dei metodi precisi per eseguire il ROSI nei topi, con l'obiettivo di gettare nuova luce sulla ricerca di base e sulle sue potenziali applicazioni cliniche.
Introduzione
La fase finale della spermatogenesi prevede la trasformazione di uno spermatide rotondo in uno spermatozoo completamente sviluppato, caratterizzato da strutture distinte della testa, del collo e della coda allungate1. Questa trasformazione comprende cambiamenti significativi nella morfologia cellulare, come la condensazione della cromatina nel nucleo, la sostituzione degli istoni con la protamina, la formazione di acrosomi, lo sviluppo della guaina mitocondriale, la migrazione e la perdita del centriolo, la formazione della struttura della coda e la rimozione dei residui cellulari2.
Nel 1992, il primo feto umano è nato con successo attraverso la tecnologia dell'iniezione intracitoplasmatica di spermatozoi (ICSI)3. Da allora, i ricercatori hanno esplorato il potenziale dell'utilizzo di spermatidi rotondi, che condividono la stessa composizione genetica aploide degli spermatozoi maturi, per fecondare gli ovociti e sostenere gravidanze vitali 2,4. Successivamente, nel 1996, è stato partorito il primo feto umano concepito con la tecnologia dell'iniezione di spermatidi rotondi (ROSI) 5,6. Vale la pena notare che gli studi che coinvolgono ICSI e ROSI nei topi sono rimasti indietro rispetto a quelli nell'uomo a causa della suscettibilità della membrana degli ovociti del topo ai danni durante il processo di iniezione. Questo problema è stato risolto con successo con l'introduzione del dispositivo piezoelettrico di rottura della membrana. Di conseguenza, nel 1995, è nato il primo mouse concepito attraverso la tecnologia ROSI. Inoltre, sono in corso anche ricerche sui ROSI in vari altri animali 7,8.
Attualmente, la ricerca sui ROSI si concentra principalmente sui seguenti aspetti: applicazione clinica, chiarimento dei meccanismi e strategie per migliorare l'efficienza dello sviluppo, insieme ad applicazioni più ampie della tecnologia ROSI. Nell'ambito delle applicazioni cliniche, nonostante la nascita del primo feto umano ROSI attraverso ROSI nel 1996, i progressi sono stati segnati da una serie di successi e fallimenti 9,10,11,12. Ad oggi, la tecnologia ROSI non ha raggiunto un'implementazione clinica diffusa, in gran parte a causa della sua bassa efficienza e della necessità di ulteriori validazioni per quanto riguarda la sicurezza dei feti concepiti attraverso la tecnologia ROSI. Statistiche incomplete indicano che a livello globale sono stati partoriti meno di 200 feti umani concepiti con ROSI. Un punto di svolta nella comprensione del potenziale della tecnologia ROSI si è verificato nel 2015, quando Tanaka e colleghi hanno riferito del successo della nascita di 14 feti attraverso la tecnologia ROSI, infondendo rinnovata fiducia nella sua applicazione clinica e fattibilità13,14. La tecnologia ROSI è molto promettente per affrontare le sfide della biologia riproduttiva, in particolare nei pazienti con azoospermia non ostruttiva. Oltre alle sue applicazioni cliniche, ROSI funge da strumento prezioso per studiare gli intricati meccanismi dello sviluppo embrionale 15,16,17.
Sono stati condotti numerosi studi sugli animali per indagare i fattori sottostanti che contribuiscono alla bassa efficienza dei ROSI nel raggiungere il pieno sviluppo embrionale. Questi fattori comprendono la scelta dei metodi di attivazione assistita degli ovociti (AOA) e i loro tempi, le anomalie nella stabilità genomica e, in particolare, le anomalie nelle modificazioni epigenetiche. È importante riconoscere che gli spermatidi rotondi sono cellule germinali immature, che differiscono in modo significativo dagli spermatozoi maturi in vari aspetti fisiologici. Mizuki Sakamoto e colleghi hanno indicato che H3K27me3, derivato da spermatidi rotondi, è associato alla cromatina che è meno accessibile e porta a una ridotta espressione genica negli embrioni ROSI18. In uno studio correlato di Jing Wang e colleghi, i difetti di riprogrammazione negli embrioni ROSI negli stadi pronucleari erano prevalentemente associati alla mancata espressione di una coorte di geni responsabili dell'attivazione minore del genoma zigotico19. Hanno anche scoperto che l'introduzione di un inibitore selettivo eucromatico dell'istone lisina metiltransferasi 2, A366, potrebbe potenzialmente aumentare il tasso di sviluppo complessivo di circa il doppio.
Il topo è uno degli animali modello più preziosi per lo studio dello sviluppo embrionale. Questo articolo approfondisce come eseguire il ROSI sui topi. Questo protocollo completo comprende la selezione di topi adatti, procedure dettagliate di induzione dell'ovulazione, tecniche AOA, tecniche di iniezione e la preparazione di topi surrogati. Inoltre, presentiamo un'analisi comparativa degli effetti di due regimi iniettivi sull'efficienza del parto: AOA seguito da ROSI (A-ROSI; primo regime) e ROSI seguito da AOA (ROSI-A; secondo regime). Il nostro obiettivo è incoraggiare i ricercatori a condurre esperimenti ROSI sui topi con maggiore precisione, offrendo un supporto più robusto per la loro applicazione clinica e la ricerca fondamentale sui meccanismi di sviluppo embrionale.
Protocollo
I topi B6D2F1 (C57BL/6 x DBA/2), C57BL/6 e ICR utilizzati in questo esperimento sono stati acquistati da Beijing Vital River Laboratory Animal Technologies Co. Ltd. (Pechino, Cina). Tutti i trattamenti sugli animali hanno aderito alle procedure sperimentali e agli standard approvati dal Comitato Etico per gli Animali Sperimentali del Primo Ospedale dell'Università di Jilin (numero di approvazione: 20200435).
1. Preparazione dei reagenti pertinenti
- Acquisire alcuni reagenti in commercio e preparare autonomamente i reagenti rimanenti.
- Ottenere dal fornitore M2, un sistema tampone per il trattamento in vitro di spermatidi rotondi (RS), spermatozoi e ovociti.
- Preparare il terreno C.L. Chatot, C.A. Ziomek e B.D. Bavister (CZB) libero da Ca2+ per l'AOA seguendo il protocollo20 precedentemente pubblicato.
- Ottenere dal fornitore il terreno ottimizzato per il potassio simplex integrato con una soluzione di aminoacidi (KSOMaa) per la coltura di embrioni.
- Preparare la ialuronidasi, con una concentrazione di lavoro dello 0,1% (1 g/L), sciogliendo 0,1 g di ialuronidasi in 1 mL di acqua embrionale. Prelevare 10 μL di soluzione di conservazione concentrata e sciogliere in 990 mL di M2, che potrebbero essere conservati a 4 °C per 1 settimana.
- Preparare il polivinilpirrolidone (PVP), con un peso molecolare medio di 360.000 e una concentrazione di massa del 12%, sciogliendo 1,2 g di PVP in 10 mL di M2. La soluzione risultante può essere conservata a 4 °C per 1 settimana.
- Conservare la soluzione madre di citocalasi B (CB) (2 μL), solubile in 18 μL di DMSO a -20 °C. Prelevare 5 μL della soluzione di conservazione concentrata e sciogliere in 995 mL di M2. La soluzione risultante può essere conservata a 4 °C per 1 settimana.
2. Preparazione degli ovociti
- Acclimatare le femmine di topo B6D2F1, di età compresa tra 6 e 8 settimane, nel loro nuovo ambiente per almeno 1 settimana. Iniettare per via intraperitoneale 7,5 UI di gonadotropina sierica (PMSG) di cavalla gravida alle 17:00, seguite da 7,5 UI di gonadotropina corionica umana (HCG) 48 ore dopo. Assicurarsi che non si verifichi alcun contatto con topi maschi dopo l'iniezione.
NOTA: L'orario specificato (ore 17) non è obbligatorio. È solo per comodità di lavoro. Le 14 ore dopo le 17 sono le 7 del mattino, quando gli ovociti sono pronti e viene eseguita l'iniezione, quindi l'orario dell'iniezione è previsto per la mattina. L'ora di inizio dell'iniezione può essere regolata in base al programma giornaliero del laboratorio. - Dopo 14 ore di iniezione di HCG, sopprimere i topi utilizzando il metodo della lussazione cervicale. Apri la cavità addominale e individua l'utero. Identifica le ovaie lungo l'utero e taglia le tube di Falloppio vicino alle ovaie usando le forbici. Ripetere la stessa procedura sull'altro lato e posizionare le tube di Falloppio in M2, che viene preriscaldato a 37 °C in anticipo.
- Al microscopio verticale (10x), individuare la parte ingrossata delle tube di Falloppio, che mostra un aspetto trasparente e gonfio. Utilizzare una siringa da 1 ml per fissare le tube di Falloppio mentre si taglia la parte ingrandita, raccogliendo i complessi cumuliformi coronali degli ovociti (OCCC).
- Inserire gli OCCC nella soluzione operativa M2 preriscaldata contenente lo 0,1% di ialuronidasi e rimuovere le cellule della granulosa soffiando delicatamente attraverso una pipetta orale.
NOTA: Mantenere gli OCCC in ialuronidasi allo 0,1% per un breve periodo, circa 2 minuti, se necessario. - Dopo aver rimosso le cellule della granulosa, trasferire l'ovocita in KSOMaa, sciacquare 3 volte e metterlo in un incubatore di anidride carbonica per un uso successivo (37 °C, 5% CO2).
3. Preparazione di spermatidi rotondi e spermatozoi
- Raccogliere spermatidi rotondi e spermatozoi dal testicolo e dall'epididimo di topi maschi C57BL/6 (8-10 settimane), rispettivamente.
- Per gli spermatozoi, sopprimere i topi mediante lussazione cervicale. Aprire la cavità addominale, individuare l'epididimo vicino al testicolo e asportare delicatamente con le forbici.
- Posizionare l'epididimo in un terreno M2 e asportare delicatamente con una siringa da 1 ml per consentire agli spermatozoi di defluire al microscopio verticale (10x).
- Aspirare gli spermatozoi che scorrono e la sospensione di M2 sul fondo di una provetta contenente 0,5 ml di M2, consentendo agli spermatozoi di fluire naturalmente a monte. Mettili da parte per un uso successivo.
- Per gli spermatidi rotondi, rimuovere i testicoli dalla cavità addominale e posizionarli in M2. Tagliare delicatamente la membrana bianca con una siringa da 1 ml e spremere i tubuli seminiferi contorti al microscopio verticale (10x).
- Asportare accuratamente i tubuli seminiferi utilizzando due siringhe da 1 mL. Estrarre la sospensione e filtrare con un setaccio da 400 maglie (38 μm).
- Centrifugare le cellule filtrate, scartare il surnatante e aggiungere 200 μl di Hoechst 33342 per la colorazione, quindi incubare a 37 °C per 10 minuti.
- Eseguire la selezione cellulare attivata dalla fluorescenza (FACS) per distinguere gli spermatidi rotondi da altri tipi di cellule. Posizionare le cellule colorate in una provetta per citometria a flusso ed eseguire uno screening rotondo degli spermatidi.
- Diversi modelli di macchine per citometria a flusso hanno parametri normativi diversi e possono essere comunicati con il supporto tecnico durante il funzionamento. Come primo passo, regolare la tensione e selezionare la popolazione cellulare in base alla diffusione diretta (FSS) e alla dispersione laterale (SSC; vedere la Tabella 1 supplementare).
- Per la seconda fase, rimuovere le aderenze cellulari secondo FSC e attivare l'ampiezza dell'impulso.
- Come terzo passaggio, seleziona gli spermatidi rotondi aploidi target. Hoechst 33342 si lega al DNA e le cellule con ploidia diversa mostrano diverse intensità di fluorescenza. Impostare la lunghezza d'onda di eccitazione su 355. Seleziona due canali di rilevamento, 460/50 e 670/30, sotto il laser a 355 lunghezze d'onda per selezionare gli spermatidi rotondi. Successivamente, conservare gli spermatidi rotondi selezionati in frigorifero a 4 °C per un uso successivo.
NOTA: È anche possibile selezionare direttamente gli spermatidi rotondi in base alla loro morfologia al microscopio, ma è necessaria una formazione per garantire l'accuratezza della selezione.
4. Iniezione di spermatidi rotondi (ROSI)
- Eseguire la procedura ROSI utilizzando un microscopio invertito con un sistema di micromanipolazione.
- Nella fase iniziale di preparazione, realizzare gli aghi di tenuta e di iniezione secondo la procedura precedentemente descritta21. Mantenere il diametro interno dell'ago per iniezione tra 6-7 μm, progettato per l'estrazione di spermatidi rotondi, e per l'ago di supporto, avere un diametro interno di 20 μm per fissare l'ovocita.
- Nella successiva fase di preparazione, creare un recipiente per l'iniezione posizionando 10 μL di goccioline M2 contenenti CB per ammorbidire gli ovociti e 10 μL di goccioline M2 per conservare gli spermatidi rotondi. Utilizzare goccioline di PVP per inumidire e pulire gli aghi per iniezione.
NOTA: L'aggiunta di CB qui non è un passaggio necessario, ma l'aggiunta di CB può migliorare notevolmente il tasso di sopravvivenza dopo l'iniezione. - Estrarre gli spermatidi rotondi utilizzando un ago per iniezione.
- Ruotare l'ovocita con un ago di fissaggio, posizionando il corpo polare dell'ovocita a ore 12 o a ore 6.
- Posizionare con cautela l'ago per iniezione a ore 3 sull'ovocita, aderendo saldamente alla zona pellucida. Utilizzare un dispositivo PiezoXpert per creare un foro nella zona pellucida. Regola la forza da piccola a grande, che qui è approssimativamente intensità = 5 e velocità = 15.
- Far avanzare delicatamente l'ago per iniezione attraverso la zona pellucida ed entrare nell'ovocita orizzontalmente. Quando passa il centro dell'ovocita, applicare un piezo (intensità = 1 e velocità = 1), provocando la rottura della membrana dell'ovocita e l'iniezione graduale dello spermatide rotondo nel citoplasma dell'ovocita.
- Estrarre l'ago per iniezione e aspirare una piccola quantità di membrana dell'ovocita vicino all'apertura per sigillarla. Questo passaggio è cruciale, poiché la mancata sigillatura provocherebbe perdite citoplasmatiche e morte degli ovociti.
NOTA: Vale la pena notare che ROSI ha richiesto AOA prima o dopo l'iniezione di spermatidi rotondi, di cui abbiamo discusso nelle sezioni successive.
5. Iniezione intracitoplasmatica di spermatozoi (ICSI)
- Eseguire gli stessi passaggi per l'ICSI e per il ROSI, con l'unica differenza del diametro dell'ago per iniezione ICSI, che misura 9-10 μm.
- Posizionare gli spermatozoi su una pista PVP per ridurre la loro velocità di nuoto e facilitare l'estrazione degli spermatozoi.
- Eseguire la separazione della testa e della coda degli spermatozoi per ICSI. Aspirare gli spermatozoi dalla coda e posizionare il collo degli spermatozoi esattamente all'imboccatura dell'ago per iniezione. Applicare un piezo (si possono usare più piezo secondo necessità, intensità = 5 e velocità = 15) per separare la testa e la coda degli spermatozoi.
6. Attivazione assistita degli ovociti (AOA)
- Secondo il protocollo, preparare un terreno CZB senza calcio e magnesio.
- Utilizzare cloruro di stronzio esaidrato (SrCl26H2O), con un peso molecolare di 266,62, a una concentrazione di 10 mM. Per prepararlo, sciogliere 0,26662 g di SrCl26H2O in 1 mL di acqua embrionale. Al momento dell'uso, aggiungere 10 μL di soluzione di conservazione concentrata a 990 μL di terreno CZB privo di Ca2+ e utilizzare immediatamente.
- Posizionare gli ovociti nel terreno CZB libero da Ca2+ contenente SrCl26H2O per l'attivazione; ogni gocciolina ha un volume di 20 μL e ogni volta vengono posizionati 20 ovociti. Incubare per 20 min.
- Contemporaneamente, stabilire un gruppo per l'attivazione della partenogenesi senza iniettare spermatidi rotondi o spermatozoi. Va notato che il gruppo di attivazione della partenogenesi è mostrato senza analisi statistica e il gruppo di controllo è l'ICSI.
7. Trasferimento di embrioni
- Ospita i topi maschi e femmine ICR legati in un rapporto di 1:2. La mattina seguente, esamina le tope femmine per la presenza di un tappo vaginale e seleziona quelle con un tappo vaginale per il trapianto.
- Iniettare gli embrioni trasferiti costituiti da embrioni a 2 cellule la mattina precedente e trasferirli il pomeriggio successivo.
- Praticare un'incisione sul dorso della topolina, esporre il grasso bianco e le ovaie e individuare la parte ingrandita delle tube di Falloppio sotto un microscopio verticale (10x).
- Utilizzare una siringa da 1 ml per creare un'apertura nella parte ingrandita delle tube di Falloppio e aspirare gli embrioni attraverso una pipetta orale. Introdurre delicatamente gli embrioni in direzione dell'utero. Sutura la ferita, utilizzando modelli 4 x 10 di aghi curvi con filo, con uno spessore di 5-0 (0,09-0,11 mm). La sutura è realizzata in due strati, con uno strato per il peritoneo e uno strato per la pelle esterna.
- Per i topi surrogati, eseguire tagli cesarei in base al programma sperimentale. Sopprimere i topi con il metodo della lussazione cervicale, disinfettare con alcol e aprire la cavità addominale. Tagliare delicatamente e rapidamente l'utero e aprire la cavità amniotica per mostrare il feto e la placenta. Rimuovere il cordone ombelicale e tagliarlo lateralmente vicino al feto; Il feto è stato nutrito con lo stesso periodo di allattamento dei topi.
NOTA: A causa della necessità di calcolare i tassi di natalità, il taglio cesareo è più accurato per quanto riguarda la capacità produttiva. Nel parto naturale, la prole può essere mangiata dalla madre, con conseguenti statistiche imprecise. Il taglio cesareo viene eseguito su topi surrogati trapiantati nella fase iniziale e il taglio cesareo per eutanasia viene eseguito prima del parto.
8. Analisi statistica
- Usa GraphPad Prism 5 per analizzare. I dati sono espressi in media ± SD; P < 0,05 indica una differenza statistica e P < 0,01 indica una differenza statistica significativa.
Risultati
Abbiamo iniziato la nostra indagine esaminando l'effetto dell'AOA sulla capacità di sviluppo degli embrioni. Un'illustrazione schematica del disegno sperimentale è mostrata nella Figura 1A. Prima dell'iniezione dello spermatozoo, gli ovociti sono stati sottoposti ad AOA (A-ICSI) o non sono stati trattati (ICSI). I dati dettagliati sullo sviluppo embrionale sono presentati nella Tabella 1. I risultati non hanno rivelato differenze significative nella scissione, nella blastocisti o nei tassi di natalità tra i gruppi A-ICSI e ICSI (P > 0,05; Figura 1B). Questi risultati indicano che l'AOA con 10 mM di SrCl2 per 20 minuti non ha influenzato il potenziale di sviluppo degli embrioni.
In precedenza era stato riportato che non vi erano differenze percepibili nell'efficienza dello sviluppo degli embrioni ROSI selezionati mediante FACS o mediante esame visivo diretto al microscopio22. I nostri esperimenti hanno utilizzato la tecnologia FACS per identificare RS (Figure 2A, B). Al microscopio, gli spermatidi rotondi di topo avevano un diametro di circa 10 μm e mostravano una struttura nucleolica simile a una sporgenza al centro (Figura 2C). Ipotizziamo che la selezione attraverso la FACS sia più accurata dell'esame visivo diretto al microscopio. Inoltre, la letteratura supporta l'esplorazione diretta della RS attraverso le differenze morfologiche. Gli embrioni ROSI sono stati generati utilizzando due metodi distinti: il gruppo A-ROSI, in cui gli ovociti sono stati sottoposti ad AOA prima dell'iniezione di spermatide rotondo, e il gruppo ROSI-A, in cui gli ovociti sono stati sottoposti ad AOA dopo l'iniezione di spermatide rotondo. Il diagramma schematico del disegno sperimentale è mostrato nella Figura 1C. In particolare, non sono state riscontrate differenze significative nei tassi di clivaggio e blastocisti tra i gruppi A-ROSI, ROSI-A e ICSI (P > 0,05; Figura 1D). I tassi di blastocisti dei gruppi A-ROSI, ROSI-A e ICSI erano significativamente più alti di quelli del gruppo di attivazione (P < 0,05; Figura 1D). Tuttavia, il tasso di natalità del gruppo ROSI era inferiore a quello del gruppo ICSI, indipendentemente dal fatto che gli ovociti fossero attivati prima o dopo l'iniezione (P < 0,05; Figura 1D). È importante sottolineare che il tasso di natalità del gruppo A-ROSI era leggermente superiore a quello del gruppo ROSI-A (Figura 1D). Ulteriori dettagli sui dati sullo sviluppo embrionale sono presentati nella Tabella 1.
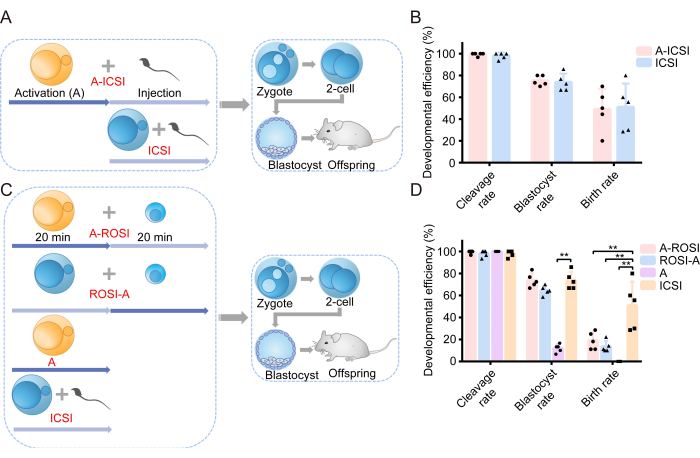
Figura 1: Gli embrioni ROSI hanno mostrato una ridotta efficienza di sviluppo rispetto agli embrioni ICSI. (A) Illustrazione schematica del protocollo sperimentale che valuta l'effetto dell'attivazione sullo sviluppo embrionale dell'ICSI. Blu = Gli ovociti non sono stati attivati; Giallo = Gli ovociti sono stati attivati. (B) Efficienza dello sviluppo degli embrioni derivati da A-ICSI e ICSI. (C) Illustrazione schematica del protocollo sperimentale per la generazione di diversi tipi di embrioni. (D) Efficienza dello sviluppo degli embrioni derivati da A-ROSI, ROSI-A, A e ICSI. **, P < 0,01. Abbreviazioni: A= Attivazione E= Giorno embrionale; ROSI= Iniezione di spermatide rotondo; ICSI= Iniezione intracitoplasmatica di spermatozoi. Le barre di errore mostrano la deviazione standard. Il confronto dei tassi viene condotto utilizzando il test del chi-quadrato. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Gli spermatidi rotondi sono stati selezionati tramite smistamento citofluorimetrico. (A) Per la selezione degli spermatidi rotondi è stato utilizzato un diagramma di smistamento citofluorimetrico. (B) Immagini rappresentative che mostrino la selezione di spermatidi rotondi. Barra di scala: 10 μm. Abbreviazioni: FSC = Forward scatter; SSC = dispersione laterale; 355 è la lunghezza d'onda di eccitazione; 460/50 e 670/30 sono due canali di rilevamento sotto laser a 355 lunghezze d'onda. Clicca qui per visualizzare una versione più grande di questa figura.
| Gruppi | Sviluppo preimpianto | Sviluppo post-impianto | |||
| Replica | Tasso di scissione (%) | Tasso di blastocisti (%) | Embrioni a 2 cellule trasferiti/ N. dei destinatari | Tasso di natalità (%) | |
| A-ICSI | 5 | 99.33 (149/150) | 75.17 (112/149) | 49/5 | 48.98 (24/49) |
| A-ROSI | 5 | 99.33 (149/150) | 73.83 (110/149) | 44/5 | 18.18 (8/44) ** |
| ROSI-A | 5 | 98.00 (147/150) | 64.63 (95/147) | 45/5 | 13.33 (6/45) ** |
| Attivazione | 5 | 100.00 (150/150) | 12.00 (18/150) ** | 51/5 | 0.00 (0/51) ** |
| ICSI | 5 | 98.00 (147/150) | 73.47 (108/147) | 46/5 | 52.17 (24/46) |
Tabella 1. L'efficienza dello sviluppo di embrioni derivati da gruppi diversi.
Tabella supplementare 1. La proporzione di diverse popolazioni cellulari ordinate mediante citometria a flusso. La parte P3 è costituita da spermatidi rotondi. Clicca qui per scaricare questo file.
Discussione
Attivazione assistita degli ovociti
Un prerequisito fondamentale per ROSI è l'AOA, poiché gli spermatidi rotondi da soli non possono avviare l'attivazione degli ovociti. Attualmente, il metodo più consolidato nei topi prevede l'uso di cloruro di stronzio23,24, mentre l'applicazione umana più avanzata impiega l'attivazione elettrica13,14. Anche la tempistica dell'attivazione degli ovociti è di grande importanza. Come riportato in letteratura, l'approccio di attivazione più ottimale nei topi prevede l'attivazione iniziale dell'ovocita e poi l'iniezione dello spermatide rotondo25. Ciò contrasta con il processo di fecondazione convenzionale, in cui gli spermatozoi entrano inizialmente negli ovociti, rilasciando successivamente la fosfolipasi C ζ per attivare l'ovocita26. La ricerca specializzata condotta da Satoshi Kishigami e colleghi sottolinea la capacità differenziale dei ROSI di formare un nucleo maschile negli ovociti pre o post-attivati. Per ottenere un tasso di produzione efficiente della prole, entrambi i tipi di iniezione devono essere effettuati prima che gli ovociti entrino nella faseG1 25.
Il diametro dell'ago per iniezione
Nel contesto della ROSI, è importante notare che un diametro maggiore dell'ago per iniezione non si traduce necessariamente in risultati migliori. L'ago per iniezione utilizzato ha un diametro di 6-7 μm, leggermente più piccolo di uno spermatide rotondo. Pertanto, quando uno spermatide rotondo viene aspirato, la membrana cellulare è sottoposta a un effetto di compressione, che può portare all'esposizione diretta del nucleo. Questa esposizione diretta può favorire la depolimerizzazione e la successiva formazione del pronucleo maschile27.
Trattamento di sigillatura
Gli ovociti di topo mostrano una viscosità citoplasmatica inferiore rispetto ad altre specie. Anche una piccola breccia nella membrana cellulare può causare la fuoriuscita del citoplasma, con conseguente degenerazione degli ovociti28. Per mitigare il rischio, dopo aver iniettato lo spermatide rotondo nel citoplasma dell'ovocita e aver ritirato l'ago per iniezione, è imperativo aspirare una piccola porzione della membrana cellulare vicino all'apertura della membrana cellulare dell'ovocita per sigillare lo spazio, in modo simile alla procedura in ICSI21. Questo processo di sigillatura riduce significativamente il rischio di degenerazione degli ovociti.
Applicazione del ROSI come modello
Oltre alle applicazioni cliniche, la tecnologia ROSI ha varie altre applicazioni come modello. Può accelerare la generazione dei topi29, salvare la letalità femminile derivante da una delezione Xist ereditata dal padre nei topi17, generare topi dopo l'iniezione di spermatidi rotondi in blastomeri partenogenetici aploidi a due cellule15, generare prole di topo transgenico16 e preservare la fertilità nei bambini adolescenti prima del trattamento del cancro30,31. Una ricerca diligente sul ROSI del topo può contribuire in modo sostanziale ai progressi nella ricerca sulla salute riproduttiva.
Limitazioni dell'articolo
Questo articolo funge da guida metodologica con diverse limitazioni, tra cui l'assenza di una selezione comparativa diretta di RS al microscopio per iniezione e una percepita mancanza di innovazione.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interessi finanziari o di altro tipo.
Riconoscimenti
Estendiamo la nostra gratitudine a Wenjie Zhao per la sua inestimabile assistenza nello smistamento degli spermatidi rotondi attraverso la citometria a flusso e a Fang Wang per la sua esperienza nel trasferimento di embrioni di topo. Questo lavoro ha ricevuto un sostegno parziale dalla Fondazione per le Scienze Naturali della Provincia di Jilin (n. YDZJ202301ZYTS461). Ringraziamo Bullet Edits Limited per l'editing linguistico e la correzione di bozze del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| CaCl22H2O | Sigma | C7902 | Preparation of CZB |
| Glucose | Sigma | G6152 | Preparation of CZB |
| HEPES-Na (basic) | Sigma | H3784 | Preparation of CZB |
| Hoechst 33342 | Beyotime | C1025 | FACS |
| human chorionic gonadotropin (HCG) | Ningbo Second Hormone Company | HCG | Ovulation promoting drugs |
| Hyaluronidase | Sigma | H3506 | Removing granulosa cells around the oocyte |
| KCl | Sigma | P5405 | Preparation of CZB |
| KH2PO4 | Sigma | P5655 | Preparation of CZB |
| KSOMaa | Caisson Labs | IVL04-100ML | Potassium simplex optimized medium supplemented with amino acids |
| L-glutamine | Sigma | G8540 | Preparation of CZB |
| M2 | Sigma | M7167-50ML | Operating fluid |
| MgSO47H2O | Sigma | M1880 | Preparation of CZB |
| Na2-EDTA2H2O | Sigma | E5134 | Preparation of CZB |
| NaCl | Sigma | S5886 | Preparation of CZB |
| NaHCO3 | Sigma | S5761 | Preparation of CZB |
| Na-lactate 60% syrup d = 1.32 g/L | Sigma | L7900 | Preparation of CZB |
| Na-pyruvate | Sigma | P4562 | Preparation of CZB |
| Piezo drill tips (ICSI) | Eppendorf | piezoXpert | Piezoelectric membrane rupture |
| pregnant mare serum gonadotropin (PMSG) | Ningbo Second Hormone Company | PMSG | Ovulation promoting drugs |
| PVA | Sigma | P8136 | Preparation of CZB |
Riferimenti
- Redgrove, K. A., McLaughlin, E. A. The role of the immune response in Chlamydia trachomatis infection of the male genital tract: A double-edged sword. Front Immunol. 5, 534 (2014).
- Yanagimachi, R. Intracytoplasmic injection of spermatozoa and spermatogenic cells: Its biology and applications in humans and animals. Reprod Biomed Online. 10 (2), 247-288 (2005).
- Palermo, G., Joris, H., Devroey, P., Van Steirteghem, A. C. Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte. Lancet. 340 (8810), 17-18 (1992).
- Kimura, Y., Yanagimachi, R. Mouse oocytes injected with testicular spermatozoa or round spermatids can develop into normal offspring. Development. 121 (8), 2397-2405 (1995).
- Tesarik, J., et al. Spermatid injection into human oocytes. II. Clinical application in the treatment of infertility due to non-obstructive azoospermia. Human Reprod. 11 (4), 780-783 (1996).
- Tesarik, J., Mendoza, C. Spermatid injection into human oocytes. I. Laboratory techniques and special features of zygote development. Human Reprod. 11 (4), 772-779 (1996).
- Hirabayashi, M., et al. Activation regimens for full-term development of rabbit oocytes injected with round spermatids. Mol Reprod Dev. 76 (6), 573-579 (2009).
- Ogonuki, N., et al. Birth of a marmoset following injection of elongated spermatid from a prepubertal male. Mol Reprod Dev. 86 (8), 928-930 (2019).
- Niederberger, C., et al. Forty years of IVF. Fertil Steril. 110 (2), 185 (2018).
- Gross, K. X., Hanson, B. M., Hotaling, J. M. Round spermatid injection. Urol Clin North Am. 47 (2), 175-183 (2020).
- Hanson, B. M., et al. Round spermatid injection into human oocytes: a systematic review and meta-analysis. Asian J Androl. 23 (4), 363-369 (2021).
- Tekayev, M., Vuruskan, A. K. Clinical values and advances in round spermatid injection (ROSI). Reprod Biol. 21 (3), 100530 (2021).
- Tanaka, A., et al. Fourteen babies born after round spermatid injection into human oocytes. Proc Natl Acad Sci U S A. 112 (47), 14629-14634 (2015).
- Tanaka, A., et al. Ninety babies born after round spermatid injection into oocytes: survey of their development from fertilization to 2 years of age. Fertil Steril. 110 (3), 443-451 (2018).
- Yang, H., Shi, L., Chen, C. D., Li, J. Mice generated after round spermatid injection into haploid two-cell blastomeres. Cell Res. 21 (5), 854-858 (2011).
- Moreira, P., et al. Transgenic mouse offspring generated by ROSI. J Reprod Dev. 62 (1), 37-42 (2016).
- Federici, F., et al. Round spermatid injection rescues female lethality of a paternally inherited Xist deletion in mouse. PLoS Genet. 12 (10), e1006358 (2016).
- Sakamoto, M., et al. Paternally inherited H3K27me3 affects chromatin accessibility in mouse embryos produced by round spermatid injection. Development. 149 (18), 200696 (2022).
- Wang, J., et al. Single-cell multiomics sequencing reveals the reprogramming defects in embryos generated by round spermatid injection. Sci Adv. 8, (2022).
- Ward, M. A., Yanagimachi, R. Intracytoplasmic sperm injection in mice. Cold Spring Harb Protoc. 2018 (1), (2018).
- Yoshida, N., Perry, A. C. Piezo-actuated mouse intracytoplasmic sperm injection (ICSI). Nat Protoc. 2 (2), 296-304 (2007).
- Zhu, L., et al. FACS selection of valuable mutant mouse round spermatids and strain rescue via round spermatid injection. Zygote. 23 (3), 336-341 (2013).
- Kong, P., et al. Effects of the histone deacetylase inhibitor 'Scriptaid' on the developmental competence of mouse embryos generated through round spermatid injection. Hum Reprod. 32 (1), 76-87 (2017).
- Hosseini, S., Salehi, M. Tricostatin A-treated round spermatid enhances preimplantation embryo developmental competency following round spermatid injection in mice. Zygote. 30 (3), 373-379 (2022).
- Kishigami, S., Wakayama, S., Nguyen, V. T., Wakayama, T. Similar time restriction for intracytoplasmic sperm injection and round spermatid injection into activated oocytes for efficient offspring production. Biol Reprod. 70 (6), 1863-1869 (2004).
- Tao, Y. Oocyte activation during round spermatid injection: state of the art. Reprod Biomed Online. 45 (2), 211-218 (2022).
- Ogura, A., Ogonuki, N., Miki, H., Inoue, K. Microinsemination and nuclear transfer using male germ cells. Int Rev Cytol. 246, 189-229 (2005).
- Kimura, Y., Yanagimachi, R. Intracytoplasmic sperm injection in the mouse. Biol Reprod. 52 (4), 709-720 (1995).
- Ogonuki, N., et al. A high-speed congenic strategy using first-wave male germ cells. PLoS One. 4 (3), e4943 (2009).
- Abdelaal, O., et al. Fertility preservation for pediatric male cancer patients: illustrating contemporary and future options; a case report. Transl Androl Urol. 10 (1), 520-526 (2021).
- Eyni, H., et al. Advanced bioengineering of male germ stem cells to preserve fertility. J Tissue Eng. 12, (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon