Method Article
マウスラウンド精子細胞注射
要約
ここでは、マウスにラウンド精子細胞注入法(ROSI)を行う方法を紹介します。これは、臨床応用が期待され、胚発生のメカニズムを調べるための有用性を持つ技術です。
要約
一倍体の遺伝的内容を特徴とする丸い精子細胞は、成熟した精子の前駆細胞を表しています。円形精子細胞注射(ROSI)の革新的な技術により、卵子をうまく受精させ、生存可能な胎児に成長させることができます。1995年に達成された画期的なマイルストーンとして、ROSI技術によって最初のマウス胎児が誕生しました。それ以来、ROSIは、胚発生を支配する複雑なメカニズムを解明するための極めて重要なツールとして浮上し、マウス生成の加速や遺伝子改変マウスの作製など、さまざまなアプリケーションで大きな可能性を秘めています。1996年、ROSI技術を通じて最初のヒト胎児が誕生し、大きな節目を迎えました。しかし、この方法の臨床応用では、成功と失敗の変動パターンが示されています。今日まで、ROSIテクノロジーは、主に出生効率が低く、胎児の安全性の検証が不十分であるため、臨床診療で広く適用されていません。この記事では、マウスでROSIを実行する正確な方法の包括的な説明を提供し、基礎研究とその潜在的な臨床応用に新たな光を当てることを目的としています。
概要
精子形成の最終段階は、丸い精子細胞が、明確な頭、首、および細長い尾の構造を特徴とする完全に発達した精子に変換することを含みます1。この形質転換は、核内のクロマチンの凝縮、ヒストンのプロタミンによる置換、アクロソーム形成、ミトコンドリア鞘の発達、中心小体の移動と損失、尾部構造の形成、細胞残基の除去など、細胞形態の大幅な変化を包含しています2。
1992年、ICSI(Sci)技術により、ヒト初の胎児の誕生に成功しました3。それ以来、研究者たちは、成熟した精子と同じ一倍体の遺伝的組成を共有する円形の精子細胞を利用して、卵子を受精させ、生存可能な妊娠を維持する可能性を探求してきました2,4。その後、1996年に、丸型精子細胞注入(ROSI)技術によって妊娠した最初のヒト胎児が出産されました5,6。マウスのICSIとROSIを含む研究は、マウスの卵子膜が注射プロセス中に損傷を受けやすいため、ヒトの研究よりも遅れていたことは注目に値します。この問題は、ピエゾ膜破砕装置の導入により解決に成功しました。その結果、1995年にROSI技術によって考案された最初のマウスが誕生しました。さらに、他のさまざまな動物におけるROSIの研究も進行中です7,8。
現在、ROSIの研究は、臨床応用、メカニズムの解明、開発効率を高めるための戦略、およびROSI技術の広範な応用を中心に研究されています。臨床応用の文脈では、1996年にROSIを通じて最初のROSIヒト胎児が誕生したにもかかわらず、進歩は一連の成功と失敗によって特徴づけられてきた9,10,11,12。これまで、ROSI技術は、その効率の低さや、ROSI技術を通じて考案された胎児の安全性に関するさらなる検証が必要であることが主な理由として、広範な臨床実装には至っていません。不完全な統計によると、世界的には、ROSIが妊娠したヒトの胎児は200人未満しか分娩されていません。ROSI技術の可能性を理解する転機となったのは、2015年に田中らがROSI技術を通じて14人の胎児が誕生したことを報告し、その臨床応用と実現可能性に新たな自信を植え付けたことでした13,14。ROSI技術は、特に非閉塞性無精子症患者における生殖生物学の課題に対処するために大きな期待を寄せています。その臨床応用に加えて、ROSIは、胚発生の複雑なメカニズムを研究するための貴重なツールとして機能します15,16,17。
完全な胚発生を達成する際のROSIの低効率に寄与する根本的な要因を調査するために、数多くの動物実験が行われてきました。これらの要因には、補助卵子活性化(AOA)法の選択とそのタイミング、ゲノム安定性の異常、特にエピジェネティックな修飾の異常が含まれます。丸い精子細胞は未熟な生殖細胞であり、さまざまな生理学的側面で成熟した精子とは大きく異なることを認識することが重要です。今回、坂本瑞樹たちの研究グループは、丸型精子細胞に由来するH3K27me3が、ROSI胚18の遺伝子発現障害につながる、アクセスしにくいクロマチンと関連していることを明らかにした。Jing Wangたちの研究グループは、これに関連して、前核期のROSI胚のリプログラミング欠損が、主にマイナーな接合子ゲノム活性化に関与する遺伝子のコホートの誤発現と関連していた19。また、選択的ユークロマティックヒストンリジンメチルトランスフェラーゼ2阻害剤であるA366を導入すると、全体の発生速度が約2倍向上する可能性があることもわかりました。
マウスは、胚発生を研究するための最も貴重なモデル動物の1つとして立っています。この記事では、マウスでROSIを実行する方法について詳しく説明します。この包括的なプロトコルには、適切なマウスの選択、詳細な排卵誘発手順、AOA技術、注射技術、および代理マウスの準備が含まれます。さらに、出生効率に対する 2 つの注射レジメンの影響の比較分析を提示します: AOA とそれに続く ROSI (A-ROSI; 最初のレジメン) と ROSI とそれに続く AOA (ROSI-A; 2 番目のレジメン)。私たちは、研究者がマウスROSI実験をより精度よく行うことを奨励し、彼らの臨床応用と胚発生メカニズムの基礎研究をより強力にサポートすることを目指しています。
プロトコル
本実験で使用したB6D2F1(C57BL/6 x DBA/2)、C57BL/6、ICRマウスは、Beijing Vital River Laboratory Animal Technologies Co. Ltd.(中国・北京市)から購入しました。すべての動物治療は、吉林大学第一病院実験動物倫理委員会が承認した実験手順と基準を遵守していました(承認番号:20200435)。
1. 関連試薬の調製
- いくつかの試薬を商業的に入手し、残りの試薬を自己調製します。
- 丸型精子細胞(RS)、精子、卵子のin vitroプロセッシング用の緩衝系であるM2をサプライヤーから入手してください。
- 以前に公開されたプロトコル20に従って、AOA用のCa2+フリーC.L. Chatot、C.A. Ziomek、およびB.D. Bavister(CZB)培地を調製します。
- 胚培養用のアミノ酸(KSOMaa)溶液を添加したシンプレックスカリウム最適化培地をサプライヤーから入手します。
- 0.1 gのヒアルロニダーゼを1 mLの胚水に溶解して、使用濃度0.1%(1 g/L)のヒアルロニダーゼを調製します。10 μLの濃縮保存溶液を取り、4°Cで1週間保存できる990 mLのM2に溶解します。
- 1.2 gのPVPを10 mLのM2に溶解することにより、平均分子量360,000、質量濃度12%のポリビニルピロリドン(PVP)を調製します。得られた溶液は、4°Cで1週間保存できます。
- サイトカラシンB(CB)ストック溶液(2 μL)を-20°Cで18 μLのDMSOに可溶にして保存します。 濃縮保存液5μLを服用し、995mLのM2に溶解します。得られた溶液は、4°Cで1週間保存できます。
2. 卵子の調製
- 6〜8週齢の雌のB6D2F1マウスを少なくとも1週間、新しい環境に順応させます。午後 5 時に 7.5 IU の妊娠中の牝馬血清ゴナドトロピン (PMSG) を腹腔内注射し、続いて 48 時間後に 7.5 IU のヒト絨毛性ゴナドトロピン (HCG) を注射します。注射後に雄マウスとの接触が発生しないようにしてください。
注:指定された時間(午後5時)は必須ではありません。あくまでも仕事の便宜のため。午後5時を過ぎた14時間は午前7時で、卵子の準備が整い、注入が行われるため、注入時間は午前中に予定されています。注入の開始時間は、検査室の日々のスケジュールに合わせて調整することができます。 - HCG注射の14時間後、子宮頸部脱臼法を使用してマウスを安楽死させます。腹腔を開き、子宮を見つけます。子宮に沿った卵巣を特定し、はさみを使用して卵巣の近くの卵管を切断します。反対側でも同じ手順を繰り返し、事前に37°Cに予熱したM2に卵管を配置します。
- 直立顕微鏡(10倍)の下で、卵管の拡大した部分を特定し、透明で腫れた外観を示します。1mLのシリンジを使用して卵管を固定し、拡大した部分を切断し、卵子冠状卵丘複合体(OCCC)を収集します。
- 0.1%ヒアルロニダーゼを含む予熱したM2 操作溶液にOCCCを入れ、経口ピペットで穏やかに息を吹きかけて顆粒膜細胞を除去します。
注:OCCCを0.1%ヒアルロニダーゼ中に短時間、必要に応じて約2分間保持する。 - 顆粒膜細胞を除去した後、卵子をKSOMaaに移し、3回すすぎ、後で使用するために二酸化炭素インキュベーター(37°C、5%CO2)に入れます。
3.丸い精子細胞と精子の調製
- 雄のC57BL/6マウスの精巣と精巣上体から、それぞれ丸い精子細胞と精子を採取します(8-10週)。
- 精子については、子宮頸部脱臼によってマウスを安楽死させます。腹腔を開き、精巣の近くに精巣上体を見つけ、はさみで優しく切除します。
- 精巣上体をM2 培地に置き、1 mLシリンジを使用して精子を静かに切除し、直立顕微鏡(10x)で精子が流出することを確認します。
- 流れる精子とM2 懸濁液を0.5mLのM2が入ったチューブの底に吸い上げ、精子が自然に上流に流れるようにします。後で使用するために取っておきます。
- 丸い精子細胞の場合は、腹腔から睾丸を取り出してM2に配置します。1 mLのシリンジを使用して白いメンブレンを静かに切断し、直立顕微鏡(10x)で回旋した精細管を絞り出します。
- 精細管を2つの1mLシリンジを使用して慎重に切除します。.懸濁液を抽出し、400メッシュのふるい(38μm)でろ過します。
- ろ過した細胞を遠心分離し、上清を捨て、200 μLのHoechst 33342を添加して染色し、続いて37°Cで10分間インキュベートします。
- 蛍光活性化セルソーティング(FACS)を実施して、丸い精子細胞を他の細胞タイプと区別します。染色した細胞をフローサイトメトリーチューブに入れ、円形の精子細胞スクリーニングを行います。
- フローサイトメトリー装置のモデルが異なれば、調節パラメータも異なり、運転中に技術サポートと連絡を取ることができます。最初のステップとして、電圧を調整し、前方散乱(FSS)と側方散乱(SSC; 補足表1を参照)に従って細胞集団を選択します。
- 2番目のステップでは、FSCとトリガーパルス幅に従って細胞接着を除去します。
- 3番目のステップとして、ターゲットの一倍体丸型精子細胞を選択します。Hoechst 33342はDNAに結合し、倍数性の異なる細胞は異なる蛍光強度を示します。励起波長を355に設定します。355波長レーザーで460/50と670/30の2つの検出チャンネルを選択し、丸い精子細胞を選別します。その後、選別した丸い精子細胞を4°Cの冷蔵庫に保管して、後で使用します。
注:顕微鏡下でその形態に基づいて丸い精子細胞を直接選択することも可能ですが、選択精度を確保するにはトレーニングが必要です。
4. ラウンド精子細胞注射(ROSI)
- マイクロマニピュレーションシステムを備えた倒立顕微鏡を使用してROSI手順を実行します。
- 最初の調製工程では、先述の手順21に従って保持針および注射針を作製する。注射針の内径を6〜7μmに保ち、丸い精子細胞の抽出用に設計され、保持針用には、卵子を固定するための内径を20μmにします。
- その後の調製ステップでは、卵子を柔らかくするためのCBを含むM2 液滴10μLと丸い精子細胞を保存するためのM2 液滴10μLを配置して、注入容器を作成します。PVP液滴を使用して、注射針を湿らせて洗浄します。
注:ここでCBを追加することは必要なステップではありませんが、CBを追加すると、注射後の生存率が大幅に向上します。 - 注射針を使用して丸い精子細胞を抽出します。
- 保持針で卵子を回転させ、卵子の極体を12時または6時の位置に配置します。
- 注射針を卵母細胞の3時の位置に注意深く置き、透明帯にしっかりと接着します。PiezoXpertデバイスを使用して、透明帯に穴を開けます。強度を小さいものから大きいものまで調整します。これは、ここでは強度 = 5、速度 = 15 です。
- 注射針を透明帯を通して静かに前進させ、卵母細胞を水平に入力します。.卵子の中心を通過するときは、ピエゾ(強度= 1、速度= 1)を適用すると、卵母細胞膜が破裂し、丸い精子細胞が卵子の細胞質に徐々に注入されます。
- 注射針を引き抜き、開口部付近の卵子の膜を少量吸引して密封します。密封に失敗すると、細胞質の漏出と卵子の死につながるため、このステップは非常に重要です。
注:ROSIは、次のセクションで説明した丸型精細胞の注入前または注射後にAOAを必要としたことは注目に値します。
5. ICSI(顕微授精)
- ICSIはROSIと同じ手順を実行しますが、唯一の違いはICSI注射針の直径が9〜10μmであることです。
- PVP滑走路に精子を配置して、遊泳速度を落とし、精子の抽出を容易にします。
- 顕細胞内科の精子の頭と尾の分離を行います。尾から精子を吸引し、精子の首を注射針の口に正確に配置します。ピエゾ(必要に応じて複数のピエゾを使用でき、強度= 5、速度= 15)を適用して、精子の頭と尾を分離します。
6. 卵子活性化補助(AOA)
- プロトコルに従って、カルシウムとマグネシウムを含まないCZB培地を準備します。
- 分子量266.62の塩化ストロンチウム六水和物(SrCl26H2O)を10mMの濃度で使用します。それを調製するには、0.26662gのSrCl26H2Oを1mLの胚水に溶解します。使用時には、Ca2+フリーCZB培地990μLに濃縮保存液10μLを加えてすぐに使用してください。
- 活性化のために、卵母細胞をSrCl26H2Oを含むCa2+フリーCZB培地に入れます。各液滴の容量は20μLで、毎回20個の卵子が配置されます。20分間インキュベートします。
- 同時に、丸い精子細胞や精子を注入せずに単為生殖活性化のためのグループを確立します。なお、単為生殖活性化群は統計解析なしで示し、対照群はICSIである。
7. 胚移植
- 結紮されたICRマウスの雄と雌のマウスを1:2の比率で収容します。翌朝、雌マウスに膣栓の有無を検査し、移植用の膣栓を有するマウスを選択します。
- 2細胞胚からなる移植胚を前日の午前中に注入し、翌日の午後に移植します。
- 雌マウスの背中を切開し、白い脂肪と卵巣を露出させ、直立顕微鏡(10倍)で卵管の肥大部分を見つけます。
- 1mLのシリンジを使用して、卵管の拡大部分に開口部を作り、経口ピペットで胚を吸引します。子宮の方向に胚をやさしく導入します。5-0(0.09-0.11mm)の厚さで、糸付きの湾曲した針の4 x 10モデルを使用して、創傷を縫合します。縫合糸は、腹膜用と外側の皮膚用の2層で作られます。
- 代理マウスの場合は、実験スケジュールに基づいて帝王切開を行います。子宮頸部脱臼法によりマウスを安楽死させ、アルコール消毒を行い、腹腔を開放します。子宮を優しく素早く切り開き、羊水腔を開いて胎児と胎盤を見せます。へその緒を取り外し、胎児に近い側から切り取ります。胎児は、母乳育児マウスと同じ期間によって栄養を与えられました。
注:出生率を計算する必要があるため、帝王切開は生産能力に関してより正確です。自然分娩では、子孫が母親に食べられる可能性があり、その結果、統計が不正確になります。帝王切開は初期に移植した代理母マウスに対して行い、安楽死帝王切開は分娩前に行います。
8. 統計分析
- GraphPad Prism 5を使用して分析します。データは平均 ± SD で表されます。 P < 0.05 は統計的な差を示し、 P < 0.01 は有意な統計的差を示します。
結果
まず、AOAが胚の発生能力に及ぼす影響を調べることから研究を開始しました。実験計画の概略図を 図1Aに示します。精子注入の前に、卵母細胞はAOA(A-ICSI)または未治療(ICSI)のいずれかを受けました。胚発生に関する詳細なデータを 表1に示します。その結果、A-ICSI群とICSI群の間で、卵割率、胚盤胞率、出生率に有意差は認められなかった(P > 0.05; 図1B)。これらの知見は、10 mM SrCl2 を20分間使用したAOAが胚の発生能に影響を与えなかったことを示している。
以前に報告されたのは、FACSによって選択されたROSI胚の発生効率または顕微鏡下での直接目視検査によって選択されたROSI胚の発生効率に識別可能な違いはなかった22。私たちの実験では、FACS技術を用いてRSを同定しました(図2A、B)。顕微鏡下では、マウスの丸い精子細胞の直径は約10μmで、中央に突起状の核小体構造を示しました(図2C)。FACSによる選択は、顕微鏡下での直接目視検査よりも正確であると仮定しています。さらに、文献は、形態学的な違いを通じてRSを直接調査することを支持しています。ROSI胚は、ラウンド精子細胞注入前に卵子をAOAにさらすA-ROSIグループと、ラウンド精細胞注入後に卵子をAOAにさらすROSI-Aグループという2つの異なる方法を使用して作製しました。実験計画の概略図を 図1Cに示します。特に、A-ROSI、ROSI-A、およびICSIグループ間で、切断率と胚盤胞率に有意差は見られませんでした(P > 0.05; 図1D)。A-ROSI、ROSI-A、およびICSI群の胚盤胞率は、活性化群の胚盤胞率よりも有意に高かった(P < 0.05; 図1D)。しかし、ROSI群の出生率は、卵子が注射前または注射後に活性化されたかどうかに関係なく、ICSI群の出生率よりも低かった(P < 0.05; 図1D)。重要なことに、A-ROSIグループの出生率はROSI-Aグループの出生率よりもわずかに高かった(図1D)。胚発生データの詳細については、 表1に示します。
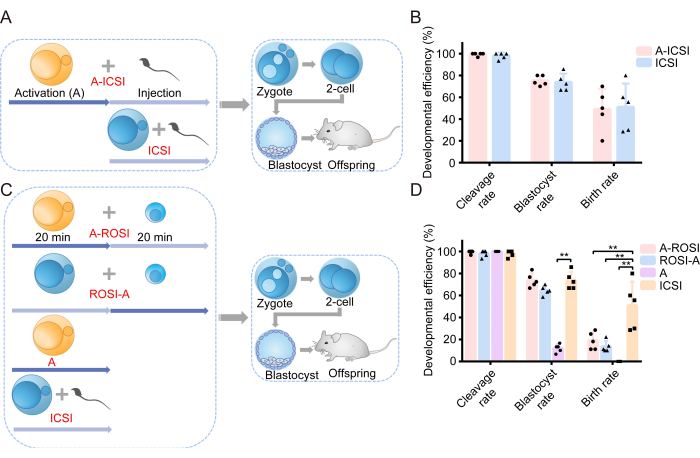
図1:ROSI胚は、ICSI胚と比較して発生効率が低下した (A)ICSI胚発生に対する活性化の影響を評価する実験プロトコルの概略図。青 = 卵子は活性化されていません。黄色 = 卵子が活性化されました。(B)A-ICSIおよびICSIに由来する胚の発生効率。(C)異なる種類の胚を生成するための実験プロトコルの概略図。(D)A-ROSI、ROSI-A、A、およびICSIに由来する胚の発生効率。**、 P < 0.01。略語:A =活性化E =胚の日;ROSI=円形精子細胞注射;ICSI=細胞質内精子注入。エラーバーは標準偏差を示します。レートの比較は、カイ2乗検定を使用して行われます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:丸型精子細胞は、フローサイトメトリーソーティングにより選択されました。 (A)ラウンド精子細胞の選択には、フローサイトメトリーソーティングダイアグラムを使用しました。(B)丸い精子細胞の選択を示す代表的な画像。スケールバー:10μm。略語:FSC =前方散乱;SSC = 側方散乱;355は励起波長です。460/50と670/30は、355波長レーザーの2つの検出チャンネルです。 この図の拡大版を表示するには、ここをクリックしてください。
| グループ | 着床前開発 | 着床後の開発 | |||
| 複製 | 劈開率(%) | 胚盤胞率(%) | 2細胞胚移植/ No.受取人の数 | 出生率(%) | |
| A-顕微精 | 5 | 99.33 (149/150) | 75.17 (112/149) | 49/5 | 48.98 (24/49) |
| A-ロシ | 5 | 99.33 (149/150) | 73.83 (110/149) | 44/5 | 18.18 (8/44) ** |
| ロジA | 5 | 98.00 (147/150) | 64.63 (95/147) | 45/5 | 13.33 (6/45) ** |
| アクティベーション | 5 | 100.00 (150/150) | 12.00 (18/150) ** | 51/5 | 0.00 (0/51) ** |
| ICSIの | 5 | 98.00 (147/150) | 73.47 (108/147) | 46/5 | 52.17 (24/46) |
テーブル 1. 異なるグループに由来する胚の発生効率。
補足表1。 フローサイトメトリーでソートされた異なる細胞集団の割合。P3部分は丸い精子細胞です。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
卵子活性化の補助
ROSIの重要な前提条件は、丸い精子細胞だけでは卵子の活性化を開始できないため、AOAです。現在、マウスで最も確立された方法は塩化ストロンチウムの使用を含みます23,24、最も進んだヒトへの応用は電気的活性化13,14を採用しています。卵子が活性化するタイミングも非常に重要です。文献で報告されているように、マウスにおける最適な活性化アプローチは、最初に卵子を活性化し、次に丸い精子細胞を注入することを含みます25。これは、精子が最初に卵子に入り、その後ホスホリパーゼC ζ放出して卵子を活性化する従来の受精プロセスとは対照的である26。岸上聡氏らが行った専門的な研究では、ROSIが活性化前または活性化後の卵子で男性核を形成する能力が異なることが強調されています。効率的な子孫生産率を達成するためには、卵子がG1フェーズ25に入る前に、両方の注入タイプを実施する必要があります。
注射針の直径
ROSIの文脈では、注射針の直径が大きいほど必ずしも良い結果につながるとは限らないことに注意することが重要です。使用される注射針は直径が6〜7μmで、丸い精子細胞よりもわずかに小さいです。したがって、丸い精子細胞を吸引すると、細胞膜は圧迫効果を受け、核が直接露出する可能性があります。この直接曝露は、解重合およびその後の雄性前核の形成を助長し得る27。
シーリング処理
マウス卵母細胞は、他の種と比較して細胞質粘度が低くなります。細胞膜がわずかに裂けるだけでも、細胞質が容易に流出し、卵子の変性を引き起こす可能性があります28。リスクを軽減するために、丸い精子細胞を卵子細胞質に注入し、注射針を抜いた後、ICSI21の手順と同様に、卵子細胞膜の開口部近くの細胞膜の小さな部分を吸引して空間を密閉することが不可欠です。このシーリングプロセスにより、卵子の変性のリスクが大幅に減少します。
モデルとしてのROSIの適用
臨床応用以外にも、ROSI技術にはモデルとしてさまざまな応用があります。それは、マウスの生成を29倍促進し、マウスの父方遺伝のXist欠失に起因する女性の致死性を救い17、一倍体単為生殖2細胞割球への円形精子細胞注射後のマウス15を生成し、トランスジェニックマウスの子孫16を生成し、癌治療30,31の前に思春期の子供の生殖能力を維持することができます。.マウスROSIの入念な研究は、リプロダクティブヘルス研究の進歩に大きく貢献することができます。
記事の制限事項
この記事は、顕微鏡下での注射用のRSの直接比較選択がないことや、イノベーションの欠如が認識されていることなど、いくつかの制限がある方法論のガイドとして機能します。
開示事項
著者は、金銭的またはその他の利益の対立を宣言しません。
謝辞
フローサイトメトリーによる丸型精子細胞の選別に貴重なご協力をいただいたWenjie Zhao氏と、マウス胚移植の専門知識を提供してくださったFang Wang氏に感謝いたします。この研究は、吉林省自然科学基金会(No.YDZJ202301ZYTS461)。原稿の言語編集と校正に携わったBullet Edits Limitedに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| CaCl22H2O | Sigma | C7902 | Preparation of CZB |
| Glucose | Sigma | G6152 | Preparation of CZB |
| HEPES-Na (basic) | Sigma | H3784 | Preparation of CZB |
| Hoechst 33342 | Beyotime | C1025 | FACS |
| human chorionic gonadotropin (HCG) | Ningbo Second Hormone Company | HCG | Ovulation promoting drugs |
| Hyaluronidase | Sigma | H3506 | Removing granulosa cells around the oocyte |
| KCl | Sigma | P5405 | Preparation of CZB |
| KH2PO4 | Sigma | P5655 | Preparation of CZB |
| KSOMaa | Caisson Labs | IVL04-100ML | Potassium simplex optimized medium supplemented with amino acids |
| L-glutamine | Sigma | G8540 | Preparation of CZB |
| M2 | Sigma | M7167-50ML | Operating fluid |
| MgSO47H2O | Sigma | M1880 | Preparation of CZB |
| Na2-EDTA2H2O | Sigma | E5134 | Preparation of CZB |
| NaCl | Sigma | S5886 | Preparation of CZB |
| NaHCO3 | Sigma | S5761 | Preparation of CZB |
| Na-lactate 60% syrup d = 1.32 g/L | Sigma | L7900 | Preparation of CZB |
| Na-pyruvate | Sigma | P4562 | Preparation of CZB |
| Piezo drill tips (ICSI) | Eppendorf | piezoXpert | Piezoelectric membrane rupture |
| pregnant mare serum gonadotropin (PMSG) | Ningbo Second Hormone Company | PMSG | Ovulation promoting drugs |
| PVA | Sigma | P8136 | Preparation of CZB |
参考文献
- Redgrove, K. A., McLaughlin, E. A. The role of the immune response in Chlamydia trachomatis infection of the male genital tract: A double-edged sword. Front Immunol. 5, 534(2014).
- Yanagimachi, R. Intracytoplasmic injection of spermatozoa and spermatogenic cells: Its biology and applications in humans and animals. Reprod Biomed Online. 10 (2), 247-288 (2005).
- Palermo, G., Joris, H., Devroey, P., Van Steirteghem, A. C. Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte. Lancet. 340 (8810), 17-18 (1992).
- Kimura, Y., Yanagimachi, R. Mouse oocytes injected with testicular spermatozoa or round spermatids can develop into normal offspring. Development. 121 (8), 2397-2405 (1995).
- Tesarik, J., et al. Spermatid injection into human oocytes. II. Clinical application in the treatment of infertility due to non-obstructive azoospermia. Human Reprod. 11 (4), 780-783 (1996).
- Tesarik, J., Mendoza, C. Spermatid injection into human oocytes. I. Laboratory techniques and special features of zygote development. Human Reprod. 11 (4), 772-779 (1996).
- Hirabayashi, M., et al. Activation regimens for full-term development of rabbit oocytes injected with round spermatids. Mol Reprod Dev. 76 (6), 573-579 (2009).
- Ogonuki, N., et al. Birth of a marmoset following injection of elongated spermatid from a prepubertal male. Mol Reprod Dev. 86 (8), 928-930 (2019).
- Niederberger, C., et al. Forty years of IVF. Fertil Steril. 110 (2), 185(2018).
- Gross, K. X., Hanson, B. M., Hotaling, J. M. Round spermatid injection. Urol Clin North Am. 47 (2), 175-183 (2020).
- Hanson, B. M., et al. Round spermatid injection into human oocytes: a systematic review and meta-analysis. Asian J Androl. 23 (4), 363-369 (2021).
- Tekayev, M., Vuruskan, A. K. Clinical values and advances in round spermatid injection (ROSI). Reprod Biol. 21 (3), 100530(2021).
- Tanaka, A., et al. Fourteen babies born after round spermatid injection into human oocytes. Proc Natl Acad Sci U S A. 112 (47), 14629-14634 (2015).
- Tanaka, A., et al. Ninety babies born after round spermatid injection into oocytes: survey of their development from fertilization to 2 years of age. Fertil Steril. 110 (3), 443-451 (2018).
- Yang, H., Shi, L., Chen, C. D., Li, J. Mice generated after round spermatid injection into haploid two-cell blastomeres. Cell Res. 21 (5), 854-858 (2011).
- Moreira, P., et al. Transgenic mouse offspring generated by ROSI. J Reprod Dev. 62 (1), 37-42 (2016).
- Federici, F., et al. Round spermatid injection rescues female lethality of a paternally inherited Xist deletion in mouse. PLoS Genet. 12 (10), e1006358(2016).
- Sakamoto, M., et al. Paternally inherited H3K27me3 affects chromatin accessibility in mouse embryos produced by round spermatid injection. Development. 149 (18), 200696(2022).
- Wang, J., et al. Single-cell multiomics sequencing reveals the reprogramming defects in embryos generated by round spermatid injection. Sci Adv. 8, (2022).
- Ward, M. A., Yanagimachi, R. Intracytoplasmic sperm injection in mice. Cold Spring Harb Protoc. 2018 (1), (2018).
- Yoshida, N., Perry, A. C. Piezo-actuated mouse intracytoplasmic sperm injection (ICSI). Nat Protoc. 2 (2), 296-304 (2007).
- Zhu, L., et al. FACS selection of valuable mutant mouse round spermatids and strain rescue via round spermatid injection. Zygote. 23 (3), 336-341 (2013).
- Kong, P., et al. Effects of the histone deacetylase inhibitor 'Scriptaid' on the developmental competence of mouse embryos generated through round spermatid injection. Hum Reprod. 32 (1), 76-87 (2017).
- Hosseini, S., Salehi, M. Tricostatin A-treated round spermatid enhances preimplantation embryo developmental competency following round spermatid injection in mice. Zygote. 30 (3), 373-379 (2022).
- Kishigami, S., Wakayama, S., Nguyen, V. T., Wakayama, T. Similar time restriction for intracytoplasmic sperm injection and round spermatid injection into activated oocytes for efficient offspring production. Biol Reprod. 70 (6), 1863-1869 (2004).
- Tao, Y. Oocyte activation during round spermatid injection: state of the art. Reprod Biomed Online. 45 (2), 211-218 (2022).
- Ogura, A., Ogonuki, N., Miki, H., Inoue, K. Microinsemination and nuclear transfer using male germ cells. Int Rev Cytol. 246, 189-229 (2005).
- Kimura, Y., Yanagimachi, R. Intracytoplasmic sperm injection in the mouse. Biol Reprod. 52 (4), 709-720 (1995).
- Ogonuki, N., et al. A high-speed congenic strategy using first-wave male germ cells. PLoS One. 4 (3), e4943(2009).
- Abdelaal, O., et al. Fertility preservation for pediatric male cancer patients: illustrating contemporary and future options; a case report. Transl Androl Urol. 10 (1), 520-526 (2021).
- Eyni, H., et al. Advanced bioengineering of male germ stem cells to preserve fertility. J Tissue Eng. 12, (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved