Method Article
마우스 라운드 Spermatid 주입
요약
여기에서는 마우스에서 ROSI(round spermatid injection)를 수행하는 방법, 유망한 임상 응용 기술을 가진 기술이며 배아 발달의 기전을 조사하기 위한 유용성을 소개합니다.
초록
반수체 유전 적 함량을 특징으로하는 둥근 정자는 성숙한 정자의 전구 세포를 나타냅니다. 라운드 정자 주입(ROSI)의 혁신적인 기술을 통해 난모세포는 성공적으로 수정되어 생존 가능한 태아로 발달할 수 있습니다. 1995년에 달성한 획기적인 이정표로, ROSI 기술을 통해 최초의 마우스 태아가 탄생했습니다. 이후 ROSI는 배아 발달을 관장하는 복잡한 메커니즘을 밝히기 위한 중추적인 도구로 부상했으며, 마우스 생성 가속화 및 유전자 변형 마우스 생산을 포함한 다양한 응용 분야에서 상당한 잠재력을 보유하고 있습니다. 1996년, ROSI 기술을 통해 최초의 인간 태아가 탄생하는 이정표가 세워졌습니다. 그러나 이 방법의 임상적 적용은 성공과 실패의 변동 패턴을 보여주었습니다. 현재까지 ROSI 기술은 주로 출산 효율이 낮고 태아 안전성에 대한 검증이 불충분하기 때문에 임상 실습에서 널리 적용되지 않았습니다. 이 기사는 기초 연구와 잠재적인 임상 응용에 대한 새로운 빛을 비추기 위해 마우스에서 ROSI를 수행하는 정확한 방법에 대한 포괄적인 설명을 제공합니다.
서문
정자 형성의 마지막 단계는 둥근 정자가 뚜렷한 머리, 목 및 길쭉한 꼬리 구조를 특징으로 하는 완전히 발달된 정자로 변형되는 것입니다1. 이 변형은 핵 내 염색질의 응축, 프로타민에 의한 히스톤 대체, 아크로솜 형성, 미토콘드리아 수초 발달, 중심소체 이동 및 손실, 꼬리 구조 형성, 세포 잔류물 제거2와 같은 세포 형태의 중요한 변화를 포함합니다.
1992년, 세포질 내 정자 주입(ICSI) 기술을 통해 최초의 인간 태아가 성공적으로 태어났다3. 그 이후로 연구자들은 성숙한 정자와 동일한 반수체 유전적 구성을 공유하는 둥근 정자를 활용하여 난모세포를 수정하고 생존 가능한 임신을 유지할 수 있는 가능성을 모색해 왔습니다 2,4. 그 후 1996년에는 ROSI(round spermatid injection) 기술을 통해 잉태된 최초의 인간 태아가 분만되었습니다 5,6. 마우스에서 ICSI 및 ROSI와 관련된 연구는 주입 과정에서 마우스 난모세포막이 손상되기 쉽기 때문에 인간을 대상으로 한 연구보다 뒤처졌다는 점은 주목할 가치가 있습니다. 이 문제는 Piezo 멤브레인 파괴 장치를 도입하여 성공적으로 해결되었습니다. 그 결과 1995년 ROSI 기술을 통해 고안된 최초의 마우스가 탄생했습니다. 또한 다양한 다른 동물의 ROSI에 대한 연구도 진행 중입니다 7,8.
현재 ROSI에 대한 연구는 주로 ROSI 기술의 광범위한 응용과 함께 임상 적용, 메커니즘 규명, 개발 효율성 향상을 위한 전략과 같은 측면을 중심으로 이루어집니다. 임상적 적용의 맥락에서, 1996년 ROSI를 통해 최초의 ROSI 인간 태아가 태어났음에도 불구하고, 일련의 성공과 실패로 인해 진보가 이루어졌습니다 9,10,11,12. 현재까지 ROSI 기술은 효율성이 낮고 ROSI 기술을 통해 잉태된 태아의 안전성에 대한 추가 검증이 필요하기 때문에 광범위한 임상 구현을 달성하지 못했습니다. 불완전한 통계에 따르면 전 세계적으로 ROSI로 잉태된 인간 태아는 200명 미만입니다. ROSI 기술의 잠재력에 대한 이해의 전환점은 2015년 Tanaka와 동료들이 ROSI 기술을 통해 14명의 태아를 성공적으로 출산했다고 보고하면서 ROSI 기술의 임상 적용과 실현 가능성에 대한 새로운 확신을 심어주었을 때 발생했습니다13,14. ROSI 기술은 특히 비폐쇄성 무정자증 환자에서 생식 생물학 문제를 해결할 수 있는 상당한 가능성을 가지고 있습니다. 임상적 응용 외에도 ROSI는 배아 발달의 복잡한 메커니즘을 연구하기 위한 귀중한 도구 역할을 합니다 15,16,17.
완전한 배아 발달을 달성하는 데 있어 ROSI의 낮은 효율성에 기여하는 근본적인 요인을 조사하기 위해 수많은 동물 연구가 수행되었습니다. 이러한 요인에는 보조 난모세포 활성화(AOA) 방법의 선택과 시기, 게놈 안정성의 이상, 특히 후성유전학적 변형의 이상이 포함됩니다. 둥근 정자는 미성숙한 생식 세포이며 다양한 생리학적 측면에서 성숙한 정자와 크게 다르다는 것을 인식하는 것이 중요합니다. 미즈키 사카모토(Mizuki Sakamoto)와 동료들은 둥근 정자(round spermatids)에서 유래한 H3K27me3가 접근하기 어렵고 ROSI 배아에서 유전자 발현 장애를 유발하는 염색질과 관련이 있다고 밝혔다18. Jing Wang과 동료들의 관련 연구에서, 전핵 단계에서 ROSI 배아의 재프로그래밍 결함은 주로 경미한 접합 게놈 활성화를 담당하는 유전자 코호트의 오발현과 관련이 있었다19. 그들은 또한 선택적 유색성 히스톤 라이신 메틸전이효소 2 억제제인 A366을 도입하면 잠재적으로 전체 발달 속도를 약 2배 향상시킬 수 있음을 발견했습니다.
쥐는 배아 발달을 연구하는 데 가장 가치 있는 모델 동물 중 하나입니다. 이 기사에서는 마우스에서 ROSI를 수행하는 방법에 대해 자세히 설명합니다. 이 포괄적인 프로토콜에는 적합한 마우스의 선택, 상세한 배란 유도 절차, AOA 기술, 주사 기술 및 대리 마우스의 준비가 포함됩니다. 또한, 두 가지 주사 요법이 출산 효율에 미치는 영향에 대한 비교 분석을 제시합니다: AOA에 이어 ROSI(A-ROSI, 첫 번째 요법), ROSI에 이어 AOA(ROSI-A, 두 번째 요법). 우리는 연구자들이 마우스 ROSI 실험을 보다 정밀하게 수행하도록 장려하여 임상 적용 및 배아 발달 메커니즘의 기초 연구에 대한 보다 강력한 지원을 제공하는 것을 목표로 합니다.
프로토콜
본 실험에 사용된 B6D2F1 (C57BL/6 x DBA/2), C57BL/6 및 ICR 마우스는 Beijing Vital River Laboratory Animal Technologies Co. Ltd. (Beijing, China)로부터 구입하였다. 모든 동물 치료는 길림대학 제1병원 실험동물윤리위원회(승인번호: 20200435)가 승인한 실험절차와 기준을 따랐다.
1. 관련 시약의 준비
- 일부 시약을 상업적으로 구입하고 나머지 시약을 자가 준비합니다.
- 공급자로부터 원형 정자류(RS), 정자 및 난모세포의 체외 처리를 위한 완충 시스템인 M2를 구합니다.
- 이전에 발표된 프로토콜20에 따라 AOA에 대해 Ca2+-free C.L. Chatot, C.A. Ziomek 및 B.D. Bavister(CZB) 배지를 준비합니다.
- 공급자로부터 배아 배양을 위한 아미노산이 보충된 단순 칼륨 최적화 배지(KSOMaa) 용액을 받으십시오.
- 0.1g의 히알루로니다아제를 배아 물 1mL에 용해시켜 작업 농도 0.1%(1g/L)의 히알루로니다아제를 준비합니다. 10μL의 농축 저장 용액을 4°C에서 1주일 동안 보관할 수 있는 990mL의 M2에 용해시킵니다.
- 평균 분자량이 360,000이고 질량 농도가 12%인 폴리비닐피롤리돈(PVP)을 10mL의 M2에 PVP 1.2g을 용해하여 제조합니다. 생성된 용액은 4°C에서 1주일 동안 보관할 수 있습니다.
- -20°C에서 18μL의 DMSO에 용해된 사이토칼라신 B(CB) 원액(2μL)을 보관하십시오. 농축 저장 용액 5μL를 취하여 995mL의 M2에 용해시킵니다. 생성된 용액은 4°C에서 1주일 동안 보관할 수 있습니다.
2. 난모세포의 준비
- 6-8주 된 암컷 B6D2F1 마우스를 최소 1주일 동안 새로운 환경에 적응시킵니다. 오후 5시에 7.5IU의 임산부 암말 혈청 성선 자극 호르몬(PMSG)을 복강내 주사한 후 48시간 후에 7.5IU의 인간 융모성 성선 자극 호르몬(HCG)을 주입합니다. 주사 후 수컷 마우스와의 접촉이 발생하지 않도록 하십시오.
참고: 지정된 시간(오후 5시)은 필수가 아닙니다. 그것은 단지 업무의 편의를 위한 것입니다. 오후 5시 이후 14시간은 난모세포가 준비되고 주사가 수행되는 오전 7시이므로 주사 시간은 오전으로 예정되어 있습니다. 주사 시작 시간은 실험실의 일일 일정에 따라 조정할 수 있습니다. - HCG 주입 14시간 후, 경추 탈구 방법을 사용하여 마우스를 안락사시킵니다. 복강을 열고 자궁을 찾습니다. 자궁을 따라 있는 난소를 확인하고 가위를 사용하여 난소 근처의 나팔관을 절단합니다. 반대쪽도 같은 절차를 반복하고 37°C로 미리 예열된 M2에 나팔관을 놓습니다.
- 정립 현미경(10x)으로 투명하고 부풀어 오른 모습을 보여주는 나팔관의 확대된 부분을 찾습니다. 1mL 주사기를 사용하여 나팔관을 고정하는 동시에 확대된 부분을 절단하여 난모세포 관상 적운 복합체(OCCC)를 수집합니다.
- 0.1% 히알루로니다아제가 함유된 예열된 M2 작동 용액에 OCCC를 넣고 구강 피펫을 통해 부드럽게 불어 과립층 세포를 제거합니다.
참고: 필요한 경우 약 2분의 짧은 시간 동안 OCCC를 0.1% 히알루로니다아제에 보관하십시오. - 과립층 세포를 제거한 후 난모세포를 KSOMaa로 옮기고 3번 헹구고 나중에 사용할 수 있도록 이산화탄소 배양기에 넣습니다(37°C, 5% CO2).
3. 둥근 정자 및 정자의 준비
- 수컷 C57BL/6 마우스(8-10주)의 고환과 부고환에서 각각 둥근 정자와 정자를 수집합니다.
- 정자의 경우, 자궁경부 탈구로 쥐를 안락사시킵니다. 복강을 열고 고환 근처의 부고환을 찾은 다음 가위로 부드럽게 절제합니다.
- 부고환을 M2 배지에 놓고 1mL 주사기를 사용하여 정자 동물이 정립 현미경(10x)으로 흘러나오도록 부드럽게 절제합니다.
- 흐르는 정자와 M2 현탁액을 0.5mL의 M2가 들어 있는 튜브의 바닥으로 빨아들여 정자가 자연스럽게 상류로 흐르도록 합니다. 나중에 사용할 수 있도록 따로 보관하십시오.
- 둥근 정자의 경우 복강에서 고환을 제거하고 M2에 놓습니다. 1mL 주사기를 사용하여 흰색 멤브레인을 부드럽게 자르고 정립 현미경(10x)으로 뒤얽힌 정세관을 짜냅니다.
- 2개의 1mL 주사기를 사용하여 정세관을 조심스럽게 절제합니다. 현탁액을 추출하고 400메쉬 체(38μm)로 여과합니다.
- 여과된 세포를 원심분리하고 상층액을 버리고 염색을 위해 200μL의 Hoechst 33342를 첨가한 다음 37°C에서 10분 동안 배양합니다.
- 형광 활성화 세포 분류(FACS)를 수행하여 둥근 정자를 다른 세포 유형과 구별합니다. 염색된 세포를 유세포분석 튜브에 넣고 원형 정자 스크리닝을 수행합니다.
- 유세포 분석 기계의 모델마다 규제 매개변수가 다르며 작동 중에 기술 지원과 소통할 수 있습니다. 첫 번째 단계로 전압을 조정하고 순방향 산란(FSS) 및 측면 산란(SSC, 보충 표 1 참조)에 따라 세포 집단을 선택합니다.
- 두 번째 단계에서는 FSC에 따라 세포 유착을 제거하고 펄스 폭을 트리거합니다.
- 세 번째 단계로 타겟 반수체 원형 정자를 선택합니다. Hoechst 33342는 DNA에 결합하고 ploidy가 다른 세포는 서로 다른 형광 강도를 나타냅니다. 여기 파장을 355로 설정합니다. 355 파장 레이저 아래에서 460/50 및 670/30의 두 가지 검출 채널을 선택하여 둥근 정자를 분류합니다. 그 후, 나중에 사용할 수 있도록 분류된 둥근 정자를 4°C 냉장고에 보관하십시오.
참고: 현미경으로 형태에 따라 둥근 정자를 직접 선택하는 것도 가능하지만 선택 정확도를 보장하기 위해서는 교육이 필요합니다.
4. 라운드 정자 주입 (ROSI)
- micromanipulation 시스템이 있는 도립 현미경을 사용하여 ROSI 절차를 수행합니다.
- 초기 준비 단계에서는 앞서 설명한 절차21에 따라 홀딩 및 주사 바늘을 만듭니다. 둥근 정자 추출을 위해 설계된 주사 바늘의 내경을 6-7 μm 사이로 유지하고 고정 바늘의 경우 난모세포를 고정하기 위해 내경이 20 μm입니다.
- 후속 준비 단계에서 난모세포를 연화시키기 위해 CB를 포함하는 10μL의 M2 방울과 둥근 정자를 저장하기 위한 10μL의 M2 방울을 배치하여 주입 용기를 만듭니다. PVP 액적을 사용하여 주사 바늘을 촉촉하게 하고 청소합니다.
참고: 여기에 CB를 추가하는 것은 필수 단계는 아니지만 CB를 추가하면 주사 후 생존율을 크게 향상시킬 수 있습니다. - 주사 바늘을 사용하여 둥근 정자를 추출합니다.
- 고정 바늘로 난모세포를 회전시켜 난모세포의 극체를 12시 또는 6시 위치에 위치시킵니다.
- 주사 바늘을 난모세포의 3시 위치에 조심스럽게 놓고 투명대에 단단히 밀착시킵니다. PiezoXpert 장치를 사용하여 투명대에 구멍을 만듭니다. 강도를 작은 것에서 큰 것으로 조정하며, 여기서 대략 강도 = 5 및 속도 = 15입니다.
- 주사 바늘을 투명대를 통해 부드럽게 전진시키고 난모세포를 수평으로 들어갑니다. 난모세포의 중심을 통과할 때 피에조(piezo)를 가하여(강도 = 1, 속도 = 1) 난모세포막이 파열되고 둥근 정자(round spermatid)가 난모세포의 세포질에 점진적으로 주입됩니다.
- 주사 바늘을 빼내고 구멍 근처에서 난모세포의 막을 소량 흡인하여 밀봉합니다. 밀봉에 실패하면 세포질 누출과 난모세포가 죽을 수 있으므로 이 단계가 중요합니다.
참고: ROSI는 후속 섹션에서 논의한 원형 정자 주입 전이나 후에 AOA를 필요로 했다는 점에 주목할 가치가 있습니다.
5. 세포질 내 정자 주입(ICSI)
- ROSI와 마찬가지로 ICSI에 대해 동일한 단계를 수행하지만 유일한 차이점은 9-10μm를 측정하는 ICSI 주사 바늘의 직경입니다.
- PVP 활주로에 정자를 배치하여 수영 속도를 줄이고 정자 추출을 용이하게 합니다.
- ICSI를 위해 정자 머리와 꼬리를 분리합니다. 꼬리에서 정자를 흡인하고 정자의 목을 주사 바늘 입구에 정확하게 위치시킵니다. 피에조(필요에 따라 여러 피에조를 사용할 수 있음, 강도 = 5 및 속도 = 15)를 적용하여 정자의 머리와 꼬리를 분리합니다.
6. 보조 난모세포 활성화(AOA)
- 프로토콜에 따라 칼슘과 마그네슘이 없는 CZB 배지를 준비합니다.
- 분자량이 266.62인 염화스트론튬 육수화물(SrCl26H2O)을 10mM 농도로 사용합니다. 이를 준비하려면 배아 물 1mL에 SrCl26H2O 0.26662g을 용해시킵니다. 사용 시 990μL의 Ca2+-free CZB 배지에 10μL의 농축 저장 용액을 첨가하고 즉시 사용하십시오.
- 활성화를 위해 SrCl26H2O를 포함하는 Ca2+-free CZB 배지에 난모세포를 배치합니다. 각 액적의 부피는 20μL이며 매번 20개의 난모세포를 배치합니다. 20분 동안 배양합니다.
- 동시에, 둥근 정자 또는 정자를 주입하지 않고 단형성 활성화를 위한 그룹을 설정합니다. 단형성 활성화 그룹은 통계적 분석 없이 표시되며 대조군은 ICSI라는 점에 유의해야 합니다.
7. 배아 이식
- 결찰된 ICR 수컷과 암컷 마우스를 1:2의 비율로 수용합니다. 다음 날 아침, 암컷 쥐에서 질 마개가 있는지 검사하고 이식을 위해 질 마개가 있는 쥐를 선택합니다.
- 2세포 배아로 구성된 이식된 배아를 전날 아침에 주입하고 다음날 오후에 이식합니다.
- 암컷 쥐의 등을 절개하여 흰색 지방과 난소를 노출시키고 정립 현미경(10x)으로 나팔관의 확대된 부분을 찾습니다.
- 1mL 주사기를 사용하여 나팔관의 확대된 부분에 구멍을 만들고 구강 피펫을 통해 배아를 흡인합니다. 자궁 방향으로 배아를 부드럽게 소개합니다. 두께가 5-0 (0.09-0.11 mm)인 실이 있는 구부러진 바늘의 4 x 10 모델을 사용하여 상처를 봉합합니다. 봉합사는 두 개의 층으로 만들어지며 한 층은 복막용이고 다른 층은 외피용입니다.
- 대리모 마우스의 경우, 실험 일정에 따라 제왕절개를 수행합니다. 자궁 경부 탈구 방법으로 쥐를 안락사시키고 알코올로 소독하고 복강을 엽니 다. 부드럽고 빠르게 자궁을 절개하고 양막을 열어 태아와 태반을 보여줍니다. 탯줄을 제거하고 태아에 가까운 쪽에서 자릅니다. 태아는 같은 시기에 모유수유를 하는 쥐에게 먹이를 먹였다.
참고: 출산율을 계산해야 하기 때문에 제왕절개는 생산 능력과 관련하여 더 정확합니다. 자연 분만에서는 자손이 엄마에 의해 먹힐 수 있으며, 이로 인해 통계가 부정확해질 수 있습니다. 제왕 절개는 초기 단계에서 이식 한 대리 마우스에서 시행되며, 안락사 제왕 절개는 출산 전에 시행됩니다.
8. 통계 분석
- GraphPad Prism 5를 사용하여 분석합니다. 데이터는 평균 ± SD로 표현됩니다. P < 0.05는 통계적 차이를 나타내고 P < 0.01은 유의한 통계적 차이를 나타냅니다.
결과
우리는 AOA가 배아의 발달 능력에 미치는 영향을 조사하는 것으로 조사를 시작했습니다. 실험 설계의 개략도는 그림 1A에 나와 있습니다. 정자 주사 전에 난모세포는 AOA(A-ICSI)를 거치거나 치료되지 않은 상태(ICSI)를 받았습니다. 배아 발달에 대한 자세한 데이터는 표 1에 제시되어 있습니다. 그 결과, A-ICSI군과 ICSI 군 간에 분열, 배반포 또는 출생률에 유의한 차이가 없는 것으로 나타났다(P > 0.05; 그림 1B). 이러한 결과는 10mM SrCl2를 20분 동안 사용하는 AOA가 배아의 발달 잠재력에 영향을 미치지 않았음을 나타냅니다.
이전에 FACS 또는 현미경 하의 직접 육안 검사에 의해 선택된 ROSI 배아의 발달 효율에는 눈에 띄는 차이가 없다고 보고되었습니다22. 우리의 실험에서는 RS를 식별하기 위해 FACS 기술을 사용했습니다(그림 2A, B). 현미경으로 보니 생쥐의 둥근 정자는 직경이 약 10μm였으며 중간에 돌출부와 같은 핵소체 구조를 보여주었습니다(그림 2C). 우리는 FACS를 통한 선택이 현미경으로 직접 육안 검사하는 것보다 더 정확하다고 가정합니다. 또한, 문헌은 형태학적 차이를 통한 RS의 직접적인 탐색을 뒷받침합니다. ROSI 배아는 두 가지 다른 방법을 사용하여 생성되었습니다: A-ROSI 그룹은 라운드 정자 주입 전에 난모세포에 AOA를 적용하고, ROSI-A 그룹은 라운드 정자 주입 후 난모세포에 AOA를 적용했습니다. 실험 설계의 개략도는 그림 1C에 나와 있습니다. 특히, A-ROSI, ROSI-A 및 ICSI 그룹에서 분열 및 배반포 비율에서 유의한 차이가 발견되지 않았습니다(P > 0.05; 그림 1D). A-ROSI, ROSI-A 및 ICSI 그룹의 배반포 비율은 활성화 그룹보다 유의하게 높았다(P < 0.05; 그림 1D). 그러나 난모세포가 주입 전후에 활성화되었는지 여부에 관계없이 ROSI 그룹의 출생률은 ICSI 그룹보다 낮았다(P < 0.05; 그림 1D). 중요한 것은 A-ROSI 그룹의 출생률이 ROSI-A 그룹의 출생률보다 약간 높았다는 것입니다(그림 1D). 배아 발달 데이터에 대한 자세한 내용은 표 1에 제시되어 있습니다.
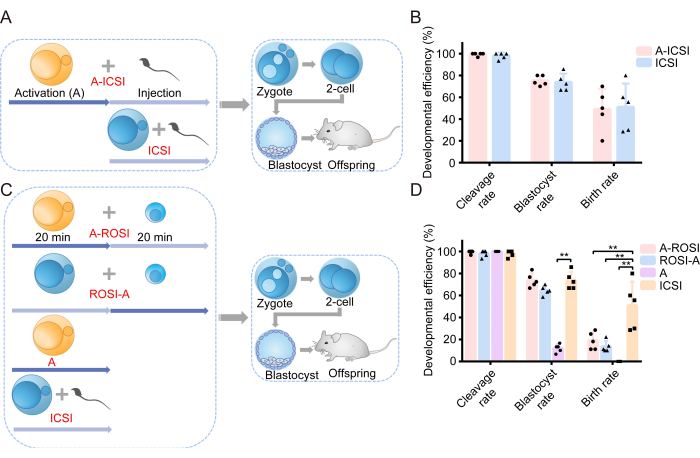
그림 1: ROSI 배아는 ICSI 배아에 비해 발달 효율이 감소한 것으로 나타났습니다. (A) ICSI 배아 발달에 대한 활성화의 효과를 평가하는 실험 프로토콜의 개략도. 파란색 = 난모세포가 활성화되지 않았습니다. 노란색 = 난모세포가 활성화되었습니다. (B) A-ICSI 및 ICSI에서 유래한 배아의 발달 효율. (C) 다양한 유형의 배아를 생성하기 위한 실험 프로토콜의 개략도. (D) A-ROSI, ROSI-A, A 및 ICSI에서 유래한 배아의 발달 효율. **, P < 0.01. 약어: A= 활성화 E= 배아의 날; ROSI= 원형 정자 주입; ICSI= 세포질 내 정자 주입. 오차 막대는 표준 편차를 보여줍니다. 속도 비교는 카이제곱 검정을 사용하여 수행됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 원형 정자류는 유세포 분석을 통해 선택되었습니다. (A) 원형 정자를 선택하기 위해 유세포 분석 분류 다이어그램을 활용했습니다. (B) 둥근 정자류의 선택을 보여주는 대표 이미지. 기준자: 10 μm. 약어: FSC = 전방 산란; SSC = 측면 산란; 355는 여기 파장입니다. 460/50 및 670/30은 355 파장 레이저에서 두 개의 감지 채널입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 그룹 | 착상 전 개발 | 주입 후 개발 | |||
| 복제 | 분열 속도(%) | 배반포 비율(%) | 2세포 배아 이식/ No. 수상자 수 | 출생률(%) | |
| A-ICSI | 5 | 99.33 (149/150) | 75.17 (112/149) | 49/5 | 48.98 (24/49) |
| A-로시 | 5 | 99.33 (149/150) | 73.83 (110/149) | 44/5 | 18.18 (8/44) ** |
| 로시-A | 5 | 98.00 (147/150) | 64.63 (95/147) | 45/5 | 13.33 (6/45) ** |
| 활성화 | 5 | 100.00 (150/150) | 12.00 (18/150) ** | 51/5 | 0.00 (0/51) ** |
| 증권 시세 표시기 | 5 | 98.00 (147/150) | 73.47 (108/147) | 46/5 | 52.17 (24/46) |
표 1. 다른 그룹에서 파생된 배아의 발달 효율성.
보충 표 1. 유세포 분석에 따라 정렬된 서로 다른 세포 집단의 비율. P3 부분은 둥근 정자입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
보조 난모세포 활성화
ROSI의 중요한 전제 조건은 AOA인데, 원형 정자만으로는 난모세포 활성화를 시작할 수 없기 때문입니다. 현재 마우스에서 가장 확립 된 방법은 염화 스트론튬23 , 24 의 사용을 포함하는 반면, 가장 진보 된 인간 응용 프로그램은 전기 활성화13 , 14를 사용합니다. 난모세포 활성화 시기도 매우 중요합니다. 문헌에 보고된 바와 같이, 마우스에서 가장 최적의 활성화 접근법은 초기에 난모세포를 활성화한 다음 둥근 정자25를 주입하는 것입니다. 이는 정자가 처음에 난모세포에 들어간 후 포스포리파아제 C를 ζ 방출하여 난모세포26을 활성화하는 기존의 수정 과정과 대조됩니다. 사토시 키시가미(Satoshi Kishigami)와 그의 동료들이 수행한 전문 연구는 활성화된 난모세포 전후 세포에서 남성핵을 형성하는 ROSI의 차등적인 능력을 강조합니다. 효율적인 자손 생산률을 달성하려면 난모세포가 G1 단계25에 진입하기 전에 두 가지 주입 유형을 모두 수행해야 합니다.
주사 바늘의 직경
ROSI의 맥락에서 주사 바늘의 직경이 더 크다고 해서 반드시 더 나은 결과를 얻을 수 있는 것은 아니라는 점에 유의하는 것이 중요합니다. 사용 된 주사 바늘의 직경은 6-7 μm로 둥근 정자보다 약간 작습니다. 따라서 둥근 정자를 흡인하면 세포막이 압착 효과를 받아 잠재적으로 핵이 직접 노출될 수 있습니다. 이러한 직접적인 노출은 탈중합 및 수컷 전핵(male pronucleus27)의 형성에 도움이 될 수 있다.
밀봉 처리
쥐 난모세포는 다른 종에 비해 세포질 점도가 적습니다. 세포막에 작은 구멍이 생겨도 세포질이 쉽게 흘러나와 난모세포 변성을 유발할 수 있습니다28. 위험을 완화하기 위해서는 둥근 정자를 난모세포 세포질에 주입하고 주사 바늘을 빼낸 후 ICSI21의 절차와 유사하게 난모세포 세포막 개구부 근처의 세포막의 작은 부분을 흡인하여 공간을 밀봉하는 것이 필수적입니다. 이 밀봉 공정은 난모세포 변성의 위험을 크게 줄입니다.
ROSI를 모델로 적용
ROSI 기술은 임상 응용 분야를 넘어 다양한 응용 분야를 모델로 삼고 있습니다. 그것은 마우스 생성시간 29를 촉진하고, 마우스17에서 부계로 유전 된 Xist 결실로 인한 여성의 치사율을 구출하고, 반수체 parthenogenetic 2 세포 할구에 라운드 정자 주입 후 마우스를 생성하고, 유전자 변형 마우스 자손16을 생성하고, 암 치료 전에 청소년 어린이의 생식력을 보존 할 수 있습니다30 , 31. 마우스 ROSI에 대한 성실한 연구는 생식 건강 연구의 발전에 크게 기여할 수 있습니다.
기사의 제한 사항
이 논문은 주입을 위해 현미경으로 RS를 직접 비교할 수 없다는 점과 혁신이 부족하다는 인식을 포함하여 몇 가지 제한 사항이 있는 방법론적 가이드 역할을 합니다.
공개
저자는 재정적 또는 기타 이해 관계의 충돌이 없음을 선언합니다.
감사의 말
유세포 분석을 통해 둥근 정자를 분류하는 데 귀중한 도움을 준 Wenjie Zhao와 마우스 배아 이식에 대한 전문 지식을 제공한 Fang Wang에게 감사를 표합니다. 이 연구는 길림성 자연과학재단(No. YDZJ202301ZYTS461). 원고의 언어 편집 및 교정에 대해 Bullet Edits Limited에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| CaCl22H2O | Sigma | C7902 | Preparation of CZB |
| Glucose | Sigma | G6152 | Preparation of CZB |
| HEPES-Na (basic) | Sigma | H3784 | Preparation of CZB |
| Hoechst 33342 | Beyotime | C1025 | FACS |
| human chorionic gonadotropin (HCG) | Ningbo Second Hormone Company | HCG | Ovulation promoting drugs |
| Hyaluronidase | Sigma | H3506 | Removing granulosa cells around the oocyte |
| KCl | Sigma | P5405 | Preparation of CZB |
| KH2PO4 | Sigma | P5655 | Preparation of CZB |
| KSOMaa | Caisson Labs | IVL04-100ML | Potassium simplex optimized medium supplemented with amino acids |
| L-glutamine | Sigma | G8540 | Preparation of CZB |
| M2 | Sigma | M7167-50ML | Operating fluid |
| MgSO47H2O | Sigma | M1880 | Preparation of CZB |
| Na2-EDTA2H2O | Sigma | E5134 | Preparation of CZB |
| NaCl | Sigma | S5886 | Preparation of CZB |
| NaHCO3 | Sigma | S5761 | Preparation of CZB |
| Na-lactate 60% syrup d = 1.32 g/L | Sigma | L7900 | Preparation of CZB |
| Na-pyruvate | Sigma | P4562 | Preparation of CZB |
| Piezo drill tips (ICSI) | Eppendorf | piezoXpert | Piezoelectric membrane rupture |
| pregnant mare serum gonadotropin (PMSG) | Ningbo Second Hormone Company | PMSG | Ovulation promoting drugs |
| PVA | Sigma | P8136 | Preparation of CZB |
참고문헌
- Redgrove, K. A., McLaughlin, E. A. The role of the immune response in Chlamydia trachomatis infection of the male genital tract: A double-edged sword. Front Immunol. 5, 534(2014).
- Yanagimachi, R. Intracytoplasmic injection of spermatozoa and spermatogenic cells: Its biology and applications in humans and animals. Reprod Biomed Online. 10 (2), 247-288 (2005).
- Palermo, G., Joris, H., Devroey, P., Van Steirteghem, A. C. Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte. Lancet. 340 (8810), 17-18 (1992).
- Kimura, Y., Yanagimachi, R. Mouse oocytes injected with testicular spermatozoa or round spermatids can develop into normal offspring. Development. 121 (8), 2397-2405 (1995).
- Tesarik, J., et al. Spermatid injection into human oocytes. II. Clinical application in the treatment of infertility due to non-obstructive azoospermia. Human Reprod. 11 (4), 780-783 (1996).
- Tesarik, J., Mendoza, C. Spermatid injection into human oocytes. I. Laboratory techniques and special features of zygote development. Human Reprod. 11 (4), 772-779 (1996).
- Hirabayashi, M., et al. Activation regimens for full-term development of rabbit oocytes injected with round spermatids. Mol Reprod Dev. 76 (6), 573-579 (2009).
- Ogonuki, N., et al. Birth of a marmoset following injection of elongated spermatid from a prepubertal male. Mol Reprod Dev. 86 (8), 928-930 (2019).
- Niederberger, C., et al. Forty years of IVF. Fertil Steril. 110 (2), 185(2018).
- Gross, K. X., Hanson, B. M., Hotaling, J. M. Round spermatid injection. Urol Clin North Am. 47 (2), 175-183 (2020).
- Hanson, B. M., et al. Round spermatid injection into human oocytes: a systematic review and meta-analysis. Asian J Androl. 23 (4), 363-369 (2021).
- Tekayev, M., Vuruskan, A. K. Clinical values and advances in round spermatid injection (ROSI). Reprod Biol. 21 (3), 100530(2021).
- Tanaka, A., et al. Fourteen babies born after round spermatid injection into human oocytes. Proc Natl Acad Sci U S A. 112 (47), 14629-14634 (2015).
- Tanaka, A., et al. Ninety babies born after round spermatid injection into oocytes: survey of their development from fertilization to 2 years of age. Fertil Steril. 110 (3), 443-451 (2018).
- Yang, H., Shi, L., Chen, C. D., Li, J. Mice generated after round spermatid injection into haploid two-cell blastomeres. Cell Res. 21 (5), 854-858 (2011).
- Moreira, P., et al. Transgenic mouse offspring generated by ROSI. J Reprod Dev. 62 (1), 37-42 (2016).
- Federici, F., et al. Round spermatid injection rescues female lethality of a paternally inherited Xist deletion in mouse. PLoS Genet. 12 (10), e1006358(2016).
- Sakamoto, M., et al. Paternally inherited H3K27me3 affects chromatin accessibility in mouse embryos produced by round spermatid injection. Development. 149 (18), 200696(2022).
- Wang, J., et al. Single-cell multiomics sequencing reveals the reprogramming defects in embryos generated by round spermatid injection. Sci Adv. 8, (2022).
- Ward, M. A., Yanagimachi, R. Intracytoplasmic sperm injection in mice. Cold Spring Harb Protoc. 2018 (1), (2018).
- Yoshida, N., Perry, A. C. Piezo-actuated mouse intracytoplasmic sperm injection (ICSI). Nat Protoc. 2 (2), 296-304 (2007).
- Zhu, L., et al. FACS selection of valuable mutant mouse round spermatids and strain rescue via round spermatid injection. Zygote. 23 (3), 336-341 (2013).
- Kong, P., et al. Effects of the histone deacetylase inhibitor 'Scriptaid' on the developmental competence of mouse embryos generated through round spermatid injection. Hum Reprod. 32 (1), 76-87 (2017).
- Hosseini, S., Salehi, M. Tricostatin A-treated round spermatid enhances preimplantation embryo developmental competency following round spermatid injection in mice. Zygote. 30 (3), 373-379 (2022).
- Kishigami, S., Wakayama, S., Nguyen, V. T., Wakayama, T. Similar time restriction for intracytoplasmic sperm injection and round spermatid injection into activated oocytes for efficient offspring production. Biol Reprod. 70 (6), 1863-1869 (2004).
- Tao, Y. Oocyte activation during round spermatid injection: state of the art. Reprod Biomed Online. 45 (2), 211-218 (2022).
- Ogura, A., Ogonuki, N., Miki, H., Inoue, K. Microinsemination and nuclear transfer using male germ cells. Int Rev Cytol. 246, 189-229 (2005).
- Kimura, Y., Yanagimachi, R. Intracytoplasmic sperm injection in the mouse. Biol Reprod. 52 (4), 709-720 (1995).
- Ogonuki, N., et al. A high-speed congenic strategy using first-wave male germ cells. PLoS One. 4 (3), e4943(2009).
- Abdelaal, O., et al. Fertility preservation for pediatric male cancer patients: illustrating contemporary and future options; a case report. Transl Androl Urol. 10 (1), 520-526 (2021).
- Eyni, H., et al. Advanced bioengineering of male germ stem cells to preserve fertility. J Tissue Eng. 12, (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유