Method Article
حقن الفأر المستدير Spermatid
In This Article
Summary
هنا ، نقدم طريقة لإجراء حقن المنوية المستديرة (ROSI) في الفئران ، وهي تقنية ذات تطبيقات سريرية واعدة وفائدة للتحقيق في الآليات الكامنة وراء التطور الجنيني.
Abstract
تمثل المنوية المستديرة ، التي تتميز بمحتواها الجيني أحادي الصيغة الصبغية ، الخلايا السلائف للحيوانات المنوية الناضجة. من خلال التقنية المبتكرة لحقن المنوية المستديرة (ROSI) ، يمكن تخصيب البويضات بنجاح وتطويرها إلى أجنة قابلة للحياة. في إنجاز رائد تم تحقيقه في عام 1995 ، ولد أول جنين فأر من خلال تقنية ROSI. ومنذ ذلك الحين ، برزت ROSI كأداة محورية لكشف الآليات المعقدة التي تحكم التطور الجنيني وتحمل إمكانات كبيرة في مختلف التطبيقات ، بما في ذلك تسريع توليد الفئران وإنتاج الفئران المعدلة وراثيا. في عام 1996 ، تم الوصول إلى معلم عندما ولد أول جنين بشري من خلال تقنية ROSI. ومع ذلك ، فقد أظهرت التطبيقات السريرية لهذه الطريقة نمطا متقلبا من النجاح والفشل. حتى الآن ، لم تجد تقنية ROSI تطبيقا واسع النطاق في الممارسة السريرية ، ويرجع ذلك أساسا إلى انخفاض كفاءتها في الولادة وعدم كفاية التحقق من سلامة الجنين. تقدم هذه المقالة وصفا شاملا للطرق الدقيقة لإجراء ROSI في الفئران ، بهدف إلقاء ضوء جديد على الأبحاث الأساسية وتطبيقاتها السريرية المحتملة.
Introduction
تتضمن المرحلة الأخيرة من تكوين المنوية تحويل المنوية المستديرة إلى منوي كامل التطور ، يتميز بهياكل مميزة للرأس والرقبة والذيل الممدود1. يشمل هذا التحول تغييرات كبيرة في مورفولوجيا الخلية ، مثل تكثيف الكروماتين في النواة ، واستبدال الهستونات بالبروتامين ، وتكوين الجسيم الأكرومي ، وتطور غمد الميتوكوندريا ، وهجرة المريكز وفقدانها ، وتكوين بنية الذيل ، وإزالة المخلفات الخلوية2.
في عام 1992 ، ولد أول جنين بشري بنجاح من خلال تقنية حقن المنوية داخل الهيولى (ICSI)3. منذ ذلك الحين ، كان الباحثون يستكشفون إمكانية استخدام المنوية المستديرة ، التي تشترك في نفس التركيب الجيني أحادي الصيغة الصبغية مثل المنوية الناضجة ، لتخصيب البويضات والحفاظ على حالات الحمل القابلة للحياة2،4. بعد ذلك ، في عام 1996 ، تم تسليم أول جنين بشري تم تصوره عن طريق تقنية حقن المنوية المستديرة (ROSI) 5,6. تجدر الإشارة إلى أن الدراسات التي شملت الحقن المجهري و ROSI في الفئران تخلفت عن تلك التي أجريت على البشر بسبب قابلية غشاء بويضة الفأر للتلف أثناء عملية الحقن. تم حل هذه المشكلة بنجاح من خلال إدخال جهاز كسر الغشاء Piezo. وبالتالي ، في عام 1995 ، ولد أول فأر تم تصميمه من خلال تقنية ROSI. بالإضافة إلى ذلك ، يجري البحث عن ROSI في العديد من الأخرى7،8.
حاليا ، تتمحور الأبحاث حول ROSI بشكل أساسي حول الجوانب التالية: التطبيق السريري ، وتوضيح الآلية ، واستراتيجيات تعزيز الكفاءة التنموية ، إلى جانب التطبيقات الأوسع لتقنية ROSI. في سياق التطبيقات السريرية ، على الرغم من ولادة أول جنين بشري ROSI من خلال ROSI في عام 1996 ، فقد تميز التقدم بسلسلة من النجاحات والإخفاقات9،10،11،12. حتى الآن ، لم تحقق تقنية ROSI تنفيذا سريريا واسع النطاق ، ويرجع ذلك إلى حد كبير إلى انخفاض كفاءتها والحاجة إلى مزيد من التحقق فيما يتعلق بسلامة الأجنة التي يتم تصورها من خلال تقنية ROSI. تشير الإحصاءات غير المكتملة إلى أنه على الصعيد العالمي ، تم ولادة أقل من 200 جنين بشري تم تصورهم ب ROSI. حدثت نقطة تحول في فهم إمكانات تقنية ROSI في عام 2015 عندما أبلغ تاناكا وزملاؤه عن الولادة الناجحة ل 14 جنينا من خلال تقنية ROSI ، مما غرس ثقة متجددة في تطبيقها السريري وجدوى13،14. تحمل تقنية ROSI واعدة كبيرة لمواجهة تحديات بيولوجيا التناسل، لا سيما في مرضى فقد النطاف غير الانسدادي. بالإضافة إلى تطبيقاته السريرية ، يعمل ROSI كأداة قيمة لدراسة الآليات المعقدة للتطور الجنيني15،16،17.
تم إجراء العديد من الدراسات التي أجريت على للتحقيق في العوامل الأساسية التي تساهم في انخفاض كفاءة ROSI في تحقيق التطور الجنيني الكامل. تشمل هذه العوامل اختيار طرق تنشيط البويضات المساعدة (AOA) وتوقياتها ، والتشوهات في الاستقرار الجيني ، وعلى وجه الخصوص ، التشوهات في التعديلات اللاجينية من المهم أن ندرك أن المنوية المستديرة هي خلايا جرثومية غير ناضجة ، تختلف اختلافا كبيرا عن المنوية الناضجة في مختلف الجوانب الفسيولوجية. أشار ميزوكي ساكاموتو وزملاؤه إلى أن H3K27me3 ، المشتق من المنوية المستديرة ، يرتبط بالكروماتين الذي يصعب الوصول إليه ويؤدي إلى ضعف التعبير الجيني في أجنة ROSI18. في دراسة ذات صلة أجراها جينغ وانغ وزملاؤه ، ارتبطت إعادة برمجة العيوب في أجنة ROSI في المراحل النووية في الغالب بسوء التعبير عن مجموعة من الجينات المسؤولة عن تنشيط الجينوم الزيجوتيالبسيط 19. ووجدوا أيضا أن إدخال مثبط انتقائي من هيستون ليسين ميثيل ترانسفيراز 2 ، A366 ، يمكن أن يعزز معدل النمو الإجمالي بمقدار الضعف تقريبا.
يقف الفأر كواحد من أكثر النموذجية قيمة لدراسة التطور الجنيني. توضح هذه المقالة كيفية إجراء ROSI على الفئران. يشمل هذا البروتوكول الشامل اختيار الفئران المناسبة ، وإجراءات تحريض الإباضة التفصيلية ، وتقنيات AOA ، وتقنيات الحقن ، وإعداد الفئران البديلة. علاوة على ذلك ، نقدم تحليلا مقارنا لتأثيرات نظامي حقن على كفاءة الولادة: AOA متبوعا ب ROSI (A-ROSI ؛ النظام الأول) و ROSI يليه AOA (ROSI-A ؛ النظام الثاني). نهدف إلى تشجيع الباحثين على إجراء تجارب ROSI للفئران بدقة أكبر ، وتقديم دعم أكثر قوة لتطبيقها السريري والبحث الأساسي لآليات التطور الجنيني.
Protocol
تم شراء الفئران B6D2F1 (C57BL / 6 x DBA / 2) و C57BL / 6 و ICR المستخدمة في هذه التجربة من شركة Beijing Vital River Animal Technologies Co. Ltd. (بكين ، الصين). التزمت جميع العلاجات الحيوانية بالإجراءات والمعايير التجريبية المعتمدة من قبل لجنة أخلاقيات التجريبي في المستشفى الأول بجامعة جيلين (رقم الموافقة: 20200435).
1. تحضير الكواشف ذات الصلة
- احصل على بعض الكواشف تجاريا وقم بإعداد الكواشف المتبقية ذاتيا.
- احصل على M2 ، وهو نظام عازل للمعالجة المختبرية للحيوانات المنوية المستديرة (RS) المنوية والبويضات من المورد.
- قم بإعداد وسيط C.L. Chatot و C.A. Ziomek و B.D. Bavister (CZB) ل AOA باتباع البروتوكول المنشورسابقا 20.
- الحصول على الوسط المحسن للبوتاسيوم البسيط المكمل بمحلول الأحماض الأمينية (KSOMaa) لزراعة الأجنة من المورد.
- تحضير الهيالورونيداز ، بتركيز عمل 0.1٪ (1 جم / لتر) ، عن طريق إذابة 0.1 جم من الهيالورونيداز في 1 مل من ماء الجنين. خذ 10 ميكرولتر من محلول التخزين المركز وقم بإذابه في 990 مل من M2 ، والذي يمكن تخزينه عند 4 درجات مئوية لمدة أسبوع واحد.
- تحضير بولي فينيل بيروليدون (PVP) ، بمتوسط وزن جزيئي يبلغ 360,000 وتركيز كتلي 12٪ ، عن طريق إذابة 1.2 جم من PVP في 10 مل من M2. يمكن تخزين المحلول الناتج عند 4 درجات مئوية لمدة أسبوع واحد.
- قم بتخزين محلول مخزون السيتوكالاسين B (CB) (2 ميكرولتر) ، قابل للذوبان في 18 ميكرولتر من DMSO عند -20 درجة مئوية. خذ 5 ميكرولتر من محلول التخزين المركز وقم بإذابه في 995 مل من M2. يمكن تخزين المحلول الناتج عند 4 درجات مئوية لمدة أسبوع واحد.
2. تحضير البويضات
- التأقلم مع إناث الفئران B6D2F1 ، التي تتراوح أعمارها بين 6 و 8 أسابيع ، في بيئتها الجديدة لمدة أسبوع واحد على الأقل. حقن داخل الصفاق مع 7.5 وحدة دولية من موجهة الغدد التناسلية مصل الفرس الحامل (PMSG) في الساعة 5 مساء, تليها 7.5 وحدة دولية من موجهة الغدد التناسلية المشيمية البشرية (HCG) 48 ساعة في وقت لاحق. تأكد من عدم حدوث أي اتصال مع ذكور الفئران بعد الحقن.
ملاحظة: الوقت المحدد (5 مساء) ليس إلزاميا. إنه فقط لراحة العمل. الساعة 14 بعد الساعة 5 مساء هي الساعة 7 صباحا ، عندما تكون البويضات جاهزة ، ويتم إجراء الحقن ، لذلك يتم تحديد وقت الحقن في الصباح. يمكن تعديل وقت بدء الحقن وفقا للجدول اليومي للمختبر. - بعد 14 ساعة من حقن قوات حرس السواحل الهايتية ، قتل الفئران باستخدام طريقة خلع عنق الرحم. افتح تجويف البطن وحدد موقع الرحم. التعرف على المبايض على طول الرحم وقطع قناتي فالوب بالقرب من المبيضين باستخدام المقص. كرر نفس الإجراء على الجانب الآخر وضع قناتي فالوب في M2 ، والتي يتم تسخينها مسبقا عند 37 درجة مئوية مسبقا.
- تحت المجهر المستقيم (10x) ، حدد موقع الجزء المتضخم من قناة فالوب ، مما يظهر مظهرا شفافا ومنتفخا. استخدم حقنة سعة 1 مل لتأمين قناة فالوب أثناء قطع الجزء المتضخم ، وجمع مجمعات الركام الإكليلي للبويضة (OCCCs).
- ضع OCCCs في محلول التشغيل M2 المسخن مسبقا الذي يحتوي على 0.1٪ هيالورونيداز وقم بإزالة الخلايا الحبيبية عن طريق النفخ برفق من خلال ماصة فموية.
ملاحظة: احتفظ ب OCCCs في 0.1٪ هيالورونيداز لفترة قصيرة ، حوالي دقيقتين ، إذا لزم الأمر. - بعد إزالة الخلايا الحبيبية ، انقل البويضة إلى KSOMaa ، واشطفها 3 مرات ، وضعها في حاضنة ثاني أكسيد الكربون لاستخدامها لاحقا (37 درجة مئوية ، 5٪ ثاني أكسيدالكربون 2).
3. تحضير المنوية المستديرة المنوية
- اجمع المنوية المستديرة المنوية من الخصية والبربخ لذكور الفئران C57BL / 6 (8-10 أسابيع) ، على التوالي.
- بالنسبة للحيوانات المنوية ، قتل الفئران عن طريق خلع عنق الرحم. افتح تجويف البطن ، وحدد موقع البربخ بالقرب من الخصية ، واستئصله برفق بالمقص.
- ضع البربخ في وسط M2 واستئصله برفق باستخدام حقنة سعة 1 مل للسماح للحيوانات المنوية بالتدفق تحت مجهر مستقيم (10x).
- قم بسحب المنوية المتدفقة وتعليق M2 في قاع أنبوب يحتوي على 0.5 مل من M2 ، مما يسمح للحيوانات المنوية بالتدفق في اتجاه المنبع بشكل طبيعي. ضعها جانبا لاستخدامها لاحقا.
- بالنسبة للحيوانات المنوية المستديرة ، قم بإزالة الخصيتين من تجويف البطن وضعها في M2. قم بقص الغشاء الأبيض برفق باستخدام حقنة سعة 1 مل واضغط على الأنابيب المنوية الملتوية تحت مجهر مستقيم (10x).
- استئصال الأنابيب المنوية بعناية باستخدام حقنتين سعة 1 مل. استخرج التعليق والفلتر بمنخل 400 شبكة (38 ميكرومتر).
- قم بالطرد المركزي للخلايا المفلترة ، وتخلص من المادة الطافية ، وأضف 200 ميكرولتر من Hoechst 33342 للتلوين ، متبوعا بالحضانة عند 37 درجة مئوية لمدة 10 دقائق.
- قم بإجراء فرز الخلايا المنشطة بالفلورة (FACS) لتمييز المنوية المستديرة عن أنواع الخلايا الأخرى. ضع الخلايا الملطخة في أنبوب قياس التدفق الخلوي وقم بإجراء فحص دائري للحيوانات المنوية.
- تتميز النماذج المختلفة لآلات قياس التدفق الخلوي بمعايير تنظيمية مختلفة ويمكن توصيلها بالدعم الفني أثناء التشغيل. كخطوة أولى ، اضبط الجهد وحدد مجموعة الخلايا وفقا للتشتت الأمامي (FSS) والمبعثر الجانبي (SSC ؛ انظر الجدول التكميلي 1).
- بالنسبة للخطوة الثانية ، قم بإزالة التصاقات الخلايا وفقا ل FSC وقم بتشغيل عرض النبضة.
- كخطوة ثالثة ، حدد المنوية المستديرة أحادية الصيغة الصبغية المستهدفة. يرتبط Hoechst 33342 بالحمض النووي ، وتظهر الخلايا ذات الصيغة الصبغية المختلفة شدة مضان مختلفة. اضبط الطول الموجي للإثارة على 355. حدد قناتين للكشف ، 460/50 و 670/30 ، تحت ليزر بطول موجي 355 لفرز المنوية المستديرة. بعد ذلك ، قم بتخزين المنوية المستديرة المصنفة في ثلاجة 4 درجات مئوية لاستخدامها لاحقا.
ملاحظة: من الممكن أيضا اختيار المنوية المستديرة مباشرة بناء على مورفولوجيتها تحت المجهر ، ولكن التدريب مطلوب لضمان دقة الاختيار.
4. حقن المنوية المستديرة (ROSI)
- قم بإجراء ROSI باستخدام مجهر مقلوب مع نظام معالجة دقيقة.
- في خطوة التحضير الأولية ، قم بعمل إبر الإمساك والحقن وفقا للإجراء الموصوفسابقا 21. حافظ على القطر الداخلي لإبرة الحقن بين 6-7 ميكرومتر ، المصمم لاستخراج المنوية المستديرة ، ولإبرة الإمساك ، بقطر داخلي يبلغ 20 ميكرومتر لتأمين البويضة.
- في خطوة التحضير اللاحقة ، قم بإنشاء وعاء حقن عن طريق وضع 10 ميكرولتر من قطرات M2 التي تحتوي على CB لتليين البويضات و 10 ميكرولتر من قطرات M2 لتخزين المنوية المستديرة. استخدم قطرات PVP لترطيب وتنظيف إبر الحقن.
ملاحظة: إن إضافة CB هنا ليست خطوة ضرورية ، ولكن إضافة CB يمكن أن يحسن بشكل كبير من معدل البقاء على قيد الحياة بعد الحقن. - استخرج المنوية المستديرة باستخدام إبرة الحقن.
- قم بتدوير البويضة بإبرة تعليق ، ووضع الجسم القطبي للبويضة إما في موضع الساعة 12 أو الساعة 6.
- ضع إبرة الحقن بعناية في موضع الساعة 3 على البويضة، مع الالتصاق بإحكام بالمنطقة الشفافة. استخدم جهاز PiezoXpert لإنشاء ثقب في المنطقة الشفافة. اضبط القوة من صغيرة إلى كبيرة ، وهي تقريبا الشدة = 5 والسرعة = 15 هنا.
- ادفع إبرة الحقن برفق عبر المنطقة الشفافة وادخل البويضة أفقيا. عندما تمر بمركز البويضة ، ضع بيزو (الشدة = 1 والسرعة = 1) ، مما يؤدي إلى تمزق غشاء البويضة والحقن التدريجي للحيوانات المنوية المستديرة في سيتوبلازم البويضة.
- اسحب إبرة الحقن واستنشق كمية صغيرة من غشاء البويضة بالقرب من الفتحة لإغلاقها. هذه الخطوة حاسمة ، لأن الفشل في الختم سيؤدي إلى تسرب السيتوبلازم وموت البويضات.
ملاحظة: تجدر الإشارة إلى أن ROSI تطلب AOA إما قبل أو بعد حقن المنوية المستديرة ، والتي ناقشناها في الأقسام اللاحقة.
5. حقن المنوية داخل الهيولى (ICSI)
- قم بتنفيذ نفس الخطوات للحقن المجهري كما هو الحال بالنسبة ل ROSI ، مع الاختلاف الوحيد هو قطر إبرة حقن الحقن المجهري ، والتي يبلغ قياسها 9-10 ميكرومتر.
- ضع المنوية على مدرج PVP لتقليل سرعة السباحة وتسهيل استخراج المنوية.
- قم بفصل رأس المنوية وذيلها للحقن المجهري. استنشق المنوية من الذيل وضع عنق المنوية بدقة عند فم إبرة الحقن. ضع بيزو (يمكن استخدام بيزو متعدد حسب الحاجة ، الشدة = 5 والسرعة = 15) لفصل رأس وذيل المنوية.
6. تنشيط البويضات بمساعدة (AOA)
- وفقا للبروتوكول ، قم بإعداد وسط CZB بدون الكالسيوم والمغنيسيوم.
- استخدم سداسي هيدرات كلوريد السترونتيوم (SrCl26H2O) ، بوزن جزيئي يبلغ 266.62 ، بتركيز 10 ملي مولار. لتحضيره ، قم بإذابة 0.26662 جم من SrCl26H2O في 1 مل من ماء الجنين. في وقت الاستخدام ، أضف 10 ميكرولتر من محلول التخزين المركز إلى 990 ميكرولتر من وسط CZB الخالي من Ca2+ واستخدمه على الفور.
- ضع البويضات في وسط CZB الخالي من Ca2 + الذي يحتوي على SrCl26H2O للتنشيط ؛ يبلغ حجم كل قطرة 20 ميكرولتر ، ويتم وضع 20 بويضة في كل مرة. احتضان لمدة 20 دقيقة.
- في الوقت نفسه ، قم بإنشاء مجموعة لتنشيط التوالد العذري دون حقن المنوية المستديرة أو المنوية. وتجدر الإشارة إلى أن مجموعة تنشيط التوالد العذري تظهر بدون تحليل إحصائي ، والمجموعة الضابطة هي الحقن المجهري.
7. نقل الأجنة
- قم بإسكان الفئران من الذكور والإناث ICR المربوطة بنسبة 1: 2. في صباح اليوم التالي ، افحص إناث الفئران بحثا عن وجود سدادة مهبلية واختر تلك التي لديها سدادة مهبلية للزراعة.
- حقن الأجنة المنقولة المكونة من أجنة 2 خلية في صباح اليوم السابق ونقلها بعد ظهر اليوم التالي.
- قم بعمل شق في الجزء الخلفي من الأنثى ، وفضح الدهون البيضاء والمبيضين ، وحدد الجزء المتضخم من قناة فالوب تحت مجهر مستقيم (10x).
- استخدم حقنة سعة 1 مل لإنشاء فتحة في الجزء المتضخم من قناة فالوب وشفط الأجنة من خلال ماصة فموية. أدخل الأجنة برفق في اتجاه الرحم. خياطة الجرح ، باستخدام نماذج 4 × 10 من الإبر المنحنية بخيط ، بسمك 5-0 (0.09-0.11 مم). تتكون الخيط من طبقتين ، مع طبقة واحدة للبريتوني وطبقة واحدة للجلد الخارجي.
- بالنسبة للفئران البديلة ، قم بإجراء عمليات قيصرية بناء على الجدول الزمني التجريبي. القتل الرحيم للفئران بطريقة خلع عنق الرحم ، وتطهيرها بالكحول ، وفتح تجويف البطن. افتح الرحم برفق وبسرعة وافتح التجويف الأمنيوسي لإظهار الجنين والمشيمة. إزالة الحبل السري وقطع من الجانب القريب من الجنين; تم تغذية الجنين في نفس فترة الفئران المرضعة.
ملاحظة: نظرا للحاجة إلى حساب معدلات المواليد ، فإن الولادة القيصرية أكثر دقة فيما يتعلق بالطاقة الإنتاجية. في الولادة الطبيعية ، قد تأكل الأم النسل ، مما يؤدي إلى إحصاءات غير دقيقة. يتم إجراء العملية القيصرية على الفئران البديلة المزروعة في المرحلة المبكرة ، ويتم إجراء الولادة القيصرية للقتل الرحيم قبل الولادة.
8. التحليل الإحصائي
- استخدم GraphPad Prism 5 للتحليل. يتم التعبير عن البيانات بمتوسط ± SD؛ يشير P < 0.05 إلى اختلاف إحصائي ، ويشير P < 0.01 إلى اختلاف إحصائي كبير.
النتائج
بدأنا تحقيقنا من خلال فحص تأثير AOA على القدرة على نمو الأجنة. يظهر رسم تخطيطي للتصميم التجريبي في الشكل 1 أ. قبل حقن المنوية ، خضعت البويضات إما لAOA (A-ICSI) أو ظلت غير معالجة (الحقن المجهري). يتم عرض بيانات مفصلة عن التطور الجنيني في الجدول 1. كشفت النتائج عن عدم وجود فروق يعتد بها في معدلات الانقسام أو الكيسة الأريمية أو المواليد بين المجموعات A-ICSI والحقن المجهري (P > 0.05; P 0.05; P 0.05; الشكل 1 ب). تشير هذه النتائج إلى أن AOA باستخدام 10 ملي مولار SrCl2 لمدة 20 دقيقة لم يؤثر على الإمكانات التنموية للأجنة.
تم الإبلاغ سابقا عن عدم وجود اختلافات ملحوظة في الكفاءة التنموية لأجنة ROSI المختارة إما عن طريق FACS أو عن طريق الفحص البصري المباشر تحت المجهر22. استخدمت تجاربنا تقنية FACS لتحديد RS (الأشكال 2 أ ، ب). تحت المجهر ، كان قطر المنوية المستديرة للفأر حوالي 10 ميكرومتر وأظهرت بنية نواة شبيهة بالنتوء في المنتصف (الشكل 2 ج). نفترض أن الاختيار من خلال FACS أكثر دقة من الفحص البصري المباشر تحت المجهر. بالإضافة إلى ذلك ، تدعم الأدبيات الاستكشاف المباشر ل RS من خلال الاختلافات المورفولوجية. تم إنشاء أجنة ROSI باستخدام طريقتين متميزتين: مجموعة A-ROSI ، حيث تعرضت البويضات ل AOA قبل حقن المنوية المستديرة ، ومجموعة ROSI-A ، حيث تعرضت البويضات ل AOA بعد حقن المنوية المستديرة. يظهر الرسم البياني التخطيطي للتصميم التجريبي في الشكل 1 ج. والجدير بالذكر أنه لم يتم العثور على فروق ذات دلالة إحصائية في معدلات الانقسام والكيسة الأريمية بين مجموعات A-ROSI و ROSI-A و ICSI (P > 0.05; الشكل 1 د). كانت معدلات الكيسة الأريمية في مجموعات A-ROSI و ROSI-A و ICSI أعلى بكثير من تلك الموجودة في مجموعة التنشيط (P < 0.05; P 0.05; P 0.05; P 0.05; P الشكل 1 د). ومع ذلك، كان معدل المواليد في مجموعة الحقن المجهري (ICSI) أقل من معدل المواليد في مجموعة الحقن المجهري، بغض النظر عما إذا كانت البويضات قد تم تفعيلها قبل الحقن أو بعده (P < 0.05; P 0.05; P 0.05; P 0.05; P 0.05; P 0.05; P 0.05; P 0.05; P 0.05; P 0.05; P 0.05; P 0.05; P الشكل 1 د). الأهم من ذلك ، أن معدل المواليد لمجموعة A-ROSI كان أعلى قليلا من معدل المواليد في مجموعة ROSI-A (الشكل 1 د). يتم تقديم مزيد من التفاصيل حول بيانات نمو الأجنة في الجدول 1.
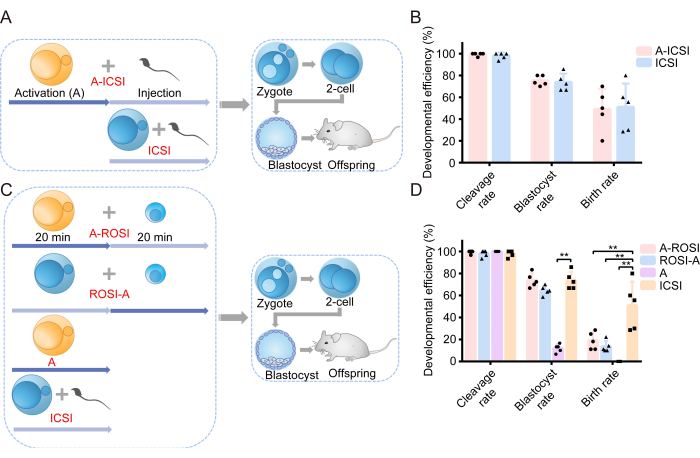
الشكل 1: أظهرت أجنة ROSI كفاءة نمو منخفضة مقارنة بأجنة الحقن المجهري. (أ) رسم تخطيطي للبروتوكول التجريبي لتقييم تأثير التنشيط على التطور الجنيني للحقن المجهري. الأزرق = لم يتم تنشيط البويضات. تم تنشيط الأصفر = البويضات. (ب) الكفاءة التنموية للأجنة المشتقة من الحقن المجهري والحقن المجهري. (ج) توضيح تخطيطي للبروتوكول التجريبي لتوليد أنواع مختلفة من الأجنة. (د) الكفاءة التنموية للأجنة المشتقة من A-ROSI ، ROSI-A ، A ، والحقن المجهري. ** ، ص < 0.01. الاختصارات: أ = التنشيط ه = اليوم الجنيني ؛ ROSI = حقن المنوية المستديرة. الحقن المجهري = حقن المنوية داخل الهيولى. تظهر أشرطة الخطأ الانحراف المعياري. يتم إجراء مقارنة الأسعار باستخدام اختبار مربع كاي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تم اختيار المنوية المستديرة عن طريق الفرز الخلوي للتدفق. (أ) تم استخدام مخطط الفرز الخلوي للتدفق لاختيار المنوية المستديرة. (ب) صور تمثيلية تعرض اختيار المنوية المستديرة. شريط المقياس: 10 ميكرومتر. الاختصارات: FSC = مبعثر إلى الأمام ؛ SSC = مبعثر جانبي ؛ 355 هو الطول الموجي للإثارة. 460/50 و 670/30 قناتان للكشف تحت ليزر بطول موجي 355. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| المجموعات | تطوير ما قبل الزرع | تطوير ما بعد الزرع | |||
| يتطابق | معدل الانقسام (٪) | معدل الكيسة الأريمية (٪) | تم نقل الأجنة المكونة من 2 خلية / لا. عدد المستفيدين | معدل المواليد (٪) | |
| أ- الحقن المجهري | 5 | 99.33 (149/150) | 75.17 (112/149) | 49/5 | 48.98 (24/49) |
| أ روزي | 5 | 99.33 (149/150) | 73.83 (110/149) | 44/5 | 18.18 (8/44) ** |
| ROSI-A | 5 | 98.00 (147/150) | 64.63 (95/147) | 45/5 | 13.33 (6/45) ** |
| التنشيط | 5 | 100.00 (150/150) | 12.00 (18/150) ** | 51/5 | 0.00 (0/51) ** |
| الحقن المجهري | 5 | 98.00 (147/150) | 73.47 (108/147) | 46/5 | 52.17 (24/46) |
الجدول 1. الكفاءة التنموية للأجنة المشتقة من مجموعات مختلفة.
الجدول التكميلي 1. نسبة مجموعات الخلايا المختلفة التي تم فرزها حسب قياس التدفق الخلوي. الجزء P3 عبارة عن منوية مستديرة. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تنشيط البويضات بمساعدة
الشرط الأساسي الحاسم ل ROSI هو AOA لأن المنوية المستديرة وحدها لا يمكنها بدء تنشيط البويضات. حاليا ، تتضمن الطريقة الأكثر رسوخا في الفئران استخدام كلوريد السترونتيوم23،24 ، بينما يستخدم التطبيق البشري الأكثر تقدما التنشيط الكهربائي13،14. توقيت تنشيط البويضات له أهمية كبيرة أيضا. كما ورد في الأدبيات ، فإن نهج التنشيط الأمثل في الفئران يتضمن في البداية تنشيط البويضة ثم حقن المنويةالمستديرة 25. يتناقض هذا مع عملية الإخصاب التقليدية ، حيث تدخل المنوية في البداية إلى البويضات ، ثم تطلق ζ الفوسفوليباز C لتنشيط البويضة26. تؤكد الأبحاث المتخصصة التي أجراها ساتوشي كيشيغامي وزملاؤه على القدرة التفاضلية ل ROSI على تكوين نواة ذكرية في البويضات قبل أو بعد تنشيطها. لتحقيق معدل إنتاج نسل فعال ، يجب إجراء كلا النوعين من الحقن قبل دخول البويضات في المرحلةG1 25.
قطر إبرة الحقن
في سياق ROSI ، من المهم ملاحظة أن القطر الأكبر لإبرة الحقن لا يترجم بالضرورة إلى نتائج أفضل. يبلغ قطر إبرة الحقن المستخدمة 6-7 ميكرومتر ، وهو أصغر قليلا من المنوية المستديرة. لذلك ، عندما يتم شفط منوي مستدير ، يتعرض غشاء الخلية لتأثير ضغط ، مما قد يؤدي إلى التعرض المباشر للنواة. قد يؤدي هذا التعرض المباشر إلى إزالة البلمرة والتكوين اللاحق للنواةالذكرية 27.
علاج الختم
تظهر بويضات الفأر لزوجة سيتوبلازمية أقل مقارنة بالأنواع الأخرى. حتى الاختراق الصغير في غشاء الخلية يمكن أن يتسبب في تدفق السيتوبلازم بسهولة ، مما يؤدي إلى تنكس البويضات28. للتخفيف من المخاطر ، بعد حقن المنوية المستديرة في سيتوبلازم البويضة وسحب إبرة الحقن ، من الضروري شفط جزء صغير من غشاء الخلية بالقرب من فتحة غشاء خلية البويضة لإغلاق المساحة ، على غرار الإجراء في الحقنالمجهري 21. تقلل عملية الختم هذه بشكل كبير من خطر تنكس البويضات.
تطبيق ROSI كنموذج
بالإضافة إلى التطبيقات السريرية ، فإن تقنية ROSI لها العديد من التطبيقات الأخرى كنموذج. يمكن أن يسرع من جيل الفئرانمرات 29 ، وينقذ فتاكة الإناث الناتجة عن حذف Xist الموروث من الأب في الفئران17 ، ويولد الفئران بعد حقن المنوية المستديرة في الأرومات أحادية الصيغة الصبغية ذات الخليتين15 ، وتولد ذرية فأر معدلة وراثيا16 ، وتحافظ على الخصوبة لدى الأطفال المراهقين قبل علاج السرطان30،31. يمكن أن تساهم الأبحاث الدؤوبة على ROSI للفأر بشكل كبير في التقدم في أبحاث الصحة الإنجابية.
قيود المقال
تعمل هذه المقالة كدليل منهجي مع العديد من القيود ، بما في ذلك عدم وجود اختيار مقارن مباشر ل RS تحت المجهر للحقن والافتقار الملحوظ إلى الابتكار.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح المالية أو غيرها.
Acknowledgements
نعرب عن امتناننا ل Wenjie Zhao لمساعدتها التي لا تقدر بثمن في فرز المنوية المستديرة من خلال قياس التدفق الخلوي وإلى Fang Wang لخبرتها في نقل أجنة الفئران. وحظي هذا العمل بدعم جزئي من مؤسسة العلوم الطبيعية في مقاطعة جيلين (رقم 10). YDZJ202301ZYTS461). نشكر Bullet Edits Limited على التحرير اللغوي والتدقيق اللغوي للمخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| CaCl22H2O | Sigma | C7902 | Preparation of CZB |
| Glucose | Sigma | G6152 | Preparation of CZB |
| HEPES-Na (basic) | Sigma | H3784 | Preparation of CZB |
| Hoechst 33342 | Beyotime | C1025 | FACS |
| human chorionic gonadotropin (HCG) | Ningbo Second Hormone Company | HCG | Ovulation promoting drugs |
| Hyaluronidase | Sigma | H3506 | Removing granulosa cells around the oocyte |
| KCl | Sigma | P5405 | Preparation of CZB |
| KH2PO4 | Sigma | P5655 | Preparation of CZB |
| KSOMaa | Caisson Labs | IVL04-100ML | Potassium simplex optimized medium supplemented with amino acids |
| L-glutamine | Sigma | G8540 | Preparation of CZB |
| M2 | Sigma | M7167-50ML | Operating fluid |
| MgSO47H2O | Sigma | M1880 | Preparation of CZB |
| Na2-EDTA2H2O | Sigma | E5134 | Preparation of CZB |
| NaCl | Sigma | S5886 | Preparation of CZB |
| NaHCO3 | Sigma | S5761 | Preparation of CZB |
| Na-lactate 60% syrup d = 1.32 g/L | Sigma | L7900 | Preparation of CZB |
| Na-pyruvate | Sigma | P4562 | Preparation of CZB |
| Piezo drill tips (ICSI) | Eppendorf | piezoXpert | Piezoelectric membrane rupture |
| pregnant mare serum gonadotropin (PMSG) | Ningbo Second Hormone Company | PMSG | Ovulation promoting drugs |
| PVA | Sigma | P8136 | Preparation of CZB |
References
- Redgrove, K. A., McLaughlin, E. A. The role of the immune response in Chlamydia trachomatis infection of the male genital tract: A double-edged sword. Front Immunol. 5, 534(2014).
- Yanagimachi, R. Intracytoplasmic injection of spermatozoa and spermatogenic cells: Its biology and applications in humans and animals. Reprod Biomed Online. 10 (2), 247-288 (2005).
- Palermo, G., Joris, H., Devroey, P., Van Steirteghem, A. C. Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte. Lancet. 340 (8810), 17-18 (1992).
- Kimura, Y., Yanagimachi, R. Mouse oocytes injected with testicular spermatozoa or round spermatids can develop into normal offspring. Development. 121 (8), 2397-2405 (1995).
- Tesarik, J., et al. Spermatid injection into human oocytes. II. Clinical application in the treatment of infertility due to non-obstructive azoospermia. Human Reprod. 11 (4), 780-783 (1996).
- Tesarik, J., Mendoza, C. Spermatid injection into human oocytes. I. Laboratory techniques and special features of zygote development. Human Reprod. 11 (4), 772-779 (1996).
- Hirabayashi, M., et al. Activation regimens for full-term development of rabbit oocytes injected with round spermatids. Mol Reprod Dev. 76 (6), 573-579 (2009).
- Ogonuki, N., et al. Birth of a marmoset following injection of elongated spermatid from a prepubertal male. Mol Reprod Dev. 86 (8), 928-930 (2019).
- Niederberger, C., et al. Forty years of IVF. Fertil Steril. 110 (2), 185(2018).
- Gross, K. X., Hanson, B. M., Hotaling, J. M. Round spermatid injection. Urol Clin North Am. 47 (2), 175-183 (2020).
- Hanson, B. M., et al. Round spermatid injection into human oocytes: a systematic review and meta-analysis. Asian J Androl. 23 (4), 363-369 (2021).
- Tekayev, M., Vuruskan, A. K. Clinical values and advances in round spermatid injection (ROSI). Reprod Biol. 21 (3), 100530(2021).
- Tanaka, A., et al. Fourteen babies born after round spermatid injection into human oocytes. Proc Natl Acad Sci U S A. 112 (47), 14629-14634 (2015).
- Tanaka, A., et al. Ninety babies born after round spermatid injection into oocytes: survey of their development from fertilization to 2 years of age. Fertil Steril. 110 (3), 443-451 (2018).
- Yang, H., Shi, L., Chen, C. D., Li, J. Mice generated after round spermatid injection into haploid two-cell blastomeres. Cell Res. 21 (5), 854-858 (2011).
- Moreira, P., et al. Transgenic mouse offspring generated by ROSI. J Reprod Dev. 62 (1), 37-42 (2016).
- Federici, F., et al. Round spermatid injection rescues female lethality of a paternally inherited Xist deletion in mouse. PLoS Genet. 12 (10), e1006358(2016).
- Sakamoto, M., et al. Paternally inherited H3K27me3 affects chromatin accessibility in mouse embryos produced by round spermatid injection. Development. 149 (18), 200696(2022).
- Wang, J., et al. Single-cell multiomics sequencing reveals the reprogramming defects in embryos generated by round spermatid injection. Sci Adv. 8, (2022).
- Ward, M. A., Yanagimachi, R. Intracytoplasmic sperm injection in mice. Cold Spring Harb Protoc. 2018 (1), (2018).
- Yoshida, N., Perry, A. C. Piezo-actuated mouse intracytoplasmic sperm injection (ICSI). Nat Protoc. 2 (2), 296-304 (2007).
- Zhu, L., et al. FACS selection of valuable mutant mouse round spermatids and strain rescue via round spermatid injection. Zygote. 23 (3), 336-341 (2013).
- Kong, P., et al. Effects of the histone deacetylase inhibitor 'Scriptaid' on the developmental competence of mouse embryos generated through round spermatid injection. Hum Reprod. 32 (1), 76-87 (2017).
- Hosseini, S., Salehi, M. Tricostatin A-treated round spermatid enhances preimplantation embryo developmental competency following round spermatid injection in mice. Zygote. 30 (3), 373-379 (2022).
- Kishigami, S., Wakayama, S., Nguyen, V. T., Wakayama, T. Similar time restriction for intracytoplasmic sperm injection and round spermatid injection into activated oocytes for efficient offspring production. Biol Reprod. 70 (6), 1863-1869 (2004).
- Tao, Y. Oocyte activation during round spermatid injection: state of the art. Reprod Biomed Online. 45 (2), 211-218 (2022).
- Ogura, A., Ogonuki, N., Miki, H., Inoue, K. Microinsemination and nuclear transfer using male germ cells. Int Rev Cytol. 246, 189-229 (2005).
- Kimura, Y., Yanagimachi, R. Intracytoplasmic sperm injection in the mouse. Biol Reprod. 52 (4), 709-720 (1995).
- Ogonuki, N., et al. A high-speed congenic strategy using first-wave male germ cells. PLoS One. 4 (3), e4943(2009).
- Abdelaal, O., et al. Fertility preservation for pediatric male cancer patients: illustrating contemporary and future options; a case report. Transl Androl Urol. 10 (1), 520-526 (2021).
- Eyni, H., et al. Advanced bioengineering of male germ stem cells to preserve fertility. J Tissue Eng. 12, (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved