Method Article
小鼠圆形精子细胞注射
摘要
在这里,我们介绍了一种在小鼠中进行圆形精子细胞注射 (ROSI) 的方法,该技术在研究胚胎发育的潜在机制方面具有很有前途的临床应用和实用性。
摘要
圆形精子细胞以其单倍体遗传内容为特征,代表成熟精子的前体细胞。通过圆形精子细胞注射 (ROSI) 的创新技术,卵母细胞可以成功受精并发育成有活力的胎儿。在 1995 年实现的开创性里程碑中,第一个小鼠胎儿通过 ROSI 技术诞生。此后,ROSI 成为解开控制胚胎发育的复杂机制的关键工具,并在各种应用中具有巨大潜力,包括加速小鼠生成和转基因小鼠的生产。1996 年,通过 ROSI 技术诞生了第一个人类胎儿,达到了一个里程碑。然而,这种方法的临床应用显示出成功和失败的波动模式。迄今为止,ROSI 技术尚未在临床实践中得到广泛应用,主要是由于其出生效率低和对胎儿安全性的验证不足。本文全面介绍了在小鼠中进行 ROSI 的精确方法,旨在为基础研究及其潜在的临床应用提供新的思路。
引言
精子发生的最后阶段涉及将圆形精子细胞转化为完全发育的精子,其特征是独特的头部、颈部和细长的尾部结构1。这种转变包括细胞形态的显著变化,例如细胞核中染色质的浓缩、鱼精蛋白取代组蛋白、顶体形成、线粒体鞘发育、中心粒迁移和丢失、尾部结构形成以及细胞残基的去除2。
1992 年,通过卵胞浆内单精子注射 (ICSI) 技术成功诞生了第一个人类胎儿3。从那时起,研究人员一直在探索利用圆形精子(与成熟精子具有相同的单倍体遗传组成)来使卵母细胞受精并维持存活妊娠的潜力 2,4。随后,在 1996 年,通过圆形精子细胞注射 (ROSI) 技术受孕的第一个人类胎儿诞生 5,6。值得注意的是,由于小鼠卵母细胞膜在注射过程中容易受到损伤,因此涉及小鼠 ICSI 和 ROSI 的研究落后于人类。随着压电膜破裂装置的引入,这个问题得到了成功解决。因此,在 1995 年,第一只通过 ROSI 技术构思的小鼠诞生了。此外,对其他各种动物的 ROSI 的研究也在进行中 7,8。
目前,ROSI 的研究主要集中在以下几个方面:临床应用、机制阐明和提高开发效率的策略,以及 ROSI 技术的广泛应用。在临床应用方面,尽管 1996 年通过 ROSI 诞生了第一个 ROSI 人类胎儿,但其进展以一系列成功和失败为标志 9,10,11,12。迄今为止,ROSI 技术尚未实现广泛的临床应用,主要是由于其效率低下,并且需要进一步验证通过 ROSI 技术受孕的胎儿的安全性。不完全的统计数据表明,在全球范围内,只有不到 200 名人类 ROSI 受孕的胎儿被分娩。了解 ROSI 技术潜力的转折点发生在 2015 年,当时 Tanaka 及其同事报告了通过 ROSI 技术成功出生了 14 个胎儿,这为其临床应用和可行性注入了新的信心13,14。ROSI 技术在解决生殖生物学挑战方面具有重大前景,尤其是在非梗阻性无精子症患者中。除了临床应用外,ROSI 还是研究胚胎发育复杂机制的宝贵工具 15,16,17。
已经进行了大量动物研究,以调查导致 ROSI 在实现完全胚胎发育方面效率低的潜在因素。这些因素包括辅助卵母细胞活化 (AOA) 方法的选择及其时间、基因组稳定性异常,特别是表观遗传修饰的异常。重要的是要认识到圆形精子细胞是未成熟的生殖细胞,在各个生理方面与成熟的精子有很大不同。Mizuki Sakamoto 及其同事指出,源自圆形精子细胞的 H3K27me3 与染色质有关,染色质较难获得,并导致 ROSI 胚胎中的基因表达受损18。在 Jing Wang 及其同事的一项相关研究中,ROSI 胚胎在原核阶段的重编程缺陷主要与负责次要合子基因组激活的一组基因的错误表达有关19。他们还发现,引入选择性常染色质组蛋白赖氨酸甲基转移酶 2 抑制剂 A366 可能会将整体发育速度提高约两倍。
小鼠是研究胚胎发育最有价值的模型动物之一。本文详细阐述了如何对小鼠进行 ROSI。该综合方案包括选择合适的小鼠、详细的排卵诱导程序、AOA 技术、注射技术和代孕小鼠的制备。此外,我们对两种注射方案对出生效率的影响进行了比较分析: AOA 后 ROSI (A-ROSI;第一方案)和 ROSI 后 AOA (ROSI-A;第二方案)。我们鼓励研究人员更精确地进行小鼠 ROSI 实验,为其临床应用和胚胎发育机制的基础研究提供更有力的支持。
研究方案
本实验中使用的 B6D2F1 (C57BL/6 x DBA/2)、C57BL/6 和 ICR 小鼠购自北京维塔河实验动物技术有限公司(中国北京)。所有动物治疗均遵循吉林大学第一医院实验动物伦理委员会批准的实验程序和标准(批准文号:20200435)。
1. 相关试剂的制备
- 从商业上获取一些试剂,并自行准备剩余的试剂。
- 从供应商处获得 M2,这是一种用于 圆形 精子细胞 (RS)、精子和卵母细胞体外加工的缓冲系统。
- 按照先前发布的方案20 制备用于 AOA 的不含 Ca2+ 的 C.L. Chatot、C.A. Ziomek 和 B.D. Bavister (CZB) 培养基。
- 从供应商处获得补充有氨基酸 (KSOMaa) 溶液的单纯钾优化培养基,用于胚胎培养。
- 通过将 0.1 g 透明质酸酶溶解在 1 mL 胚胎水中,制备工作浓度为 0.1% (1 g/L) 的透明质酸酶。取 10 μL 浓缩储存溶液,溶于 990 mL M2 中,可在 4 °C 下储存 1 周。
- 通过将 1.2 g PVP 溶解在 10 mL M2 中,制备平均分子量为 360,000 且质量浓度为 12% 的聚乙烯吡咯烷酮 (PVP)。所得溶液可在 4 °C 下储存 1 周。
- 将细胞松弛素 B (CB) 储备液 (2 μL) 储存在 -20 °C 的 18 μL DMSO 中。 取 5 μL 浓缩储存溶液,溶于 995 mL M2 中。所得溶液可在 4 °C 下储存 1 周。
2. 卵母细胞的制备
- 使 6-8 周龄的雌性 B6D2F1 小鼠适应新环境至少 1 周。下午 5 点腹膜内注射 7.5 IU 妊娠母马血清促性腺激素 (PMSG),48 小时后腹膜注射 7.5 IU 人绒毛膜促性腺激素 (HCG)。确保注射后不与雄性小鼠接触。
注意:指定的时间(下午 5 点)不是强制性的。这只是为了工作方便。下午 5 点后的 14 小时是早上 7 点,此时卵母细胞准备好了,可以进行注射,因此注射时间安排在早上。注射的开始时间可以根据实验室的日常时间表进行调整。 - 注射 HCG 14 小时后,使用宫颈脱位法对小鼠实施安乐死。打开腹腔并找到子宫。识别子宫沿线的卵巢,并用剪刀切断卵巢附近的输卵管。在另一侧重复相同的步骤,将输卵管放入 M 2 中,M2 提前预热至 37 °C。
- 在正置显微镜 (10x) 下,定位输卵管的增大部分,呈现透明和肿胀的外观。使用 1 mL 注射器固定输卵管,同时切割扩大的部分,收集卵母细胞冠状状卵丘复合体 (OCCC)。
- 将 OCCC 放入含有 0.1% 透明质酸酶的预热 M2 作溶液中,并通过口腔移液管轻轻吹气去除颗粒细胞。
注意:如果需要,将 OCCC 在 0.1% 透明质酸酶中短时间保存,大约 2 分钟。 - 取出颗粒细胞后,将卵母细胞转移到 KSOMaa,冲洗 3 次,并置于二氧化碳培养箱中以备后用(37 °C,5% CO2 )。
3. 圆形精子细胞和精子的制备
- 分别从雄性 C57BL/6 小鼠的睾丸和附睾(8-10 周)收集圆形精子细胞和精子。
- 对于精子,通过宫颈脱位对小鼠实施安乐死。打开腹腔,找到睾丸附近的附睾,用剪刀轻轻切除。
- 将附睾放入 M2 培养基中,并使用 1 mL 注射器轻轻切除,让精子在正置显微镜 (10x)出。
- 将流动的精子和 M2 悬浮液虹吸到含有 0.5 mL M2 的试管底部,使精子自然流向上游。将它们放在一边以备后用。
- 对于圆形精子细胞,从腹腔中取出睾丸并将它们放入 M2 中。使用 1 mL 注射器轻轻切开白色膜,并在正置显微镜 (10x) 下挤出曲折的生精小管。
- 使用两个 1 mL 注射器小心地切除生精小管。提取悬浮液并用 400 目筛 (38 μm) 过滤。
- 离心过滤的细胞,弃去上清液,加入 200 μL Hoechst 33342 染色,然后在 37 °C 下孵育 10 分钟。
- 进行荧光激活细胞分选 (FACS) 以区分圆形精子细胞和其他细胞类型。将染色的细胞放入流式细胞术管中,进行圆形精子细胞筛选。
- 不同型号的流式细胞仪具有不同的调节参数,可以在作过程中与技术支持人员进行沟通。第一步,根据前向散射 (FSS) 和侧向散射 (SSC;参见 补充表 1) 调整电压并选择细胞群。
- 对于第二步,根据 FSC 和触发脉冲宽度去除细胞粘附。
- 作为第三步,选择目标单倍体圆形精子细胞。Hoechst 33342 与 DNA 结合,具有不同倍性特征的细胞表现出不同的荧光强度。将激发波长设置为 355。在 355 波长激光下选择两个检测通道 460/50 和 670/30 来分选圆形精子细胞。随后,将分选的圆形精子细胞储存在 4 °C 冰箱中以备后用。
注意:也可以在显微镜下根据它们的形态直接选择圆形精子细胞,但需要培训以确保选择的准确性。
4. 圆形精子细胞注射液 (ROSI)
- 使用带有显微作系统的倒置显微镜进行 ROSI 程序。
- 在初始准备步骤中,根据先前描述的程序21 制作固定针和注射针。将注射针的内径保持在 6-7 μm 之间,设计用于提取圆形精子细胞,对于固定针,内径为 20 μm,用于固定卵母细胞。
- 在随后的制备步骤中,通过放置 10 μL 含有 CB 的 M2 液滴来软化卵母细胞,并放置 10 μL 的 M2 液滴来储存圆形精子细胞,从而创建一个注射容器。使用 PVP 液滴润湿和清洁注射针头。
注意:这里添加CB不是必要的步骤,但添加CB可以大大提高注射后的存活率。 - 使用注射针提取圆形精子细胞。
- 用固定针旋转卵母细胞,将卵母细胞的极体定位在 12 点钟或 6 点钟位置。
- 小心地将注射针放在卵母细胞的 3 点钟位置,紧紧粘附在透明带上。使用 PiezoXpert 器件在透明带上创建一个孔。从小到大调整强度,这里大约是强度 = 5 和速度 = 15。
- 轻轻地将注射针穿过透明带并水平进入卵母细胞。当它通过卵母细胞中心时,施加压电陶瓷(强度 = 1 和速度 = 1),导致卵母细胞膜破裂并将圆形精子细胞逐渐注射到卵母细胞的细胞质中。
- 抽出注射针头,在开口附近吸出少量卵母细胞膜以密封它。这一步至关重要,因为密封失败会导致细胞质渗漏和卵母细胞死亡。
注意:值得注意的是,ROSI 在注射圆形精子细胞之前或之后都需要 AOA,我们将在后续部分中讨论。
5. 卵胞浆内单精子注射 (ICSI)
- 对 ICSI 执行与 ROSI 相同的步骤,唯一的区别是 ICSI 注射针的直径,其尺寸为 9-10 μm。
- 将精子放在 PVP 跑道上,以降低它们的游泳速度并促进精子提取。
- 对 ICSI 的精子头部和尾部进行分离。从尾部吸出精子,并将精子的颈部精确定位在注射针的口处。应用压电陶瓷(可根据需要使用多个压电陶瓷,强度 = 5 和速度 = 15)以分离精子的头部和尾部。
6. 辅助卵母细胞活化 (AOA)
- 根据方案,制备不含钙和镁的 CZB 培养基。
- 使用氯化锶六水合物 (SrCl26H2O),分子量为 266.62,浓度为 10 mM。制备时,将 0.26662 g SrCl26H2O 溶解在 1 mL 胚胎水中。使用时,将 10 μL 浓缩储存溶液添加到 990 μL 不含 Ca2+ 的 CZB 培养基中,并立即使用。
- 将卵母细胞置于含有 SrCl26H2O 的不含 Ca2+ 的 CZB 培养基中以活化;每个液滴的体积为 20 μL,每次放置 20 个卵母细胞。孵育 20 分钟。
- 同时,在不注射圆形精子细胞或精子的情况下建立一个孤雌生殖激活组。应该注意的是,孤雌生殖激活组在没有统计分析的情况下显示,对照组是 ICSI。
7. 胚胎移植
- 以 1:2 的比例饲养连接的 ICR 雄性和雌性小鼠。第二天早上,检查雌性小鼠是否存在阴道栓,并选择带有阴道栓的小鼠进行移植。
- 前一天早上注射由 2 细胞胚胎组成的移植胚胎,并在第二天下午移植它们。
- 在雌性小鼠的背部切开一个切口,露出白色脂肪和卵巢,并在正置显微镜 (10x) 下定位输卵管的扩大部分。
- 使用 1 mL 注射器在输卵管的扩大部分开一个口,然后通过口腔移液管吸出胚胎。轻轻地将胚胎引入子宫方向。使用 4 x 10 型号的带线弯曲针缝合伤口,厚度为 5-0 (0.09-0.11 mm)。缝合线分为两层,一层用于腹膜,一层用于外层皮肤。
- 对于代孕小鼠,根据实验时间表进行剖宫产。宫颈脱位法对小鼠实施安乐死,用酒精消毒,打开腹腔。轻轻快速地切开子宫并打开羊膜腔,露出胎儿和胎盘。去除脐带,从靠近胎儿的一侧剪断;胎儿由相同时期的母乳喂养小鼠喂养。
注意:由于需要计算出生率,剖宫产在生产能力方面更准确。在自然分娩中,后代可能会被母亲吃掉,从而导致统计数据不准确。对早期移植的代孕小鼠进行剖宫产术,并在分娩前进行安乐死剖宫产术。
8. 统计分析
- 使用 GraphPad Prism 5 进行分析。数据以平均值 ± SD 表示; P < 0.05 表示统计学差异, P < 0.01 表示显著统计学差异。
结果
我们通过检查 AOA 对胚胎发育能力的影响来开始我们的调查。实验设计的示意图如图 1A 所示。在精子注射之前,卵母细胞接受 AOA (A-ICSI) 或未处理 (ICSI)。胚胎发育的详细数据见 表 1。结果显示 A-ICSI 组和 ICSI 组之间的卵裂、囊胚或出生率无显著差异 (P > 0.05; 图 1B)。这些发现表明,使用 10 mM SrCl2 20 分钟的 AOA 不会影响胚胎的发育潜力。
先前报道,通过 FACS 或在显微镜下直接目视检查选择的 ROSI 胚胎的发育效率没有明显的差异22。我们的实验采用 FACS 技术来识别 RS(图 2A、B)。在显微镜下,小鼠圆形精子细胞的直径约为 10 μm,中间显示突起状核仁结构(图 2C)。我们认为通过 FACS 进行选择比在显微镜下直接目视检查更准确。此外,文献支持通过形态学差异直接探索 RS。ROSI 胚胎是使用两种不同的方法生成的:A-ROSI 组,其中卵母细胞在圆形精子细胞注射前进行 AOA,以及 ROSI-A 组,其中卵母细胞在圆形精子细胞注射后进行 AOA。实验设计的示意图如图 1C 所示。值得注意的是,A-ROSI、ROSI-A 和 ICSI 组之间的卵裂率和囊胚率无显著差异 (P > 0.05; 图 1D)。A-ROSI 、 ROSI-A 和 ICSI 组的囊胚率显著高于激活组 (P < 0.05; 图 1D)。然而,无论卵母细胞是在注射前还是注射后被激活,ROSI 组的出生率都低于 ICSI 组 (P < 0.05; 图 1D)。重要的是,A-ROSI 组的出生率略高于 ROSI-A 组(图 1D)。有关胚胎发育数据的更多详细信息见 表 1。
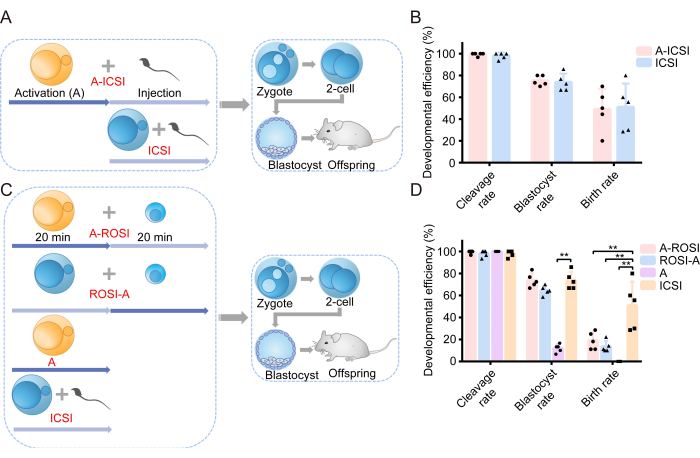
图 1:与 ICSI 胚胎相比,ROSI 胚胎的发育效率降低。 (A) 评估激活对 ICSI 胚胎发育影响的实验方案的示意图。蓝色 = 卵母细胞未被激活;黄色 = 卵母细胞被激活。(B) 来自 A-ICSI 和 ICSI 的胚胎的发育效率。(C) 产生不同类型胚胎的实验方案的示意图。(D) 源自 A-ROSI、ROSI-A、A 和 ICSI 的胚胎的发育效率。**, P < 0.01。缩写: A= 活化 E= 胚胎日;ROSI= 圆形精子细胞注射;ICSI= 卵胞浆内单精子注射。误差线显示标准偏差。使用卡方检验对费率进行比较。 请单击此处查看此图的较大版本。

图 2:通过流式细胞术分选选择圆形精子细胞。 (A) 使用流式细胞术分选图来选择圆形精子细胞。(B) 展示圆形精子细胞选择的代表性图像。比例尺:10 μm。缩写: FSC = 前向散射;SSC = 侧向散射;355 是激发波长;460/50 和 670/30 是 355 波长激光器下的两个检测通道。 请单击此处查看此图的较大版本。
| 组 | 植入前开发 | 植入后发育 | |||
| 复制 | 卵裂率 (%) | 囊胚率 (%) | 移植的 2 细胞胚胎/编号收件人数 | 出生率 (%) | |
| A-ICSI | 5 | 99.33 (149/150) | 75.17 (112/149) | 49/5 | 48.98 (24/49) |
| A-罗西 | 5 | 99.33 (149/150) | 73.83 (110/149) | 44/5 | 18.18 (8/44) ** |
| 罗西-A | 5 | 98.00 (147/150) | 64.63 (95/147) | 45/5 | 13.33 (6/45) ** |
| 激活 | 5 | 100.00 (150/150) | 12.00 (18/150) ** | 51/5 | 0.00 (0/51) ** |
| ICSI 国际细胞指数 | 5 | 98.00 (147/150) | 73.47 (108/147) | 46/5 | 52.17 (24/46) |
表 1. 来自不同群体的胚胎的发育效率。
补充表 1. 通过流式细胞术分选的不同细胞群的比例。P3 部分是圆形精子细胞。 请点击此处下载此文件。
讨论
辅助卵母细胞活化
ROSI 的一个关键先决条件是 AOA,因为单独的圆形精子细胞不能启动卵母细胞活化。目前,在小鼠中最成熟的方法涉及使用氯化锶 23,24,而最先进的人类应用采用电激活 13,14。卵母细胞活化的时机也具有重要意义。如文献所述,小鼠的最佳激活方法包括最初激活卵母细胞,然后注射圆形精子细胞25。这与传统的受精过程形成鲜明对比,在传统的受精过程中,精子最初进入卵母细胞,随后释放磷脂酶 C ζ以激活卵母细胞26。Satoshi Kishigami 及其同事进行的专业研究强调了 ROSI 在活化前或活化后卵母细胞中形成雄性核的不同能力。为了实现高效的后代生产率,两种注射类型都必须在卵母细胞进入 G1 期25 之前进行。
注射针的直径
在 ROSI 的背景下,重要的是要注意注射针的更大直径并不一定转化为更好的结果。使用的注射针直径为 6-7 μm,比圆形精子细胞略小。因此,当吸出圆形精子细胞时,细胞膜会受到挤压作用,可能导致细胞核直接暴露。这种直接暴露可能有利于解聚和随后形成雄性前核27。
密封处理
与其他物种相比,小鼠卵母细胞表现出较低的细胞质粘度。即使是细胞膜上的一个小裂口也会导致细胞质容易流出,导致卵母细胞变性28。为了降低风险,在将圆形精子细胞注射到卵母细胞细胞质中并撤回注射针后,必须在卵母细胞膜开口附近吸出一小部分细胞膜以密封空间,类似于 ICSI21 中的程序。这种密封过程显着降低了卵母细胞变性的风险。
ROSI 作为模型的应用
除了临床应用之外,ROSI 技术还有各种其他应用作为模型。它可以加快小鼠世代29 倍,挽救小鼠父系遗传的 Xist 缺失导致的雌性致死17,将精子细胞圆形注射到单倍体孤雌生殖双细胞卵裂球后生成小鼠15,生成转基因小鼠后代16,并在癌症治疗前保持青春期儿童的生育能力30,31.对小鼠 ROSI 的勤奋研究可以极大地促进生殖健康研究的进步。
文章的局限性
本文作为方法指南,但存在一些局限性,包括缺乏在显微镜下直接比较选择 RS 进行注射以及被认为缺乏创新。
披露声明
作者声明不存在财务或其他利益冲突。
致谢
我们感谢 Wenjie Zhao 在通过流式细胞术对圆形精子细胞进行分类方面提供的宝贵帮助,并感谢 Fang Wang 在小鼠胚胎移植方面的专业知识。这项工作得到了吉林省自然科学基金 (No.YDZJ202301ZYTS461)。我们感谢 Bullet Edits Limited 对手稿进行语言编辑和校对。
材料
| Name | Company | Catalog Number | Comments |
| CaCl22H2O | Sigma | C7902 | Preparation of CZB |
| Glucose | Sigma | G6152 | Preparation of CZB |
| HEPES-Na (basic) | Sigma | H3784 | Preparation of CZB |
| Hoechst 33342 | Beyotime | C1025 | FACS |
| human chorionic gonadotropin (HCG) | Ningbo Second Hormone Company | HCG | Ovulation promoting drugs |
| Hyaluronidase | Sigma | H3506 | Removing granulosa cells around the oocyte |
| KCl | Sigma | P5405 | Preparation of CZB |
| KH2PO4 | Sigma | P5655 | Preparation of CZB |
| KSOMaa | Caisson Labs | IVL04-100ML | Potassium simplex optimized medium supplemented with amino acids |
| L-glutamine | Sigma | G8540 | Preparation of CZB |
| M2 | Sigma | M7167-50ML | Operating fluid |
| MgSO47H2O | Sigma | M1880 | Preparation of CZB |
| Na2-EDTA2H2O | Sigma | E5134 | Preparation of CZB |
| NaCl | Sigma | S5886 | Preparation of CZB |
| NaHCO3 | Sigma | S5761 | Preparation of CZB |
| Na-lactate 60% syrup d = 1.32 g/L | Sigma | L7900 | Preparation of CZB |
| Na-pyruvate | Sigma | P4562 | Preparation of CZB |
| Piezo drill tips (ICSI) | Eppendorf | piezoXpert | Piezoelectric membrane rupture |
| pregnant mare serum gonadotropin (PMSG) | Ningbo Second Hormone Company | PMSG | Ovulation promoting drugs |
| PVA | Sigma | P8136 | Preparation of CZB |
参考文献
- Redgrove, K. A., McLaughlin, E. A. The role of the immune response in Chlamydia trachomatis infection of the male genital tract: A double-edged sword. Front Immunol. 5, 534 (2014).
- Yanagimachi, R. Intracytoplasmic injection of spermatozoa and spermatogenic cells: Its biology and applications in humans and animals. Reprod Biomed Online. 10 (2), 247-288 (2005).
- Palermo, G., Joris, H., Devroey, P., Van Steirteghem, A. C. Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte. Lancet. 340 (8810), 17-18 (1992).
- Kimura, Y., Yanagimachi, R. Mouse oocytes injected with testicular spermatozoa or round spermatids can develop into normal offspring. Development. 121 (8), 2397-2405 (1995).
- Tesarik, J., et al. Spermatid injection into human oocytes. II. Clinical application in the treatment of infertility due to non-obstructive azoospermia. Human Reprod. 11 (4), 780-783 (1996).
- Tesarik, J., Mendoza, C. Spermatid injection into human oocytes. I. Laboratory techniques and special features of zygote development. Human Reprod. 11 (4), 772-779 (1996).
- Hirabayashi, M., et al. Activation regimens for full-term development of rabbit oocytes injected with round spermatids. Mol Reprod Dev. 76 (6), 573-579 (2009).
- Ogonuki, N., et al. Birth of a marmoset following injection of elongated spermatid from a prepubertal male. Mol Reprod Dev. 86 (8), 928-930 (2019).
- Niederberger, C., et al. Forty years of IVF. Fertil Steril. 110 (2), 185 (2018).
- Gross, K. X., Hanson, B. M., Hotaling, J. M. Round spermatid injection. Urol Clin North Am. 47 (2), 175-183 (2020).
- Hanson, B. M., et al. Round spermatid injection into human oocytes: a systematic review and meta-analysis. Asian J Androl. 23 (4), 363-369 (2021).
- Tekayev, M., Vuruskan, A. K. Clinical values and advances in round spermatid injection (ROSI). Reprod Biol. 21 (3), 100530 (2021).
- Tanaka, A., et al. Fourteen babies born after round spermatid injection into human oocytes. Proc Natl Acad Sci U S A. 112 (47), 14629-14634 (2015).
- Tanaka, A., et al. Ninety babies born after round spermatid injection into oocytes: survey of their development from fertilization to 2 years of age. Fertil Steril. 110 (3), 443-451 (2018).
- Yang, H., Shi, L., Chen, C. D., Li, J. Mice generated after round spermatid injection into haploid two-cell blastomeres. Cell Res. 21 (5), 854-858 (2011).
- Moreira, P., et al. Transgenic mouse offspring generated by ROSI. J Reprod Dev. 62 (1), 37-42 (2016).
- Federici, F., et al. Round spermatid injection rescues female lethality of a paternally inherited Xist deletion in mouse. PLoS Genet. 12 (10), e1006358 (2016).
- Sakamoto, M., et al. Paternally inherited H3K27me3 affects chromatin accessibility in mouse embryos produced by round spermatid injection. Development. 149 (18), 200696 (2022).
- Wang, J., et al. Single-cell multiomics sequencing reveals the reprogramming defects in embryos generated by round spermatid injection. Sci Adv. 8, (2022).
- Ward, M. A., Yanagimachi, R. Intracytoplasmic sperm injection in mice. Cold Spring Harb Protoc. 2018 (1), (2018).
- Yoshida, N., Perry, A. C. Piezo-actuated mouse intracytoplasmic sperm injection (ICSI). Nat Protoc. 2 (2), 296-304 (2007).
- Zhu, L., et al. FACS selection of valuable mutant mouse round spermatids and strain rescue via round spermatid injection. Zygote. 23 (3), 336-341 (2013).
- Kong, P., et al. Effects of the histone deacetylase inhibitor 'Scriptaid' on the developmental competence of mouse embryos generated through round spermatid injection. Hum Reprod. 32 (1), 76-87 (2017).
- Hosseini, S., Salehi, M. Tricostatin A-treated round spermatid enhances preimplantation embryo developmental competency following round spermatid injection in mice. Zygote. 30 (3), 373-379 (2022).
- Kishigami, S., Wakayama, S., Nguyen, V. T., Wakayama, T. Similar time restriction for intracytoplasmic sperm injection and round spermatid injection into activated oocytes for efficient offspring production. Biol Reprod. 70 (6), 1863-1869 (2004).
- Tao, Y. Oocyte activation during round spermatid injection: state of the art. Reprod Biomed Online. 45 (2), 211-218 (2022).
- Ogura, A., Ogonuki, N., Miki, H., Inoue, K. Microinsemination and nuclear transfer using male germ cells. Int Rev Cytol. 246, 189-229 (2005).
- Kimura, Y., Yanagimachi, R. Intracytoplasmic sperm injection in the mouse. Biol Reprod. 52 (4), 709-720 (1995).
- Ogonuki, N., et al. A high-speed congenic strategy using first-wave male germ cells. PLoS One. 4 (3), e4943 (2009).
- Abdelaal, O., et al. Fertility preservation for pediatric male cancer patients: illustrating contemporary and future options; a case report. Transl Androl Urol. 10 (1), 520-526 (2021).
- Eyni, H., et al. Advanced bioengineering of male germ stem cells to preserve fertility. J Tissue Eng. 12, (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。