Method Article
Мышиная инъекция круглого сперматида
В этой статье
Резюме
В этой статье мы представляем метод выполнения круговой инъекции сперматид (ROSI) мышам, метод с многообещающим клиническим применением и полезностью для исследования механизмов, лежащих в основе эмбрионального развития.
Аннотация
Круглые сперматиды, характеризующиеся своим гаплоидным генетическим составом, представляют собой клетки-предшественники зрелых сперматозоидов. Благодаря инновационной методике круглой инъекции сперматид (ROSI) ооциты могут быть успешно оплодотворены и развиться в жизнеспособные плоды. В 1995 году с помощью технологии ROSI был рожден первый эмбрион мыши. С тех пор ROSI стал ключевым инструментом для разгадки сложных механизмов, управляющих эмбриональным развитием, и обладает значительным потенциалом в различных приложениях, включая ускорение генерации мышей и производство генетически модифицированных мышей. В 1996 году была достигнута важная веха, когда с помощью технологии ROSI родился первый человеческий плод. Тем не менее, клиническое применение этого метода показало колеблющуюся картину успеха и неудачи. На сегодняшний день технология ROSI не нашла широкого применения в клинической практике, в первую очередь из-за низкой эффективности родов и недостаточной валидации безопасности плода. В этой статье представлен всесторонний отчет о точных методах проведения ROSI у мышей, направленный на то, чтобы пролить новый свет на фундаментальные исследования и их потенциальное клиническое применение.
Введение
Заключительная стадия сперматогенеза включает в себя превращение круглой сперматиды в полностью развитый сперматозоид, характеризующийся отчетливымиструктурами головы, шеи и удлиненного хвоста. Эта трансформация включает в себя значительные изменения в морфологии клетки, такие как конденсация хроматина в ядре, замещение гистонов протамином, образование акросом, развитие митохондриальной оболочки, миграция и потеря центриолей, формирование структуры хвоста и удаление клеточныхостатков.
В 1992 году спомощью технологии интрацитоплазматической инъекции сперматозоида (ИКСИ) был успешно рожден первый человеческий плод. С тех пор исследователи изучают потенциал использования круглых сперматид, которые имеют тот же гаплоидный генетический состав, что и зрелые сперматозоиды, для оплодотворения ооцитов и поддержания жизнеспособной беременности. Впоследствии, в 1996 году,был доставлен первый человеческий плод, зачатый с помощью технологии круглой инъекции сперматид (ROSI). Стоит отметить, что исследования с использованием ИКСИ и РОСИ у мышей отставали от исследований на людях из-за подверженности мембраны ооцитов мыши к повреждениям в процессе инъекции. Этот вопрос был успешно решен с внедрением устройства для разрыва пьезомембран. В результате в 1995 году на свет появилась первая мышь, зачатая с помощью технологии ROSI. Кроме того, также ведутся исследования ROSI у различных других животных 7,8.
В настоящее время исследования ROSI в основном сосредоточены на следующих аспектах: клиническое применение, выяснение механизмов и стратегии повышения эффективности разработки, а также более широкое применение технологии ROROS. В контексте клинического применения, несмотря на рождение первого человеческого плода с помощью ROSI в 1996 году, прогресс был отмечен рядом успехов и неудач 9,10,11,12. На сегодняшний день технология ROSI не получила широкого клинического внедрения, в основном из-за ее низкой эффективности и необходимости дальнейшей валидации безопасности плодов, зачатых с помощью технологии ROSI. Неполные статистические данные свидетельствуют о том, что во всем мире было рождено менее 200 человеческих плодов, зачатых с помощью ROSI. Поворотный момент в понимании потенциала технологии ROSI произошел в 2015 году, когда Танака и его коллеги сообщили об успешном рождении 14 плодов с помощью технологии ROSI, вселив новую уверенность в ее клиническом применениии осуществимости. Технология ROSI имеет значительные перспективы для решения проблем репродуктивной биологии, особенно у пациентов с необструктивной азооспермией. В дополнение к своему клиническому применению, ROSI служит ценным инструментом для изучения сложных механизмов эмбрионального развития 15,16,17.
Были проведены многочисленные исследования на животных для изучения основных факторов, способствующих низкой эффективности ROSI в достижении полного эмбрионального развития. К таким факторам относятся выбор методов вспомогательной активации ооцитов (АОА) и их сроки, аномалии стабильности генома и, в частности, аномалии эпигенетических модификаций. Важно признать, что круглые сперматиды являются незрелыми половыми клетками, существенно отличающимися от зрелых сперматозоидов в различных физиологических аспектах. Мидзуки Сакамото и его коллеги указали, что H3K27me3, полученный из круглых сперматид, связан с хроматином, который менее доступен и приводит к нарушению экспрессии генов у эмбрионов ROSI18. В аналогичном исследовании Jing Wang и его коллег перепрограммирование дефектов в эмбрионах ROSI на пронуклеарных стадиях было преимущественно связано с неправильной экспрессией когорты генов, ответственных за незначительнуюактивацию зиготического генома. Они также обнаружили, что введение селективного эухроматического ингибитора гистон-лизинметилтрансферазы 2, A366, потенциально может увеличить общую скорость развития примерно в два раза.
Мышь является одним из наиболее ценных модельных животных для изучения эмбрионального развития. В этой статье подробно рассказывается о том, как проводить ROSI на мышах. Этот комплексный протокол включает в себя выбор подходящих мышей, подробные процедуры индукции овуляции, методы АОА, техники инъекций и подготовку суррогатных мышей. Кроме того, мы представляем сравнительный анализ влияния двух схем инъекций на эффективность родов: АОА с последующей РОСИ (A-ROSI; первая схема) и ROSI с последующей AOA (ROSI-A; вторая схема). Мы стремимся поощрять исследователей проводить эксперименты с ROSI на мышах с большей точностью, предлагая более надежную поддержку для их клинического применения и фундаментальных исследований механизмов эмбрионального развития.
протокол
Мыши B6D2F1 (C57BL/6 x DBA/2), C57BL/6 и ICR, использованные в этом эксперименте, были приобретены у Beijing Vital River Laboratory Animal Technologies Co. Ltd. (Пекин, Китай). Все методы лечения животных проводились в соответствии с экспериментальными процедурами и стандартами, утвержденными Комитетом по этике экспериментальных животных Первой больницы Цзилиньского университета (номер одобрения: 20200435).
1. Приготовление соответствующих реагентов
- Приобретите некоторые реагенты в коммерческих целях и самостоятельно приготовьте оставшиеся реагенты.
- Получите от поставщика M2, буферную систему для обработки in vitro круглых сперматид (РС), сперматозоидов и ооцитов.
- Приготовьте среду Ca2+-free C.L. Chatot, C.A. Ziomek и B.D. Bavister (CZB) для AOA в соответствии с ранее опубликованным протоколом20.
- Приобретите оптимизированную среду для симплексного калия с добавлением раствора аминокислот (KSOMaa) для культивирования эмбрионов от поставщика.
- Готовят гиалуронидазу с рабочей концентрацией 0,1% (1 г/л), растворяя 0,1 г гиалуронидазы в 1 мл эмбриональной воды. Возьмите 10 мкл концентрированного раствора для хранения и растворите в 990 млМ2, который можно хранить при 4 °С в течение 1 недели.
- Получают поливинилпирролидон (ПВП) со средней молекулярной массой 360 000 и массовой концентрацией 12%, растворяя 1,2 г ПВП в 10 млМ2. Полученный раствор можно хранить при температуре 4 °C в течение 1 недели.
- Храните стоковый раствор цитохалазина B (CB) (2 μL), растворимый в 18 μL DMSO при -20 °C. Возьмите 5 мкл концентрированного раствора для хранения и растворите в 995 млМ2. Полученный раствор можно хранить при температуре 4 °C в течение 1 недели.
2. Подготовка ооцитов
- Акклиматизируйте самок мышей B6D2F1 в возрасте 6-8 недель к новой среде обитания в течение как минимум 1 недели. Введите внутрибрюшинно 7,5 МЕ гонадотропина сыворотки крови беременной кобылы (PMSG) в 5 часов вечера, а затем 7,5 МЕ хорионического гонадотропина человека (ХГЧ) через 48 часов. Убедитесь, что после инъекции не происходит контакта с самцами мышей.
ПРИМЕЧАНИЕ: Указанное время (5 часов вечера) не является обязательным. Это просто для удобства работы. 14 часов после 5 часов вечера – это 7 часов утра, когда ооциты готовы, и выполняется инъекция, поэтому время инъекции запланировано на утро. Время начала инъекции может быть скорректировано в соответствии с ежедневным графиком лаборатории. - После 14 ч инъекции ХГЧ усыпьте мышей методом шейного вывиха. Откройте брюшную полость и найдите матку. Определите яичники вдоль матки и перережьте маточные трубы рядом с яичниками с помощью ножниц. Повторите ту же процедуру с другой стороны и поместите фаллопиевы трубы в М2, который предварительно нагрет до 37 °C.
- Под вертикальным микроскопом (10x) найдите увеличенную часть фаллопиевой трубы, показывающую прозрачный и опухший вид. С помощью шприца объемом 1 мл закрепите фаллопиеву трубу во время разрезания увеличенной части, собирая ооциты коронально-кумулюсных комплексов (OCCC).
- Поместите OCCC в предварительно подогретый рабочий раствор M2 , содержащий 0,1% гиалуронидазы, и удалите гранулезные клетки, осторожно продув через пероральную пипетку.
ПРИМЕЧАНИЕ: При необходимости держите OCCC в 0,1% гиалуронидазе в течение короткого времени, примерно 2 минуты. - После удаления гранулезных клеток перенесите ооцит в KSOMaa, промойте 3 раза и поместите в инкубатор с углекислым газом для последующего использования (37 °C, 5%CO2).
3. Заготовка круглых сперматид и сперматозоидов
- Соберите круглые сперматиды и сперматозоиды из яичек и придатков яичек самцов мышей C57BL/6 (8-10 недель) соответственно.
- Для сперматозоидов усыпляют мышей при вывихе шейки матки. Вскрыть брюшную полость, расположить придаток яичка рядом с яичком и аккуратно иссечь ножницами.
- Поместите придаток яичка в среду М2 и аккуратно иссеките с помощью шприца объемом 1 мл, чтобы сперматозоиды могли вытекать под вертикальным микроскопом (10x).
- Высосите текучие сперматозоиды и суспензиюМ2 на дно пробирки, содержащей 0,5 млМ2, позволяя сперматозоидам течь вверх по течению естественным образом. Отложите их в сторону для последующего использования.
- При круглых сперматидах удалите яички из брюшной полости и поместите их в М2. Аккуратно разрежьте белую мембрану с помощью шприца объемом 1 мл и выдавите извитые семенные канальцы под вертикальным микроскопом (10x).
- Осторожно исчерпайте семенные канальцы с помощью двух шприцев объемом 1 мл. Извлеките суспензию и отфильтруйте с помощью сита с плотностью 400 меш (38 мкм).
- Отфильтрованные клетки центрифугируют, отбраковывают надосадочную жидкость и добавляют 200 мкл Hoechst 33342 для окрашивания, после чего проводят инкубацию при 37 °C в течение 10 минут.
- Выполните флуоресцентно-активируемую сортировку клеток (FACS), чтобы отличить круглые сперматиды от других типов клеток. Поместите окрашенные клетки в пробирку проточной цитометрии и проведите круглый скрининг сперматид.
- Различные модели аппаратов проточной цитометрии имеют разные регуляторные параметры и могут быть связаны со службой технической поддержки во время работы. В качестве первого шага отрегулируйте напряжение и выберите популяцию элементов в соответствии с прямым рассеянием (FSS) и боковым рассеянием (SSC; см. дополнительную таблицу 1).
- На втором этапе удалите клеточные спайки в соответствии с FSC и длительностью импульса запуска.
- В качестве третьего шага выберите целевую гаплоидную круглую сперматиду. Hoechst 33342 связывается с ДНК, и клетки с различной плоидностью проявляют разную интенсивность флуоресценции. Установите длину волны возбуждения на 355. Выберите два канала обнаружения, 460/50 и 670/30, под лазером с длиной волны 355 для сортировки круглых сперматид. Впоследствии храните отсортированные круглые сперматиды в холодильнике при температуре 4 °C для последующего использования.
ПРИМЕЧАНИЕ: Также возможно непосредственное выделение круглых сперматид на основе их морфологии под микроскопом, но для обеспечения точности отбора требуется обучение.
4. Круглая инъекция сперматид (ROSI)
- Проводят процедуру ROSI с помощью инвертированного микроскопа с микроманипуляционной системой.
- На начальном этапе подготовки сделайте удерживающие и инъекционные иглы в соответствии с ранее описанной процедурой21. Поддерживайте внутренний диаметр инъекционной иглы в пределах 6-7 мкм, предназначенной для извлечения круглых сперматид, а для удержания иглы, имеющей внутренний диаметр 20 мкм для закрепления ооцита.
- На следующем этапе подготовки создайте инъекционный сосуд, поместив 10 мкл капельМ2 , содержащих КБ, для размягчения ооцитов и 10 мкл капельМ2 для хранения круглых сперматид. Используйте капли PVP для увлажнения и очищения инъекционных игл.
ПРИМЕЧАНИЕ: Добавление CB здесь не является необходимым шагом, но добавление CB может значительно улучшить выживаемость после инъекции. - Извлеките круглые сперматиды с помощью инъекционной иглы.
- Поверните ооцит с помощью удерживающей иглы, расположив полярное тело ооцита в положении «12 часов» или «6 часов».
- Осторожно поместите иглу для инъекций в положение «3 часа» на ооците, плотно прилегая к пеллюцидной зоне. Используйте устройство PiezoXpert для создания отверстия в zona pellucida. Отрегулируйте силу от малой к большой, что примерно равно интенсивности = 5 и скорости = 15.
- Аккуратно проведите иглу для инъекций через пеллюцидную зону и введите ооцит горизонтально. Когда он проходит через центр ооцита, нанесите пьезо (интенсивность = 1 и скорость = 1), что приведет к разрыву мембраны ооцита и постепенному введению круглой сперматиды в цитоплазму ооцита.
- Извлеките иглу для инъекции и аспирируйте небольшое количество оболочки ооцита рядом с отверстием, чтобы запечатать ее. Этот шаг имеет решающее значение, так как неспособность запечатать приведет к утечке цитоплазмы и гибели ооцитов.
ПРИМЕЧАНИЕ: Стоит отметить, что ROSI требовала АОА либо до, либо после инъекции круглых сперматид, о которых мы говорили в последующих разделах.
5. Интрацитоплазматическая инъекция сперматозоида (ИКСИ)
- Для ИКСИ проделайте те же действия, что и для ROSI, с той лишь разницей, что диаметр инъекционной иглы ИКСИ составляет 9-10 мкм.
- Поместите сперматозоидов на взлетно-посадочную полосу PVP, чтобы снизить скорость их плавания и облегчить извлечение сперматозоидов.
- Проводят разделение головки и хвоста сперматозоидов при проведении ИКСИ. Отсадите сперматозоиды из хвоста и расположите шейку сперматозоида точно у входа в иглу для инъекций. Нанесите пьезо (при необходимости можно использовать несколько пьезо, интенсивность = 5 и скорость = 15) для разделения головки и хвоста сперматозоидов.
6. Вспомогательная активация ооцитов (АОА)
- Согласно протоколу, приготовьте среду CZB без кальция и магния.
- Используют гексагидрат хлорида стронция (SrCl26H2O), с молекулярной массой 266,62, в концентрации 10 мМ. Чтобы его приготовить, растворите 0,26662 г SrCl26H2O в 1 мл воды для эмбриона. Во время использования добавьте 10 мкл концентрированного раствора для хранения к 990 мкл среды CZB без Ca2+ и немедленно используйте.
- Поместите ооциты в среду Ca2+-free CZB, содержащую SrCl26H2O для активации; каждая капля имеет объем 20 мкл, и каждый раз помещается 20 ооцитов. Выдерживать в течение 20 минут.
- Одновременно создать группу для активации партеногенеза без введения круглых сперматид или сперматозоидов. Следует отметить, что группа активации партеногенеза показана без статистического анализа, а контрольная группа – ИКСИ.
7. Перенос эмбрионов
- Разместите перевязанных мышей ICR мужского и женского пола в соотношении 1:2. На следующее утро осмотрите самок мышей на наличие вагинальной пробки и выберите тех, у кого есть вагинальная пробка для трансплантации.
- Введите перенесенные эмбрионы, состоящие из двухклеточных эмбрионов, предыдущим утром и перенесите их на следующий день.
- Сделайте надрез на спине самки мыши, обнажите белый жир и яичники, а также найдите увеличенную часть фаллопиевой трубы под вертикальным микроскопом (10x).
- С помощью шприца объемом 1 мл создайте отверстие в увеличенной части фаллопиевой трубы и отсасывайте эмбрионы через оральную пипетку. Аккуратно введите эмбрионы по направлению к матке. Зашивают рану, используя модели 4 х 10 изогнутых игл с нитью, толщиной 5-0 (0,09-0,11 мм). Шов делается в два слоя, один слой для брюшины и один слой для наружной кожи.
- Суррогатным мышам проводят кесарево сечение на основе экспериментального графика. Усыпить мышей методом шейного вывиха, продезинфицировать спиртом, вскрыть брюшную полость. Аккуратно и быстро разрежьте матку и откройте околоплодные воды, чтобы показать плод и плаценту. Удалить пуповину и разрезать сбоку близко к плоду; Плод вскармливался в тот же период грудного вскармливания мышами.
ПРИМЕЧАНИЕ: В связи с необходимостью расчета рождаемости, кесарево сечение является более точным в отношении производственных мощностей. При естественных родах потомство может быть съедено матерью, что приводит к неточной статистике. Кесарево сечение проводится на суррогатных мышах, пересаженных на ранней стадии, а кесарево сечение эвтаназии проводится перед родами.
8. Статистический анализ
- Для анализа используйте GraphPad Prism 5. Данные выражаются в среднем ± SD; P < 0,05 указывает на статистическую разницу, а P < 0,01 указывает на значимую статистическую разницу.
Результаты
Мы начали наше исследование с изучения влияния АОА на способность эмбрионов к развитию. Схематическая иллюстрация плана эксперимента показана на рисунке 1А. Перед инъекцией сперматозоидов ооциты подвергались либо AOA (A-ICSI), либо оставались нелеченными (ICSI). Подробные данные об эмбриональном развитии представлены в таблице 1. Результаты не выявили существенных различий в расщеплении, бластоцисте или частоте рождаемости между группами А-ИКСИ и ИКСИ (P > 0,05; Рисунок 1B). Эти данные указывают на то, что АОА с использованием 10 мМ SrCl2 в течение 20 мин не повлиял на потенциал развития эмбрионов.
Ранее сообщалось, что не было заметных различий в эффективности развития эмбрионов ROSI, отобранных с помощью FACS или прямого визуального исследования подмикроскопом. В наших экспериментах использовалась технология FACS для идентификации ДЗ (рис. 2A, B). Под микроскопом круглые сперматиды мыши имели диаметр около 10 мкм и имели выпячивающуюся ядрышковую структуру в середине (рис. 2C). Мы утверждаем, что отбор с помощью FACS является более точным, чем прямой визуальный осмотр под микроскопом. Кроме того, литература поддерживает прямое исследование РС через морфологические различия. Эмбрионы ROSI были получены с использованием двух различных методов: группы A-ROSI, где ооциты подвергались воздействию AOA до круглой инъекции сперматиды, и группы ROSI-A, где ооциты подвергались воздействию AOA после круглой инъекции сперматиды. Принципиальная схема плана эксперимента представлена на рисунке 1С. Примечательно, что не было обнаружено существенных различий в показателях расщепления и бластоцисты в группах A-ROSI, ROSI-A и ИКСИ (P > 0,05; Рисунок 1D). Частота бластоцисты в группах A-ROSI, ROSI-A и ИКСИ была достоверно выше, чем в группе активации (P < 0,05; Рисунок 1D). Тем не менее, рождаемость в группе ROSI была ниже, чем в группе ИКСИ, независимо от того, были ли ооциты активированы до или после инъекции (P < 0,05; Рисунок 1D). Важно отметить, что уровень рождаемости в группе A-ROSI был немного выше, чем в группе ROSI-A (рисунок 1D). Более подробная информация о развитии эмбрионов представлена в таблице 1.
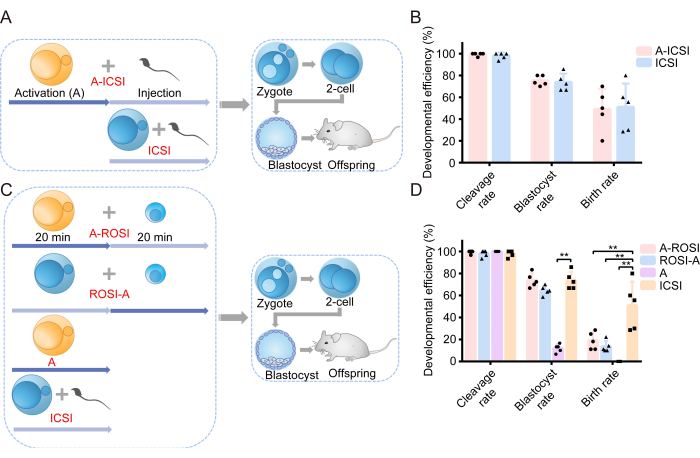
Рисунок 1: Эмбрионы ROSI продемонстрировали сниженную эффективность развития по сравнению с эмбрионами ИКСИ. (A) Схематическая иллюстрация экспериментального протокола, оценивающего влияние активации на эмбриональное развитие ИКСИ. Синий = ооциты не были активированы; Желтый = ооциты были активированы. (В) Эффективность развития эмбрионов, полученных с помощью А-ИКСИ и ИКСИ. (C) Схематическое изображение экспериментального протокола для получения различных типов эмбрионов. (D) Эффективность развития эмбрионов, полученных из A-ROSI, ROSI-A, A и ICSI. **, P < 0,01. Сокращения: А = Активация Е = Эмбриональный день; ROSI = Круглая инъекция сперматид; ИКСИ = интрацитоплазматическая инъекция сперматозоида. Полосы погрешностей показывают стандартное отклонение. Сравнение скоростей проводится с помощью критерия хи-квадрат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Круглые сперматиды были отобраны с помощью проточной цитометрической сортировки. (A) Диаграмма проточной цитометрической сортировки была использована для отбора круглых сперматид. (B) Репрезентативные изображения, демонстрирующие выбор круглых сперматид. Масштабная линейка: 10 μм. Сокращения: FSC = Прямой разброс; SSC = боковой разброс; 355 - длина волны возбуждения; 460/50 и 670/30 - это два канала детектирования под лазером с длиной волны 355. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Группы | Предимплантационная разработка | Постимплантационное развитие | |||
| Реплицирует | Коэффициент спайности (%) | Частота бластоцисты (%) | Перенесены 2-клеточные эмбрионы/ No. получателей | Рождаемость (%) | |
| А-ИКСИ | 5 | 99.33 (149/150) | 75.17 (112/149) | 49/5 | 48.98 (24/49) |
| А-РОЗИ | 5 | 99.33 (149/150) | 73.83 (110/149) | 44/5 | 18.18 (8/44) ** |
| РОСИ-А | 5 | 98.00 (147/150) | 64.63 (95/147) | 45/5 | 13.33 (6/45) ** |
| Активация | 5 | 100.00 (150/150) | 12.00 (18/150) ** | 51/5 | 0.00 (0/51) ** |
| ИКСИ | 5 | 98.00 (147/150) | 73.47 (108/147) | 46/5 | 52.17 (24/46) |
Таблица 1. Эффективность развития эмбрионов, полученных из разных групп.
Дополнительная таблица 1. Доля различных клеточных популяций, отсортированных с помощью проточной цитометрии. Часть P3 представляет собой круглые сперматиды. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Вспомогательная активация ооцитов
Важнейшей предпосылкой для ROSI является АОА, поскольку круглые сперматиды сами по себе не могут инициировать активацию ооцитов. В настоящее время наиболее распространенный метод на мышах включает использование хлорида стронция 23,24, в то время как наиболее продвинутое применение на людях использует электрическую активацию13,14. Время активации ооцитов также имеет большое значение. Как сообщается в литературе, наиболее оптимальный подход к активации у мышей включает в себя первоначальную активацию ооцита, а затем введение круглого сперматиды25. Это контрастирует с обычным процессом оплодотворения, при котором сперматозоиды сначала попадают в ооциты, а затем высвобождают фосфолипазу C ζ для активации ооцита26. Специализированное исследование, проведенное Сатоши Кишигами и его коллегами, подчеркивает дифференциальную способность ROSI образовывать мужское ядро в пре- или постактивированных ооцитах. Для достижения эффективной скорости производства потомства оба типа инъекций должны быть проведены до того, как ооциты войдут в фазуG1 25.
Диаметр инъекционной иглы
В контексте ROSI важно отметить, что больший диаметр инъекционной иглы не обязательно приводит к лучшим результатам. Используемая инъекционная игла имеет диаметр 6-7 мкм, что немного меньше круглой сперматиды. Поэтому при аспирации круглой сперматиды клеточная мембрана подвергается сжимающему эффекту, потенциально приводящему к прямому обнажению ядра. Такое прямое воздействие может способствовать деполимеризации и последующему образованию мужского пронуклеуса27.
Герметизирующая обработка
Ооциты мышей демонстрируют меньшую цитоплазматическую вязкость по сравнению с другими видами. Даже небольшой разрыв в клеточной мембране может привести к тому, что цитоплазма будет легко вытекать, что приведет к дегенерации ооцитов28. Чтобы снизить риск, после введения круглой сперматиды в цитоплазму ооцита и извлечения инъекционной иглы, необходимо аспирировать небольшую часть клеточной мембраны рядом с отверстием клеточной мембраны ооцита, чтобы запечатать пространство, аналогично процедуре при ИКСИ21. Этот процесс герметизации значительно снижает риск дегенерации ооцитов.
Применение ROSI в качестве модели
Помимо клинического применения, технология ROSI имеет множество других применений в качестве модели. Он может ускорить генерацию мышей в29 раз, спасти женскую летальность в результате унаследованной по отцовской линии делеции Xist у мышей17, создать мышей после круглой инъекции сперматид в гаплоидные партеногенетические двухклеточные бластомеры15, создать трансгенное потомство мышей16 и сохранить фертильность у детей подросткового возраста до лечения рака30,31. Тщательные исследования ROSI у мышей могут внести существенный вклад в прогресс в исследованиях в области репродуктивного здоровья.
Ограничения статьи
Данная статья служит методологическим руководством с рядом ограничений, включая отсутствие прямого сравнительного отбора ДЗ под микроскопом для инъекций и ощущаемое отсутствие инноваций.
Раскрытие информации
Авторы заявляют об отсутствии конфликта финансовых или иных интересов.
Благодарности
Мы выражаем нашу благодарность Вэньцзе Чжао за ее неоценимую помощь в сортировке круглых сперматид с помощью проточной цитометрии и Фан Ван за ее опыт в переносе эмбрионов мышей. Эта работа получила частичную поддержку от Фонда естественных наук провинции Цзилинь (No. YDZJ202301ZYTS461). Мы благодарим компанию Bullet Edits Limited за лингвистическое редактирование и корректуру рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| CaCl22H2O | Sigma | C7902 | Preparation of CZB |
| Glucose | Sigma | G6152 | Preparation of CZB |
| HEPES-Na (basic) | Sigma | H3784 | Preparation of CZB |
| Hoechst 33342 | Beyotime | C1025 | FACS |
| human chorionic gonadotropin (HCG) | Ningbo Second Hormone Company | HCG | Ovulation promoting drugs |
| Hyaluronidase | Sigma | H3506 | Removing granulosa cells around the oocyte |
| KCl | Sigma | P5405 | Preparation of CZB |
| KH2PO4 | Sigma | P5655 | Preparation of CZB |
| KSOMaa | Caisson Labs | IVL04-100ML | Potassium simplex optimized medium supplemented with amino acids |
| L-glutamine | Sigma | G8540 | Preparation of CZB |
| M2 | Sigma | M7167-50ML | Operating fluid |
| MgSO47H2O | Sigma | M1880 | Preparation of CZB |
| Na2-EDTA2H2O | Sigma | E5134 | Preparation of CZB |
| NaCl | Sigma | S5886 | Preparation of CZB |
| NaHCO3 | Sigma | S5761 | Preparation of CZB |
| Na-lactate 60% syrup d = 1.32 g/L | Sigma | L7900 | Preparation of CZB |
| Na-pyruvate | Sigma | P4562 | Preparation of CZB |
| Piezo drill tips (ICSI) | Eppendorf | piezoXpert | Piezoelectric membrane rupture |
| pregnant mare serum gonadotropin (PMSG) | Ningbo Second Hormone Company | PMSG | Ovulation promoting drugs |
| PVA | Sigma | P8136 | Preparation of CZB |
Ссылки
- Redgrove, K. A., McLaughlin, E. A. The role of the immune response in Chlamydia trachomatis infection of the male genital tract: A double-edged sword. Front Immunol. 5, 534(2014).
- Yanagimachi, R. Intracytoplasmic injection of spermatozoa and spermatogenic cells: Its biology and applications in humans and animals. Reprod Biomed Online. 10 (2), 247-288 (2005).
- Palermo, G., Joris, H., Devroey, P., Van Steirteghem, A. C. Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte. Lancet. 340 (8810), 17-18 (1992).
- Kimura, Y., Yanagimachi, R. Mouse oocytes injected with testicular spermatozoa or round spermatids can develop into normal offspring. Development. 121 (8), 2397-2405 (1995).
- Tesarik, J., et al. Spermatid injection into human oocytes. II. Clinical application in the treatment of infertility due to non-obstructive azoospermia. Human Reprod. 11 (4), 780-783 (1996).
- Tesarik, J., Mendoza, C. Spermatid injection into human oocytes. I. Laboratory techniques and special features of zygote development. Human Reprod. 11 (4), 772-779 (1996).
- Hirabayashi, M., et al. Activation regimens for full-term development of rabbit oocytes injected with round spermatids. Mol Reprod Dev. 76 (6), 573-579 (2009).
- Ogonuki, N., et al. Birth of a marmoset following injection of elongated spermatid from a prepubertal male. Mol Reprod Dev. 86 (8), 928-930 (2019).
- Niederberger, C., et al. Forty years of IVF. Fertil Steril. 110 (2), 185(2018).
- Gross, K. X., Hanson, B. M., Hotaling, J. M. Round spermatid injection. Urol Clin North Am. 47 (2), 175-183 (2020).
- Hanson, B. M., et al. Round spermatid injection into human oocytes: a systematic review and meta-analysis. Asian J Androl. 23 (4), 363-369 (2021).
- Tekayev, M., Vuruskan, A. K. Clinical values and advances in round spermatid injection (ROSI). Reprod Biol. 21 (3), 100530(2021).
- Tanaka, A., et al. Fourteen babies born after round spermatid injection into human oocytes. Proc Natl Acad Sci U S A. 112 (47), 14629-14634 (2015).
- Tanaka, A., et al. Ninety babies born after round spermatid injection into oocytes: survey of their development from fertilization to 2 years of age. Fertil Steril. 110 (3), 443-451 (2018).
- Yang, H., Shi, L., Chen, C. D., Li, J. Mice generated after round spermatid injection into haploid two-cell blastomeres. Cell Res. 21 (5), 854-858 (2011).
- Moreira, P., et al. Transgenic mouse offspring generated by ROSI. J Reprod Dev. 62 (1), 37-42 (2016).
- Federici, F., et al. Round spermatid injection rescues female lethality of a paternally inherited Xist deletion in mouse. PLoS Genet. 12 (10), e1006358(2016).
- Sakamoto, M., et al. Paternally inherited H3K27me3 affects chromatin accessibility in mouse embryos produced by round spermatid injection. Development. 149 (18), 200696(2022).
- Wang, J., et al. Single-cell multiomics sequencing reveals the reprogramming defects in embryos generated by round spermatid injection. Sci Adv. 8, (2022).
- Ward, M. A., Yanagimachi, R. Intracytoplasmic sperm injection in mice. Cold Spring Harb Protoc. 2018 (1), (2018).
- Yoshida, N., Perry, A. C. Piezo-actuated mouse intracytoplasmic sperm injection (ICSI). Nat Protoc. 2 (2), 296-304 (2007).
- Zhu, L., et al. FACS selection of valuable mutant mouse round spermatids and strain rescue via round spermatid injection. Zygote. 23 (3), 336-341 (2013).
- Kong, P., et al. Effects of the histone deacetylase inhibitor 'Scriptaid' on the developmental competence of mouse embryos generated through round spermatid injection. Hum Reprod. 32 (1), 76-87 (2017).
- Hosseini, S., Salehi, M. Tricostatin A-treated round spermatid enhances preimplantation embryo developmental competency following round spermatid injection in mice. Zygote. 30 (3), 373-379 (2022).
- Kishigami, S., Wakayama, S., Nguyen, V. T., Wakayama, T. Similar time restriction for intracytoplasmic sperm injection and round spermatid injection into activated oocytes for efficient offspring production. Biol Reprod. 70 (6), 1863-1869 (2004).
- Tao, Y. Oocyte activation during round spermatid injection: state of the art. Reprod Biomed Online. 45 (2), 211-218 (2022).
- Ogura, A., Ogonuki, N., Miki, H., Inoue, K. Microinsemination and nuclear transfer using male germ cells. Int Rev Cytol. 246, 189-229 (2005).
- Kimura, Y., Yanagimachi, R. Intracytoplasmic sperm injection in the mouse. Biol Reprod. 52 (4), 709-720 (1995).
- Ogonuki, N., et al. A high-speed congenic strategy using first-wave male germ cells. PLoS One. 4 (3), e4943(2009).
- Abdelaal, O., et al. Fertility preservation for pediatric male cancer patients: illustrating contemporary and future options; a case report. Transl Androl Urol. 10 (1), 520-526 (2021).
- Eyni, H., et al. Advanced bioengineering of male germ stem cells to preserve fertility. J Tissue Eng. 12, (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены