Method Article
Inyección de espermatida redonda de ratón
En este artículo
Resumen
Aquí, presentamos un método para realizar la inyección redonda de espermatida (ROSI) en ratones, una técnica con aplicaciones clínicas prometedoras y utilidad para investigar los mecanismos subyacentes al desarrollo embrionario.
Resumen
Las espermátidas redondas, caracterizadas por su contenido genético haploide, representan las células precursoras de los espermatozoides maduros. A través de la innovadora técnica de inyección redonda de espermatida (ROSI), los ovocitos pueden fertilizarse con éxito y convertirse en fetos viables. En un hito revolucionario logrado en 1995, nació el primer feto de ratón gracias a la tecnología ROSI. Desde entonces, ROSI se ha convertido en una herramienta fundamental para desentrañar los intrincados mecanismos que rigen el desarrollo embrionario y tiene un potencial significativo en diversas aplicaciones, incluida la aceleración de la generación de ratones y la producción de ratones modificados genéticamente. En 1996, se alcanzó un hito cuando nació el primer feto humano a través de la tecnología ROSI. Sin embargo, las aplicaciones clínicas de este método han mostrado un patrón fluctuante de éxito y fracaso. Hasta la fecha, la tecnología ROSI no ha encontrado una aplicación generalizada en la práctica clínica, principalmente debido a su baja eficiencia en el parto y a la insuficiente validación de la seguridad fetal. Este artículo proporciona una descripción completa de los métodos precisos de realización de ROSI en ratones, con el objetivo de arrojar nueva luz sobre la investigación básica y sus posibles aplicaciones clínicas.
Introducción
La etapa final de la espermatogénesis implica la transformación de una espermatida redonda en un espermatozoide completamente desarrollado, caracterizadopor estructuras distintas de cabeza, cuello y cola alargada. Esta transformación abarca cambios significativos en la morfología celular, como la condensación de la cromatina en el núcleo, el reemplazo de histonas por protamina, la formación de acrosomas, el desarrollo de la vaina mitocondrial, la migración y pérdida de centriolos, la formación de la estructura de la cola y la eliminación de residuos celulares2.
En 1992, el primer feto humano nació con éxito gracias a la tecnología de inyección intracitoplasmática de espermatozoides (ICSI)3. Desde entonces, los investigadores han estado explorando el potencial de utilizar espermátidas redondas, que comparten la misma composición genética haploide que los espermatozoides maduros, para fertilizar ovocitos y mantener embarazos viables 2,4. Posteriormente, en 1996, nació el primer feto humano concebido mediante la tecnología de inyección redonda de espermatida (ROSI) 5,6. Vale la pena señalar que los estudios que involucraron ICSI y ROSI en ratones quedaron rezagados con respecto a los de humanos debido a la susceptibilidad de la membrana del ovocito de ratón al daño durante el proceso de inyección. Este problema se resolvió con éxito con la introducción del dispositivo de ruptura de membrana piezoeléctrica. Así, en 1995 nació el primer ratón concebido a través de la tecnología ROSI. Además, también se están llevando a cabo investigaciones sobre el ROSI en otros animales 7,8.
Actualmente, la investigación sobre ROSI se centra principalmente en los siguientes aspectos: aplicación clínica, elucidación de mecanismos y estrategias para mejorar la eficiencia del desarrollo, junto con aplicaciones más amplias de la tecnología ROSI. En el contexto de las aplicaciones clínicas, a pesar del nacimiento del primer feto humano ROSI a través de ROSI en 1996, el progreso ha estado marcado por una serie de éxitos y fracasos 9,10,11,12. Hasta la fecha, la tecnología ROSI no ha logrado una implementación clínica generalizada, en gran parte debido a su baja eficiencia y a la necesidad de una mayor validación con respecto a la seguridad de los fetos concebidos a través de la tecnología ROSI. Las estadísticas incompletas indican que, a nivel mundial, se han dado a luz menos de 200 fetos humanos concebidos por ROSI. Un punto de inflexión en la comprensión del potencial de la tecnología ROSI ocurrió en 2015 cuando Tanaka y sus colegas informaron sobre el nacimiento exitoso de 14 fetos a través de la tecnología ROSI, infundiendo una confianza renovada en su aplicación clínica y factibilidad13,14. La tecnología ROSI es muy prometedora para abordar los desafíos de la biología reproductiva, particularmente en pacientes con azoospermia no obstructiva. Además de sus aplicaciones clínicas, ROSI sirve como una herramienta valiosa para estudiar los intrincados mecanismos del desarrollo embrionario 15,16,17.
Se han llevado a cabo numerosos estudios en animales para investigar los factores subyacentes que contribuyen a la baja eficiencia de ROSI para lograr el desarrollo embrionario completo. Estos factores abarcan la elección de los métodos de activación asistida de ovocitos (AOA) y sus momentos, las anomalías en la estabilidad genómica y, en particular, las anomalías en las modificaciones epigenéticas. Es importante reconocer que las espermátidas redondas son células germinales inmaduras, que difieren significativamente de los espermatozoides maduros en varios aspectos fisiológicos. Mizuki Sakamoto y sus colegas indicaron que H3K27me3, derivado de espermátidas redondas, está asociado con la cromatina que es menos accesible y conduce a una expresión génica alterada en los embriones ROSI18. En un estudio relacionado realizado por Jing Wang y sus colegas, los defectos de reprogramación en los embriones ROSI en las etapas pronucleares se asociaron predominantemente con la expresión errónea de una cohorte de los genes responsables de la activación menor del genoma cigótico19. También descubrieron que la introducción de un inhibidor selectivo de la histona eucromática lisina metiltransferasa 2, A366, podría mejorar la tasa de desarrollo general aproximadamente dos veces.
El ratón se erige como uno de los animales modelo más valiosos para el estudio del desarrollo embrionario. Este artículo explica cómo realizar el ROSI en ratones. Este protocolo integral abarca la selección de ratones adecuados, procedimientos detallados de inducción de la ovulación, técnicas de AOA, técnicas de inyección y la preparación de ratones sustitutos. Además, presentamos un análisis comparativo de los efectos de dos regímenes de inyección sobre la eficiencia del parto: AOA seguido de ROSI (A-ROSI; primer régimen) y ROSI seguido de AOA (ROSI-A; segundo régimen). Nuestro objetivo es animar a los investigadores a realizar experimentos con ROSI en ratones con mayor precisión, ofreciendo un apoyo más sólido para su aplicación clínica y la investigación fundamental de los mecanismos de desarrollo embrionario.
Protocolo
Los ratones B6D2F1 (C57BL/6 x DBA/2), C57BL/6 e ICR utilizados en este experimento se compraron a Beijing Vital River Laboratory Animal Technologies Co. Ltd. (Beijing, China). Todos los tratamientos con animales se adhirieron a los procedimientos y estándares experimentales aprobados por el Comité de Ética de Animales Experimentales del Primer Hospital de la Universidad de Jilin (número de aprobación: 20200435).
1. Preparación de los reactivos pertinentes
- Adquiera algunos reactivos comercialmente y prepare usted mismo los reactivos restantes.
- Obtenga M2, un sistema tampón para el procesamiento in vitro de espermátidas redondas (RS), espermatozoides y ovocitos del proveedor.
- Prepare el medio C.L. Chatot, C.A. Ziomek y B.D. Bavister (CZB) libre de Ca2+ para AOA siguiendo el protocolo20 publicado anteriormente.
- Obtenga la solución de medio optimizado de potasio simple suplementado con aminoácidos (KSOMaa) para el cultivo de embriones del proveedor.
- Preparar hialuronidasa, con una concentración de trabajo del 0,1% (1 g/L), disolviendo 0,1 g de hialuronidasa en 1 mL de agua embrionaria. Tomar 10 μL de solución concentrada de almacenamiento y disolver en 990 mL deM2, que podría almacenarse a 4 °C durante 1 semana.
- Preparar polivinilpirrolidona (PVP), con un peso molecular medio de 360.000 y una concentración másica del 12%, disolviendo 1,2 g de PVP en 10 mL deM2. La solución resultante podría almacenarse a 4 °C durante 1 semana.
- Almacene la solución madre de citocalasina B (CB) (2 μL), soluble en 18 μL de DMSO a -20 °C. Tome 5 μL de la solución concentrada de almacenamiento y disuelva en 995 mL deM2. La solución resultante podría almacenarse a 4 °C durante 1 semana.
2. Preparación de ovocitos
- Aclimatar ratones hembra B6D2F1, de 6 a 8 semanas, a su nuevo entorno durante al menos 1 semana. Inyectar por vía intraperitoneal 7,5 UI de gonadotropina sérica (PMSG) de yegua preñada a las 17 horas, seguido de 7,5 UI de gonadotropina coriónica humana (HCG) 48 h después. Asegúrese de que no haya contacto con ratones macho después de la inyección.
NOTA: La hora especificada (5 pm) no es obligatoria. Es solo por conveniencia laboral. Las 14 horas posteriores a las 5 pm son las 7 am, cuando los ovocitos están listos, y se realiza la inyección, por lo que la hora de la inyección está programada para la mañana. La hora de inicio de la inyección se puede ajustar de acuerdo con el horario diario del laboratorio. - Después de 14 h de inyección de HCG, eutanasiar a los ratones utilizando el método de luxación cervical. Abre la cavidad abdominal y localiza el útero. Identifique los ovarios a lo largo del útero y corte las trompas de Falopio cerca de los ovarios con unas tijeras. Repita el mismo procedimiento en el otro lado y coloque las trompas de Falopio en M2, que se precalienta a 37 °C con anticipación.
- Bajo un microscopio vertical (10x), localice la parte agrandada de la trompa de Falopio, que muestra un aspecto transparente e hinchado. Utilice una jeringa de 1 ml para asegurar la trompa de Falopio mientras corta la parte agrandada, recogiendo los complejos de cúmulos coronales de los ovocitos (OCCC).
- Coloque los OCCC en la solución operativa M2 precalentada que contiene un 0,1 % de hialuronidasa y elimine las células de la granulosa soplando suavemente a través de una pipeta oral.
NOTA: Mantenga los OCCC en hialuronidasa al 0,1% durante un corto período, aproximadamente 2 minutos, si es necesario. - Después de extraer las células de la granulosa, transfiera el ovocito a KSOMaa, enjuague 3 veces y colóquelo en una incubadora de dióxido de carbono para su uso posterior (37 °C, 5% CO2).
3. Preparación de espermátidas redondas y espermatozoides.
- Recolecta espermátidas redondas y espermatozoides de los testículos y el epidídimo de ratones machos C57BL/6 (8-10 semanas), respectivamente.
- En el caso de los espermatozoides, se practica la eutanasia a los ratones mediante dislocación cervical. Abra la cavidad abdominal, ubique el epidídimo cerca del testículo y extirpe suavemente con unas tijeras.
- Coloque el epidídimo en medio M2 y extirpe suavemente con una jeringa de 1 ml para permitir que los espermatozoides fluyan bajo un microscopio vertical (10x).
- Sifón los espermatozoides que fluyen y la suspensión deM2 en el fondo de un tubo que contenga 0,5 mL deM2, permitiendo que los espermatozoides fluyan aguas arriba de forma natural. Déjalos a un lado para usarlos más tarde.
- Para espermátidas redondas, retire los testículos de la cavidad abdominal y colóquelos en M2. Corte suavemente la membrana blanca con una jeringa de 1 mL y exprima los túbulos seminíferos contorneados bajo un microscopio vertical (10x).
- Extirpar los túbulos seminíferos cuidadosamente con dos jeringas de 1 mL. Extraiga la suspensión y el filtro con un tamiz de malla 400 (38 μm).
- Centrifugar las células filtradas, desechar el sobrenadante y añadir 200 μL de Hoechst 33342 para la tinción, seguido de la incubación a 37 °C durante 10 min.
- Realizar la clasificación de células activadas por fluorescencia (FACS) para distinguir las espermátidas redondas de otros tipos de células. Coloque las células teñidas en un tubo de citometría de flujo y realice un cribado redondo de espermatidas.
- Los diferentes modelos de máquinas de citometría de flujo tienen diferentes parámetros regulatorios y se pueden comunicar con el soporte técnico durante la operación. Como primer paso, ajuste el voltaje y seleccione la población de celdas de acuerdo con la dispersión directa (FSS) y la dispersión lateral (SSC; consulte la Tabla complementaria 1).
- Para el segundo paso, elimine las adherencias de las células de acuerdo con FSC y active el ancho de pulso.
- Como tercer paso, seleccione las espermátidas redondas haploides objetivo. Hoechst 33342 se une al ADN, y las células con diferente ploidía exhiben diferentes intensidades de fluorescencia. Establezca la longitud de onda de excitación en 355. Seleccione dos canales de detección, 460/50 y 670/30, bajo un láser de longitud de onda de 355 para clasificar las espermátidas redondas. A continuación, almacene las espermátidas redondas clasificadas en un frigorífico a 4 °C para su uso posterior.
NOTA: También es posible seleccionar directamente espermátidas redondas en función de su morfología bajo un microscopio, pero se requiere capacitación para garantizar la precisión de la selección.
4. Inyección redonda de espermatida (ROSI)
- Realizar el procedimiento ROSI utilizando un microscopio invertido con un sistema de micromanipulación.
- En la etapa inicial de preparación, realice las agujas de sujeción e inyección de acuerdo con el procedimiento descrito anteriormente21. Mantenga el diámetro interior de la aguja de inyección entre 6-7 μm, diseñada para la extracción de espermátidas redondas, y para la aguja de sujeción, tenga un diámetro interior de 20 μm para asegurar el ovocito.
- En el siguiente paso de preparación, cree un recipiente de inyección colocando 10 μL de gotas M2 que contengan CB para ablandar los ovocitos y 10 μL de gotas M2 para almacenar espermátidas redondas. Utilice gotas de PVP para humedecer y limpiar las agujas de inyección.
NOTA: Agregar CB aquí no es un paso necesario, pero agregar CB puede mejorar en gran medida la tasa de supervivencia después de la inyección. - Extrae las espermátidas redondas con una aguja de inyección.
- Gire el ovocito con una aguja de sujeción, colocando el cuerpo polar del ovocito en la posición de las 12 o las 6 en punto.
- Coloque la aguja de inyección con cuidado en la posición de las 3 en punto del ovocito, adhiriéndose firmemente a la zona pelúcida. Utilice un dispositivo PiezoXpert para crear un agujero en la zona pelúcida. Ajuste la fuerza de pequeña a grande, que es aproximadamente intensidad = 5 y velocidad = 15 aquí.
- Avance suavemente la aguja de inyección a través de la zona pelúcida e introduzca el ovocito horizontalmente. Cuando pase por el centro del ovocito, aplique un piezoeléctrico (intensidad = 1 y velocidad = 1), lo que provoca la ruptura de la membrana del ovocito y la inyección gradual de la espermatida redonda en el citoplasma del ovocito.
- Retire la aguja de inyección y aspire una pequeña cantidad de la membrana del ovocito cerca de la abertura para sellarla. Este paso es crucial, ya que si no se sella, se produciría una fuga citoplasmática y la muerte del ovocito.
NOTA: Vale la pena señalar que ROSI requirió AOA antes o después de la inyección de espermátidas redondas, lo cual hemos discutido en secciones posteriores.
5. Inyección intracitoplasmática de espermatozoides (ICSI)
- Realice los mismos pasos para ICSI que para ROSI, con la única diferencia de que el diámetro de la aguja de inyección ICSI, que mide 9-10 μm.
- Coloque los espermatozoides en una pista PVP para reducir su velocidad de natación y facilitar la extracción de espermatozoides.
- Realizar la separación de la cabeza y la cola de los espermatozoides para la ICSI. Aspire los espermatozoides desde la cola y coloque el cuello de los espermatozoides con precisión en la boca de la aguja de inyección. Aplique un piezoeléctrico (se pueden usar varios piezoeléctricos según sea necesario, intensidad = 5 y velocidad = 15) para separar la cabeza y la cola de los espermatozoides.
6. Activación asistida de ovocitos (AOA)
- De acuerdo con el protocolo, prepare un medio CZB sin calcio y magnesio.
- Utilizar cloruro de estroncio hexahidratado (SrCl26H2O), con un peso molecular de 266,62, a una concentración de 10 mM. Para prepararlo, disuelva 0,26662 g de SrCl26H2O en 1 mL de agua embrionaria. En el momento de su uso, agregue 10 μL de solución de almacenamiento concentrada a 990 μL de medio CZB libre de Ca2+ y úselo inmediatamente.
- Colocar los ovocitos en el medio CZB libre de Ca2+ que contiene SrCl26H2O para su activación; cada gota tiene un volumen de 20 μL, y se colocan 20 ovocitos cada vez. Incubar durante 20 min.
- Al mismo tiempo, establecer un grupo para la activación de la partenogénesis sin inyectar espermátidas redondas o espermatozoides. Cabe destacar que el grupo de activación de partenogénesis se muestra sin análisis estadístico, y el grupo control es ICSI.
7. Transferencia embrionaria
- Aloje los ratones macho y hembra ICR ligados en una proporción de 1:2. A la mañana siguiente, examine a los ratones hembra para detectar la presencia de un tapón vaginal y seleccione aquellos con un tapón vaginal para el trasplante.
- Inyecte los embriones transferidos que consisten en embriones de 2 células la mañana anterior y transfiéralos la tarde siguiente.
- Haga una incisión en el dorso de la ratona hembra, exponga la grasa blanca y los ovarios, y localice la parte agrandada de la trompa de Falopio bajo un microscopio vertical (10x).
- Utilice una jeringa de 1 ml para crear una abertura en la parte agrandada de la trompa de Falopio y aspire los embriones a través de una pipeta oral. Introducir suavemente los embriones en dirección al útero. Suturar la herida, utilizando modelos 4 x 10 de agujas curvas con hilo, con un grosor de 5-0 (0,09-0,11 mm). La sutura se realiza en dos capas, con una capa para el peritoneo y otra para la piel externa.
- En el caso de los ratones sustitutos, realice cesáreas según el calendario experimental. Eutanasia a los ratones mediante el método de luxación cervical, desinfectar con alcohol y abrir la cavidad abdominal. Abra el útero de manera suave y rápida y abra la cavidad amniótica para mostrar el feto y la placenta. Retire el cordón umbilical y corte desde el lado cercano al feto; El feto fue alimentado por el mismo período de ratones lactantes.
NOTA: Debido a la necesidad de calcular las tasas de natalidad, la cesárea es más precisa en cuanto a la capacidad de producción. En el parto natural, las crías pueden ser devoradas por la madre, lo que da lugar a estadísticas inexactas. La cesárea se realiza en ratones sustitutos trasplantados en la etapa temprana, y la cesárea con eutanasia se realiza antes del parto.
8. Análisis estadístico
- Utilice GraphPad Prism 5 para analizar. Los datos se expresan en media ± DE; P < 0,05 indica una diferencia estadística y P < 0,01 indica una diferencia estadística significativa.
Resultados
Comenzamos nuestra investigación examinando el efecto de AOA en la capacidad de desarrollo de los embriones. En la Figura 1A se muestra una ilustración esquemática del diseño experimental. Antes de la inyección de espermatozoides, los ovocitos se sometieron a AOA (A-ICSI) o permanecieron sin tratamiento (ICSI). En la Tabla 1 se presentan datos detallados sobre el desarrollo embrionario. Los resultados no revelaron diferencias significativas en las tasas de escisión, blastocisto o natalidad entre los grupos A-ICSI e ICSI (P > 0,05; Figura 1B). Estos hallazgos indican que el uso de AOA 10 mM SrCl2 durante 20 min no afectó el potencial de desarrollo de los embriones.
Anteriormente se informó que no había diferencias perceptibles en la eficiencia del desarrollo de los embriones ROSI seleccionados por FACS o por examen visual directo bajo un microscopio22. Nuestros experimentos emplearon la tecnología FACS para identificar RS (Figuras 2A,B). Bajo el microscopio, las espermátidas redondas de ratón tenían aproximadamente 10 μm de diámetro y mostraban una estructura de nucléolo similar a una protuberancia en el centro (Figura 2C). Postulamos que la selección a través de FACS es más precisa que el examen visual directo bajo un microscopio. Además, la literatura apoya la exploración directa de las RS a través de las diferencias morfológicas. Los embriones ROSI se generaron utilizando dos métodos distintos: el grupo A-ROSI, en el que los ovocitos se sometieron a AOA antes de la inyección redonda de espermatida, y el grupo ROSI-A, en el que los ovocitos se sometieron a AOA después de la inyección redonda de espermatida. El diagrama esquemático del diseño experimental se muestra en la Figura 1C. Cabe destacar que no se encontraron diferencias significativas en las tasas de escisión y blastocisto entre los grupos A-ROSI, ROSI-A e ICSI (P > 0,05; Figura 1D). Las tasas de blastocisto de los grupos A-ROSI, ROSI-A e ICSI fueron significativamente más altas que las del grupo de activación (P < 0,05; Figura 1D). Sin embargo, la tasa de natalidad del grupo ROSI fue menor que la del grupo ICSI, independientemente de si los ovocitos se activaron antes o después de la inyección (P < 0,05; Figura 1D). Es importante destacar que la tasa de natalidad del grupo A-ROSI fue ligeramente superior a la del grupo ROSI-A (Figura 1D). En la Tabla 1 se presentan más detalles sobre los datos de desarrollo embrionario.
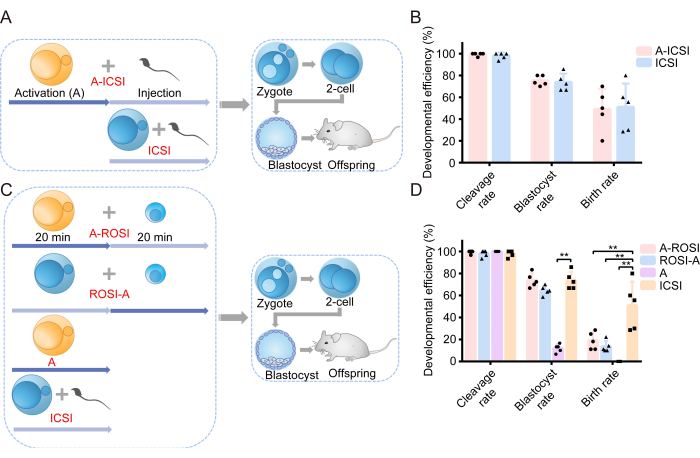
Figura 1: Los embriones ROSI mostraron una eficiencia de desarrollo reducida en comparación con los embriones ICSI. (A) Ilustración esquemática del protocolo experimental que evalúa el efecto de la activación en el desarrollo embrionario ICSI. Azul = Los ovocitos no estaban activados; Amarillo = Los ovocitos estaban activados. (B) Eficiencia en el desarrollo de embriones derivados de A-ICSI e ICSI. (C) Ilustración esquemática del protocolo experimental para la generación de diferentes tipos de embriones. (D) Eficiencia en el desarrollo de embriones derivados de A-ROSI, ROSI-A, A e ICSI. **, P < 0,01. Abreviaturas: A= Activación E= Día embrionario; ROSI= Inyección redonda de espermatida; ICSI= Inyección intracitoplasmática de espermatozoides. Las barras de error muestran la desviación estándar. La comparación de tasas se realiza mediante la prueba de chi-cuadrado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Las espermátidas redondas se seleccionaron mediante clasificación por citometría de flujo. (A) Se utilizó un diagrama de clasificación por citometría de flujo para la selección de espermátidas redondas. (B) Imágenes representativas que muestren la selección de espermátidas redondas. Barra de escala: 10 μm. Abreviaturas: FSC = Dispersión directa; SSC = dispersión lateral; 355 es la longitud de onda de excitación; 460/50 y 670/30 son dos canales de detección bajo láser de 355 longitudes de onda. Haga clic aquí para ver una versión más grande de esta figura.
| Grupos | Desarrollo preimplantacional | Desarrollo post-implantación | |||
| Replica | Tasa de escisión (%) | Tasa de blastocisto (%) | Embriones de 2 células transferidos/ No. de los destinatarios | Tasa de natalidad (%) | |
| A-ICSI | 5 | 99.33 (149/150) | 75.17 (112/149) | 49/5 | 48.98 (24/49) |
| A-ROSI | 5 | 99.33 (149/150) | 73.83 (110/149) | 44/5 | 18.18 (8/44) ** |
| ROSI-A | 5 | 98.00 (147/150) | 64.63 (95/147) | 45/5 | 13.33 (6/45) ** |
| Activación | 5 | 100.00 (150/150) | 12.00 (18/150) ** | 51/5 | 0.00 (0/51) ** |
| ICSI | 5 | 98.00 (147/150) | 73.47 (108/147) | 46/5 | 52.17 (24/46) |
Tabla 1. La eficiencia del desarrollo de embriones derivados de diferentes grupos.
Tabla complementaria 1. Proporción de diferentes poblaciones celulares ordenadas por citometría de flujo. La parte P3 son espermátidas redondas. Haga clic aquí para descargar este archivo.
Discusión
Activación asistida de ovocitos
Un requisito previo crítico para ROSI es AOA, ya que las espermátidas redondas por sí solas no pueden iniciar la activación de los ovocitos. En la actualidad, el método más establecido en ratones implica el uso de cloruro de estroncio23,24, mientras que la aplicación humana más avanzada emplea la activación eléctrica13,14. El momento de la activación de los ovocitos también es de gran importancia. Como se ha reportado en la literatura, el enfoque de activación más óptimo en ratones implica activar inicialmente el ovocito y luego inyectar la espermatida redonda25. Esto contrasta con el proceso de fecundación convencional, en el que los espermatozoides entran inicialmente en los ovocitos, liberando posteriormente fosfolipasa C ζ activar el ovocito26. La investigación especializada llevada a cabo por Satoshi Kishigami y sus colegas enfatiza la capacidad diferencial de ROSI para formar un núcleo masculino en ovocitos pre o post-activados. Para lograr una tasa de producción eficiente de descendencia, ambos tipos de inyección deben realizarse antes de que los ovocitos entren en la fase G125.
El diámetro de la aguja de inyección
En el contexto de ROSI, es importante tener en cuenta que un diámetro mayor de la aguja de inyección no se traduce necesariamente en mejores resultados. La aguja de inyección utilizada tiene un diámetro de 6-7 μm, ligeramente más pequeño que una espermátida redonda. Por lo tanto, cuando se aspira una espermatida redonda, la membrana celular se somete a un efecto de compresión, lo que puede conducir a la exposición directa del núcleo. Esta exposición directa puede ser propicia para la despolimerización y la posterior formación del pronúcleo masculino27.
Tratamiento de sellado
Los ovocitos de ratón exhiben menos viscosidad citoplasmática en comparación con otras especies. Incluso una pequeña brecha en la membrana celular puede hacer que el citoplasma fluya fácilmente, lo que resulta en la degeneración de los ovocitos28. Para mitigar el riesgo, después de inyectar la espermatida redonda en el citoplasma del ovocito y retirar la aguja de inyección, es imperativo aspirar una pequeña porción de la membrana celular cerca de la abertura de la membrana celular del ovocito para sellar el espacio, similar al procedimiento en ICSI21. Este proceso de sellado reduce significativamente el riesgo de degeneración de los ovocitos.
Aplicación de ROSI como modelo
Más allá de las aplicaciones clínicas, la tecnología ROSI tiene como modelo otras aplicaciones. Puede acelerar la generación de ratones29 veces, rescatar la letalidad femenina resultante de una deleción de Xist heredada por el padre en ratones17, generar ratones después de la inyección redonda de espermatida en blastómeros partenogenéticos haploide de dos células15, generar descendencia de ratones transgénicos16 y preservar la fertilidad en niños adolescentes antes del tratamiento contra el cáncer30,31. La investigación diligente sobre el ROSI del ratón puede contribuir sustancialmente a los avances en la investigación de la salud reproductiva.
Limitaciones del artículo
Este artículo sirve como una guía metodológica con varias limitaciones, incluyendo la ausencia de una selección comparativa directa de RS bajo un microscopio para inyección y una falta de innovación percibida.
Divulgaciones
Los autores declaran no tener conflictos de intereses financieros o de otro tipo.
Agradecimientos
Extendemos nuestro agradecimiento a Wenjie Zhao por su inestimable ayuda en la clasificación de espermátidas redondas a través de la citometría de flujo y a Fang Wang por su experiencia en la transferencia de embriones de ratón. Este trabajo recibió apoyo parcial de la Fundación de Ciencias Naturales de la Provincia de Jilin (No. YDZJ202301ZYTS461). Agradecemos a Bullet Edits Limited por la edición lingüística y la revisión del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| CaCl22H2O | Sigma | C7902 | Preparation of CZB |
| Glucose | Sigma | G6152 | Preparation of CZB |
| HEPES-Na (basic) | Sigma | H3784 | Preparation of CZB |
| Hoechst 33342 | Beyotime | C1025 | FACS |
| human chorionic gonadotropin (HCG) | Ningbo Second Hormone Company | HCG | Ovulation promoting drugs |
| Hyaluronidase | Sigma | H3506 | Removing granulosa cells around the oocyte |
| KCl | Sigma | P5405 | Preparation of CZB |
| KH2PO4 | Sigma | P5655 | Preparation of CZB |
| KSOMaa | Caisson Labs | IVL04-100ML | Potassium simplex optimized medium supplemented with amino acids |
| L-glutamine | Sigma | G8540 | Preparation of CZB |
| M2 | Sigma | M7167-50ML | Operating fluid |
| MgSO47H2O | Sigma | M1880 | Preparation of CZB |
| Na2-EDTA2H2O | Sigma | E5134 | Preparation of CZB |
| NaCl | Sigma | S5886 | Preparation of CZB |
| NaHCO3 | Sigma | S5761 | Preparation of CZB |
| Na-lactate 60% syrup d = 1.32 g/L | Sigma | L7900 | Preparation of CZB |
| Na-pyruvate | Sigma | P4562 | Preparation of CZB |
| Piezo drill tips (ICSI) | Eppendorf | piezoXpert | Piezoelectric membrane rupture |
| pregnant mare serum gonadotropin (PMSG) | Ningbo Second Hormone Company | PMSG | Ovulation promoting drugs |
| PVA | Sigma | P8136 | Preparation of CZB |
Referencias
- Redgrove, K. A., McLaughlin, E. A. The role of the immune response in Chlamydia trachomatis infection of the male genital tract: A double-edged sword. Front Immunol. 5, 534 (2014).
- Yanagimachi, R. Intracytoplasmic injection of spermatozoa and spermatogenic cells: Its biology and applications in humans and animals. Reprod Biomed Online. 10 (2), 247-288 (2005).
- Palermo, G., Joris, H., Devroey, P., Van Steirteghem, A. C. Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte. Lancet. 340 (8810), 17-18 (1992).
- Kimura, Y., Yanagimachi, R. Mouse oocytes injected with testicular spermatozoa or round spermatids can develop into normal offspring. Development. 121 (8), 2397-2405 (1995).
- Tesarik, J., et al. Spermatid injection into human oocytes. II. Clinical application in the treatment of infertility due to non-obstructive azoospermia. Human Reprod. 11 (4), 780-783 (1996).
- Tesarik, J., Mendoza, C. Spermatid injection into human oocytes. I. Laboratory techniques and special features of zygote development. Human Reprod. 11 (4), 772-779 (1996).
- Hirabayashi, M., et al. Activation regimens for full-term development of rabbit oocytes injected with round spermatids. Mol Reprod Dev. 76 (6), 573-579 (2009).
- Ogonuki, N., et al. Birth of a marmoset following injection of elongated spermatid from a prepubertal male. Mol Reprod Dev. 86 (8), 928-930 (2019).
- Niederberger, C., et al. Forty years of IVF. Fertil Steril. 110 (2), 185 (2018).
- Gross, K. X., Hanson, B. M., Hotaling, J. M. Round spermatid injection. Urol Clin North Am. 47 (2), 175-183 (2020).
- Hanson, B. M., et al. Round spermatid injection into human oocytes: a systematic review and meta-analysis. Asian J Androl. 23 (4), 363-369 (2021).
- Tekayev, M., Vuruskan, A. K. Clinical values and advances in round spermatid injection (ROSI). Reprod Biol. 21 (3), 100530 (2021).
- Tanaka, A., et al. Fourteen babies born after round spermatid injection into human oocytes. Proc Natl Acad Sci U S A. 112 (47), 14629-14634 (2015).
- Tanaka, A., et al. Ninety babies born after round spermatid injection into oocytes: survey of their development from fertilization to 2 years of age. Fertil Steril. 110 (3), 443-451 (2018).
- Yang, H., Shi, L., Chen, C. D., Li, J. Mice generated after round spermatid injection into haploid two-cell blastomeres. Cell Res. 21 (5), 854-858 (2011).
- Moreira, P., et al. Transgenic mouse offspring generated by ROSI. J Reprod Dev. 62 (1), 37-42 (2016).
- Federici, F., et al. Round spermatid injection rescues female lethality of a paternally inherited Xist deletion in mouse. PLoS Genet. 12 (10), e1006358 (2016).
- Sakamoto, M., et al. Paternally inherited H3K27me3 affects chromatin accessibility in mouse embryos produced by round spermatid injection. Development. 149 (18), 200696 (2022).
- Wang, J., et al. Single-cell multiomics sequencing reveals the reprogramming defects in embryos generated by round spermatid injection. Sci Adv. 8, (2022).
- Ward, M. A., Yanagimachi, R. Intracytoplasmic sperm injection in mice. Cold Spring Harb Protoc. 2018 (1), (2018).
- Yoshida, N., Perry, A. C. Piezo-actuated mouse intracytoplasmic sperm injection (ICSI). Nat Protoc. 2 (2), 296-304 (2007).
- Zhu, L., et al. FACS selection of valuable mutant mouse round spermatids and strain rescue via round spermatid injection. Zygote. 23 (3), 336-341 (2013).
- Kong, P., et al. Effects of the histone deacetylase inhibitor 'Scriptaid' on the developmental competence of mouse embryos generated through round spermatid injection. Hum Reprod. 32 (1), 76-87 (2017).
- Hosseini, S., Salehi, M. Tricostatin A-treated round spermatid enhances preimplantation embryo developmental competency following round spermatid injection in mice. Zygote. 30 (3), 373-379 (2022).
- Kishigami, S., Wakayama, S., Nguyen, V. T., Wakayama, T. Similar time restriction for intracytoplasmic sperm injection and round spermatid injection into activated oocytes for efficient offspring production. Biol Reprod. 70 (6), 1863-1869 (2004).
- Tao, Y. Oocyte activation during round spermatid injection: state of the art. Reprod Biomed Online. 45 (2), 211-218 (2022).
- Ogura, A., Ogonuki, N., Miki, H., Inoue, K. Microinsemination and nuclear transfer using male germ cells. Int Rev Cytol. 246, 189-229 (2005).
- Kimura, Y., Yanagimachi, R. Intracytoplasmic sperm injection in the mouse. Biol Reprod. 52 (4), 709-720 (1995).
- Ogonuki, N., et al. A high-speed congenic strategy using first-wave male germ cells. PLoS One. 4 (3), e4943 (2009).
- Abdelaal, O., et al. Fertility preservation for pediatric male cancer patients: illustrating contemporary and future options; a case report. Transl Androl Urol. 10 (1), 520-526 (2021).
- Eyni, H., et al. Advanced bioengineering of male germ stem cells to preserve fertility. J Tissue Eng. 12, (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados