Method Article
Genom Düzenleme ve İlaç Dağıtımı için Yenidoğan Farenin İntratekal Enjeksiyonu
Bu Makalede
Özet
Mevcut protokol, gen düzenleme ve ilaç dağıtımı için yenidoğan farelerde intratekal enjeksiyonların gerçekleştirilmesi için adım adım talimatları özetlemektedir.
Özet
İntratekal enjeksiyon, hem pediatrik hem de yetişkin kliniklerinde yaygın olarak kullanılan bir prosedürdür ve ilaç ve tedavileri uygulamak için etkili bir araç olarak hizmet eder. Bu yöntem, ilaçları ve tedavileri doğrudan merkezi sinir sisteminin beyin omurilik sıvısına vererek, intravenöz, deri altı veya kas içi enjeksiyonlar gibi diğer yollara kıyasla sistemik yan etkileri azaltırken daha yüksek lokalize ilaç konsantrasyonları sağlar. İntratekal enjeksiyon, kemirgenlerde ve insan olmayan primatlar da dahil olmak üzere diğer büyük hayvanlarda nörogenetik bozuklukların tedavisine odaklanan klinik öncesi çalışmalarda hayati bir rol oynadığından, önemi klinik ortamların ötesine uzanır. Bununla birlikte, yaygın olarak uygulanmasına rağmen, genç, özellikle yenidoğan yavrularda intratekal enjeksiyon, küçük boyutları ve kırılgan yapıları nedeniyle önemli teknik zorluklar doğurmaktadır. Yenidoğan farelerde intratekal enjeksiyonların başarılı ve güvenilir bir şekilde uygulanması, ayrıntılara titizlikle dikkat edilmesini ve çeşitli faktörlerin dikkatli bir şekilde değerlendirilmesini gerektirir. Bu nedenle, yalnızca talimatlar sağlamakla kalmayıp aynı zamanda prosedürel tutarlılığın yanı sıra hayvanların güvenliği ve refahını sağlamak için temel teknik hususları ve iyi laboratuvar uygulamalarını vurgulayan standart bir protokole çok önemli bir ihtiyaç vardır.
Bu karşılanmamış ihtiyacı karşılamak için, özellikle doğum sonrası 1. günde (P1) yenidoğan yavrularda intratekal enjeksiyonların gerçekleştirilmesi için ayrıntılı ve kapsamlı bir protokol sunuyoruz. Araştırmacılar, adım adım talimatları izleyerek, yenidoğan yavrularında intratekal enjeksiyonları güvenle gerçekleştirebilir ve gen replasmanı veya genom düzenlemeye dayalı tedaviler için ilaçların, antisens oligoların ve virüslerin doğru bir şekilde verilmesini sağlayabilir. Ayrıca, hayvanların refahını korumak ve güvenilir deney sonuçları sağlamak için iyi laboratuvar uygulamalarına bağlı kalmanın önemi vurgulanmaktadır. Bu protokol, yenidoğan farelerde intratekal enjeksiyonlarla ilgili teknik zorlukları ele almayı ve sonuçta potansiyel terapötik müdahaleler geliştirmeyi amaçlayan nörogenetik araştırma alanındaki ilerlemeleri kolaylaştırmayı amaçlamaktadır.
Giriş
İntratekal (IT) enjeksiyon, kliniklerde hem pediatrik hem de yetişkin hastalarda ilaç uygulamak, beyin omurilik sıvısı toplamak ve kafa içi basıncı korumak için kullanılan yaygın bir klinik prosedürdür 1,2. İlaçların intratekal enjeksiyon yoluyla uygulanması, sistemik maruziyeti en aza indirirken merkezi sinir sistemindeki (MSS) ilaç konsantrasyonlarını artırmak için etkili bir yaklaşımdır. Sonuç olarak, bu yöntem terapötik etkinliği arttırır ve özellikle sıcaklığa duyarlı ve kısa yarı ömürlü ilaçlar için yan etkileri azaltır3.
Kemirgen modelleri kullanılarak yeni ilaçları ve tedavileri test eden klinik öncesi çalışmalarda, daha fazla hassasiyet ve sonuç tekrarlanabilirliği sunan güvenilir bir ilaç uygulama yönteminin kullanılması zorunludur 4,5. Nörogenetik ve nörogelişimsel bozukluklar için yeni tedavileri değerlendiren klinik öncesi çalışmalar için, erken tedavi, ilk kavram kanıtlama çalışmaları için çok önemlidir, çünkü daha önceki müdahalelerin tipik olarak daha olumlu sonuçlar vereceği tahmin edilmektedir 6,7,8.
Konvansiyonel intraserebrovataküler (ICV) enjeksiyonlarla karşılaştırıldığında, BT enjeksiyonları serebral korteksten doğrudan penetrasyon ihtiyacını ortadan kaldırdığı için önemli ölçüde daha düşük riskler taşır. Bu avantaj, bölgesel kortikal dokuya ve çevresindeki sinirlere olası hasarı önemli ölçüde azaltır. Ayrıca, BT enjeksiyonları, tek bir enjeksiyonla uygulanabilir ilaç hacminde en az beş kat artışa izin vererek, tekrarlanan uygulamaların fizibilitesini büyük ölçüde artırır. Bununla birlikte, yenidoğan farelerin küçük boyutu ve kırılgan doğası nedeniyle, yenidoğan yavrularda intratekal enjeksiyonların yapılması teknik olarak zordur ve özel teknikler, ekipman ve titiz kullanım gerektirir.
Bu makale, P1 yenidoğan yavrularında intratekal enjeksiyonların gerçekleştirilmesi için adım adım talimatlar içeren ayrıntılı bir protokol sunmaktadır. Uygulamanın tutarlılığını ve prosedür sırasında hayvanların güvenliğini ve refahını sağlamak için burada temel hususlar ve iyi laboratuvar uygulamaları vurgulanmaktadır. Araştırmacılar, bu protokolü izleyerek, hayvanlar için olası riskleri veya rahatsızlıkları en aza indirirken, hassasiyet ve tekrarlanabilirlik ile deneyleri güvenle yürütebilirler.
Protokol
Açıklanan prosedürler ve protokoller, Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüleri Kılavuzu'nda belirtilen yönergelere uygundur. Ek olarak, prosedürler Yale Üniversitesi Tıp Fakültesi'ndeki Hayvan Bakım ve Kullanım Komitesi'nden onay aldı. Sunulan çalışma için yenidoğan vahşi tip (WT) C57BL / 6J erkek ve dişi fareler kullanıldı. Hayvanlar ticari bir kaynaktan elde edilmiştir (bkz.
1. Çalışma alanının hazırlanması
- Önce aşağıdaki öğeleri hazırlayın: kriyo-anestezi için ıslak buz, yavruları barajdan ayırmak için boş bir kafes, bir diseksiyon mikroskobu, bir ışık kaynağı, enjeksiyon sırasında hayvanı yerleştirmek için temiz bir yüzey, pamuklu çubuklar, bir ısıtma yastığı, 25/10 μL şırınga ve 34 G / 0.375 "/ 12 ° İğne (Malzeme Tablosuna bakınız).
NOT: Islak buz kullanan fare yavruları için kriyo-anestezi, kullanımı kolaylaştırmayı, yavru hareketini azaltmayı ve olası hayvan rahatsızlığını en aza indirmeyi amaçlayan isteğe bağlı bir adımdır. Bu kriyo-anestezi aşaması aynı zamanda kafa içi basıncın düşürülmesi ve hacimle ilgili komplikasyonların azaltılması yararını da sağlayabilir 9,10. - Yavruları tutarken barajdan uzakta ayrı bir kafese taşıyın.
- Her yavruyu tartın ve ağırlıklarını belgeleyin.
- Gazlı bez ve etanol kullanarak farenin arkasını silin. Diseksiyon mikroskobu kullanarak intervertebral boşluğu veya en azından omurilik kanalının orta hattını (P1 yavrularında kırmızı görünmelidir) onaylayın (Ek Video 1).
2. Enjeksiyon prosedürü
- Tek bir yavruyu uyuşturmak için, 3-5 dakika boyunca bir buz banyosu üzerinde lateks kılıf veya alüminyum folyo gibi su geçirmez bir bariyer üzerine nazikçe yerleştirin. Hayvanı uzun süre buz üzerinde bırakmaktan kaçınmak önemlidir, çünkü bunu yapmak ventriküler fibrilasyon, doku hipoksisi ve metabolik asidoz dahil olmak üzere hipotermi ile ilgili komplikasyonlar için potansiyel riskler oluşturabilir.
NOT: 3-5 dakikalık süre duruma göre değişebilir. Uygun süreyi belirlemek için ayak parmağı sıkışmasına yanıt vermeme gibi anestezi belirtilerini değerlendirin. - Hayvan buzun üzerindeyken, şırıngaya 10 μL ilaç formülasyonu, virüs hazırlığı veya yapay omurilik sıvısını kontrol etme vb.
NOT: Öğrenme aşamasında, dağıtım malzemeleriyle aynı hacimde karışık %1 Hızlı Yeşil boya enjekte etme seçeneğini göz önünde bulundurun (Malzeme Tablosuna bakın). Bu, enjeksiyon sürecini görselleştirmeye yardımcı olabilir ve tekniğin öğrenilmesine ve iyileştirilmesine yardımcı olabilir. Hızlı Yeşil Boya veya benzeri malzemeler enjekte edilen yavrular, bu malzemeler hayvanlarda enflamatuar reaksiyonlara veya diğer yan etkilere neden olabileceğinden, onaylanmış protokole göre enjeksiyondan kısa bir süre sonra ötenazi yapılmalıdır. - Hayvan tamamen uyuşturulduktan sonra, vücut hareketinin azalması veya olmaması ile onaylandığı gibi, yavruları mikroskop altında nazikçe konumlandırın.
- Sol işaret parmağı ve başparmak ile, bilateral pelvik kuşaklar arasında yer alan orta hat boyunca intervertebral boşluğu dikkatlice palpe edin (Ek Video 1). Omurganın orta hattını tanımlamaya yardımcı olmak için kuyruğun tabanını hafifçe döndürün.
- Enjeksiyondan önce iğne eğimini hayvanın kafasına doğru ayarlayın.
- Şırınganın merkezi sagital düzlemle aynı hizada kalmasını sağlarken, girintinin kesiştiği noktada 70°-80°'lik bir açıyla hafifçe eğerek iğneyi dikkatlice yerleştirin. İğne kemikle temas ettiğinde, açıyı kademeli olarak yaklaşık 30°'ye düşürün, ardından iğneyi intervertebral boşluğa yaklaşık 2 mm ilerletin.
NOT: İğnenin tüm vücudu hafifçe kaldırma yeteneği, intradural boşluğa başarılı bir şekilde girildiğinin bir işaretidir. - 50-60 s içinde 10 μL hacme kadar yavaşça enjekte edin. Teslimat tamamlandıktan sonra iğneyi 10-20 saniye yerinde tutun. Sızıntıyı önlemek için iğneyi hafif bir dönüşle geri çekin.
NOT: İğneyi çekmeden önce beyincik yeşile dönecektir. Ayrıca, yavaş itme, doğumla ilişkili kafa içi basıncında bir artışı önlemek ve olası komplikasyonları en aza indirmek için kritik öneme sahiptir. 500'den fazla yavru köpekte enjeksiyon konusundaki deneyimimize dayanarak, 50-60 sn boyunca 10 μL'lik bir hacim sağlamak en uygunudur.
3. Enjeksiyon sonrası
- Herhangi bir sızıntı veya kan varsa enjeksiyon bölgesine pamuklu çubuk uygulayın.
NOT: Çoğu durumda hiç olmamalıdır. Deneyimlerimize göre, sızıntı izleri veya kan izleri ile tedavi edilen yavrular hala kullanılabilir, ancak veri analizi sırasında azaltılmış dozda ilaç veya tedavilerin dikkate alınması gerekebilir. - Yavruyu bir ısıtma yastığına yerleştirin ve yavruların tamamen iyileşmesi ve yeniden ısınması için 10-15 dakika bekleyin. Yavruları ev kafeslerine geri döndürmeden önce uyanık olduklarından ve aktif olarak hareket ettiklerinden emin olmak için dikkatlice gözlemleyin. Bir farenin yeterli iyileşmesi, pembe ten renginin restorasyonu, artan spontan vücut hareketi ve dokunmaya duyarlı reaksiyonlar ile gösterilir.
- Yavruyu ev kafesine geri yerleştirin ve yavrunun yatak takımı, yuva veya her ikisiyle de düzgün bir şekilde örtüldüğünden emin olun. Bu, yavrunun barajdan gerekli anne bakımını almasını sağlar.
- Enjeksiyondan sonra en az 3 gün boyunca genel görünümü ve aktiviteyi günlük olarak değerlendirin. Hasta bir görünüm ve azalmış aktivite, enfeksiyon, tedaviye bağlı yan etkiler veya diğer komplikasyonlar vb. olasılığını artırabilir. Gerekirse, veteriner bakımına danışın.
Sonuçlar
Başarılı intratekal enjeksiyon, uygulanan çözeltinin yaygın dağılımına neden oldu, ancak gerçek hücresel penetrasyon, verilen ilaçların ve materyallerin doğasına bağlıydı. Bu çalışmada, vahşi tip yenidoğanlarda intratekal enjeksiyon (IT) sonrası hemen sonuçları görselleştirmek için Fast Green kullandık (Şekil 1A-K) ve geleneksel intraserebroventriküler (ICV) enjeksiyonla karşılaştırdık (Şekil 1L-N). Uzun vadeli sonuçlar (enjeksiyondan 10 gün sonra), CRISPR / Cas9 tabanlı gen düzenleme7'nin verilmesiyle aktive edilen YFP raportör fareler kullanılarak da incelendi. YFP ekspresyonu, CRISPR / Cas9 ile tedavi edilmeyen farelere kıyasla tüm fare beyninde yaygın olarak gözlenmiştir (Şekil 2). YFP ekspresyonu, daha yüksek büyütme altındaki hücrelerin çoğunda gözlendi. 500'den fazla yenidoğan yavruya enjeksiyon yapıldı ve enjekte edilen yavruların %98'inden fazlası prosedürden kurtuldu. Tedavi edilen yavruların uzun süreli sağkalımı ve sağlığı üzerinde herhangi bir zararlı etki gözlenmemiştir (Ek Şekil 1).
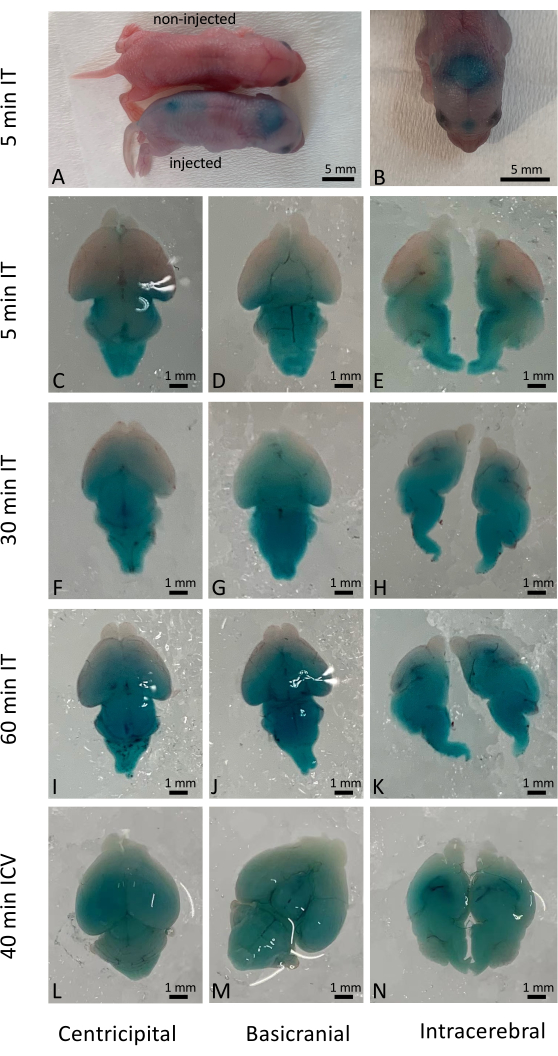
Şekil 1: Fare beyinlerinde Hızlı Yeşil boyanın zamansal ve uzamsal dağılımı. (A) İntratekal enjeksiyondan 5 dakika sonra enjekte edilen ve enjekte edilmeyen farelerin karşılaştırılması. (B) Diseksiyondan önce fare beynindeki Hızlı Yeşil boya dağılımının görselleştirilmesi. (C-E) İntratekal uygulamadan 5 dakika sonra diseke beyinlerde boyanın dağılımı. (F-H) İntratekal uygulamadan 30 dakika sonra boyanın diseke beyinlerde dağılımı. (I-K) İntratekal uygulamadan 60 dakika sonra diseke beyinlerde boyanın dağılımı. (L-N) Karşılaştırma için, boyanın diseke beyinlerde intraserebroventriküler uygulamadan 40 dakika sonra dağılımı. Ölçek çubuğu: 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: İntratekal olarak uygulanan CRISPR / Cas9 gen düzenlemesinin uzun vadeli etkileri. CRISPR/Cas9 gen düzenlemesinin intratekal enjeksiyonunu takiben fare beyninde YFP muhabirinin yaygın ekspresyonu: beyincik (AF), posterior korteks (DF) ve prefrontal korteks (GI). Ölçek çubuğu: 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: İntratekal CRISPR gen düzenlemesinden sonra Angelman Sendromu farelerinin sağkalım eğrisi. Tedavi edilmeyen ve vahşi tip farelere kıyasla, intratekal uygulama yoluyla CRISPR gen düzenlemesi alan Angelman Sendromu farelerinin sonuçlarını gösteren sağkalım eğrisi. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Video 1: Yenidoğan farelerde intratekal enjeksiyon prosedürü. Yenidoğan farelere intratekal enjeksiyon yapma sürecini gösteren video. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Yenidoğan farelerde (P1) intratekal enjeksiyon için adım adım bir prosedür tarif edilmiştir ve beyinlerinde yaygın ilaç dağılımı ile sonuçlanır. Serebral korteks11'in delinmesini içeren yenidoğan farelere ilaç vermek için yaygın intraserebroventriküler enjeksiyon yöntemiyle karşılaştırıldığında, intratekal enjeksiyon, iğne penetrasyonu nedeniyle yenidoğan fare beyninin doğrudan yaralanmasını önler. Minimal invazivlik nedeniyle, intratekal enjeksiyon gerektiğinde tekrar tekrar gerçekleştirilebilir ve klinik ortamda insanlarda tekrarlanan uygulamaları simüle eder12.
İntrakraniyal basınçtaki değişiklikler genellikle intratekal enjeksiyon13 ile ilişkilidir ve potansiyel olarak yavrulardaki davranış değişiklikleri nedeniyle barajın reddedilmesine ve beslenmeyi reddetmesine yol açar. Bununla birlikte, enjekte edilen yavrular arasında davranışta akut değişiklikler veya sağkalımda azalma gözlenmemiştir. Benzer şekilde, yetişkinlerde intratekal enjeksiyonlarla ilişkili olağandışı veya anormal davranışlar fark edilmemiştir (veriler gösterilmemiştir).
Birkaç teknik ipucu başarıya katkıda bulunmuş olabilir ve vurgulanmaya değer. Daha yavaş enjeksiyon hızı muhtemelen önemli bir faktördür. Ek olarak, kriyo-anestezi, enjeksiyondan önce kafa içi basıncını azaltabilir, intratekal enjeksiyon sırasında geri akışı en aza indirebilir ve diğer komplikasyonları azaltabilir. Son olarak, enjeksiyon bölgesinin hassasiyeti de başarı oranını etkileyebilir.
İntratekal uygulama yoluyla en iyi etkinliği elde etmek için, yavrular teslim edildikten sonra prosedürün mümkün olan en kısa sürede gerçekleştirilmesi çok önemlidir. İntratekal enjeksiyon yoluyla verilen ilaçlar ve diğer maddeler, beyni ve omuriliği çevreleyen meninkslerin araknoid mater ve pia mater katmanları arasındaki boşluk olan intratekal boşluğa girer. Bu nedenle, intratekal enjeksiyon yoluyla verilen ilaçlar meninkslerin bu katmanlarındangeçer 12. Kemirgenlerde, insanlarda olduğu gibi, meninksler üç katmandan oluşur: dura mater, araknoid mater ve pia mater14. Bu zarlar embriyonik gelişim sırasında oluşur ve doğum sonrası 2. günde (P2)15 tamamen olgunlaşır. Bu nedenle, özellikle gen düzenleme deneyleri gibi hayvan genotiplerini içeren deneyler için, yavruları birkaç saat içinde deney gruplarına atamak için hızlı bir genotipleme protokolü kullanılması önerilir. Yavrulara ne kadar erken enjekte edilirse, sonuç o kadar iyi olur. Enjeksiyonlar tipik olarak doğumdan sonraki 3 saat içinde tamamlanır. Bu zaman penceresi, enjekte edilen ilaçların beyin omurilik sıvısının beyin parankimine akışını takip etmesine izin verirken, ependimal astar hala olgunlaşmamıştır ve ilaç parçacıklarının boyutundan daha az etkilenir. İnsanlar ve fareler arasındaki gelişimsel farklılıklara dikkat çekmeye değer. P1 yenidoğan fareleri, insan beyni gelişiminin geç gebelik aşamasına karşılık gelir16. P1 yenidoğan fareleri üzerinde yapılan deneylerden elde edilen sonuçlar, değerli bir kavram kanıtı olarak hizmet eder, ancak bu sonuçları translasyonel çalışma tasarımlarında insanlara tahmin ederken dikkatli olunmalıdır.
Bu tekniğe, kısıtlı bir yönetim zaman penceresi ve yüksek vasıflı deneyciler için gereklilik nedeniyle meydan okunmaktadır. Deneycinin tecrübesi yoksa, yüksek mortalite prosedürle ilişkilendirilebilir. Bununla birlikte, dar zaman dilimi, çalışmalar içinde ve arasında daha yüksek düzeyde hassasiyet ve tekrarlanabilirlik gerektirir. Ayrıca, yeterli uygulama ile bu yöntemin yeterliliği ve başarı oranı önemli ölçüde artırılabilir.
Enjeksiyonlar doğru yapılırsa, enjekte edilen yavruların hayatta kalması öncelikle anne bakımından etkilenir. Hedefleriniz için koruyucu dişi çiftler hazırlamanız önerilir. Hedeflenen yavruların enjeksiyon günü öğleden sonra karınlarında süt lekesi yoksa, derhal koruyucu dişiye transfer edilmelidir. Dişi fareler bebeklerini kokudan tanırlar. Bu nedenle, işlem sırasında ve sonrasında yavrulara deneycilerden veya ilgisiz barajlardan gelen alışılmadık kokuların bulaşmasını önlemek çok önemlidir. Bununla birlikte, koruyucu dişilerin kullanılmasının gerekliliği bireysel deneyler için değerlendirilmelidir. Prosedürün iyi havalandırılan bir odada, ideal olarak biyolojik bir davlumbazda yapılması da önerilir. Yavruları barajın yatağı ve dışkısı ile karıştırmak da yararlıdır. İşlem sonrası ilk kontrolden sonra, stresi azaltmak için en az 3 gün boyunca barajdaki rahatsızlığın en aza indirilmesi önerilir. Her cerrahi işlemde olduğu gibi işlem sonrası enfeksiyon riski de göz önünde bulundurulmalıdır. Bu nedenle, enjeksiyon sırasında steril prosedürler için iyi laboratuvar uygulamalarına sıkı sıkıya bağlı kalınmalıdır. İntratekal basıncın dış ortamdan daha yüksek olduğu ve enfeksiyona karşı doğal koruma sağladığı unutulmamalıdır. Deneyimler, enjeksiyon sonrası enfeksiyon oranının nadir olduğunu göstermektedir. Bununla birlikte, enfeksiyon veya diğer komplikasyonların belirti ve semptomlarını tespit etmek için enjeksiyondan en az 3 gün sonra yavruların genel görünümünün ve aktivitesinin günlük olarak izlenmesi önerilir. Özel durumlarda, önemli komplikasyonları olan yavruları ötenazi yapmak yerine veterinerlik hizmetlerine danışılması gerekebilir.
Açıklamalar
YHJ, Couragene'nin kurucu ortağıdır, ancak bu proje için çıkar çatışması yoktur.
Teşekkürler
XNL, Angelman Sendromu Terapötik Vakfı (FAST) Doktora Sonrası Bursu tarafından desteklenmektedir. YHJ ayrıca FAST ve NIH Grant R01HD110195 ve R01MH117289 tarafından da desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Balance | Ohaus Corporation | 30253017 | |
| C57BL/6J mice | The Jackson Laboratory | 000664 | |
| Digital Microscope | RWD | DOM-1001 | |
| DPBS | ThermoFisher | 14190144 | |
| Fast Green | Sigma | F7252-5G | |
| Heating pad | RWD | 69020 | |
| Needles | Hamilton | 6PK (34/0.375”/4/12DEG)S | |
| Syringe | Hamilton | 1702RN | |
| Syringe Filters | Sigma | SLGVM33RS |
Referanslar
- Hoy, S. M. Onasemnogene abeparvovec: first global approval. Drugs. 79 (11), 1255-1262 (2019).
- Ramos, D. M., et al. Age-dependent SMN expression in disease-relevant tissue and implications for SMA treatment. J Clin Invest. 129 (11), 4817-4831 (2019).
- Fedorova, E., Battini, L., Prakash-Cheng, A., Marras, D., Gusella, G. L. Lentiviral gene delivery to CNS by spinal intrathecal administration to neonatal mice. J Gene Med. 8 (4), 414-424 (2006).
- Dindot, S. V., et al. An ASO therapy for Angelman syndrome that targets an evolutionarily conserved region at the start of the UBE3A-AS transcript. Sci Transl Med. 15, eabf4077(2023).
- Amanat, M., Nemeth, C. L., Fine, A. S., Leung, D. G., Fatemi, A. Antisense oligonucleotide therapy for the nervous system: from bench to bedside with emphasis on pediatric neurology. Pharmaceutics. 14 (11), 2389(2022).
- Frangoul, H., et al. CRISPR-Cas9 gene editing for sickle cell disease and β-Thalassemia. N Engl J Med. 384, 252-260 (2021).
- Gillmore, J. D., et al. CRISPR-Cas9 in vivo gene editing for transthyretin amyloidosis. N Engl J Med. 385, 493-502 (2021).
- Krol, A., Feng, G. Windows of opportunity: timing in neurodevelopmental disorders. Curr Opin Neurobiol. 48, 59-63 (2018).
- Birg, T., et al. Brain temperature influences intracranial pressure and cerebral perfusion pressure after traumatic brain injury: A CENTER-TBI Study. Neurocrit Care. 35, 651-661 (2021).
- Rossi, S., Zanier, E. R., Mauri, I., Columbo, A., Stocchetti, N. Brain temperature, body core temperature, and intracranial pressure in acute cerebral damage. J Neurol Neurosurg Psychiatry. 71 (4), 448-454 (2001).
- Kim, J. Y., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. J Vis Exp. 91, e51863(2014).
- Petrou, P., Kassis, I., Yaghmour, N. E., Ginzberg, A., Karussis, D. A phase II clinical trial with repeated intrathecal injections of autologous mesenchymal stem cells in patients with amyotrophic lateral sclerosis. Front Biosci (Landmark Ed). 26 (10), 693-706 (2021).
- Kroin, J. S., et al. The mechanisms of intracranial pressure modulation by epidural blood and other injectates in a postdural puncture rat model. Anesth Analg. 95 (2), 423-429 (2002).
- Møllgård, K., et al. A mesothelium divides the subarachnoid space into functional compartments. Science. 379 (6627), 84-88 (2023).
- Chakrabarty, P., et al. Capsid serotype and timing of injection determines AAV transduction in the neonatal mice brain. PLoS One. 8, e67680(2013).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Prog Neurobiol. 160-107, 1-16 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır