Method Article
Inyección intratecal de ratón recién nacido para la edición del genoma y la administración de fármacos
En este artículo
Resumen
El presente protocolo describe las instrucciones paso a paso para realizar inyecciones intratecales en ratones neonatos para la edición de genes y la administración de fármacos.
Resumen
La inyección intratecal es un procedimiento comúnmente empleado tanto en clínicas pediátricas como para adultos, que sirve como un medio eficaz para administrar medicamentos y tratamientos. Al administrar directamente medicamentos y tratamientos en el líquido cefalorraquídeo del sistema nervioso central, este método logra concentraciones localizadas más altas del fármaco al tiempo que reduce los efectos secundarios sistémicos en comparación con otras vías, como las inyecciones intravenosas, subcutáneas o intramusculares. Su importancia se extiende más allá de los entornos clínicos, ya que la inyección intratecal desempeña un papel vital en los estudios preclínicos centrados en el tratamiento de trastornos neurogenéticos en roedores y otros animales grandes, incluidos los primates no humanos. Sin embargo, a pesar de su aplicación generalizada, la inyección intratecal en cachorros jóvenes, especialmente neonatos, plantea importantes desafíos técnicos debido a su pequeño tamaño y naturaleza frágil. La administración exitosa y confiable de inyecciones intratecales en ratones recién nacidos requiere una atención meticulosa a los detalles y una cuidadosa consideración de varios factores. Por lo tanto, existe una necesidad crucial de un protocolo estandarizado que no solo proporcione instrucciones, sino que también destaque las consideraciones técnicas clave y las buenas prácticas de laboratorio para garantizar la coherencia de los procedimientos, así como la seguridad y el bienestar de los animales.
Para abordar esta necesidad insatisfecha, presentamos un protocolo detallado y completo para realizar inyecciones intratecales específicamente en cachorros recién nacidos en el día postnatal 1 (P1). Siguiendo las instrucciones paso a paso, los investigadores pueden realizar inyecciones intratecales con confianza en cachorros neonatos, lo que permite la administración precisa de fármacos, oligonucleótidos antisentido y virus para tratamientos basados en el reemplazo de genes o la edición del genoma. Además, se enfatiza la importancia de adherirse a las buenas prácticas de laboratorio para mantener el bienestar de los animales y garantizar resultados experimentales confiables. Este protocolo tiene como objetivo abordar los desafíos técnicos asociados con las inyecciones intratecales en ratones neonatos, facilitando en última instancia los avances en el campo de la investigación neurogenética que tiene como objetivo desarrollar posibles intervenciones terapéuticas.
Introducción
La inyección intratecal (IT) es un procedimiento clínico común utilizado para administrar medicamentos, recolectar líquido cefalorraquídeo y mantener la presión intracraneal en pacientes pediátricos y adultos en clínicas 1,2. La administración de medicamentos a través de una inyección intratecal es un enfoque eficaz para aumentar las concentraciones de medicamentos en el sistema nervioso central (SNC) y minimizar la exposición sistémica. En consecuencia, este método mejora la eficacia terapéutica y reduce los efectos secundarios, especialmente en el caso de los fármacos sensibles a la temperatura y de vida media corta3.
En los estudios preclínicos que prueban nuevos fármacos y tratamientos utilizando modelos de roedores, es imperativo emplear un método fiable de administración de fármacos que ofrezca mayor precisión y reproducibilidad de los resultados 4,5. Para los estudios preclínicos que evalúan nuevos tratamientos para trastornos neurogenéticos y del neurodesarrollo, el tratamiento temprano es crucial para los estudios iniciales de prueba de concepto, ya que generalmente se predice que las intervenciones tempranas producirán resultados más favorables 6,7,8.
En comparación con las inyecciones intracerebroventriculares (ICV) convencionales, las inyecciones IT conllevan riesgos significativamente menores, ya que evitan la necesidad de penetración directa a través de la corteza cerebral. Esta ventaja reduce sustancialmente el daño potencial al tejido cortical regional y a los nervios circundantes. Además, las inyecciones IT permiten al menos cinco veces más en el volumen administrable de medicamentos a través de una sola inyección, lo que mejora en gran medida la viabilidad de las administraciones repetidas. Sin embargo, debido al pequeño tamaño y la naturaleza frágil de los ratones recién nacidos, la realización de inyecciones intratecales en cachorros recién nacidos es técnicamente desafiante y requiere técnicas especializadas, equipos y un manejo meticuloso.
Este artículo proporciona un protocolo detallado con instrucciones paso a paso para realizar inyecciones intratecales en cachorros recién nacidos P1. Aquí se hace hincapié en las consideraciones clave y las buenas prácticas de laboratorio para garantizar la coherencia de la administración y la seguridad y el bienestar de los animales durante el procedimiento. Al seguir este protocolo, los investigadores pueden realizar experimentos con confianza con precisión y reproducibilidad, al tiempo que minimizan cualquier riesgo potencial o incomodidad para los animales.
Protocolo
Los procedimientos y protocolos descritos cumplían con las pautas descritas en la Guía de los Institutos Nacionales de Salud para el Cuidado y Uso de Animales de Laboratorio. Además, los procedimientos recibieron la aprobación del Comité de Cuidado y Uso de Animales de la Facultad de Medicina de la Universidad de Yale. Para el estudio presentado se utilizaron ratones machos y hembras recién nacidos de tipo salvaje (WT) C57BL/6J. Los animales se obtuvieron de una fuente comercial (ver Tabla de Materiales).
1. Preparación del espacio de trabajo
- Prepare primero los siguientes elementos: hielo húmedo para crioanestesia, una jaula vacía para separar a las crías de la madre, un microscopio de disección, una fuente de luz, una superficie limpia para colocar al animal durante la inyección, hisopos de algodón, una almohadilla térmica, una jeringa de 25/10 μL y una aguja de 34 G/ 0,375"/ 12 DEG (ver Tabla de materiales).
NOTA: La crioanestesia para cachorros de ratón con hielo húmedo es un paso opcional destinado a facilitar el manejo, reducir el movimiento de los cachorros y minimizar las posibles molestias de los animales. Este paso de crioanestesia también puede proporcionar el beneficio de disminuir la presión intracraneal y reducir las complicaciones relacionadas con el volumen 9,10. - Mueva a los cachorros a una jaula separada lejos de la madre mientras los manipula.
- Pesa a cada cachorro y documenta su peso.
- Limpie la parte posterior del mouse con gasa y etanol. Confirme el espacio intervertebral o, como mínimo, la línea media del canal espinal (que debe aparecer roja en las crías P1) utilizando el microscopio de disección (Video complementario 1).
2. Procedimiento de inyección
- Para anestesiar a un solo cachorro, colóquelo suavemente sobre una barrera a prueba de agua, como una funda de látex o papel de aluminio, en un baño de hielo durante 3 a 5 minutos. Es importante evitar dejar al animal en el hielo durante un período prolongado, ya que hacerlo podría presentar riesgos potenciales de complicaciones relacionadas con la hipotermia, como fibrilación ventricular, hipoxia tisular y acidosis metabólica.
NOTA: La duración de 3-5 min puede variar según el caso. Evalúe los signos de la anestesia, como la falta de respuesta a un pellizco en el dedo del pie, para determinar la duración adecuada. - Mientras el animal está en el hielo, cargue la jeringa con 10 μL de la formulación del medicamento, preparación de virus o líquido cefalorraquídeo artificial de control, etc.
NOTA: Durante la fase de aprendizaje, considere la opción de inyectar el mismo volumen de colorante Fast Green mezclado al 1% con los materiales de entrega (consulte la Tabla de materiales). Esto puede ayudar a visualizar el proceso de inyección y ayudar a aprender y refinar la técnica. Los cachorros inyectados con Fast Green Dye o materiales similares deben ser sacrificados poco después de la inyección según el protocolo aprobado, ya que estos materiales pueden provocar reacciones inflamatorias u otros efectos secundarios en los animales. - Una vez que el animal esté completamente anestesiado, confirmado por la reducción o ausencia de movimiento corporal, coloque suavemente a los cachorros bajo el microscopio.
- Con los dedos índice y pulgar izquierdos, palpar cuidadosamente el espacio intervertebral a lo largo de la línea media, situado entre las cinturas pélvicas bilaterales (Video complementario 1). Gira suavemente la base de la cola ligeramente para ayudar a identificar la línea media de la columna vertebral.
- Ajuste el bisel de la aguja hacia la cabeza del animal antes de la inyección.
- Inserte con cuidado la aguja, inclinándola ligeramente en un ángulo de 70°-80° en el punto donde se cruza la hendidura, asegurándose de que la jeringa permanezca alineada con el plano sagital central. A medida que la aguja hace contacto con el hueso, disminuya gradualmente el ángulo hasta aproximadamente 30°, luego avance la aguja unos 2 mm en el espacio intervertebral.
NOTA: La capacidad de la aguja para levantar ligeramente todo el cuerpo es un signo de entrada exitosa en el espacio intradural. - Inyecte lentamente hasta 10 μL de volumen en 50-60 s. Mantenga la aguja en su lugar durante 10-20 segundos después de completar el parto. Retire la aguja con una rotación suave para evitar fugas.
NOTA: El cerebelo se volverá verde antes de retirar la aguja. Además, el empuje lento es fundamental para evitar un aumento de la presión intracraneal asociado con el parto y para minimizar las posibles complicaciones. Basándonos en nuestra experiencia con inyecciones en más de 500 cachorros, lo óptimo es administrar un volumen de 10 μL durante 50-60 s.
3. Después de la inyección
- Aplique un hisopo de algodón en el lugar de la inyección si hay alguna fuga o sangre.
NOTA: No debería haber ninguno en la mayoría de los casos. Según nuestra experiencia, los cachorros tratados con rastros de fugas o sangre siguen siendo utilizables, pero puede ser necesario considerar una dosis reducida de medicamentos o tratamientos durante el análisis de datos. - Coloque al cachorro en una almohadilla térmica y espere de 10 a 15 minutos para que los cachorros se recuperen por completo y se vuelvan a calentar. Observe cuidadosamente a los cachorros para asegurarse de que estén alerta y se muevan activamente antes de devolverlos a su jaula de origen. La recuperación adecuada de un ratón está indicada por la restauración del color rosado de la piel, el aumento del movimiento corporal espontáneo y las reacciones de respuesta al tacto.
- Vuelva a colocar al cachorro en la jaula de la casa y asegúrese de que el cachorro esté bien cubierto con ropa de cama, un nido o ambos. Esto asegura que el cachorro reciba los cuidados maternos necesarios por parte de la madre.
- Evalúe el aspecto general y la actividad diaria durante al menos 3 días después de la inyección. Una apariencia enferma y una actividad reducida pueden aumentar la posibilidad de infección, efectos secundarios asociados al tratamiento u otras complicaciones, etc. Si es necesario, consulte con atención veterinaria.
Resultados
El éxito de la inyección intratecal dio lugar inmediatamente a la distribución generalizada de la solución administrada, aunque la penetración celular real dependía de la naturaleza de los fármacos y materiales administrados. En este estudio, utilizamos Fast Green para visualizar los resultados inmediatos después de la inyección intratecal (IT) en neonatos de tipo salvaje (Figura 1A-K) y lo comparamos con la inyección intracerebroventricular (ICV) convencional (Figura 1L-N). Los resultados a largo plazo (10 días después de la inyección) también se examinaron utilizando ratones reporteros YFP activados por la administración de la edición genética basada en CRISPR/Cas97. La expresión de YFP se observó ampliamente en todo el cerebro del ratón en comparación con los ratones no tratados con CRISPR/Cas9 (Figura 2). La expresión de YFP se observó en la mayoría de las células bajo mayor aumento. Se realizaron inyecciones en más de 500 cachorros recién nacidos, y más del 98% de los cachorros inyectados sobrevivieron al procedimiento. No se observaron efectos nocivos sobre la supervivencia y la salud a largo plazo de las crías tratadas (Figura suplementaria 1).
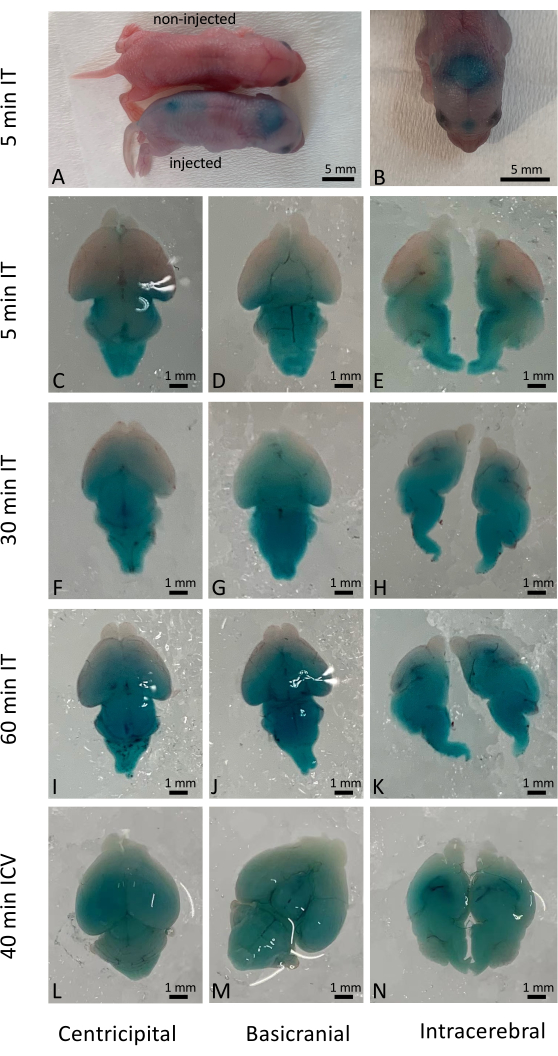
Figura 1: Distribución temporal y espacial del colorante Fast Green en cerebros de ratones. (A) Observación macroscópica de ratones, comparando ratones inyectados y no inyectados 5 minutos después de la inyección intratecal. (B) Visualización de la distribución del colorante Fast Green en el cerebro del ratón antes de la disección. (C-E) Distribución del colorante en cerebros disecados 5 min después de la administración intratecal. (F-H) Distribución del colorante en cerebros disecados 30 min después de la administración intratecal. (I-K) Distribución del colorante en cerebros disecados 60 min después de la administración intratecal. (De izquierda a derecha) A modo de comparación, la distribución del colorante en cerebros disecados 40 min después de la administración intracerebroventricular. Barra de escala: 1 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Efectos a largo plazo de la edición genética CRISPR/Cas9 administrada por vía intratecal. Expresión generalizada del reportero YFP en el cerebro del ratón después de la inyección intratecal de la edición del gen CRISPR/Cas9: cerebelo (A-F), corteza posterior (D-F) y corteza prefrontal (G-I). Barra de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Curva de supervivencia de ratones con síndrome de Angelman después de la edición genética CRISPR intratecal. Curva de supervivencia que muestra los resultados de los ratones con síndrome de Angelman que recibieron edición genética CRISPR a través de la administración intratecal, en comparación con ratones no tratados y de tipo salvaje. Haga clic aquí para descargar este archivo.
Video complementario 1: Procedimiento de inyección intratecal en ratones neonatos. Video que muestra el proceso de administración de inyecciones intratecales a ratones neonatos. Haga clic aquí para descargar este video.
Discusión
Se describe un procedimiento paso a paso para la inyección intratecal en ratones neonatos (P1), lo que resulta en una distribución generalizada del fármaco en sus cerebros. En comparación con el método común de inyección intracerebroventricular para administrar medicamentos a ratones neonatos, que implica perforar la corteza cerebral11, la inyección intratecal evita lesiones directas en el cerebro del ratón neonatal debido a la penetración de la aguja. Debido a su mínima invasividad, la inyección intratecal puede realizarse repetidamente cuando sea necesario, simulando la administración repetida en humanos en un entorno clínico12.
Los cambios en la presión intracraneal se asocian comúnmente con la inyección intratecal13, lo que puede conducir al rechazo y rechazo de la madre a alimentarse debido a cambios de comportamiento en las crías. Sin embargo, no se han observado cambios agudos en el comportamiento o una reducción de la supervivencia entre los cachorros inyectados. Del mismo modo, no se han observado comportamientos inusuales o anormales asociados con las inyecciones intratecales en adultos (datos no mostrados).
Varios consejos técnicos pueden haber contribuido al éxito y vale la pena enfatizarlos. Es probable que la velocidad más lenta de inyección sea un factor importante. Además, la crioanestesia puede reducir la presión intracraneal antes de la inyección, minimizando el reflujo durante la inyección intratecal y reduciendo otras complicaciones. Por último, la precisión del lugar de inyección también puede influir en la tasa de éxito.
Para lograr la mejor eficacia a través de la administración intratecal, es fundamental realizar el procedimiento lo antes posible después del parto de las crías. Los medicamentos y otras sustancias administradas a través de una inyección intratecal ingresan al espacio intratecal, que es el espacio entre las capas de aracnoides y piamadre de las meninges que rodean el cerebro y la médula espinal. Por lo tanto, los fármacos administrados por inyección intratecal pasan a través de estas capas de las meninges12. En los roedores, al igual que en los humanos, las meninges constan de tres capas: la duramadre, la aracnoides y la piamadre14. Estas membranas se forman durante el desarrollo embrionario y están completamente maduras en el día 2 (P2) postnatal15. Por lo tanto, se recomienda el uso de un protocolo de genotipado rápido para asignar las crías a grupos experimentales en unas pocas horas, especialmente para experimentos que involucran genotipos animales, como los experimentos de edición de genes. Cuanto antes se inyecte a los cachorros, mejor será el resultado. Por lo general, las inyecciones se completan dentro de las 3 horas posteriores al nacimiento. Esta ventana de tiempo permite que los fármacos inyectados sigan el flujo de líquido cefalorraquídeo hacia el parénquima cerebral, mientras que el revestimiento ependimario aún es inmaduro y se ve menos afectado por el tamaño de las partículas del fármaco. Vale la pena señalar las diferencias de desarrollo entre humanos y ratones. Los ratones neonatos P1 corresponden a la etapa gestacional tardía del desarrollo del cerebro humano16. Los resultados de los experimentos en ratones neonatos P1 sirven como una valiosa prueba de concepto, pero se debe tener precaución al extrapolar estos resultados a los humanos en los diseños de estudios traslacionales.
Esta técnica se ve desafiada por una ventana de tiempo de administración limitada y la necesidad de experimentadores altamente calificados. La alta mortalidad puede estar asociada con el procedimiento si el experimentador carece de experiencia. Sin embargo, el estrecho marco temporal exige un mayor nivel de precisión y repetibilidad dentro de los estudios y entre ellos. Además, con la práctica adecuada, la competencia y la tasa de éxito de este método pueden mejorarse significativamente.
Si las inyecciones se realizan correctamente, la supervivencia de las crías inyectadas se ve afectada principalmente por el cuidado materno. Se recomienda preparar parejas de hembras adoptivas para sus objetivos. Si los cachorros objetivo no tienen una mancha de leche en el vientre en la tarde del día de la inyección, deben ser transferidos a la hembra adoptiva de inmediato. Los ratones hembra reconocen a sus crías por el olor. Por lo tanto, es fundamental evitar la introducción de olores desconocidos de los experimentadores o de las presas no relacionadas a los cachorros durante y después del procedimiento. Sin embargo, la necesidad de utilizar hembras adoptivas debe evaluarse para experimentos individuales. También se recomienda realizar el procedimiento en una habitación bien ventilada, idealmente en una campana de gases biológicos. Mezclar a los cachorros con la ropa de cama y los excrementos de la madre también es útil. Después de la verificación inicial posterior al procedimiento, se recomienda minimizar las perturbaciones en la presa durante al menos 3 días para reducir el estrés. Al igual que cualquier procedimiento quirúrgico, se debe considerar el riesgo de infección posterior al procedimiento. Por lo tanto, se debe seguir el estricto cumplimiento de las buenas prácticas de laboratorio para procedimientos estériles durante la inyección. Cabe señalar que la presión intratecal es mayor que la del ambiente externo, lo que proporciona una protección natural contra la infección. La experiencia indica que la tasa de infección posterior a la inyección es rara. Sin embargo, se recomienda un control diario de la apariencia general y la actividad de los cachorros durante al menos 3 días después de la inyección para detectar signos y síntomas de infección u otras complicaciones. En casos especiales, puede estar justificada la consulta con los servicios veterinarios en lugar de sacrificar a los cachorros con complicaciones significativas.
Divulgaciones
YHJ es cofundador de Couragene, pero no hay conflicto de intereses para este proyecto.
Agradecimientos
XNL cuenta con el apoyo de la beca postdoctoral de la Fundación para la Terapia del Síndrome de Angelman (FAST). YHJ también cuenta con el apoyo de FAST y NIH Grant R01HD110195 y R01MH117289.
Materiales
| Name | Company | Catalog Number | Comments |
| Balance | Ohaus Corporation | 30253017 | |
| C57BL/6J mice | The Jackson Laboratory | 000664 | |
| Digital Microscope | RWD | DOM-1001 | |
| DPBS | ThermoFisher | 14190144 | |
| Fast Green | Sigma | F7252-5G | |
| Heating pad | RWD | 69020 | |
| Needles | Hamilton | 6PK (34/0.375”/4/12DEG)S | |
| Syringe | Hamilton | 1702RN | |
| Syringe Filters | Sigma | SLGVM33RS |
Referencias
- Hoy, S. M. Onasemnogene abeparvovec: first global approval. Drugs. 79 (11), 1255-1262 (2019).
- Ramos, D. M., et al. Age-dependent SMN expression in disease-relevant tissue and implications for SMA treatment. J Clin Invest. 129 (11), 4817-4831 (2019).
- Fedorova, E., Battini, L., Prakash-Cheng, A., Marras, D., Gusella, G. L. Lentiviral gene delivery to CNS by spinal intrathecal administration to neonatal mice. J Gene Med. 8 (4), 414-424 (2006).
- Dindot, S. V., et al. An ASO therapy for Angelman syndrome that targets an evolutionarily conserved region at the start of the UBE3A-AS transcript. Sci Transl Med. 15, eabf4077(2023).
- Amanat, M., Nemeth, C. L., Fine, A. S., Leung, D. G., Fatemi, A. Antisense oligonucleotide therapy for the nervous system: from bench to bedside with emphasis on pediatric neurology. Pharmaceutics. 14 (11), 2389(2022).
- Frangoul, H., et al. CRISPR-Cas9 gene editing for sickle cell disease and β-Thalassemia. N Engl J Med. 384, 252-260 (2021).
- Gillmore, J. D., et al. CRISPR-Cas9 in vivo gene editing for transthyretin amyloidosis. N Engl J Med. 385, 493-502 (2021).
- Krol, A., Feng, G. Windows of opportunity: timing in neurodevelopmental disorders. Curr Opin Neurobiol. 48, 59-63 (2018).
- Birg, T., et al. Brain temperature influences intracranial pressure and cerebral perfusion pressure after traumatic brain injury: A CENTER-TBI Study. Neurocrit Care. 35, 651-661 (2021).
- Rossi, S., Zanier, E. R., Mauri, I., Columbo, A., Stocchetti, N. Brain temperature, body core temperature, and intracranial pressure in acute cerebral damage. J Neurol Neurosurg Psychiatry. 71 (4), 448-454 (2001).
- Kim, J. Y., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. J Vis Exp. 91, e51863(2014).
- Petrou, P., Kassis, I., Yaghmour, N. E., Ginzberg, A., Karussis, D. A phase II clinical trial with repeated intrathecal injections of autologous mesenchymal stem cells in patients with amyotrophic lateral sclerosis. Front Biosci (Landmark Ed). 26 (10), 693-706 (2021).
- Kroin, J. S., et al. The mechanisms of intracranial pressure modulation by epidural blood and other injectates in a postdural puncture rat model. Anesth Analg. 95 (2), 423-429 (2002).
- Møllgård, K., et al. A mesothelium divides the subarachnoid space into functional compartments. Science. 379 (6627), 84-88 (2023).
- Chakrabarty, P., et al. Capsid serotype and timing of injection determines AAV transduction in the neonatal mice brain. PLoS One. 8, e67680(2013).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Prog Neurobiol. 160-107, 1-16 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados