Method Article
게놈 편집 및 약물 전달을 위한 신생아 마우스의 척수강내 주사
요약
본 프로토콜은 유전자 편집 및 약물 전달을 위해 신생아 마우스에서 척수강내 주사를 수행하기 위한 단계별 지침을 설명합니다.
초록
척수강내 주사는 소아과 및 성인 클리닉에서 일반적으로 사용되는 절차로, 약물 및 치료를 투여하는 효과적인 수단으로 사용됩니다. 중추신경계의 뇌척수액에 약물과 치료제를 직접 전달함으로써 정맥 주사, 피하 주사 또는 근육 주사와 같은 다른 경로에 비해 전신 부작용을 줄이면서 더 높은 국소 약물 농도를 달성하는 방법입니다. 척수강내 주사는 설치류 및 인간이 아닌 영장류를 포함한 기타 대형 동물의 신경 유전 질환 치료에 중점을 둔 전임상 연구에서 중요한 역할을 하기 때문에 그 중요성은 임상 환경을 넘어 확장됩니다. 그러나 광범위한 적용에도 불구하고 어린 새끼, 특히 신생아 새끼의 척수강내 주사는 작은 크기와 취약한 특성으로 인해 상당한 기술적 문제를 제기합니다. 신생아용 마우스에서 척수강내 주사를 성공적이고 안정적으로 투여하려면 세부 사항에 대한 세심한 주의와 다양한 요인에 대한 신중한 고려가 필요합니다. 따라서 지침을 제공할 뿐만 아니라 절차적 일관성과 동물의 안전 및 복지를 보장하기 위해 주요 기술적 고려 사항과 우수 실험실 관행을 강조하는 표준화된 프로토콜이 매우 필요합니다.
이러한 미충족 수요를 해결하기 위해 우리는 특히 출생 후 1일(P1)에 신생아 새끼에게 척수강내 주사를 수행하기 위한 상세하고 포괄적인 프로토콜을 제시합니다. 단계별 지침을 따르면 연구자들은 신생아 새끼에게 자신 있게 척수강내 주사를 수행할 수 있으며, 유전자 대체 또는 게놈 편집 기반 치료를 위한 약물, 안티센스 올리고 및 바이러스를 정확하게 전달할 수 있습니다. 또한 동물의 복지를 유지하고 신뢰할 수 있는 실험 결과를 보장하기 위해 우수한 실험실 관행을 준수하는 것이 중요합니다. 이 프로토콜은 신생아 마우스의 척수강내 주사와 관련된 기술적 문제를 해결하여 궁극적으로 잠재적인 치료 개입을 개발하는 것을 목표로 하는 신경유전학 연구 분야의 발전을 촉진하는 것을 목표로 합니다.
서문
척수강내(IT) 주사는 클리닉에서 소아 및 성인 환자 모두에서 약물을 투여하고, 뇌척수액을 수집하고, 두개내압을 유지하는 데 사용되는 일반적인 임상 절차입니다 1,2. 척수강내 주사를 통한 약물 투여는 전신 노출을 최소화하면서 중추신경계(CNS)의 약물 농도를 높이는 효과적인 방법입니다. 결과적으로, 이 방법은 치료 효능을 향상시키고 부작용을 감소시키며, 특히 온도에 민감하고 반감기가 짧은 약물에 대한 부작용을 감소시킨다3.
설치류 모델을 사용하여 신약 및 치료법을 테스트하는 전임상 연구에서는 더 높은 정밀도와 결과 재현성을 제공하는 신뢰할 수 있는 약물 투여 방법을 사용하는 것이 필수적입니다 4,5. 신경유전 및 신경 발달 장애에 대한 새로운 치료법을 평가하는 전임상 연구의 경우, 조기 개입이 일반적으로 더 유리한 결과를 얻을 것으로 예측되기 때문에 초기 개념 증명 연구에서 조기 치료가 중요합니다 6,7,8.
기존의 뇌내(ICV) 주사와 비교할 때 IT 주사는 대뇌 피질을 통해 직접 침투할 필요가 없기 때문에 위험이 훨씬 낮습니다. 이러한 장점은 국소 피질 조직과 주변 신경에 대한 잠재적 손상을 크게 줄여줍니다. 또한 IT 주사는 단일 주사를 통해 투여 가능한 약물의 양을 최소 5배 증가시킬 수 있어 반복 투여의 가능성을 크게 높입니다. 그러나 신생아 마우스의 작은 크기와 연약한 특성으로 인해 갓 태어난 새끼에게 척수강내 주사를 수행하는 것은 기술적으로 어렵고 전문 기술, 장비 및 세심한 취급이 필요합니다.
이 기사는 P1 신생아 새끼에서 척수강내 주사를 수행하기 위한 단계별 지침과 함께 자세한 프로토콜을 제공합니다. 주요 고려 사항과 우수한 실험실 관행은 절차 중 관리의 일관성과 동물의 안전 및 복지를 보장하기 위해 여기에서 강조됩니다. 이 프로토콜을 따름으로써 연구자들은 동물에 대한 잠재적인 위험이나 불편함을 최소화하면서 정밀하고 재현성 있는 실험을 자신 있게 수행할 수 있습니다.
프로토콜
설명된 절차 및 프로토콜은 실험실 동물의 관리 및 사용을 위한 국립보건원(National Institutes of Health) 가이드에 요약된 지침을 준수했습니다. 또한 이 절차는 예일 대학교 의과대학의 동물 관리 및 사용 위원회(Animal Care and Use Committee)의 승인을 받았습니다. 신생아 야생형(WT) C57BL/6J 수컷 및 암컷 마우스를 제시된 연구에 사용했습니다. 동물은 상업적 출처에서 얻었다( 자료표 참조).
1. 작업 공간 준비
- 냉동 마취를 위한 습식 얼음, 댐에서 새끼를 분리하기 위한 빈 케이지, 해부 현미경, 광원, 주사하는 동안 동물을 놓기 위한 깨끗한 표면, 면봉, 가열 패드, 25/10μL 주사기 및 34G/0.375"/12도 바늘( 재료 표 참조).
알림: 습식 얼음을 사용하는 새끼 쥐의 냉동 마취는 취급을 용이하게 하고 강아지의 움직임을 줄이며 잠재적인 동물의 불편함을 최소화하기 위한 선택적 단계입니다. 이 냉동 마취 단계는 또한 두개내압을 낮추고 용적 관련 합병증을 줄이는 이점을 제공할 수 있다 9,10. - 새끼를 다루는 동안 댐에서 떨어진 별도의 케이지로 옮기십시오.
- 각 강아지의 무게를 측정하고 체중을 기록하십시오.
- 거즈와 에탄올을 사용하여 마우스 뒷면을 닦습니다. 해부 현미경(보충 비디오 1)을 사용하여 추간 공간 또는 최소한 척추관의 정중선(P1 새끼의 경우 빨간색으로 표시되어야 함)을 확인합니다.
2. 주입 절차
- 강아지 한 마리를 마취시키려면 얼음 욕조에서 라텍스 슬리브나 알루미늄 호일과 같은 방수 장벽에 3-5분 동안 부드럽게 놓습니다. 동물을 얼음 위에 장기간 방치하면 심실 세동, 조직 저산소증 및 대사성 산증을 포함한 저체온증 관련 합병증의 잠재적 위험이 발생할 수 있으므로 피하는 것이 중요합니다.
알림: 3-5분의 시간은 경우에 따라 다를 수 있습니다. 발가락 꼬집음에 대한 무반응과 같은 마취 징후를 평가하여 적절한 기간을 결정합니다. - 동물이 얼음 위에 있는 동안 주사기에 10μL의 약물 제형, 바이러스 제제를 넣거나 인공 척수액 등을 조절합니다.
참고: 학습 단계에서 동일한 부피의 혼합된 1% Fast Green 염료를 전달 물질과 함께 주입하는 옵션을 고려하십시오( 재료 표 참조). 이는 사출 공정을 시각화하는 데 도움이 될 수 있으며 기술을 배우고 개선하는 데 도움이 될 수 있습니다. Fast Green Dye 또는 이와 유사한 물질을 주입한 새끼는 동물에게 염증 반응이나 기타 부작용을 일으킬 수 있으므로 승인된 프로토콜에 따라 주사 직후 안락사시켜야 합니다. - 동물이 완전히 마취되면 신체 움직임이 감소하거나 없는 것으로 확인된 대로 새끼를 현미경 아래에 부드럽게 배치합니다.
- 왼쪽 검지와 엄지손가락으로 양측 골반 거들 사이에 위치한 정중선을 따라 추간 공간을 조심스럽게 촉진합니다(보충 비디오 1). 꼬리 밑부분을 약간 돌려 척추의 정중선을 식별할 수 있도록 합니다.
- 주입하기 전에 바늘 경사를 동물의 머리 쪽으로 조정하십시오.
- 바늘을 조심스럽게 삽입하고 움푹 들어간 부분이 교차하는 지점에서 70°-80° 각도로 약간 기울이고 주사기가 중앙 시상면과 정렬되도록 합니다. 바늘이 뼈에 닿으면서 각도를 약 30°로 점차 줄인 다음 바늘을 추간 공간으로 약 2mm 전진시킵니다.
알림: 바늘이 몸 전체를 약간 들어 올리는 능력은 경막내 공간에 성공적으로 진입했다는 신호입니다. - 50-60초 이내에 최대 10μL 부피를 천천히 주입합니다. 배송이 완료된 후 10-20초 동안 바늘을 제자리에 두십시오. 누출을 방지하기 위해 바늘을 부드럽게 돌려 빼십시오.
알림: 바늘을 빼기 전에 소뇌가 녹색으로 바뀝니다. 또한 천천히 누르는 것은 분만과 관련된 두개내 압력의 증가를 방지하고 잠재적인 합병증을 최소화하는 데 중요합니다. 500마리 이상의 새끼에게 주사한 경험에 비추어 볼 때 50-60초 동안 10μL 부피를 전달하는 것이 최적입니다.
3. 주입 후
- 누출이나 피가 있는 경우 주사 부위에 면봉을 바릅니다.
참고: 대부분의 경우 없어야 합니다. 우리의 경험에 비추어 볼 때, 누출이나 혈액의 흔적으로 치료된 새끼는 여전히 사용할 수 있지만 데이터 분석 중에 약물 또는 치료의 감소량을 고려해야 할 수 있습니다. - 강아지를 가열 패드에 놓고 강아지가 완전히 회복하고 다시 따뜻해질 때까지 10-15분 동안 기다립니다. 새끼를 집 케이지로 돌려보내기 전에 새끼가 경계하고 적극적으로 움직이는지 주의 깊게 관찰하십시오. 쥐의 적절한 회복은 분홍색 피부색의 회복, 자발적인 신체 움직임 증가, 접촉에 대한 반응으로 나타납니다.
- 강아지를 홈 케이지에 다시 넣고 강아지가 침구, 둥지 또는 둘 다로 제대로 덮여 있는지 확인하십시오. 이렇게 하면 강아지가 댐에서 필요한 모성 보살핌을 받을 수 있습니다.
- 주사 후 최소 3일 동안 매일 일반적인 외모와 활동을 평가합니다. 아픈 모습과 활동 감소는 감염, 치료 관련 부작용 또는 기타 합병증 등의 가능성을 높일 수 있습니다. 필요한 경우 수의사와 상담하십시오.
결과
척수강내 주사에 성공한 후 투여된 용액이 즉시 널리 보급되었지만, 실제 세포 침투는 전달된 약물 및 물질의 특성에 따라 달랐습니다. 이 연구에서는 Fast Green을 사용하여 야생형 신생아(그림 1A-K)에서 척수강내 주사(IT) 후 즉각적인 결과를 시각화하고 기존 뇌뇌실내(ICV) 주사(그림 1L-N)와 비교했습니다. 장기 결과(주입 후 10일)는 CRISPR/Cas9 기반 유전자 편집7의 전달에 의해 활성화된 YFP 리포터 마우스를 사용하여 검사되었습니다. YFP 발현은 CRISPR/Cas9을 처리하지 않은 쥐에 비해 전체 쥐의 뇌에서 광범위하게 관찰되었습니다(그림 2). YFP의 발현은 고배율 하에서 대부분의 세포에서 관찰되었다. 500마리 이상의 갓 태어난 새끼에게 주사를 놓았고, 주사를 맞은 새끼의 98% 이상이 수술에서 살아남았다. 치료된 새끼의 장기 생존 및 건강에 대한 유해한 영향은 관찰되지 않았습니다(보충 그림 1).
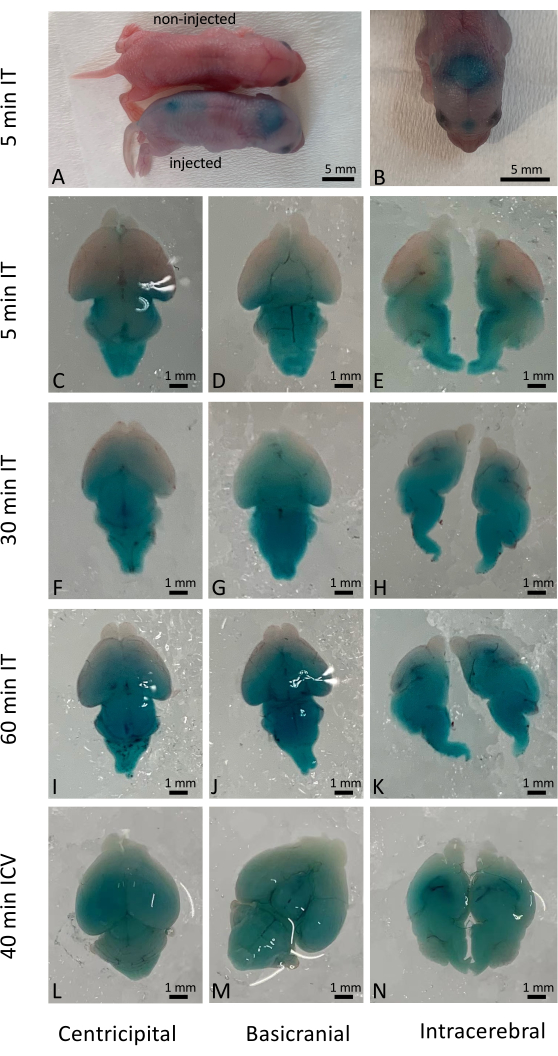
그림 1: 쥐 뇌에서 Fast Green 염료의 시간적 및 공간적 분포. (A) 척수강내 주사 후 5분 후 주입된 마우스와 주입되지 않은 마우스를 비교한 마우스의 총 관찰. (B) 해부 전 쥐 뇌의 Fast Green 염료 분포 시각화. (씨-E) 척수강내 투여 후 5분 후에 절개된 뇌에서의 염료 분포. (FH) 척수강내 투여 후 30분 동안 절개된 뇌에서의 염료 분포. (I-K) 척수강내 투여 후 60분 동안 절개된 뇌에서 염료의 분포. (LN) 비교를 위해, 뇌내 투여 후 40 분 절개 된 뇌에서 염료의 분포. 축척 막대: 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 척수강내 투여 CRISPR/Cas9 유전자 편집의 장기적 효과. CRISPR/Cas9 유전자 편집의 척수강내 주입 후 쥐 뇌에서 YFP 리포터의 광범위한 발현: 소뇌(A-F), 후방 피질(D-F) 및 전전두엽 피질(G-I). 척도 막대: 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 척수강내 CRISPR 유전자 편집 후 Angelman Syndrome 마우스의 생존 곡선. Angelman Syndrome 마우스가 척수강내 투여를 통해 CRISPR 유전자 편집을 받은 결과와 치료되지 않은 야생형 마우스의 결과를 비교한 생존 곡선. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 비디오 1: 신생아 마우스의 척수강내 주사 절차. 신생아 마우스에게 척수강내 주사를 전달하는 과정을 보여주는 비디오. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
신생아 마우스(P1)에서 척수강내 주사를 위한 단계별 절차가 설명되어 있으며, 그 결과 뇌에서 광범위한 약물 분포가 발생합니다. 대뇌피질(11)을 관통하는 것을 포함하는 신생아 마우스에게 약물을 전달하기 위한 일반적인 뇌내주사법과 비교하여, 척수강내 주사는 바늘 관통으로 인한 신생아 마우스의 뇌에 대한 직접적인 손상을 방지한다. 최소 침습성으로 인해, 척수강내 주사는 필요한 경우 반복적으로 수행될 수 있으며, 임상 환경에서 인간에 대한 반복적인 투여를 시뮬레이션할 수 있다12.
두개내 압력의 변화는 일반적으로 척수강내 주입(intrathecal injection)과 연관되어 있으며, 잠재적으로 새끼의 행동 변화로 인해 댐의 거부 및 수유 거부로 이어질 수 있다. 그러나 주사를 맞은 새끼들의 급격한 행동 변화나 생존율 감소는 관찰되지 않았다. 유사하게, 성인의 척수강내 주사와 관련된 비정상적이거나 비정상적인 행동은 발견되지 않았다(데이터는 표시되지 않음).
몇 가지 기술 팁이 성공에 기여했을 수 있으며 강조할 가치가 있습니다. 느린 주입 속도가 중요한 요인일 수 있습니다. 또한 냉동 마취는 주사 전에 두개내 압력을 낮추어 척수강내 주사 중 역류를 최소화하고 다른 합병증을 줄일 수 있습니다. 마지막으로, 주입 부위의 정밀도도 성공률에 영향을 미칠 수 있습니다.
척수강내 투여를 통해 최상의 효능을 얻으려면 새끼가 분만된 후 가능한 한 빨리 절차를 수행하는 것이 중요합니다. 척수강내 주사를 통해 전달된 약물 및 기타 물질은 뇌와 척수를 둘러싸고 있는 수막의 지주막과 지주막 사이의 공간인 척수강내 공간으로 들어갑니다. 그러므로, 척수강내 주사 를 통해 전달된 약물은 이러한 수막층(12)을 통과한다. 인간과 마찬가지로 설치류에서 수막은 경막, 거미막 및 pia mater14의 세 층으로 구성됩니다. 이 막은 배아 발달 중에 형성되며 출생 후 2일(P2)에 완전히 성숙합니다15. 따라서 특히 유전자 편집 실험과 같은 동물 유전자형과 관련된 실험의 경우 신속한 유전형 분석 프로토콜을 사용하여 몇 시간 내에 새끼를 실험 그룹에 할당하는 것이 좋습니다. 새끼에게 일찍 주사를 놓을수록 더 좋은 결과를 얻을 수 있습니다. 주사는 일반적으로 출생 후 3시간 이내에 완료됩니다. 이 시간 창은 주사된 약물이 뇌척수액이 뇌실질로 흐르는 흐름을 따라갈 수 있도록 하는 반면, 뇌실막은 아직 미성숙하고 약물 입자의 크기에 덜 영향을 받습니다. 인간과 생쥐의 발달 차이에 주목할 필요가 있다. P1 신생아 마우스는 인간 뇌 발달의 후기 임신 단계에 해당한다16. P1 신생아 마우스에 대한 실험 결과는 귀중한 개념 증명 역할을 하지만, 중개 연구 설계에서 이러한 결과를 인간에게 외삽할 때는 주의해야 합니다.
이 기술은 제한된 투여 시간과 고도로 숙련된 실험자에 대한 요구 사항으로 인해 어려움을 겪고 있습니다. 실험자가 경험이 부족한 경우 높은 사망률이 절차와 관련될 수 있습니다. 그러나 기간이 짧기 때문에 연구 내에서, 그리고 연구 간에 높은 수준의 정밀도와 반복성이 요구됩니다. 또한 적절한 연습을 통해 이 방법의 숙련도와 성공률을 크게 높일 수 있습니다.
주사가 올바르게 수행되면 주사를 맞은 새끼의 생존은 주로 모성 관리에 의해 영향을 받습니다. 목표를 위해 위탁 암컷 쌍을 준비하는 것이 좋습니다. 표적이 된 새끼가 주사 당일 오후에 배에 우유 반점이 없으면 즉시 위탁 암컷에게 옮겨야 합니다. 암컷 쥐는 냄새로 새끼를 인식합니다. 따라서 시술 중과 시술 후에 실험자나 관련 없는 댐에서 낯선 냄새가 강아지에게 유입되지 않도록 하는 것이 중요합니다. 그러나 위탁 암컷을 사용할 필요성은 개별 실험에 대해 평가되어야 합니다. 환기가 잘 되는 방, 이상적으로는 생물학적 흄 후드에서 절차를 수행하는 것이 좋습니다. 새끼를 댐의 침구 및 배설물과 섞는 것도 도움이 됩니다. 초기 시술 후 점검 후 스트레스를 줄이기 위해 최소 3일 동안 댐에 대한 교란을 최소화하는 것이 좋습니다. 다른 수술과 마찬가지로 시술 후 감염의 위험을 고려해야 합니다. 따라서 주입 중에 멸균 절차에 대한 우수한 실험실 관행을 엄격하게 준수해야 합니다. 척수강내 압력은 외부 환경보다 높아 감염에 대한 자연적인 보호를 제공한다는 점에 유의해야 합니다. 경험에 따르면 주사 후 감염률은 드뭅니다. 그러나 감염 또는 기타 합병증의 징후와 증상을 감지하기 위해 주사 후 최소 3일 동안 강아지의 일반적인 외모와 활동을 매일 모니터링하는 것이 좋습니다. 특별한 경우에는 심각한 합병증이 있는 새끼를 안락사시키는 대신 수의사와의 상담이 필요할 수 있습니다.
공개
YHJ는 Couragene의 공동 창립자이지만 이 프로젝트에 대한 이해 상충은 없습니다.
감사의 말
XNL은 FAST(Foundation for Angelman Syndrome Therapeutic) 박사후 연구원의 지원을 받습니다. YHJ는 또한 FAST와 NIH 보조금 R01HD110195 및 R01MH117289의 지원을 받고 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| Balance | Ohaus Corporation | 30253017 | |
| C57BL/6J mice | The Jackson Laboratory | 000664 | |
| Digital Microscope | RWD | DOM-1001 | |
| DPBS | ThermoFisher | 14190144 | |
| Fast Green | Sigma | F7252-5G | |
| Heating pad | RWD | 69020 | |
| Needles | Hamilton | 6PK (34/0.375”/4/12DEG)S | |
| Syringe | Hamilton | 1702RN | |
| Syringe Filters | Sigma | SLGVM33RS |
참고문헌
- Hoy, S. M. Onasemnogene abeparvovec: first global approval. Drugs. 79 (11), 1255-1262 (2019).
- Ramos, D. M., et al. Age-dependent SMN expression in disease-relevant tissue and implications for SMA treatment. J Clin Invest. 129 (11), 4817-4831 (2019).
- Fedorova, E., Battini, L., Prakash-Cheng, A., Marras, D., Gusella, G. L. Lentiviral gene delivery to CNS by spinal intrathecal administration to neonatal mice. J Gene Med. 8 (4), 414-424 (2006).
- Dindot, S. V., et al. An ASO therapy for Angelman syndrome that targets an evolutionarily conserved region at the start of the UBE3A-AS transcript. Sci Transl Med. 15, eabf4077(2023).
- Amanat, M., Nemeth, C. L., Fine, A. S., Leung, D. G., Fatemi, A. Antisense oligonucleotide therapy for the nervous system: from bench to bedside with emphasis on pediatric neurology. Pharmaceutics. 14 (11), 2389(2022).
- Frangoul, H., et al. CRISPR-Cas9 gene editing for sickle cell disease and β-Thalassemia. N Engl J Med. 384, 252-260 (2021).
- Gillmore, J. D., et al. CRISPR-Cas9 in vivo gene editing for transthyretin amyloidosis. N Engl J Med. 385, 493-502 (2021).
- Krol, A., Feng, G. Windows of opportunity: timing in neurodevelopmental disorders. Curr Opin Neurobiol. 48, 59-63 (2018).
- Birg, T., et al. Brain temperature influences intracranial pressure and cerebral perfusion pressure after traumatic brain injury: A CENTER-TBI Study. Neurocrit Care. 35, 651-661 (2021).
- Rossi, S., Zanier, E. R., Mauri, I., Columbo, A., Stocchetti, N. Brain temperature, body core temperature, and intracranial pressure in acute cerebral damage. J Neurol Neurosurg Psychiatry. 71 (4), 448-454 (2001).
- Kim, J. Y., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. J Vis Exp. 91, e51863(2014).
- Petrou, P., Kassis, I., Yaghmour, N. E., Ginzberg, A., Karussis, D. A phase II clinical trial with repeated intrathecal injections of autologous mesenchymal stem cells in patients with amyotrophic lateral sclerosis. Front Biosci (Landmark Ed). 26 (10), 693-706 (2021).
- Kroin, J. S., et al. The mechanisms of intracranial pressure modulation by epidural blood and other injectates in a postdural puncture rat model. Anesth Analg. 95 (2), 423-429 (2002).
- Møllgård, K., et al. A mesothelium divides the subarachnoid space into functional compartments. Science. 379 (6627), 84-88 (2023).
- Chakrabarty, P., et al. Capsid serotype and timing of injection determines AAV transduction in the neonatal mice brain. PLoS One. 8, e67680(2013).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Prog Neurobiol. 160-107, 1-16 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유