Method Article
ゲノム編集とドラッグデリバリーのための新生児マウスの髄腔内注射
要約
本プロトコルは、遺伝子編集および薬物送達のために新生児マウスで髄腔内注射を行うためのステップバイステップの指示を概説する。
要約
髄腔内注射は、小児科と成人の両方の診療所で一般的に採用されている手順であり、投薬や治療を投与するための効果的な手段として機能します。中枢神経系の脳脊髄液に直接薬剤や治療を送達することで、静脈内注射、皮下注射、筋肉内注射などの他の経路と比較して全身の副作用を軽減しながら、より高い局所的な薬物濃度を実現します。髄腔内注射は、げっ歯類やヒト以外の霊長類を含む他の大型動物の神経遺伝性疾患の治療に焦点を当てた前臨床試験で重要な役割を果たすため、その重要性は臨床現場にとどまらず、臨床現場にとどまりません。しかし、その広範な適用にもかかわらず、若い、特に新生児の子犬への髄腔内注射は、そのサイズが小さく、壊れやすい性質のために重大な技術的課題を提起します。新生児マウスへの髄腔内注射を成功させ、信頼性の高い投与を行うには、細部に細心の注意を払い、さまざまな要因を慎重に検討する必要があります。したがって、指示を提供するだけでなく、手順の一貫性、および動物の安全性と福祉を確保するために、主要な技術的考慮事項と優れた実験室慣行を強調する標準化されたプロトコルが決定的に必要とされています。
この満たされていないニーズに対処するために、出生後1日目(P1)に新生児の子犬に特に髄腔内注射を実施するための詳細で包括的なプロトコルを提示します。ステップバイステップの指示に従うことで、研究者は自信を持って新生児の子犬に髄腔内注射を行うことができ、遺伝子置換やゲノム編集ベースの治療のための薬物、アンチセンスオリゴ、ウイルスの正確な送達が可能になります。さらに、動物の健康を維持し、信頼性の高い実験結果を確保するために、優れた実験慣行を遵守することの重要性が強調されています。このプロトコルは、新生児マウスの髄腔内注射に関連する技術的課題に対処することを目的としており、最終的には、潜在的な治療介入の開発を目的とした神経遺伝学的研究の分野の進歩を促進します。
概要
髄腔内(IT)注射は、クリニックの小児患者と成人患者の両方で、投薬、脳脊髄液の収集、および頭蓋内圧の維持に使用される一般的な臨床手順です1,2。髄腔内注射による薬物の投与は、全身曝露を最小限に抑えながら、中枢神経系(CNS)の薬物濃度を高めるための効果的なアプローチです。その結果、この方法は、特に温度に敏感で半減期の短い薬物の場合、治療効果を高め、副作用を軽減します3。
げっ歯類モデルを用いて新薬や治療法を試験する前臨床試験では、より高い精度と結果の再現性を提供する信頼性の高い薬物投与方法を採用することが不可欠です4,5。神経遺伝性疾患および神経発達障害の新しい治療法を評価する前臨床試験では、早期の介入が通常、より好ましい結果をもたらすと予測されるため、早期治療が最初の概念実証研究に不可欠です6,7,8。
従来の脳室内(ICV)注射と比較して、IT注射は大脳皮質を直接貫通する必要がないため、リスクが大幅に低くなります。この利点は、局所皮質組織および周囲の神経への潜在的な損傷を大幅に軽減します。さらに、IT注射は、1回の注射で投与可能な薬剤量を少なくとも5倍に増やすことができ、反復投与の実現性を大幅に高めます。しかし、新生児マウスはサイズが小さく壊れやすいため、新生児に髄腔内注射を行うことは技術的に困難であり、特殊な技術、機器、細心の注意を払った取り扱いが必要です。
この記事では、P1新生児の子犬に髄腔内注射を行うための詳細なプロトコルとステップバイステップの手順を提供します。ここでは、投与の一貫性と、処置中の動物の安全性と健康を確保するために、重要な考慮事項と適切な検査方法が強調されています。このプロトコルに従うことで、研究者は動物への潜在的なリスクや不快感を最小限に抑えながら、正確で再現性の高い実験を自信を持って行うことができます。
プロトコル
記載されている手順とプロトコルは、National Institutes of Health Guide for the Care and Use of Laboratory Animals(国立衛生研究所の実験動物のケアと使用に関するガイド)に概説されているガイドラインに準拠していました。さらに、この手順は、イェール大学医学部の動物管理および使用委員会から承認を受けました。新生児野生型(WT)C57BL/6Jの雄と雌のマウスを研究に使用しました。動物は市販の供給源から入手した( 資料表参照)。
1. ワークスペースの準備
- まず、凍結麻酔用のウェットアイス、仔犬をダムから分離するための空のケージ、解剖顕微鏡、光源、注射中に動物を置くための清潔な表面、綿棒、加熱パッド、25/10μLの注射器、34 G / 0.375 "/ 12°の針)を準備します( 資料表を参照)。
注:ウェットアイスを使用したマウスの子犬の凍結麻酔は、取り扱いを容易にし、子犬の動きを減らし、潜在的な動物の不快感を最小限に抑えることを目的としたオプションのステップです。この凍結麻酔ステップは、頭蓋内圧を下げ、容積関連の合併症を減らすという利点も提供する可能性があります9,10。 - 子犬を扱いながら、ダムから離れた別のケージに移動します。
- 各子犬の体重を量り、体重を記録します。
- ガーゼとエタノールを使用してマウスの背面を拭きます。解剖顕微鏡を使用して、椎間腔または少なくとも脊柱管の正中線(P1の子犬では赤く見えるはずです)を確認します(補足ビデオ1)。
2.注射手順
- 1匹の子犬に麻酔をかけるには、ラテックススリーブやアルミホイルなどの防水バリアの上に氷浴で3〜5分間そっと置きます。動物を長時間氷の上に放置すると、心室細動、組織低酸素症、代謝性アシドーシスなどの低体温症関連の合併症の潜在的なリスクが生じる可能性があるため、避けることが重要です。
注意: 3〜5分の持続時間は、ケースバイケースで異なる場合があります。つま先のつまみに対する無反応などの麻酔の兆候を評価して、適切な期間を決定します。 - 動物が氷上にいる間に、シリンジに10μLの製剤、ウイルス製剤、またはコントロール人工脊髄液などを装填します。
注:学習段階では、同量の混合1%ファストグリーン色素をデリバリ材料に注入するオプションを検討してください( 材料表を参照)。これは、射出プロセスを視覚化し、技術の学習と改良に役立ちます。Fast Green Dyeまたは同様の材料を注射した子犬は、動物に炎症反応やその他の副作用を引き起こす可能性があるため、承認されたプロトコルに従って注射後すぐに安楽死させる必要があります。 - 動物が完全に麻酔されたら、体の動きの減少または不在によって確認されるように、子犬を顕微鏡の下にそっと配置します。
- 左手の人差し指と親指で、両側の骨盤帯の間にある正中線に沿って椎間腔を慎重に触診します(補足ビデオ1)。尾の付け根を少しゆっくりと回転させて、背骨の正中線を特定しやすくします。
- 注射する前に、針の斜角を動物の頭に向かって調整します。
- 針を慎重に挿入し、くぼみが交差する点で70°〜80°の角度にわずかに傾け、シリンジが中央矢状面に揃っていることを確認します。針が骨に接触したら、徐々に角度を約30°に下げてから、針を椎間腔に約2mm進めます。
注意: 針が全身をわずかに持ち上げる能力は、硬膜内腔への侵入が成功した兆候です。 - 50〜60秒以内に最大10μLの容量をゆっくりと注入します。配達が完了した後、針を10〜20秒間所定の位置に置いてください。漏れを防ぐために、針を穏やかに回転させて引き出します。
注意: 針を抜く前に小脳が緑色に変わります。また、分娩に伴う頭蓋内圧の上昇を防ぎ、潜在的な合併症を最小限に抑えるために、ゆっくりと押すことが重要です。500匹以上の子犬への注射の経験に基づくと、50〜60秒で10μLの容量を送達することが最適です。
3. ポスト注入
- 漏れや血液がある場合は、注射部位に綿棒を塗ります。
注:ほとんどの場合、何もありません。私たちの経験から、微量の漏れや血液で治療された子犬はまだ使用可能ですが、データ分析中に薬や治療の減量を検討する必要があるかもしれません。 - 子犬を加熱パッドの上に置き、子犬が完全に回復して再温まるまで10〜15分待ちます。子犬を注意深く観察して、子犬が警戒し、活発に動いていることを確認してから、自宅のケージに戻してください。マウスの適切な回復は、ピンク色の皮膚色の回復、自発的な体の動きの増加、および触覚に対する反応反応によって示されます。
- 子犬をホームケージに戻し、子犬が寝具、雛、またはその両方で適切に覆われていることを確認します。これにより、子犬はダムから必要な母親のケアを受けることができます。
- 注射後少なくとも3日間、一般的な外観と活動を毎日評価します。.体調が悪く、活動性が低下すると、感染症や治療に伴う副作用、その他の合併症などの可能性が高くなります。必要に応じて、獣医師に相談してください。
結果
髄腔内注射が成功すると、投与された溶液がすぐに広範囲に分布しましたが、実際の細胞浸透は送達された薬物および材料の性質に依存していました。本研究では、Fast Greenを用いて、野生型新生児の髄腔内注射(IT)直後の結果を可視化し(図1A-K)、従来の脳室内(ICV)注射(図1L-N)と比較しました。長期結果(注射後10日)は、CRISPR/Cas9ベースの遺伝子編集7の送達によって活性化されたYFPレポーターマウスを用いても調べた。YFPの発現は、CRISPR/Cas9処理されていないマウスと比較して、マウスの脳全体で広く観察されました(図2)。YFPの発現は、高倍率で大部分の細胞で観察されました。500頭以上の新生児に注射が行われ、注射された子犬の98%以上が手術を生き延びました。治療した仔動物の長期生存と健康への有害な影響は観察されませんでした(補足図1)。
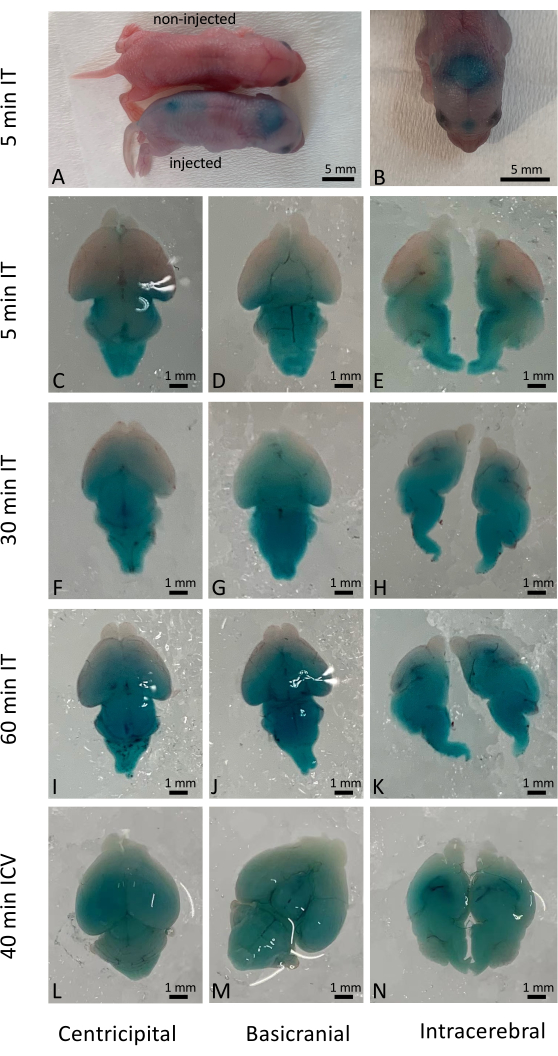
図1:マウス脳におけるFast Green色素の時間的および空間的分布。 (A)髄腔内注射の5分後に注射されたマウスと注射されていないマウスを比較したマウスの肉眼的観察。(B)解剖前のマウス脳内のFast Green色素の分布の可視化。(C-E)髄腔内投与の5分後の解剖された脳における色素の分布。(F-H)髄腔内投与の30分後の解剖された脳における色素の分布。(I-K)髄腔内投与の60分後の解剖された脳における色素の分布。(左から左)比較のために、脳室内投与の40分後の解剖された脳における色素の分布。スケールバー:1 mm。この図の拡大版をご覧になるには、ここをクリックしてください。

図2:髄腔内投与されたCRISPR/Cas9遺伝子編集の長期的影響。CRISPR/Cas9遺伝子編集の髄腔内注射後のマウス脳におけるYFPレポーターの広範な発現:小脳(A-F)、後部皮質(D-F)、および前頭前野(G-I)。スケールバー:50 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
補足図1:髄腔内CRISPR遺伝子編集後のアンジェルマン症候群マウスの生存曲線。 髄腔内投与によってCRISPR遺伝子編集を受けたアンジェルマン症候群マウスの転帰を、未治療および野生型マウスと比較した生存曲線。 このファイルをダウンロードするには、ここをクリックしてください。
補足動画1:新生仔マウスにおける髄腔内注射法。 新生児マウスに髄腔内注射を送達するプロセスを示すビデオ。 このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
新生仔マウス(P1)における髄腔内注射の段階的な手順を説明し、その結果、脳内に薬物が広範囲に分布する。大脳皮質11に穿刺する新生仔マウスに薬剤を送達するための一般的な脳室内注射法と比較して、髄腔内注射は、針の貫通による新生児マウスの脳への直接的な損傷を回避します。侵襲性が最小限であるため、髄腔内注射は必要に応じて繰り返し行うことができ、臨床現場でのヒトへの反復投与をシミュレートします12。
頭蓋内圧の変化は、一般的に髄腔内注射13と関連しており、仔の行動変化による母体の拒絶反応や摂食拒否につながる可能性があります。しかし、注射された子犬の行動の急激な変化や生存率の低下は観察されていません。.同様に、成人の髄腔内注射に関連する異常または異常な行動は認識されていません(データは示されていません)。.
いくつかの技術的なヒントが成功に貢献した可能性があり、強調する価値があります。注入速度が遅いことが重要な要因である可能性があります。さらに、凍結麻酔は注射前に頭蓋内圧を低下させ、髄腔内注射中の逆流を最小限に抑え、他の合併症を軽減する可能性があります。最後に、注射部位の精度も成功率に影響を与える可能性があります。
髄腔内投与 によって 最高の効果を達成するには、子犬が分娩された後、できるだけ早く手順を実行することが重要です。髄腔内注射 で 送達された薬物やその他の物質は、脳と脊髄を取り囲む髄膜のくも膜層と軟膜層の間の空間である髄腔内腔に入ります。したがって、髄腔内注射 を介して 送達された薬物は、髄膜12のこれらの層を通過する。げっ歯類では、ヒトと同様に、髄膜は硬膜、くも膜、軟膜の3つの層で構成されています14。これらの膜は胚発生中に形成され、出生後2日目(P2)までに完全に成熟します15。したがって、特に遺伝子編集実験など、動物の遺伝子型を含む実験では、ラピッドジェノタイピングプロトコルを使用して数時間以内に子犬を実験グループに割り当てることが推奨されます。子犬が早く注射されるほど、結果は良くなります。注射は通常、出生後3時間以内に完了します。この時間枠により、注射された薬物は脳脊髄液が脳実質に流れ込むのに対し、上衣の内層はまだ未熟で、薬物粒子のサイズの影響を受けにくい。人間とマウスの発達の違いは注目に値します。P1新生仔マウスは、ヒトの脳発達の妊娠後期に対応する16。P1新生児マウスを用いた実験結果は、貴重な概念実証として役立つが、トランスレーショナルスタディデザインにおいてこれらの結果をヒトに外挿する際には注意が必要である。
この手法は、管理期間の制約と高度なスキルを持つ実験者の要件によって課題となっています。高い死亡率は、実験者が経験に乏しい場合、手順に関連している可能性があります。しかし、時間枠が狭いため、研究内および研究間でより高いレベルの精度と再現性が要求されます。さらに、十分な練習を積めば、この方法の習熟度と成功率を大幅に向上させることができます。
注射が正しく行われれば、注射された子犬の生存は主に母親のケアの影響を受けます。ターゲットに合わせて里親のメスペアを準備することをお勧めします。対象となる仔犬が注射日の午後にお腹にミルクスポットがない場合は、すぐに里親のメスに移す必要があります。雌マウスは匂いで赤ちゃんを認識します。したがって、実験者や無関係なダムからのなじみのない臭いを、手順中および手順後に子犬に持ち込まないようにすることが重要です。ただし、里親の雌を使用する必要性は、個々の実験で評価する必要があります。換気の良い部屋、理想的には生物学的ドラフトで手順を実行することもお勧めします。仔犬をダムの寝具や排泄物と混ぜるのも効果的です。最初の処置後のチェックの後、ストレスを軽減するために、少なくとも3日間はダムへの干渉を最小限に抑えることをお勧めします。他の外科的処置と同様に、処置後の感染のリスクを考慮する必要があります。したがって、注射中は、無菌手順の適切な実験室慣行を厳守する必要があります。.髄腔内圧は外部環境よりも高く、感染に対する自然な保護を提供することに注意すべきです。経験上、注射後の感染率はまれです。ただし、感染やその他の合併症の兆候や症状を検出するために、注射後少なくとも3日間、子犬の一般的な外観と活動を毎日監視することをお勧めします。.特別なケースでは、重大な合併症のある子犬を安楽死させる代わりに、獣医サービスとの相談が正当化される場合があります。
開示事項
YHJはCourageneの共同設立者ですが、このプロジェクトには利益相反はありません。
謝辞
XNLは、Foundation for Angelman Syndrome Therapeutic(FAST)ポスドクフェローシップの支援を受けています。YHJは、FASTとNIHの助成金R01HD110195とR01MH117289の支援も受けています。
資料
| Name | Company | Catalog Number | Comments |
| Balance | Ohaus Corporation | 30253017 | |
| C57BL/6J mice | The Jackson Laboratory | 000664 | |
| Digital Microscope | RWD | DOM-1001 | |
| DPBS | ThermoFisher | 14190144 | |
| Fast Green | Sigma | F7252-5G | |
| Heating pad | RWD | 69020 | |
| Needles | Hamilton | 6PK (34/0.375”/4/12DEG)S | |
| Syringe | Hamilton | 1702RN | |
| Syringe Filters | Sigma | SLGVM33RS |
参考文献
- Hoy, S. M. Onasemnogene abeparvovec: first global approval. Drugs. 79 (11), 1255-1262 (2019).
- Ramos, D. M., et al. Age-dependent SMN expression in disease-relevant tissue and implications for SMA treatment. J Clin Invest. 129 (11), 4817-4831 (2019).
- Fedorova, E., Battini, L., Prakash-Cheng, A., Marras, D., Gusella, G. L. Lentiviral gene delivery to CNS by spinal intrathecal administration to neonatal mice. J Gene Med. 8 (4), 414-424 (2006).
- Dindot, S. V., et al. An ASO therapy for Angelman syndrome that targets an evolutionarily conserved region at the start of the UBE3A-AS transcript. Sci Transl Med. 15, eabf4077(2023).
- Amanat, M., Nemeth, C. L., Fine, A. S., Leung, D. G., Fatemi, A. Antisense oligonucleotide therapy for the nervous system: from bench to bedside with emphasis on pediatric neurology. Pharmaceutics. 14 (11), 2389(2022).
- Frangoul, H., et al. CRISPR-Cas9 gene editing for sickle cell disease and β-Thalassemia. N Engl J Med. 384, 252-260 (2021).
- Gillmore, J. D., et al. CRISPR-Cas9 in vivo gene editing for transthyretin amyloidosis. N Engl J Med. 385, 493-502 (2021).
- Krol, A., Feng, G. Windows of opportunity: timing in neurodevelopmental disorders. Curr Opin Neurobiol. 48, 59-63 (2018).
- Birg, T., et al. Brain temperature influences intracranial pressure and cerebral perfusion pressure after traumatic brain injury: A CENTER-TBI Study. Neurocrit Care. 35, 651-661 (2021).
- Rossi, S., Zanier, E. R., Mauri, I., Columbo, A., Stocchetti, N. Brain temperature, body core temperature, and intracranial pressure in acute cerebral damage. J Neurol Neurosurg Psychiatry. 71 (4), 448-454 (2001).
- Kim, J. Y., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. J Vis Exp. 91, e51863(2014).
- Petrou, P., Kassis, I., Yaghmour, N. E., Ginzberg, A., Karussis, D. A phase II clinical trial with repeated intrathecal injections of autologous mesenchymal stem cells in patients with amyotrophic lateral sclerosis. Front Biosci (Landmark Ed). 26 (10), 693-706 (2021).
- Kroin, J. S., et al. The mechanisms of intracranial pressure modulation by epidural blood and other injectates in a postdural puncture rat model. Anesth Analg. 95 (2), 423-429 (2002).
- Møllgård, K., et al. A mesothelium divides the subarachnoid space into functional compartments. Science. 379 (6627), 84-88 (2023).
- Chakrabarty, P., et al. Capsid serotype and timing of injection determines AAV transduction in the neonatal mice brain. PLoS One. 8, e67680(2013).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Prog Neurobiol. 160-107, 1-16 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved