Method Article
新生小鼠鞘内注射用于基因组编辑和药物递送
摘要
本方案概述了在新生小鼠中进行鞘内注射以进行基因编辑和药物递送的分步说明。
摘要
鞘内注射是儿科和成人诊所常用的程序,是管理药物和治疗的有效手段。通过将药物和治疗直接输送到中枢神经系统的脑脊液中,与其他途径(如静脉注射、皮下注射或肌肉注射)相比,这种方法实现了更高的局部药物浓度,同时减少了全身副作用。其重要性超出了临床环境,因为鞘内注射在专注于治疗啮齿动物和其他大型动物(包括非人灵长类动物)的神经遗传疾病的临床前研究中起着至关重要的作用。然而,尽管鞘内注射应用广泛,但鞘内注射幼崽,尤其是新生幼崽,由于其体积小且易碎,因此带来了重大的技术挑战。在新生小鼠中成功和可靠地进行鞘内注射需要一丝不苟地关注细节并仔细考虑各种因素。因此,迫切需要一个标准化的协议,不仅要提供说明,还要强调关键的技术考虑因素和良好的实验室规范,以确保程序的一致性以及动物的安全和福利。
为了解决这一未满足的需求,我们提出了一个详细而全面的方案,用于在出生后第 1 天 (P1) 专门对新生幼崽进行鞘内注射。通过遵循分步说明,研究人员可以自信地在新生幼崽中进行鞘内注射,从而能够准确递送药物、反义寡核苷酸和病毒,用于基因替换或基于基因组编辑的治疗。此外,还强调了遵守良好实验室规范的重要性,以维持动物的健康并确保可靠的实验结果。该协议旨在解决与新生小鼠鞘内注射相关的技术挑战,最终促进神经遗传学研究领域的进步,旨在开发潜在的治疗干预措施。
引言
鞘内 (IT) 注射是一种常见的临床程序,用于给药、收集脑脊液和维持儿科和成人患者的颅内压 1,2。通过鞘内注射给药是增加中枢神经系统 (CNS) 中药物浓度同时最大限度地减少全身暴露的有效方法。因此,该方法增强了治疗效果并减少了副作用,特别是对于温度敏感和半衰期短的药物3。
在使用啮齿动物模型测试新药和治疗方法的临床前研究中,必须采用可靠的药物给药方法,以提供更高的精度和结果可重复性4,5。对于评估神经遗传和神经发育障碍新疗法的临床前研究,早期治疗对于初始概念验证研究至关重要,因为早期干预通常预计会产生更有利的结果6,7,8。
与传统的脑室内 (ICV) 注射相比,IT 注射的风险显着降低,因为它们避免了直接穿透大脑皮层的需要。这一优势大大减少了对区域皮质组织和周围神经的潜在损害。此外,IT注射允许通过单次注射将药物的可管理量增加至少五倍,大大提高了重复给药的可行性。然而,由于新生小鼠体型小且脆弱,对新生幼崽进行鞘内注射在技术上具有挑战性,需要专门的技术、设备和细致的处理。
本文提供了详细的方案,其中包含在 P1 新生幼崽中进行鞘内注射的分步说明。这里强调关键考虑因素和良好的实验室规范,以确保给药的一致性以及手术过程中动物的安全和福祉。通过遵循该协议,研究人员可以自信地进行精确和可重复的实验,同时最大限度地减少对动物的任何潜在风险或不适。
研究方案
所描述的程序和协议符合美国国立卫生研究院《实验动物护理和使用指南》中概述的指南。此外,这些程序还获得了耶鲁大学医学院动物护理和使用委员会的批准。采用新生野生型(WT)C57BL/6J雄性和雌性小鼠进行研究。这些动物是从商业来源获得的(见 材料表)。
1. 工作空间的准备
- 首先准备以下物品:用于冷冻麻醉的湿冰、将幼崽与大坝分开的空笼子、解剖显微镜、光源、用于在注射过程中放置动物的清洁表面、棉签、加热垫、25/10 μL 注射器和 34 G/0.375"/12 DEG 针头(见 材料表)。
注意:使用湿冰对小鼠幼崽进行冷冻麻醉是一个可选步骤,旨在促进处理、减少幼崽运动并最大限度地减少潜在的动物不适。这种冷冻麻醉步骤还可能提供降低颅内压和减少与容量相关的并发症的益处9,10。 - 在处理幼崽时,将幼崽移到远离大坝的单独笼子中。
- 称量每只幼犬的体重并记录它们的体重。
- 用纱布和乙醇擦拭鼠标背面。使用解剖显微镜确认椎间隙或至少确认椎管的中线(在 P1 幼崽中应显示为红色)(补充视频 1)。
2. 注射程序
- 要麻醉一只幼犬,请轻轻地将其放在防水屏障上,例如冰浴上的乳胶套或铝箔 3-5 分钟。避免将动物长时间留在冰上很重要,因为这样做可能会带来与体温过低相关的并发症的潜在风险,包括心室颤动、组织缺氧和代谢性酸中毒。
注意:3-5 分钟的持续时间可能因具体情况而异。评估麻醉体征,例如对脚趾捏伤无反应,以确定适当的持续时间。 - 当动物在冰上时,在注射器中装入 10 μL 药物制剂、病毒制剂或控制人工脊髓液等。
注意:在学习阶段,考虑将相同体积的混合 1% Fast Green 染料与递送材料一起注入的选项(参见 材料表)。这有助于可视化注射过程,并有助于学习和改进技术。根据批准的方案,注射了快速绿色染料或类似材料的幼犬应在注射后不久被安乐死,因为这些材料可能会导致动物的炎症反应或其他副作用。 - 一旦动物被完全麻醉,如身体运动减少或不存在所证实的那样,轻轻地将幼崽放在显微镜下。
- 用左手食指和拇指小心触诊位于双侧骨盆带之间的中线椎间隙(补充视频1)。轻轻旋转尾巴的底部,以帮助识别脊柱的中线。
- 注射前将针头斜面调整到动物头部。
- 小心地插入针头,在压痕相交处将其稍微倾斜至 70°-80° 的角度,同时确保注射器与中央矢状面对齐。当针头与骨骼接触时,逐渐将角度减小至约 30°,然后将针头推进约 2 毫米进入椎间隙。
注意: 针头轻微抬起整个身体的能力是成功进入硬膜内腔的标志。 - 在 50-60 秒内缓慢进样至 10 μL 体积。分娩完成后,将针头保持在原位 10-20 秒。轻轻旋转取出针头,以免漏水。
注意: 在拔出针头之前,小脑会变绿。此外,缓慢推动对于防止与分娩相关的颅内压升高和最大限度地减少潜在的并发症至关重要。根据我们在 500 多只幼崽中注射的经验,在 50-60 秒内提供 10 μL 的体积是最佳的。
3.注射后
- 如果有任何渗漏或血液,请将棉签涂抹在注射部位。
注意:在大多数情况下,不应该有任何。根据我们的经验,用渗漏或血液痕迹处理的幼崽仍然可以使用,但在数据分析期间可能需要考虑减少药物或治疗剂量。 - 将幼犬放在加热垫上,等待 10-15 分钟让幼犬完全恢复并重新加热。仔细观察幼崽,确保它们保持警觉并积极移动,然后再将它们放回家中笼子。小鼠的充分恢复表现为粉红色的恢复,自发的身体运动增加以及对触摸的反应。
- 将幼犬放回家庭笼子中,并确保幼犬被床上用品、燕窝或两者正确覆盖。这确保了幼犬从大坝获得必要的孕产妇护理。
- 注射后至少 3 天每天评估一般外观和活动。生病的外观和活动减少可能会增加感染、治疗相关副作用或其他并发症等的可能性。如有必要,请咨询兽医护理。
结果
成功的鞘内注射立即导致给药溶液的广泛分布,尽管实际的细胞渗透取决于递送的药物和材料的性质。在这项研究中,我们使用 Fast Green 可视化野生型新生儿鞘内注射 (IT) 后的即时结果(图 1A-K),并将其与传统的脑室内 (ICV) 注射进行比较(图 1L-N)。还使用由递送基于 CRISPR/Cas9 的基因编辑激活的 YFP 报告小鼠检查了长期结果(注射后 10 天)7。与未经CRISPR/Cas9处理的小鼠相比,YFP在整个小鼠大脑中广泛表达(图2)。在较高放大倍率下,在大多数细胞中观察到YFP的表达。对 500 多只新生幼崽进行了注射,超过 98% 的注射幼崽在手术中幸存下来。未观察到对接受治疗的幼崽的长期存活和健康产生有害影响(补充图1)。
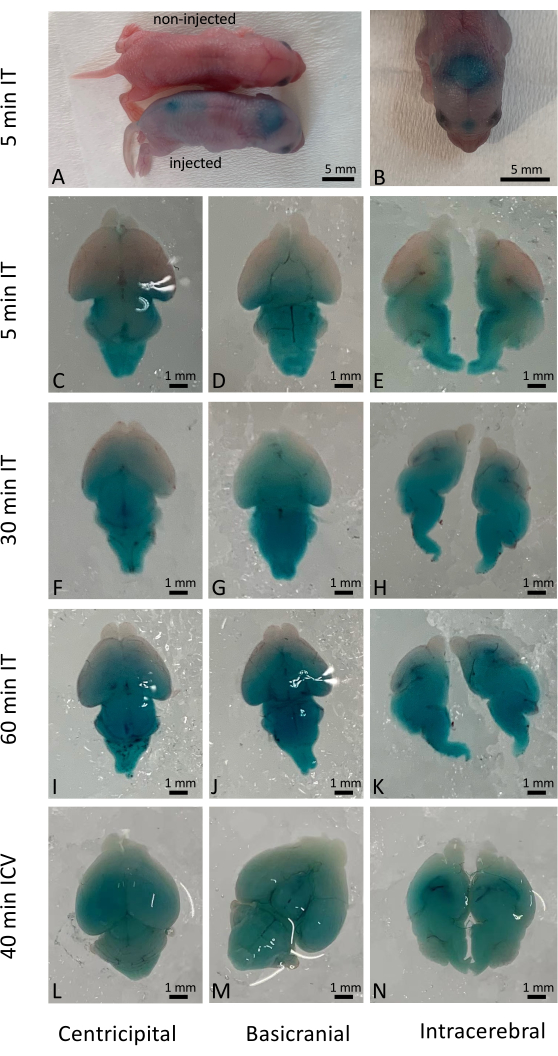
图1:Fast Green染料在小鼠大脑中的时空分布。 (A)大体观察小鼠,在鞘内注射后5分钟比较注射和未注射的小鼠。(B)解剖前Fast Green染料在小鼠大脑中的分布可视化。(C-E)鞘内给药后5分钟在解剖脑中的分布。(F-H)鞘内给药后30分钟在解剖脑中的分布。(I-K)鞘内给药后60分钟在解剖脑中的分布。(从左到北)为了进行比较,在脑室内给药后40分钟解剖脑中的染料分布。比例尺:1 毫米。 请点击这里查看此图的较大版本.

图 2:鞘内给药 CRISPR/Cas9 基因编辑的长期影响。鞘内注射 CRISPR/Cas9 基因编辑后,YFP 报告基因在小鼠大脑中广泛表达:小脑 (A-F)、后皮层 (D-F) 和前额叶皮层 (G-I)。比例尺:50 μm。 请点击这里查看此图的较大版本.
补充图1:鞘内CRISPR基因编辑后Angelman综合征小鼠的生存曲线。 与未治疗和野生型小鼠相比,通过鞘内给药接受 CRISPR 基因编辑的 Angelman 综合征小鼠的结果的生存曲线。 请点击此处下载此文件。
补充视频1:新生小鼠的鞘内注射程序。 视频演示了向新生小鼠进行鞘内注射的过程。 请按此下载此影片。
讨论
所描述的是在新生小鼠(P1)中鞘内注射的分步程序,导致药物在其大脑中广泛分布。与常见的脑室内注射方法相比,用于向新生小鼠递送药物的方法涉及刺穿大脑皮层11,鞘内注射避免了由于针刺而对新生小鼠大脑的直接伤害。由于侵入性最小,鞘内注射可以在必要时重复进行,模拟在临床环境中在人体中重复给药12。
颅内压的变化通常与鞘内注射有关 13,由于幼崽的行为变化,可能导致大坝排斥和拒绝进食。然而,尚未观察到注射幼崽行为的急性变化或存活率降低。同样,与成人鞘内注射相关的异常或异常行为也没有被注意到(数据未显示)。
一些技术技巧可能有助于取得成功,值得强调。较慢的注射速度可能是一个重要因素。此外,冷冻麻醉可以降低注射前的颅内压,最大限度地减少鞘内注射期间的回流并减少其他并发症。最后,注射部位的精度也可能影响成功率。
为了 通过 鞘内给药达到最佳疗效,在幼崽分娩后尽快执行该程序至关重要。 通过 鞘内注射输送的药物和其他物质进入鞘内间隙,鞘内间隙是围绕大脑和脊髓的脑膜的蛛网膜层和软脑膜层之间的空间。因此, 通过 鞘内注射给药的药物通过脑膜的这些层12.在啮齿动物中,与人类一样,脑膜由三层组成:硬脑膜、蛛网膜和软脑膜14。这些膜在胚胎发育过程中形成,并在出生后第 2 天 (P2) 完全成熟15。因此,建议使用快速基因分型方案在几个小时内将幼崽分配到实验组,特别是对于涉及动物基因型的实验,例如基因编辑实验。幼崽越早注射,结果越好。注射通常在出生后 3 小时内完成。这个时间窗口允许注射的药物跟随脑脊液流入脑实质,而室管膜内膜仍不成熟,受药物颗粒大小的影响较小。值得注意的是人类和小鼠之间的发育差异。P1新生小鼠对应于人脑发育的妊娠晚期16。P1新生小鼠的实验结果可作为有价值的概念证明,但在转化研究设计中将这些结果外推到人类时应谨慎行事。
这种技术受到有限的管理时间窗口和对高技能实验人员的要求的挑战。如果实验者缺乏经验,则高死亡率可能与该程序有关。然而,时间紧迫,要求在研究内部和研究之间提高精度和可重复性。此外,通过充分的练习,可以显着提高该方法的熟练程度和成功率。
如果注射正确,注射幼崽的存活主要受母体护理的影响。建议为您的目标准备寄养雌性对。如果目标幼崽在注射当天下午腹部没有乳点,应立即将其转移到寄养雌性。雌性小鼠通过气味识别它们的婴儿。因此,在手术期间和之后,避免将实验人员或无关水坝的不熟悉气味引入幼崽至关重要。然而,应根据个别实验评估使用寄养女性的必要性。还建议在通风良好的房间内进行该过程,最好是在生物通风橱中进行。将幼崽与大坝的垫料和排泄物混合也很有帮助。在最初的术后检查后,建议将对大坝的干扰最小化至少 3 天以减轻压力。与任何外科手术一样,应考虑术后感染的风险。因此,在注射过程中应严格遵守无菌程序的良好实验室规范。应该注意的是,鞘内压高于外部环境,提供自然保护,防止感染。经验表明,注射后感染的发生率很少见。但是,建议在注射后至少3天内每天监测幼犬的一般外观和活动,以检测感染或其他并发症的体征和症状。在特殊情况下,可能需要咨询兽医服务,而不是对有严重并发症的幼犬实施安乐死。
披露声明
YHJ是Couragene的联合创始人,但与该项目没有利益冲突。
致谢
XNL得到了天使综合症治疗基金会(FAST)博士后奖学金的支持。YHJ 还得到了 FAST 和 NIH Grant R01HD110195 和 R01MH117289 的支持。
材料
| Name | Company | Catalog Number | Comments |
| Balance | Ohaus Corporation | 30253017 | |
| C57BL/6J mice | The Jackson Laboratory | 000664 | |
| Digital Microscope | RWD | DOM-1001 | |
| DPBS | ThermoFisher | 14190144 | |
| Fast Green | Sigma | F7252-5G | |
| Heating pad | RWD | 69020 | |
| Needles | Hamilton | 6PK (34/0.375”/4/12DEG)S | |
| Syringe | Hamilton | 1702RN | |
| Syringe Filters | Sigma | SLGVM33RS |
参考文献
- Hoy, S. M. Onasemnogene abeparvovec: first global approval. Drugs. 79 (11), 1255-1262 (2019).
- Ramos, D. M., et al. Age-dependent SMN expression in disease-relevant tissue and implications for SMA treatment. J Clin Invest. 129 (11), 4817-4831 (2019).
- Fedorova, E., Battini, L., Prakash-Cheng, A., Marras, D., Gusella, G. L. Lentiviral gene delivery to CNS by spinal intrathecal administration to neonatal mice. J Gene Med. 8 (4), 414-424 (2006).
- Dindot, S. V., et al. An ASO therapy for Angelman syndrome that targets an evolutionarily conserved region at the start of the UBE3A-AS transcript. Sci Transl Med. 15, eabf4077(2023).
- Amanat, M., Nemeth, C. L., Fine, A. S., Leung, D. G., Fatemi, A. Antisense oligonucleotide therapy for the nervous system: from bench to bedside with emphasis on pediatric neurology. Pharmaceutics. 14 (11), 2389(2022).
- Frangoul, H., et al. CRISPR-Cas9 gene editing for sickle cell disease and β-Thalassemia. N Engl J Med. 384, 252-260 (2021).
- Gillmore, J. D., et al. CRISPR-Cas9 in vivo gene editing for transthyretin amyloidosis. N Engl J Med. 385, 493-502 (2021).
- Krol, A., Feng, G. Windows of opportunity: timing in neurodevelopmental disorders. Curr Opin Neurobiol. 48, 59-63 (2018).
- Birg, T., et al. Brain temperature influences intracranial pressure and cerebral perfusion pressure after traumatic brain injury: A CENTER-TBI Study. Neurocrit Care. 35, 651-661 (2021).
- Rossi, S., Zanier, E. R., Mauri, I., Columbo, A., Stocchetti, N. Brain temperature, body core temperature, and intracranial pressure in acute cerebral damage. J Neurol Neurosurg Psychiatry. 71 (4), 448-454 (2001).
- Kim, J. Y., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. J Vis Exp. 91, e51863(2014).
- Petrou, P., Kassis, I., Yaghmour, N. E., Ginzberg, A., Karussis, D. A phase II clinical trial with repeated intrathecal injections of autologous mesenchymal stem cells in patients with amyotrophic lateral sclerosis. Front Biosci (Landmark Ed). 26 (10), 693-706 (2021).
- Kroin, J. S., et al. The mechanisms of intracranial pressure modulation by epidural blood and other injectates in a postdural puncture rat model. Anesth Analg. 95 (2), 423-429 (2002).
- Møllgård, K., et al. A mesothelium divides the subarachnoid space into functional compartments. Science. 379 (6627), 84-88 (2023).
- Chakrabarty, P., et al. Capsid serotype and timing of injection determines AAV transduction in the neonatal mice brain. PLoS One. 8, e67680(2013).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Prog Neurobiol. 160-107, 1-16 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。