Method Article
Injection intrathécale de souris nouveau-née pour l’édition du génome et l’administration de médicaments
Dans cet article
Résumé
Le présent protocole décrit les instructions étape par étape pour effectuer des injections intrathécales chez les souris néonatales pour l’édition de gènes et l’administration de médicaments.
Résumé
L’injection intrathécale est une procédure couramment utilisée dans les cliniques pédiatriques et adultes, servant de moyen efficace d’administrer des médicaments et des traitements. En administrant directement des médicaments et des traitements dans le liquide céphalo-rachidien du système nerveux central, cette méthode permet d’obtenir des concentrations localisées plus élevées de médicaments tout en réduisant les effets secondaires systémiques par rapport à d’autres voies telles que les injections intraveineuses, sous-cutanées ou intramusculaires. Son importance s’étend au-delà des paramètres cliniques, car l’injection intrathécale joue un rôle essentiel dans les études précliniques axées sur le traitement des troubles neurogénétiques chez les rongeurs et autres grands animaux, y compris les primates non humains. Cependant, malgré son application généralisée, l’injection intrathécale chez les jeunes, en particulier les nouveau-nés, pose des défis techniques importants en raison de leur petite taille et de leur nature fragile. L’administration réussie et fiable d’injections intrathécales chez les souris nouveau-nées nécessite une attention méticuleuse aux détails et un examen minutieux de divers facteurs. Il est donc crucial de disposer d’un protocole normalisé qui non seulement fournit des instructions, mais met également en évidence les principales considérations techniques et les bonnes pratiques de laboratoire afin d’assurer la cohérence des procédures, ainsi que la sécurité et le bien-être des animaux.
Pour répondre à ce besoin non satisfait, nous présentons un protocole détaillé et complet pour effectuer des injections intrathécales spécifiquement chez les nouveau-nés au jour 1 postnatal (P1). En suivant les instructions étape par étape, les chercheurs peuvent effectuer en toute confiance des injections intrathécales chez les chiots nouveau-nés, permettant l’administration précise de médicaments, d’oligos antisens et de virus pour le remplacement de gènes ou les traitements basés sur l’édition du génome. De plus, l’importance d’adhérer aux bonnes pratiques de laboratoire est soulignée pour maintenir le bien-être des animaux et garantir des résultats expérimentaux fiables. Ce protocole vise à relever les défis techniques associés aux injections intrathécales chez la souris néonatale, facilitant ainsi les avancées dans le domaine de la recherche neurogénétique qui vise à développer des interventions thérapeutiques potentielles.
Introduction
L’injection intrathécale (IT) est une procédure clinique courante utilisée pour administrer des médicaments, recueillir du liquide céphalo-rachidien et maintenir la pression intracrânienne chez les patients pédiatriques et adultes dans les cliniques 1,2. L’administration de médicaments par injection intrathécale est une approche efficace pour augmenter les concentrations de médicaments dans le système nerveux central (SNC) tout en minimisant l’exposition systémique. Par conséquent, cette méthode améliore l’efficacité thérapeutique et réduit les effets secondaires, en particulier pour les médicaments sensibles à la température et à demi-vie courte3.
Dans les études précliniques testant de nouveaux médicaments et traitements à l’aide de modèles de rongeurs, il est impératif d’utiliser une méthode fiable d’administration des médicaments qui offre une plus grande précision et une plus grande reproductibilité des résultats 4,5. Pour les études précliniques évaluant de nouveaux traitements pour les troubles neurogénétiques et neurodéveloppementaux, un traitement précoce est crucial pour les études initiales de validation de concept, car les interventions précoces sont généralement prédites pour donner des résultats plus favorables 6,7,8.
Par rapport aux injections intracérébroventriculaires (ICV) conventionnelles, les injections IT comportent des risques nettement inférieurs car elles évitent la nécessité d’une pénétration directe à travers le cortex cérébral. Cet avantage réduit considérablement les dommages potentiels au tissu cortical régional et aux nerfs environnants. De plus, les injections informatiques permettent de multiplier par cinq au moins le volume de médicaments administrables en une seule injection, ce qui améliore considérablement la faisabilité des administrations répétées. Cependant, en raison de la petite taille et de la nature fragile des souris nouveau-nées, la réalisation d’injections intrathécales chez les nouveau-nés est techniquement difficile et nécessite des techniques spécialisées, de l’équipement et une manipulation méticuleuse.
Cet article fournit un protocole détaillé avec des instructions étape par étape pour effectuer des injections intrathécales chez les nouveau-nés P1. Les principales considérations et les bonnes pratiques de laboratoire sont soulignées ici pour assurer la cohérence de l’administration ainsi que la sécurité et le bien-être des animaux pendant la procédure. En suivant ce protocole, les chercheurs peuvent mener des expériences en toute confiance avec précision et reproductibilité tout en minimisant les risques potentiels ou l’inconfort pour les animaux.
Protocole
Les procédures et protocoles décrits étaient conformes aux lignes directrices énoncées dans le Guide des National Institutes of Health pour les soins et l’utilisation des animaux de laboratoire. De plus, les procédures ont reçu l’approbation du comité de soin et d’utilisation des animaux de la faculté de médecine de l’Université Yale. Des souris mâles et femelles C57BL/6J de type sauvage nouveau-né (WT) ont été utilisées pour l’étude présentée. Les animaux ont été obtenus d’une source commerciale (voir la Table des matières).
1. Préparation de l’espace de travail
- Préparez d’abord les éléments suivants : de la glace humide pour la cryo-anesthésie, une cage vide pour séparer les petits de la mère, un microscope à dissection, une source de lumière, une surface propre pour placer l’animal pendant l’injection, des cotons-tiges, un coussin chauffant, une seringue de 25/10 μL et une aiguille de 34 G/0,375"/ 12 DEG (voir le tableau des matériaux).
REMARQUE : La cryo-anesthésie pour les bébés souris à l’aide de glace humide est une étape facultative destinée à faciliter la manipulation, à réduire les mouvements des petits et à minimiser l’inconfort potentiel des animaux. Cette étape de cryo-anesthésie peut également offrir l’avantage d’abaisser la pression intracrânienne et de réduire les complications liées au volume 9,10. - Déplacez les chiots dans une cage séparée loin de la mère pendant que vous les manipulez.
- Pesez chaque chiot et documentez son poids.
- Essuyez le dos de la souris avec de la gaze et de l’éthanol. Confirmez l’espace intervertébral ou, au minimum, la ligne médiane du canal rachidien (qui devrait apparaître rouge chez les petits P1) à l’aide du microscope à dissection (vidéo supplémentaire 1).
2. Procédure d’injection
- Pour anesthésier un seul chiot, placez-le doucement sur une barrière étanche telle qu’un manchon en latex ou du papier d’aluminium sur un bain de glace pendant 3 à 5 minutes. Il est important d’éviter de laisser l’animal sur la glace pendant une période prolongée, car cela pourrait entraîner des risques potentiels de complications liées à l’hypothermie, notamment la fibrillation ventriculaire, l’hypoxie tissulaire et l’acidose métabolique.
REMARQUE : La durée de 3 à 5 minutes peut varier au cas par cas. Évaluez les signes de l’anesthésie, tels que l’absence de réponse à un pincement des orteils, pour déterminer la durée appropriée. - Pendant que l’animal est sur la glace, chargez la seringue avec 10 μL de la formulation du médicament, de la préparation virale ou du liquide céphalo-rachidien artificiel, etc.
REMARQUE : Pendant la phase d’apprentissage, envisagez l’option d’injecter le même volume de colorant vert rapide mélangé à 1 % avec les matériaux d’administration (voir le tableau des matériaux). Cela peut aider à visualiser le processus d’injection et à apprendre et affiner la technique. Les chiots injectés avec Fast Green Dye ou des matériaux similaires doivent être euthanasiés peu de temps après l’injection selon le protocole approuvé, car ces matériaux peuvent entraîner des réactions inflammatoires ou d’autres effets secondaires chez les animaux. - Une fois que l’animal est complètement anesthésié, comme le confirme une réduction ou une absence de mouvement du corps, placez doucement les chiots sous le microscope.
- Avec l’index et le pouce gauches, palper soigneusement l’espace intervertébral le long de la ligne médiane, situé entre les ceintures pelviennes bilatérales (vidéo supplémentaire 1). Faites légèrement pivoter la base de la queue pour aider à identifier la ligne médiane de la colonne vertébrale.
- Ajustez le biseau de l’aiguille vers la tête de l’animal avant l’injection.
- Insérez soigneusement l’aiguille, en l’inclinant légèrement à un angle de 70° à 80° au point d’intersection de l’indentation, tout en veillant à ce que la seringue reste alignée avec le plan sagittal central. Au fur et à mesure que l’aiguille entre en contact avec l’os, diminuez progressivement l’angle jusqu’à environ 30°, puis avancez l’aiguille d’environ 2 mm dans l’espace intervertébral.
REMARQUE : La capacité de l’aiguille à soulever légèrement tout le corps est un signe d’entrée réussie dans l’espace intradural. - Injecter lentement jusqu’à 10 μL de volume en 50-60 s. Gardez l’aiguille en place pendant 10 à 20 s après l’accouchement. Retirez l’aiguille avec une rotation douce pour éviter les fuites.
REMARQUE : Le cervelet deviendra vert avant de retirer l’aiguille. De plus, la poussée lente est essentielle pour prévenir une augmentation de la pression intracrânienne associée à l’accouchement et pour minimiser les complications potentielles. D’après notre expérience avec des injections chez plus de 500 petits, la délivrance d’un volume de 10 μL en 50-60 s est optimale.
3. Après l’injection
- Appliquez un coton-tige sur le site d’injection s’il y a des fuites ou du sang.
REMARQUE : Il ne devrait pas y en avoir dans la plupart des cas. D’après notre expérience, les chiots traités avec des traces de fuite ou de sang sont toujours utilisables, mais la prise en compte d’une dose réduite de médicaments ou de traitements peut être nécessaire lors de l’analyse des données. - Placez le chiot sur un coussin chauffant et attendez 10 à 15 minutes pour que les chiots se rétablissent complètement et se réchauffent. Observez attentivement les chiots pour vous assurer qu’ils sont alertes et bougent activement avant de les remettre dans leur cage d’origine. La récupération adéquate d’une souris est indiquée par la restauration de la couleur rose de la peau, l’augmentation des mouvements spontanés du corps et les réactions réactives au toucher.
- Remettez le chiot dans la cage de la maison et assurez-vous qu’il est correctement recouvert de litière, de nid ou des deux. Cela garantit que le chiot reçoit les soins maternels nécessaires de la mère.
- Évaluer l’apparence générale et l’activité quotidiennement pendant au moins 3 jours après l’injection. Une apparence malade et une activité réduite peuvent augmenter la possibilité d’une infection, d’effets secondaires associés au traitement ou d’autres complications, etc. Si nécessaire, consultez un vétérinaire.
Résultats
L’injection intrathécale réussie a immédiatement entraîné la distribution généralisée de la solution administrée, bien que la pénétration cellulaire réelle dépende de la nature des médicaments et des matériaux délivrés. Dans cette étude, nous avons utilisé Fast Green pour visualiser les résultats immédiats après injection intrathécale (IT) chez les nouveau-nés de type sauvage (Figure 1A-K) et l’avons comparée à l’injection intraventriculaire conventionnelle (ICV) (Figure 1L-N). Les résultats à long terme (10 jours après l’injection) ont également été examinés à l’aide de souris rapporteures YFP activées par l’administration d’une édition de gènes basée sur CRISPR/Cas97. L’expression de YFP a été largement observée dans l’ensemble du cerveau de la souris par rapport aux souris non traitées par CRISPR/Cas9 (Figure 2). L’expression de YFP a été observée dans la majorité des cellules sous un grossissement plus élevé. Des injections ont été effectuées chez plus de 500 nouveau-nés, et plus de 98 % des chiots injectés ont survécu à la procédure. Aucun effet nocif sur la survie à long terme et la santé des petits traités n’a été observé (figure supplémentaire 1).
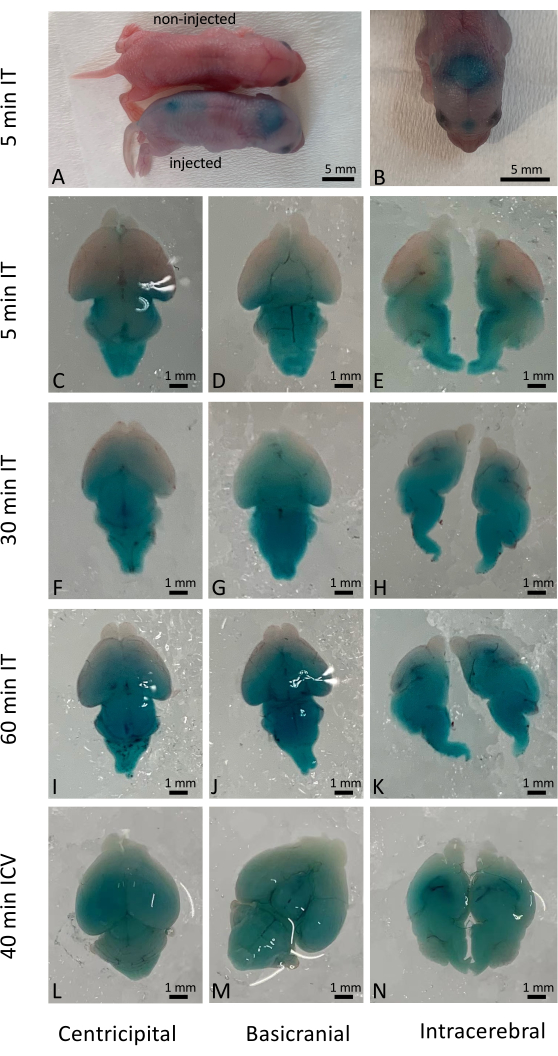
Figure 1 : Distribution temporelle et spatiale du colorant Fast Green dans le cerveau de souris. (A) Observation grossière de souris, comparant des souris injectées et non injectées 5 min après l’injection intrathécale. (B) Visualisation de la distribution du colorant Fast Green dans le cerveau de la souris avant la dissection. (C-E) Distribution du colorant dans les cerveaux disséqués 5 min après administration intrathécale. (F-H) Distribution du colorant dans les cerveaux disséqués 30 min après administration intrathécale. (I-K) Distribution du colorant dans les cerveaux disséqués 60 min après administration intrathécale. (L-N) À titre de comparaison, la distribution du colorant dans les cerveaux disséqués 40 minutes après l’administration intra-rébroventriculaire. Barre d’échelle : 1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Effets à long terme de l’édition de gènes CRISPR/Cas9 administrée par voie intrathécale. Expression généralisée du rapporteur YFP dans le cerveau de la souris après injection intrathécale de l’édition du gène CRISPR/Cas9 : cervelet (A-F), cortex postérieur (D-F) et cortex préfrontal (G-I). Barre d’échelle : 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Courbe de survie des souris atteintes du syndrome d’Angelman après l’édition du gène CRISPR intrathécal. Courbe de survie décrivant les résultats des souris atteintes du syndrome d’Angelman recevant l’édition de gènes CRISPR par administration intrathécale, par rapport aux souris non traitées et de type sauvage. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire 1 : Procédure d’injection intrathécale chez la souris néonatale. Vidéo démontrant le processus d’administration d’injections intrathécales à des souris nouveau-nées. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Il s’agit d’une procédure étape par étape pour l’injection intrathécale chez les souris nouveau-nées (P1), entraînant une distribution généralisée de médicaments dans leur cerveau. Par rapport à la méthode d’injection intra-ventriculaire courante pour administrer des médicaments aux souris nouveau-nées, qui consiste à percer le cortex cérébral11, l’injection intrathécale évite les lésions directes au cerveau de la souris néonatale dues à la pénétration de l’aiguille. En raison de son caractère peu invasif, l’injection intrathécale peut être effectuée à plusieurs reprises si nécessaire, simulant des administrations répétées chez l’homme en milieu clinique12.
Les changements de pression intracrânienne sont généralement associés à l’injection intrathécale13, ce qui peut entraîner le rejet de la mère et le refus de se nourrir en raison de changements de comportement chez les petits. Cependant, aucun changement aigu de comportement ou réduction de la survie chez les chiots injectés n’a été observé. De même, les comportements inhabituels ou anormaux associés aux injections intrathécales chez les adultes n’ont pas été remarqués (données non présentées).
Plusieurs conseils techniques ont peut-être contribué au succès et méritent d’être soulignés. Le taux d’injection plus lent est probablement un facteur important. De plus, la cryo-anesthésie peut réduire la pression intracrânienne avant l’injection, minimiser le reflux pendant l’injection intrathécale et réduire d’autres complications. Enfin, la précision du site d’injection peut également avoir un impact sur le taux de réussite.
Pour obtenir la meilleure efficacité par administration intrathécale, il est essentiel d’effectuer la procédure dès que possible après la mise bas des chiots. Les drogues et autres substances administrées par injection intrathécale pénètrent dans l’espace intrathécal, qui est l’espace entre les couches arachnoïdiennes et pies des méninges qui entourent le cerveau et la moelle épinière. Par conséquent, les médicaments délivrés par injection intrathécale traversent ces couches des méninges12. Chez les rongeurs, comme chez les humains, les méninges sont constituées de trois couches : la dure-mère, l’arachnoïdienne et la pie-mère14. Ces membranes se forment au cours du développement embryonnaire et sont complètement matures au jour 2 postnatal (P2)15. Par conséquent, il est recommandé d’utiliser un protocole de génotypage rapide pour affecter les petits à des groupes expérimentaux en quelques heures, en particulier pour les expériences impliquant des génotypes animaux, telles que les expériences d’édition de gènes. Plus les chiots sont injectés tôt, meilleur est le résultat. Les injections sont généralement terminées dans les 3 heures suivant la naissance. Cette fenêtre de temps permet aux médicaments injectés de suivre le flux de liquide céphalo-rachidien dans le parenchyme cérébral tandis que la muqueuse épendymaire est encore immature et moins affectée par la taille des particules de médicament. Il convient de noter les différences de développement entre les humains et les souris. Les souris nouveau-nées P1 correspondent au stade gestationnel tardif du développement du cerveau humain16. Les résultats des expériences sur des souris néonatales P1 constituent une preuve de concept précieuse, mais il faut faire preuve de prudence lors de l’extrapolation de ces résultats à l’homme dans les plans d’études translationnelles.
Cette technique est remise en question par une fenêtre de temps d’administration limitée et la nécessité d’expérimenter hautement qualifiés. Une mortalité élevée peut être associée à la procédure si l’expérimentateur manque d’expérience. Cependant, le délai serré exige un niveau accru de précision et de répétabilité au sein des études et entre elles. De plus, avec une pratique adéquate, la compétence et le taux de réussite de cette méthode peuvent être considérablement améliorés.
Si les injections sont effectuées correctement, la survie des chiots injectés est principalement affectée par les soins maternels. Il est recommandé de préparer les couples de femelles d’accueil pour vos cibles. Si les chiots ciblés n’ont pas de tache de lait sur le ventre dans l’après-midi du jour de l’injection, ils doivent être transférés immédiatement à la femelle d’accueil. Les souris femelles reconnaissent leurs bébés par l’odeur. Par conséquent, il est essentiel d’éviter d’introduire des odeurs inconnues provenant d’expérimentateurs ou de mères non apparentées aux chiots pendant et après la procédure. Cependant, la nécessité de faire appel à des femelles nourricières devrait être évaluée pour des expériences individuelles. Il est également recommandé d’effectuer la procédure dans une pièce bien ventilée, idéalement dans une hotte biologique. Mélanger les chiots avec la litière et les excréments de la mère est également utile. Après la vérification initiale après la procédure, il est recommandé de minimiser les perturbations du barrage pendant au moins 3 jours pour réduire le stress. Comme toute intervention chirurgicale, le risque d’infection post-opératoire doit être pris en compte. Ainsi, le strict respect des bonnes pratiques de laboratoire pour les procédures stériles doit être suivi pendant l’injection. Il convient de noter que la pression intrathécale est plus élevée que l’environnement extérieur, offrant une protection naturelle contre les infections. L’expérience indique que le taux d’infection post-injection est rare. Cependant, il est recommandé de surveiller quotidiennement l’apparence générale et l’activité des petits pendant au moins 3 jours après l’injection pour détecter les signes et symptômes d’infection ou d’autres complications. Dans des cas particuliers, il peut être justifié de consulter les services vétérinaires au lieu d’euthanasier les chiots présentant des complications importantes.
Déclarations de divulgation
YHJ est co-fondateur de Couragene mais aucun conflit d’intérêts pour ce projet.
Remerciements
XNL est soutenu par la bourse postdoctorale de la Fondation pour la thérapie du syndrome d’Angelman (FAST). YHJ est également soutenu par FAST et NIH Grant R01HD110195 et R01MH117289.
matériels
| Name | Company | Catalog Number | Comments |
| Balance | Ohaus Corporation | 30253017 | |
| C57BL/6J mice | The Jackson Laboratory | 000664 | |
| Digital Microscope | RWD | DOM-1001 | |
| DPBS | ThermoFisher | 14190144 | |
| Fast Green | Sigma | F7252-5G | |
| Heating pad | RWD | 69020 | |
| Needles | Hamilton | 6PK (34/0.375”/4/12DEG)S | |
| Syringe | Hamilton | 1702RN | |
| Syringe Filters | Sigma | SLGVM33RS |
Références
- Hoy, S. M. Onasemnogene abeparvovec: first global approval. Drugs. 79 (11), 1255-1262 (2019).
- Ramos, D. M., et al. Age-dependent SMN expression in disease-relevant tissue and implications for SMA treatment. J Clin Invest. 129 (11), 4817-4831 (2019).
- Fedorova, E., Battini, L., Prakash-Cheng, A., Marras, D., Gusella, G. L. Lentiviral gene delivery to CNS by spinal intrathecal administration to neonatal mice. J Gene Med. 8 (4), 414-424 (2006).
- Dindot, S. V., et al. An ASO therapy for Angelman syndrome that targets an evolutionarily conserved region at the start of the UBE3A-AS transcript. Sci Transl Med. 15, eabf4077(2023).
- Amanat, M., Nemeth, C. L., Fine, A. S., Leung, D. G., Fatemi, A. Antisense oligonucleotide therapy for the nervous system: from bench to bedside with emphasis on pediatric neurology. Pharmaceutics. 14 (11), 2389(2022).
- Frangoul, H., et al. CRISPR-Cas9 gene editing for sickle cell disease and β-Thalassemia. N Engl J Med. 384, 252-260 (2021).
- Gillmore, J. D., et al. CRISPR-Cas9 in vivo gene editing for transthyretin amyloidosis. N Engl J Med. 385, 493-502 (2021).
- Krol, A., Feng, G. Windows of opportunity: timing in neurodevelopmental disorders. Curr Opin Neurobiol. 48, 59-63 (2018).
- Birg, T., et al. Brain temperature influences intracranial pressure and cerebral perfusion pressure after traumatic brain injury: A CENTER-TBI Study. Neurocrit Care. 35, 651-661 (2021).
- Rossi, S., Zanier, E. R., Mauri, I., Columbo, A., Stocchetti, N. Brain temperature, body core temperature, and intracranial pressure in acute cerebral damage. J Neurol Neurosurg Psychiatry. 71 (4), 448-454 (2001).
- Kim, J. Y., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. J Vis Exp. 91, e51863(2014).
- Petrou, P., Kassis, I., Yaghmour, N. E., Ginzberg, A., Karussis, D. A phase II clinical trial with repeated intrathecal injections of autologous mesenchymal stem cells in patients with amyotrophic lateral sclerosis. Front Biosci (Landmark Ed). 26 (10), 693-706 (2021).
- Kroin, J. S., et al. The mechanisms of intracranial pressure modulation by epidural blood and other injectates in a postdural puncture rat model. Anesth Analg. 95 (2), 423-429 (2002).
- Møllgård, K., et al. A mesothelium divides the subarachnoid space into functional compartments. Science. 379 (6627), 84-88 (2023).
- Chakrabarty, P., et al. Capsid serotype and timing of injection determines AAV transduction in the neonatal mice brain. PLoS One. 8, e67680(2013).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Prog Neurobiol. 160-107, 1-16 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon