Method Article
Iniezione intratecale di topo neonato per l'editing del genoma e la somministrazione di farmaci
In questo articolo
Riepilogo
Il presente protocollo delinea le istruzioni passo-passo per l'esecuzione di iniezioni intratecali nei topi neonatali per l'editing genetico e la somministrazione di farmaci.
Abstract
L'iniezione intratecale è una procedura comunemente impiegata sia nelle cliniche pediatriche che in quelle per adulti, che funge da mezzo efficace per somministrare farmaci e trattamenti. Somministrando direttamente farmaci e trattamenti nel liquido cerebrospinale del sistema nervoso centrale, questo metodo consente di ottenere concentrazioni localizzate di farmaci più elevate, riducendo al contempo gli effetti collaterali sistemici rispetto ad altre vie come le iniezioni endovenose, sottocutanee o intramuscolari. La sua importanza va oltre le impostazioni cliniche, poiché l'iniezione intratecale svolge un ruolo fondamentale negli studi preclinici incentrati sul trattamento dei disturbi neurogenetici nei roditori e in altri animali di grandi dimensioni, compresi i primati non umani. Tuttavia, nonostante la sua ampia applicazione, l'iniezione intratecale nei cuccioli giovani, in particolare neonatali, pone sfide tecniche significative a causa delle loro piccole dimensioni e della loro natura fragile. Una somministrazione efficace e affidabile di iniezioni intratecali nei topi neonati richiede una meticolosa attenzione ai dettagli e un'attenta considerazione di vari fattori. Pertanto, c'è un bisogno cruciale di un protocollo standardizzato che non solo fornisca istruzioni, ma evidenzi anche le considerazioni tecniche chiave e le buone pratiche di laboratorio per garantire la coerenza procedurale, nonché la sicurezza e il benessere degli animali.
Per rispondere a questa esigenza insoddisfatta, presentiamo un protocollo dettagliato e completo per l'esecuzione di iniezioni intratecali specifiche nei cuccioli appena nati il giorno 1 postnatale (P1). Seguendo le istruzioni passo-passo, i ricercatori possono eseguire con sicurezza iniezioni intratecali nei cuccioli neonatali, consentendo la somministrazione accurata di farmaci, oligo antisenso e virus per la sostituzione genica o trattamenti basati sull'editing del genoma. Inoltre, viene sottolineata l'importanza di aderire alle buone pratiche di laboratorio per mantenere il benessere degli animali e garantire risultati sperimentali affidabili. Questo protocollo mira ad affrontare le sfide tecniche associate alle iniezioni intratecali nei topi neonatali, facilitando in ultima analisi i progressi nel campo della ricerca neurogenetica che mira a sviluppare potenziali interventi terapeutici.
Introduzione
L'iniezione intratecale (IT) è una procedura clinica comune utilizzata per somministrare farmaci, raccogliere liquido cerebrospinale e mantenere la pressione intracranica sia nei pazienti pediatrici che in quelli adulti nelle cliniche 1,2. La somministrazione di farmaci tramite iniezione intratecale è un approccio efficace per aumentare le concentrazioni di farmaci nel sistema nervoso centrale (SNC) riducendo al minimo l'esposizione sistemica. Di conseguenza, questo metodo migliora l'efficacia terapeutica e riduce gli effetti collaterali, in particolare per i farmaci sensibili alla temperatura e a breve emivita3.
Negli studi preclinici che testano nuovi farmaci e trattamenti utilizzando modelli di roditori, è imperativo utilizzare un metodo affidabile di somministrazione dei farmaci che offra maggiore precisione e riproducibilità dei risultati 4,5. Per gli studi preclinici che valutano nuovi trattamenti per i disturbi neurogenetici e del neurosviluppo, il trattamento precoce è fondamentale per gli studi iniziali proof-of-concept perché si prevede che gli interventi precoci producano risultati più favorevoli 6,7,8.
Rispetto alle iniezioni intracerebroventricolari convenzionali (ICV), le iniezioni di IT comportano rischi significativamente inferiori poiché ovviano alla necessità di penetrazione diretta attraverso la corteccia cerebrale. Questo vantaggio riduce sostanzialmente il potenziale danno al tessuto corticale regionale e ai nervi circostanti. Inoltre, le iniezioni di IT consentono un aumento di almeno cinque volte del volume somministrabile di farmaci attraverso una singola iniezione, migliorando notevolmente la fattibilità di somministrazioni ripetute. Tuttavia, a causa delle piccole dimensioni e della natura fragile dei topi appena nati, l'esecuzione di iniezioni intratecali nei cuccioli appena nati è tecnicamente impegnativa e richiede tecniche specializzate, attrezzature e una manipolazione meticolosa.
Questo articolo fornisce un protocollo dettagliato con istruzioni dettagliate per l'esecuzione di iniezioni intratecali nei cuccioli neonati P1. Le considerazioni chiave e le buone pratiche di laboratorio sono qui enfatizzate per garantire la coerenza della somministrazione e la sicurezza e il benessere degli animali durante la procedura. Seguendo questo protocollo, i ricercatori possono condurre esperimenti con sicurezza con precisione e riproducibilità, riducendo al minimo qualsiasi potenziale rischio o disagio per gli animali.
Protocollo
Le procedure e i protocolli descritti erano conformi alle linee guida delineate nella Guida del National Institutes of Health per la cura e l'uso degli animali da laboratorio. Inoltre, le procedure hanno ricevuto l'approvazione del Comitato per la cura e l'uso degli animali presso la Yale University School of Medicine. Per lo studio presentato sono stati utilizzati topi maschi e femmine neonati wild-type (WT) C57BL/6J. Gli animali sono stati ottenuti da una fonte commerciale (vedi Tabella dei materiali).
1. Preparazione dello spazio di lavoro
- Preparare prima i seguenti elementi: ghiaccio umido per crioanestesia, una gabbia vuota per separare i cuccioli dalla madre, un microscopio da dissezione, una fonte di luce, una superficie pulita per posizionare l'animale durante l'iniezione, cotton fioc, un termoforo, una siringa da 25/10 μL e un ago da 34 G/ 0,375"/ 12 DEG (vedi Tabella dei materiali).
NOTA: La crioanestesia per i cuccioli di topo che utilizza ghiaccio umido è un passaggio facoltativo destinato a facilitare la manipolazione, ridurre il movimento del cucciolo e ridurre al minimo il potenziale disagio dell'animale. Questa fase di crioanestesia può anche fornire il vantaggio di abbassare la pressione intracranica e ridurre le complicanze legate al volume 9,10. - Sposta i cuccioli in una gabbia separata lontano dalla diga mentre li maneggi.
- Pesa ogni cucciolo e documenta il suo peso.
- Pulisci la parte posteriore del mouse usando una garza ed etanolo. Confermare lo spazio intervertebrale o, come minimo, la linea mediana del canale spinale (che dovrebbe apparire rossa nei cuccioli P1) utilizzando il microscopio da dissezione (Video supplementare 1).
2. Procedura di iniezione
- Per anestetizzare un singolo cucciolo, posizionalo delicatamente su una barriera impermeabile come un manicotto di lattice o un foglio di alluminio su un bagno di ghiaccio per 3-5 minuti. È importante evitare di lasciare l'animale sul ghiaccio per un periodo prolungato, poiché ciò potrebbe comportare potenziali rischi di complicanze legate all'ipotermia, tra cui fibrillazione ventricolare, ipossia tissutale e acidosi metabolica.
NOTA: La durata di 3-5 minuti può variare caso per caso. Valutare i segni dell'anestesia, come la mancata risposta a un pizzicotto del dito del piede, per determinare la durata appropriata. - Mentre l'animale è sul ghiaccio, caricare la siringa con 10 μL di formulazione del farmaco, preparazione del virus o liquido spinale artificiale di controllo, ecc.
NOTA: Durante la fase di apprendimento, considerare l'opzione di iniettare lo stesso volume di colorante Fast Green miscelato all'1% con i materiali di consegna (vedi Tabella dei materiali). Questo può aiutare a visualizzare il processo di iniezione e aiutare ad apprendere e perfezionare la tecnica. I cuccioli a cui è stato iniettato Fast Green Dye o materiali simili devono essere soppressi poco dopo l'iniezione secondo il protocollo approvato, poiché questi materiali possono provocare reazioni infiammatorie o altri effetti collaterali negli animali. - Una volta che l'animale è completamente anestetizzato, come confermato da movimenti del corpo ridotti o assenti, posizionare delicatamente i cuccioli sotto il microscopio.
- Con l'indice e il pollice sinistri, palpare con cautela lo spazio intervertebrale lungo la linea mediana, situato tra i cingoli pelvici bilaterali (Video supplementare 1). Ruota leggermente la base della coda per aiutare a identificare la linea mediana della colonna vertebrale.
- Regolare lo smusso dell'ago verso la testa dell'animale prima dell'iniezione.
- Inserire con cautela l'ago, inclinandolo leggermente ad un angolo di 70°-80° nel punto in cui la rientranza si interseca, assicurandosi che la siringa rimanga allineata con il piano sagittale centrale. Quando l'ago entra in contatto con l'osso, diminuire gradualmente l'angolo a circa 30°, quindi far avanzare l'ago di circa 2 mm nello spazio intervertebrale.
NOTA: La capacità dell'ago di sollevare leggermente l'intero corpo è un segno di successo dell'ingresso nello spazio intradurale. - Iniettare lentamente fino a 10 μL di volume entro 50-60 s. Tenere l'ago in posizione per 10-20 secondi dopo il completamento della consegna. Estrarre l'ago con una leggera rotazione per evitare perdite.
NOTA: Il cervelletto diventerà verde prima di estrarre l'ago. Inoltre, la spinta lenta è fondamentale per prevenire un aumento della pressione intracranica associata al parto e per ridurre al minimo le potenziali complicanze. Sulla base della nostra esperienza con le iniezioni in più di 500 cuccioli, la somministrazione di un volume di 10 μL in 50-60 secondi è ottimale.
3. Post iniezione
- Applicare un batuffolo di cotone sul sito di iniezione in caso di perdite o sangue.
NOTA: Nella maggior parte dei casi non dovrebbe essercene alcuno. In base alla nostra esperienza, i cuccioli trattati con tracce di perdite o sangue sono ancora utilizzabili, ma durante l'analisi dei dati può essere necessario prendere in considerazione una dose ridotta di farmaci o trattamenti. - Metti il cucciolo su un termoforo e attendi 10-15 minuti affinché i cuccioli si riprendano completamente e si riscaldino. Osserva attentamente i cuccioli per assicurarti che siano vigili e si muovano attivamente prima di riportarli nella loro gabbia di casa. Un adeguato recupero di un topo è indicato dal ripristino del colore rosa della pelle, dall'aumento del movimento spontaneo del corpo e dalle reazioni reattive al tocco.
- Rimetti il cucciolo nella gabbia di casa e assicurati che sia adeguatamente coperto con lettiera, nido o entrambi. Ciò garantisce che il cucciolo riceva le cure materne necessarie dalla madre.
- Valutare l'aspetto generale e l'attività quotidiana per almeno 3 giorni dopo l'iniezione. Un aspetto malato e un'attività ridotta possono aumentare la possibilità di infezioni, effetti collaterali associati al trattamento o altre complicazioni, ecc. Se necessario, consultare il veterinario.
Risultati
Il successo dell'iniezione intratecale ha portato immediatamente alla distribuzione capillare della soluzione somministrata, sebbene l'effettiva penetrazione cellulare dipendesse dalla natura dei farmaci e dei materiali somministrati. In questo studio, abbiamo utilizzato Fast Green per visualizzare i risultati immediati dopo l'iniezione intratecale (IT) nei neonati wild-type (Figura 1A-K) e li abbiamo confrontati con l'iniezione intracerebroventricolare convenzionale (ICV) (Figura 1L-N). I risultati a lungo termine (10 giorni dopo l'iniezione) sono stati esaminati anche utilizzando topi reporter YFP attivati dalla somministrazione di editing genetico basato su CRISPR/Cas97. L'espressione di YFP è stata ampiamente osservata in tutto il cervello del topo rispetto ai topi non trattati con CRISPR/Cas9 (Figura 2). L'espressione di YFP è stata osservata nella maggior parte delle cellule sotto un ingrandimento più elevato. Le iniezioni sono state eseguite in più di 500 cuccioli appena nati e oltre il 98% dei cuccioli iniettati è sopravvissuto alla procedura. Non sono stati osservati effetti dannosi sulla sopravvivenza a lungo termine e sulla salute dei cuccioli trattati (Figura 1 supplementare).
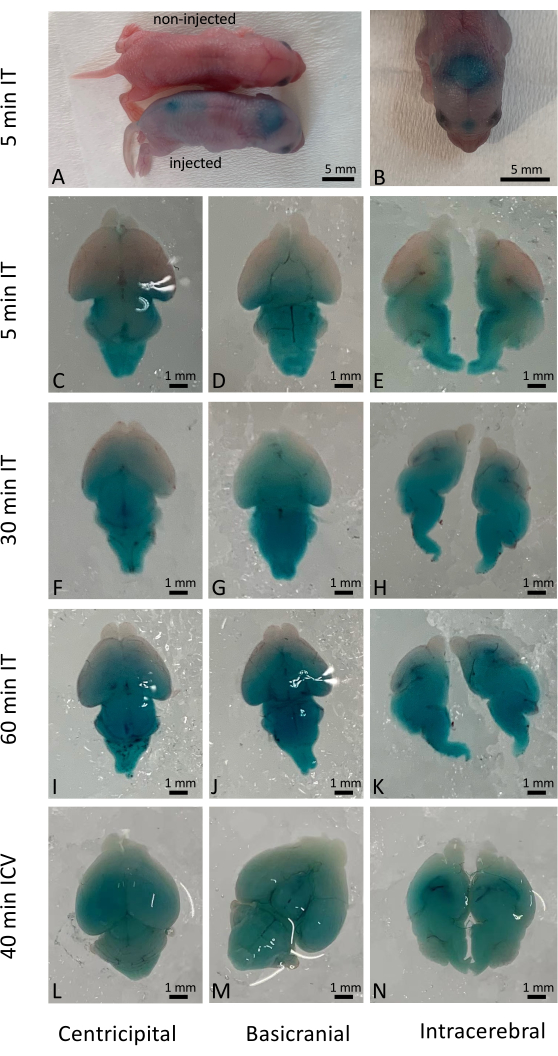
Figura 1: Distribuzione temporale e spaziale del colorante Fast Green nel cervello dei topi. (A) Osservazione macroscopica dei topi, confrontando topi iniettati e non iniettati 5 minuti dopo l'iniezione intratecale. (B) Visualizzazione della distribuzione del colorante Fast Green nel cervello del topo prima della dissezione. (C-E) Distribuzione del colorante nei cervelli sezionati 5 minuti dopo la somministrazione intratecale. (F-H) Distribuzione del colorante nei cervelli sezionati 30 minuti dopo la somministrazione intratecale. (I-K) Distribuzione del colorante nei cervelli sezionati 60 minuti dopo la somministrazione intratecale. (L-N) Per fare un confronto, la distribuzione del colorante nei cervelli sezionati 40 minuti dopo la somministrazione intracerebroventricolare. Barra della scala: 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Effetti a lungo termine dell'editing genetico CRISPR/Cas9 somministrato per via intratecale. Espressione diffusa del reporter YFP nel cervello del topo dopo l'iniezione intratecale di editing genico CRISPR/Cas9: cervelletto (A-F), corteccia posteriore (DF) e corteccia prefrontale (G-I). Barra graduata: 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Curva di sopravvivenza dei topi con sindrome di Angelman dopo editing genetico CRISPR intratecale. Curva di sopravvivenza che mostra gli esiti dei topi con sindrome di Angelman che hanno ricevuto l'editing genetico CRISPR attraverso la somministrazione intratecale, rispetto ai topi non trattati e wild-type. Fare clic qui per scaricare il file.
Video supplementare 1: Procedura di iniezione intratecale nei topi neonatali. Video che mostra il processo di somministrazione di iniezioni intratecali ai topi neonatali. Clicca qui per scaricare questo video.
Discussione
Viene descritta una procedura passo-passo per l'iniezione intratecale nei topi neonatali (P1), con conseguente distribuzione diffusa del farmaco nel loro cervello. Rispetto al comune metodo di iniezione intracerebroventricolare per la somministrazione di farmaci ai topi neonatali, che prevede la perforazione della corteccia cerebrale11, l'iniezione intratecale evita lesioni dirette al cervello del topo neonatale a causa della penetrazione dell'ago. A causa della minima invasività, l'iniezione intratecale può essere eseguita ripetutamente quando necessario, simulando somministrazioni ripetute nell'uomo in un contesto clinico12.
I cambiamenti nella pressione intracranica sono comunemente associati all'iniezione intratecale13, portando potenzialmente al rigetto della madre e al rifiuto di nutrirsi a causa di cambiamenti comportamentali nei cuccioli. Tuttavia, non sono stati osservati cambiamenti acuti nel comportamento o una ridotta sopravvivenza tra i cuccioli iniettati. Allo stesso modo, non sono stati osservati comportamenti insoliti o anormali associati alle iniezioni intratecali negli adulti (dati non mostrati).
Diversi consigli tecnici possono aver contribuito al successo e vale la pena sottolinearli. La velocità di iniezione più lenta è probabilmente un fattore importante. Inoltre, la crioanestesia può ridurre la pressione intracranica prima dell'iniezione, riducendo al minimo il riflusso durante l'iniezione intratecale e riducendo altre complicanze. Infine, anche la precisione del sito di iniezione può influire sul tasso di successo.
Per ottenere la migliore efficacia attraverso la somministrazione intratecale, è fondamentale eseguire la procedura il prima possibile dopo il parto dei cuccioli. I farmaci e altre sostanze somministrate tramite iniezione intratecale entrano nello spazio intratecale, che è lo spazio tra gli strati aracnoideo e pia madre delle meningi che circondano il cervello e il midollo spinale. Pertanto, i farmaci somministrati tramite iniezione intratecale passano attraverso questi strati delle meningi12. Nei roditori, come nell'uomo, le meningi sono costituite da tre strati: la dura madre, la madre aracnoidea e la pia madre14. Queste membrane si formano durante lo sviluppo embrionale e sono completamente mature entro il 2° giorno postnatale (P2)15. Pertanto, si raccomanda l'utilizzo di un protocollo di genotipizzazione rapida per assegnare i cuccioli a gruppi sperimentali entro poche ore, soprattutto per gli esperimenti che coinvolgono genotipi animali, come gli esperimenti di editing genetico. Prima vengono iniettati i cuccioli, migliore è il risultato. Le iniezioni vengono in genere completate entro 3 ore dalla nascita. Questa finestra temporale consente ai farmaci iniettati di seguire il flusso del liquido cerebrospinale nel parenchima cerebrale mentre il rivestimento ependimale è ancora immaturo e meno influenzato dalle dimensioni delle particelle di farmaco. Vale la pena notare le differenze di sviluppo tra esseri umani e topi. I topi neonatali P1 corrispondono alla fase gestazionale avanzata dello sviluppo del cervello umano16. I risultati degli esperimenti sui topi neonatali P1 servono come preziosa prova di concetto, ma è necessario prestare attenzione quando si estrapolano questi risultati all'uomo nei disegni di studio traslazionale.
Questa tecnica è messa alla prova da una finestra temporale di somministrazione limitata e dalla necessità di sperimentatori altamente qualificati. L'alta mortalità può essere associata alla procedura se lo sperimentatore manca di esperienza. Tuttavia, il lasso di tempo ristretto richiede un elevato livello di precisione e ripetibilità all'interno e tra gli studi. Inoltre, con un'adeguata pratica, la competenza e il tasso di successo di questo metodo possono essere notevolmente migliorati.
Se le iniezioni vengono eseguite correttamente, la sopravvivenza dei cuccioli iniettati è influenzata principalmente dalle cure materne. Si consiglia di preparare coppie di femmine in affido per i tuoi obiettivi. Se i cuccioli bersaglio non hanno una macchia di latte sulla pancia nel pomeriggio del giorno dell'iniezione, devono essere trasferiti immediatamente alla femmina adottiva. Le femmine di topo riconoscono i loro piccoli dall'odore. Pertanto, è fondamentale evitare di introdurre odori sconosciuti da parte di sperimentatori o madri non correlate ai cuccioli durante e dopo la procedura. Tuttavia, la necessità di utilizzare femmine in affido dovrebbe essere valutata per i singoli esperimenti. Si consiglia inoltre di eseguire la procedura in una stanza ben ventilata, idealmente in una cappa biologica. È utile anche mescolare i cuccioli con la lettiera e gli escrementi della madre. Dopo il controllo iniziale post-procedura, si raccomanda di ridurre al minimo il disturbo alla diga per almeno 3 giorni per ridurre lo stress. Come ogni procedura chirurgica, deve essere considerato il rischio di infezione post-procedura. Pertanto, durante l'iniezione deve essere seguita una stretta osservanza delle buone pratiche di laboratorio per le procedure sterili. Va notato che la pressione intratecale è superiore all'ambiente esterno, fornendo una protezione naturale contro le infezioni. L'esperienza indica che il tasso di infezione post-iniezione è raro. Tuttavia, si raccomanda il monitoraggio quotidiano dell'aspetto generale e dell'attività dei cuccioli per almeno 3 giorni dopo l'iniezione per rilevare segni e sintomi di infezione o altre complicanze. In casi speciali, può essere giustificata la consultazione con i servizi veterinari invece di sopprimere i cuccioli con complicazioni significative.
Divulgazioni
YHJ è co-fondatore di Couragene, ma non c'è alcun conflitto di interessi per questo progetto.
Riconoscimenti
XNL è supportato dalla borsa di studio post-dottorato della Fondazione per la terapia della sindrome di Angelman (FAST). YHJ è anche supportato da FAST e NIH Grant R01HD110195 e R01MH117289.
Materiali
| Name | Company | Catalog Number | Comments |
| Balance | Ohaus Corporation | 30253017 | |
| C57BL/6J mice | The Jackson Laboratory | 000664 | |
| Digital Microscope | RWD | DOM-1001 | |
| DPBS | ThermoFisher | 14190144 | |
| Fast Green | Sigma | F7252-5G | |
| Heating pad | RWD | 69020 | |
| Needles | Hamilton | 6PK (34/0.375”/4/12DEG)S | |
| Syringe | Hamilton | 1702RN | |
| Syringe Filters | Sigma | SLGVM33RS |
Riferimenti
- Hoy, S. M. Onasemnogene abeparvovec: first global approval. Drugs. 79 (11), 1255-1262 (2019).
- Ramos, D. M., et al. Age-dependent SMN expression in disease-relevant tissue and implications for SMA treatment. J Clin Invest. 129 (11), 4817-4831 (2019).
- Fedorova, E., Battini, L., Prakash-Cheng, A., Marras, D., Gusella, G. L. Lentiviral gene delivery to CNS by spinal intrathecal administration to neonatal mice. J Gene Med. 8 (4), 414-424 (2006).
- Dindot, S. V., et al. An ASO therapy for Angelman syndrome that targets an evolutionarily conserved region at the start of the UBE3A-AS transcript. Sci Transl Med. 15, eabf4077(2023).
- Amanat, M., Nemeth, C. L., Fine, A. S., Leung, D. G., Fatemi, A. Antisense oligonucleotide therapy for the nervous system: from bench to bedside with emphasis on pediatric neurology. Pharmaceutics. 14 (11), 2389(2022).
- Frangoul, H., et al. CRISPR-Cas9 gene editing for sickle cell disease and β-Thalassemia. N Engl J Med. 384, 252-260 (2021).
- Gillmore, J. D., et al. CRISPR-Cas9 in vivo gene editing for transthyretin amyloidosis. N Engl J Med. 385, 493-502 (2021).
- Krol, A., Feng, G. Windows of opportunity: timing in neurodevelopmental disorders. Curr Opin Neurobiol. 48, 59-63 (2018).
- Birg, T., et al. Brain temperature influences intracranial pressure and cerebral perfusion pressure after traumatic brain injury: A CENTER-TBI Study. Neurocrit Care. 35, 651-661 (2021).
- Rossi, S., Zanier, E. R., Mauri, I., Columbo, A., Stocchetti, N. Brain temperature, body core temperature, and intracranial pressure in acute cerebral damage. J Neurol Neurosurg Psychiatry. 71 (4), 448-454 (2001).
- Kim, J. Y., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. J Vis Exp. 91, e51863(2014).
- Petrou, P., Kassis, I., Yaghmour, N. E., Ginzberg, A., Karussis, D. A phase II clinical trial with repeated intrathecal injections of autologous mesenchymal stem cells in patients with amyotrophic lateral sclerosis. Front Biosci (Landmark Ed). 26 (10), 693-706 (2021).
- Kroin, J. S., et al. The mechanisms of intracranial pressure modulation by epidural blood and other injectates in a postdural puncture rat model. Anesth Analg. 95 (2), 423-429 (2002).
- Møllgård, K., et al. A mesothelium divides the subarachnoid space into functional compartments. Science. 379 (6627), 84-88 (2023).
- Chakrabarty, P., et al. Capsid serotype and timing of injection determines AAV transduction in the neonatal mice brain. PLoS One. 8, e67680(2013).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Prog Neurobiol. 160-107, 1-16 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon