Method Article
הזרקה תוך-תטית של עכבר שזה עתה נולד לצורך עריכת גנום ואספקת תרופות
In This Article
Summary
הפרוטוקול הנוכחי מתווה הוראות שלב אחר שלב לביצוע זריקות תוך-תיקליות בעכברים יילודים לצורך עריכת גנים והעברת תרופות.
Abstract
הזרקה תוך-תאית היא הליך נפוץ הן במרפאות ילדים והן במרפאות מבוגרים, ומשמשת כאמצעי יעיל למתן תרופות וטיפולים. על ידי העברה ישירה של תרופות וטיפולים לנוזל השדרה של מערכת העצבים המרכזית, שיטה זו משיגה ריכוזי תרופות מקומיים גבוהים יותר תוך הפחתת תופעות לוואי מערכתיות בהשוואה למסלולים אחרים כגון זריקות תוך ורידי, תת עוריות או תוך שריריות. חשיבותו משתרעת מעבר להגדרות קליניות, שכן הזרקה תוך-תאית ממלאת תפקיד חיוני במחקרים פרה-קליניים המתמקדים בטיפול בהפרעות נוירוגנטיות במכרסמים ובבעלי חיים גדולים אחרים, כולל פרימטים שאינם אנושיים. עם זאת, למרות היישום הנרחב שלה, הזרקה intrathecal בצעירים, במיוחד גורי יילודים, מציב אתגרים טכניים משמעותיים בשל גודלם הקטן ואופיים השברירי. מתן מוצלח ואמין של זריקות תוך-תיקליות בעכברים שזה עתה נולדו דורש תשומת לב קפדנית לפרטים והתחשבות זהירה בגורמים השונים. לפיכך, יש צורך חיוני בפרוטוקול סטנדרטי שלא רק מספק הוראות, אלא גם מדגיש שיקולים טכניים מרכזיים ונוהלי מעבדה טובים כדי להבטיח עקביות פרוצדורלית, כמו גם את בטיחותם ורווחתם של בעלי החיים.
כדי לענות על צורך זה שלא נענה, אנו מציגים פרוטוקול מפורט ומקיף לביצוע זריקות תוך תאיות במיוחד בגורים שזה עתה נולדו ביום 1 שלאחר הלידה (P1). על ידי ביצוע ההוראות שלב אחר שלב, חוקרים יכולים לבצע בביטחון זריקות intrathecal בגורים יילודים, המאפשר משלוח מדויק של תרופות, אוליגוס אנטיסנס, וירוסים עבור החלפת גנים או טיפולים מבוססי עריכת גנום. יתר על כן, מודגשת החשיבות של הקפדה על שיטות מעבדה טובות כדי לשמור על רווחתם של בעלי חיים ולהבטיח תוצאות ניסוי אמינות. פרוטוקול זה נועד להתמודד עם האתגרים הטכניים הקשורים לזריקות תוך-תיקליות בעכברים יילודים, ובסופו של דבר להקל על התקדמות בתחום המחקר הנוירוגנטי שמטרתו לפתח התערבויות טיפוליות פוטנציאליות.
Introduction
הזרקה תוך-תאית (IT) היא הליך קליני נפוץ המשמש למתן תרופות, איסוף נוזל מוחי שדרתי ושמירה על לחץ תוך גולגולתי הן בחולים ילדים והן במבוגרים במרפאות 1,2. מתן תרופות באמצעות הזרקה תוך-תאית הוא גישה יעילה להעלאת ריכוזי התרופות במערכת העצבים המרכזית (CNS) תוך מזעור החשיפה המערכתית. כתוצאה מכך, שיטה זו משפרת את היעילות הטיפולית ומפחיתה תופעות לוואי, במיוחד עבור תרופות רגישות לטמפרטורה וקצרות זמןמחצית חיים 3.
במחקרים פרה-קליניים הבודקים תרופות וטיפולים חדשים באמצעות מודלים של מכרסמים, הכרחי להשתמש בשיטה אמינה של מתן תרופות המציעה דיוק רב יותר ויכולת שחזור תוצאה 4,5. עבור מחקרים פרה-קליניים המעריכים טיפולים חדשים להפרעות נוירוגנטיות ונוירו-התפתחותיות, טיפול מוקדם הוא חיוני למחקרי הוכחת היתכנות ראשוניים מכיוון שהתערבויות מוקדמות יותר צפויות בדרך כלל להניב תוצאות חיוביות יותר 6,7,8.
בהשוואה לזריקות תוך-מוחיות קונבנציונליות (ICV), זריקות IT נושאות סיכונים נמוכים משמעותית מכיוון שהן מייתרות את הצורך בחדירה ישירה דרך קליפת המוח. יתרון זה מפחית באופן משמעותי את הנזק הפוטנציאלי לרקמת קליפת המוח האזורית ולעצבים הסובבים אותה. יתר על כן, הזרקות IT מאפשרות להגדיל לפחות פי חמישה את נפח התרופות באמצעות זריקה אחת, מה שמשפר מאוד את ההיתכנות של מתן חוזר. עם זאת, בשל גודלם הקטן ואופיים השברירי של עכברים שזה עתה נולדו, ביצוע זריקות תוך-תיקליות בגורים שזה עתה נולדו הוא מאתגר מבחינה טכנית ודורש טכניקות מיוחדות, ציוד וטיפול קפדני.
מאמר זה מספק פרוטוקול מפורט עם הוראות שלב אחר שלב לביצוע זריקות intrathecal בגורי P1 שזה עתה נולדו. השיקולים המרכזיים ונוהלי מעבדה טובים מודגשים כאן כדי להבטיח את עקביות הניהול ואת הבטיחות והרווחה של בעלי החיים במהלך ההליך. על ידי ביצוע פרוטוקול זה, החוקרים יכולים לבצע ניסויים בביטחון בדיוק וביכולת שחזור תוך מזעור סיכונים פוטנציאליים או אי נוחות לבעלי החיים.
Protocol
הנהלים והפרוטוקולים המתוארים היו בהתאם להנחיות המפורטות במדריך המכונים הלאומיים לבריאות לטיפול ושימוש בחיות מעבדה. בנוסף, ההליכים קיבלו אישור מהוועדה לטיפול ושימוש בבעלי חיים בבית הספר לרפואה של אוניברסיטת ייל. עכברים ונקבות מסוג בר שזה עתה נולדו (WT) C57BL/6J שימשו למחקר שהוצג. בעלי החיים התקבלו ממקור מסחרי (ראו טבלת חומרים).
1. הכנת סביבת העבודה
- הכינו תחילה את הפריטים הבאים: קרח רטוב להרדמה בהקפאה, כלוב ריק להפרדת הגורים מהסכר, מיקרוסקופ נתיחה, מקור אור, משטח נקי להנחת בעל החיים בזמן ההזרקה, צמר גפן, כרית חימום, מזרק 25/10 מיקרוליטר ומחט 34 גרם / 0.375 אינץ' / 12 DEG (ראה טבלת חומרים).
הערה: הרדמה Cryo-רדמה עבור גורי עכברים באמצעות קרח רטוב היא צעד אופציונלי שנועד להקל על הטיפול, להפחית את תנועת הגורים ולמזער אי נוחות פוטנציאלית לבעלי חיים. שלב זה של הרדמה בהקפאה עשוי גם לספק את היתרון של הורדת לחץ תוך גולגולתי והפחתת סיבוכים הקשורים לנפח 9,10. - העבירו את הגורים לכלוב נפרד הרחק מהסכר בזמן הטיפול בהם.
- שקלו כל גור ותעדו את משקלו.
- נגב את גב העכבר באמצעות גזה ואתנול. אשר את החלל הבין חולייתי או, לכל הפחות, את קו האמצע של תעלת עמוד השדרה (שאמור להופיע אדום בגורי P1) באמצעות המיקרוסקופ המנתח (וידאו משלים 1).
2. הליך הזרקה
- כדי להרדים גור בודד, הניחו אותו בעדינות על מחסום עמיד למים כגון שרוול לטקס או רדיד אלומיניום על אמבט קרח למשך 3-5 דקות. חשוב להימנע מלהשאיר את בעל החיים על הקרח לתקופה ממושכת, שכן הדבר עלול להוות סיכונים פוטנציאליים לסיבוכים הקשורים להיפותרמיה, כולל פרפור חדרים, היפוקסיה של רקמות וחמצת מטבולית.
הערה: משך הזמן של 3-5 דקות עשוי להשתנות בכל מקרה לגופו. להעריך את סימני ההרדמה, כגון חוסר תגובה צביטת בוהן, כדי לקבוע את משך הזמן המתאים. - בזמן שהחיה נמצאת על הקרח, טען את המזרק עם 10 μL של נוסחת התרופה, הכנת וירוסים, או לשלוט בנוזל עמוד השדרה המלאכותי וכו '.
הערה: במהלך שלב הלמידה, שקול את האפשרות להזריק את אותו נפח של צבע ירוק מהיר 1% מעורב עם חומרי המשלוח (ראה טבלת חומרים). זה יכול לסייע בהדמיה של תהליך ההזרקה ולסייע בלמידה ושכלול של הטכניקה. גורים המוזרקים להם צבע ירוק מהיר או חומרים דומים צריכים לעבור המתת חסד זמן קצר לאחר ההזרקה בהתאם לפרוטוקול המאושר, שכן חומרים אלה עלולים לגרום לתגובות דלקתיות או לתופעות לוואי אחרות בבעלי חיים. - לאחר שהחיה מורדמת במלואה, כפי שאושר על ידי תנועת גוף מופחתת או נעדרת, מקמו בעדינות את הגורים מתחת למיקרוסקופ.
- בעזרת האצבע המורה והאגודל השמאליים, יש למשש בזהירות את החלל הבין חולייתי לאורך קו האמצע, הממוקם בין חגורות האגן הדו-צדדיות (סרטון משלים 1). סובב מעט בעדינות את בסיס הזנב כדי לסייע בזיהוי קו האמצע של עמוד השדרה.
- כוונן את שיפוע המחט לכיוון ראש החיה לפני ההזרקה.
- הכנס בזהירות את המחט, הטה אותה מעט לזווית של 70°-80° בנקודה שבה השקע מצטלב, תוך הקפדה על כך שהמזרק נשאר מיושר עם מישור הקשת המרכזי. כאשר המחט יוצרת מגע עם העצם, להקטין בהדרגה את הזווית עד כ 30°, ולאחר מכן לקדם את המחט על 2 מ"מ לתוך החלל הבין חולייתי.
הערה: היכולת של המחט להרים מעט את כל הגוף היא סימן לכניסה מוצלחת לחלל התוך-דוראלי. - להזריק באיטיות עד 10 μL נפח בתוך 50-60 שניות. שמור את המחט במקום במשך 10-20 שניות לאחר השלמת הלידה. משכו את המחט בסיבוב עדין כדי למנוע דליפה.
הערה: המוח הקטן יהפוך לירוק לפני משיכת המחט. כמו כן, הדחיפה האיטית היא קריטית כדי למנוע עלייה בלחץ תוך גולגולתי הקשור ללידה ולמזער סיבוכים פוטנציאליים. בהתבסס על הניסיון שלנו עם זריקות ביותר מ-500 גורים, אספקת נפח של 10 μL במשך 50-60 שניות היא אופטימלית.
3. לאחר הזרקה
- יש למרוח צמר גפן על אתר ההזרקה אם יש דליפה או דם.
הערה: לא אמור להיות כזה ברוב המקרים. מניסיוננו, גורים שטופלו עם עקבות של דליפה או דם עדיין שמישים, אך ייתכן שיהיה צורך לשקול מינון מופחת של תרופות או טיפולים במהלך ניתוח הנתונים. - הניחו את הגור על כרית חימום והמתינו 10-15 דקות עד שהגורים יתאוששו לחלוטין ויתחממו מחדש. התבוננו היטב בגורים כדי לוודא שהם ערניים ונעים באופן פעיל לפני החזרתם לכלוב הביתי שלהם. התאוששות נאותה של עכבר מסומנת על ידי שחזור צבע העור הוורוד, תנועת גוף ספונטנית מוגברת ותגובות תגובה למגע.
- החזירו את הגור לכלוב הביתי וודאו שהגור מכוסה כראוי במצעים, בקן או בשניהם. זה מבטיח שהגור יקבל את הטיפול האימהי הדרוש מהסכר.
- להעריך את המראה הכללי ואת הפעילות מדי יום לפחות 3 ימים לאחר ההזרקה. הופעה חולנית ופעילות מופחתת עלולים להעלות את האפשרות לזיהום, תופעות לוואי הקשורות לטיפול או סיבוכים אחרים וכו'. במידת הצורך, יש להתייעץ עם רופא וטרינרי.
תוצאות
הזרקה אינטרתאית מוצלחת הביאה מיד להפצה נרחבת של התמיסה המנוהלת, אם כי החדירה התאית בפועל הייתה תלויה באופי התרופות והחומרים המועברים. במחקר הזה השתמשנו בירוק מהיר כדי להמחיש את התוצאות המיידיות לאחר הזרקה תוך-תאית (IT) בילודים מסוג בר (איור 1A-K) והשווינו זאת להזרקה תוך-מוחית קונבנציונלית (ICV) (איור 1L-N). התוצאות ארוכות הטווח (10 ימים לאחר ההזרקה) נבדקו גם באמצעות עכברי כתב YFP שהופעלו על ידי מתן עריכה גנטית מבוססת CRISPR/Cas97. ביטוי YFP נצפה באופן נרחב בכל מוח העכבר בהשוואה לעכברים שלא טופלו ב-CRISPR/Cas9 (איור 2). ביטוי YFP נצפה ברוב התאים תחת הגדלה גבוהה יותר. הזריקות בוצעו ביותר מ-500 גורים שזה עתה נולדו, ויותר מ-98% מהגורים שהוזרקו שרדו את ההליך. לא נצפו השפעות מזיקות על הישרדותם ובריאותם לטווח ארוך של גורים מטופלים (איור משלים 1).
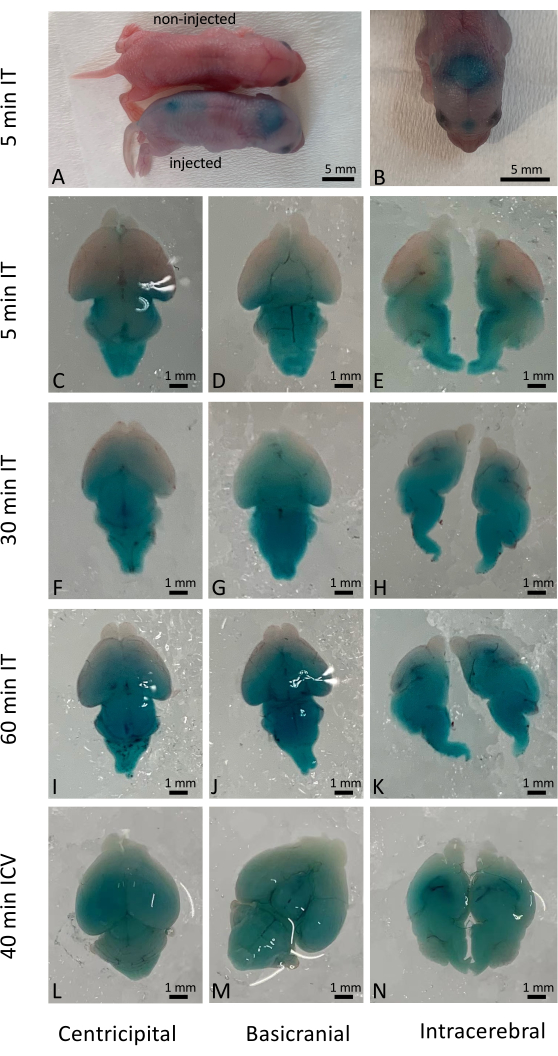
איור 1: התפלגות טמפורלית ומרחבית של צבע ירוק מהיר במוחות עכברים. (A) תצפית גסה על עכברים, השוואה בין עכברים מוזרקים ללא מוזרקים 5 דקות לאחר הזרקה תוך-תקלית. (B) הדמיה של התפלגות הצבע הירוק המהיר במוח העכבר לפני נתיחה. (ג-ה) פיזור הצבע במוחות מנותחים 5 דקות לאחר מתן תוך-תיקלי. (פ-ח) פיזור הצבע במוחות מנותחים 30 דקות לאחר מתן תוך-תיקלי. (ט-ק) פיזור הצבע במוחות מנותחים 60 דקות לאחר מתן תוך-תיקלי. (יב-נ) לשם השוואה, התפלגות הצבע במוחות מנותחים 40 דקות לאחר מתן תוך-מוחי. סרגל קנה מידה: 1 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: השפעות ארוכות טווח של עריכת גנים CRISPR/Cas9 תוך תתי. ביטוי נרחב של כתב YFP במוח העכבר בעקבות הזרקה תוך-תאית של עריכת גנים CRISPR/Cas9: המוח הקטן (A-F), קליפת המוח האחורית (D-F) וקליפת המוח הקדם-מצחית (G-I). סרגל קנה מידה: 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים 1: עקומת הישרדות של עכברי תסמונת אנג'למן לאחר עריכת גנים תוך-תאיים של CRISPR. עקומת הישרדות המתארת את התוצאות של עכברי תסמונת אנג'למן שקיבלו עריכה גנטית של CRISPR באמצעות מתן תוך-תאי, בהשוואה לעכברים מסוג לא מטופל ופראי. אנא לחץ כאן כדי להוריד קובץ זה.
סרטון משלים 1: הליך הזרקה תוך-תאי בעכברי יילודים. סרטון המדגים את תהליך מתן הזריקות התוך-תאיות לעכברים יילודים. אנא לחץ כאן כדי להוריד סרטון זה.
Discussion
מתואר הליך שלב אחר שלב להזרקה תוך-תאית בעכברים יילודים (P1), וכתוצאה מכך הפצה נרחבת של תרופות במוחם. בהשוואה לשיטת ההזרקה התוך-מוחית הנפוצה למתן תרופות לעכברי יילודים, הכוללת פירסינג בקליפת המוח11, הזרקה תוך-תאית מונעת פגיעה ישירה במוח העכבר של היילוד עקב חדירת מחט. בשל פולשניות מינימלית, הזרקה intrathecal יכול להתבצע שוב ושוב בעת הצורך, המדמה מתן חוזר בבני אדם במסגרת קלינית12.
שינויים בלחץ התוך גולגולתי קשורים בדרך כלל להזרקה תוך-תאית13, מה שעלול להוביל לדחיית הסכר וסירוב להאכיל עקב שינויים התנהגותיים אצל הגורים. עם זאת, לא נצפו שינויים חריפים בהתנהגות או הישרדות מופחתת בקרב גורים מוזרקים. באופן דומה, התנהגויות חריגות או חריגות הקשורות לזריקות תוך תאיות במבוגרים לא הבחינו (הנתונים לא מוצגים).
ייתכן שמספר טיפים טכניים תרמו להצלחה וכדאי לשים עליהם דגש. קצב ההזרקה האיטי יותר הוא ככל הנראה גורם חשוב. בנוסף, הרדמה קריו-הרדמה עשויה להפחית את הלחץ התוך גולגולתי לפני ההזרקה, למזער את הזרימה האחורית במהלך ההזרקה התוך-תאית ולהפחית סיבוכים אחרים. לבסוף, הדיוק של אתר ההזרקה עשוי להשפיע גם על שיעור ההצלחה.
כדי להשיג את היעילות הטובה ביותר באמצעות מתן תוך-תיקלי, ביצוע ההליך בהקדם האפשרי לאחר לידת הגורים הוא קריטי. תרופות וחומרים אחרים המועברים באמצעות הזרקה תוך-תאית נכנסים לחלל התוך-תאי, שהוא החלל שבין שכבות הארכנואיד מאטר והפיה מאטר של קרומי המוח המקיפים את המוח וחוט השדרה. לכן, התרופות המועברות באמצעות הזרקה תוך-תאית עוברות דרך שכבות אלה של קרומי המוח12. במכרסמים, כמו בבני אדם, קרומי המוח מורכבים משלוש שכבות: דורה מאטר, מאטר ארכנואיד ופיה מאטר14. קרומים אלה נוצרים במהלך ההתפתחות העוברית והם בשלים לחלוטין ביום 2 (P2)15 שלאחר הלידה. לכן, מומלץ להשתמש בפרוטוקול גנוטיפ מהיר כדי להקצות את הגורים לקבוצות ניסוי תוך מספר שעות, במיוחד בניסויים הכוללים גנוטיפים של בעלי חיים, כגון ניסויים בעריכת גנים. ככל שהגורים מוזרקים מוקדם יותר, כך התוצאה טובה יותר. הזריקות מסתיימות בדרך כלל תוך 3 שעות לאחר הלידה. חלון זמן זה מאפשר לתרופות המוזרקות לעקוב אחר זרימת הנוזל השדרתי לתוך פרנכימה במוח בעוד רירית אפנדימל עדיין לא בשלה ופחות מושפעת מגודל חלקיקי הסמים. ראוי לציין את ההבדלים ההתפתחותיים בין בני אדם לעכברים. עכברי יילודים P1 מתאימים לשלב ההריון המאוחר של התפתחות המוח האנושי16. תוצאות מניסויים בעכברי יילודים P1 משמשות כהוכחת היתכנות רבת ערך, אך יש לנקוט משנה זהירות כאשר משערים תוצאות אלה לבני אדם בתכנוני מחקר תרגומי.
טכניקה זו מאותגרת על ידי חלון זמן ניהול מוגבל והדרישה לנסיינים מיומנים. תמותה גבוהה עשויה להיות קשורה להליך אם הנסיין חסר ניסיון. עם זאת, מסגרת הזמן הצרה דורשת רמה מוגברת של דיוק וחזרתיות בתוך ובין מחקרים. יתר על כן, עם תרגול נאות, המיומנות ושיעור ההצלחה של שיטה זו ניתן לשפר באופן משמעותי.
אם הזריקות מבוצעות כראוי, הישרדותם של גורים מוזרקים מושפעת בעיקר מטיפול אימהי. מומלץ להכין זוגות נשים אומנה למטרות שלך. אם לגורים המיועדים אין כתם חלב על הבטן בשעות אחר הצהריים של יום ההזרקה, יש להעבירם מיד לנקבת האומנה. נקבות עכברים מזהות את התינוקות שלהן לפי הריח. לכן, חשוב להימנע מהחדרת ריחות לא מוכרים של נסיינים או סכרים לא קשורים לגורים במהלך ההליך ולאחריו. עם זאת, יש לבחון את הצורך בשימוש בנקבות אומנה לצורך ניסויים פרטניים. מומלץ גם לבצע את ההליך בחדר מאוורר היטב, רצוי במנדף ביולוגי. ערבוב הגורים עם מצעי הסכר וצואה מועיל גם הוא. לאחר הבדיקה הראשונית שלאחר ההליך, מומלץ למזער את ההפרעה לסכר למשך 3 ימים לפחות כדי להפחית את הלחץ. כמו כל הליך כירורגי, יש לקחת בחשבון את הסיכון לזיהום לאחר ההליך. לפיכך, יש להקפיד על נוהלי מעבדה טובים להליכים סטריליים במהלך ההזרקה. יש לציין כי לחץ intrathecal הוא גבוה יותר מאשר הסביבה החיצונית, מתן הגנה טבעית מפני זיהום. הניסיון מצביע על כך ששיעור הזיהומים לאחר ההזרקה הוא נדיר. עם זאת, מומלץ לעקוב מדי יום אחר המראה הכללי והפעילות של הגורים לפחות 3 ימים לאחר ההזרקה כדי לזהות סימנים ותסמינים של זיהום או סיבוכים אחרים. במקרים מיוחדים ניתן להצדיק התייעצות עם השירותים הווטרינריים במקום המתת חסד של גורים עם סיבוכים משמעותיים.
Disclosures
YHJ הוא מייסד שותף של Couragene אך אין ניגוד אינטרסים בפרויקט זה.
Acknowledgements
XNL נתמך על ידי הקרן לפוסט-דוקטורט תרפויטי של תסמונת אנג'למן (FAST). YHJ נתמך גם על ידי FAST ו-NIH Grant R01HD110195 ו-R01MH117289.
Materials
| Name | Company | Catalog Number | Comments |
| Balance | Ohaus Corporation | 30253017 | |
| C57BL/6J mice | The Jackson Laboratory | 000664 | |
| Digital Microscope | RWD | DOM-1001 | |
| DPBS | ThermoFisher | 14190144 | |
| Fast Green | Sigma | F7252-5G | |
| Heating pad | RWD | 69020 | |
| Needles | Hamilton | 6PK (34/0.375”/4/12DEG)S | |
| Syringe | Hamilton | 1702RN | |
| Syringe Filters | Sigma | SLGVM33RS |
References
- Hoy, S. M. Onasemnogene abeparvovec: first global approval. Drugs. 79 (11), 1255-1262 (2019).
- Ramos, D. M., et al. Age-dependent SMN expression in disease-relevant tissue and implications for SMA treatment. J Clin Invest. 129 (11), 4817-4831 (2019).
- Fedorova, E., Battini, L., Prakash-Cheng, A., Marras, D., Gusella, G. L. Lentiviral gene delivery to CNS by spinal intrathecal administration to neonatal mice. J Gene Med. 8 (4), 414-424 (2006).
- Dindot, S. V., et al. An ASO therapy for Angelman syndrome that targets an evolutionarily conserved region at the start of the UBE3A-AS transcript. Sci Transl Med. 15, eabf4077(2023).
- Amanat, M., Nemeth, C. L., Fine, A. S., Leung, D. G., Fatemi, A. Antisense oligonucleotide therapy for the nervous system: from bench to bedside with emphasis on pediatric neurology. Pharmaceutics. 14 (11), 2389(2022).
- Frangoul, H., et al. CRISPR-Cas9 gene editing for sickle cell disease and β-Thalassemia. N Engl J Med. 384, 252-260 (2021).
- Gillmore, J. D., et al. CRISPR-Cas9 in vivo gene editing for transthyretin amyloidosis. N Engl J Med. 385, 493-502 (2021).
- Krol, A., Feng, G. Windows of opportunity: timing in neurodevelopmental disorders. Curr Opin Neurobiol. 48, 59-63 (2018).
- Birg, T., et al. Brain temperature influences intracranial pressure and cerebral perfusion pressure after traumatic brain injury: A CENTER-TBI Study. Neurocrit Care. 35, 651-661 (2021).
- Rossi, S., Zanier, E. R., Mauri, I., Columbo, A., Stocchetti, N. Brain temperature, body core temperature, and intracranial pressure in acute cerebral damage. J Neurol Neurosurg Psychiatry. 71 (4), 448-454 (2001).
- Kim, J. Y., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. J Vis Exp. 91, e51863(2014).
- Petrou, P., Kassis, I., Yaghmour, N. E., Ginzberg, A., Karussis, D. A phase II clinical trial with repeated intrathecal injections of autologous mesenchymal stem cells in patients with amyotrophic lateral sclerosis. Front Biosci (Landmark Ed). 26 (10), 693-706 (2021).
- Kroin, J. S., et al. The mechanisms of intracranial pressure modulation by epidural blood and other injectates in a postdural puncture rat model. Anesth Analg. 95 (2), 423-429 (2002).
- Møllgård, K., et al. A mesothelium divides the subarachnoid space into functional compartments. Science. 379 (6627), 84-88 (2023).
- Chakrabarty, P., et al. Capsid serotype and timing of injection determines AAV transduction in the neonatal mice brain. PLoS One. 8, e67680(2013).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Prog Neurobiol. 160-107, 1-16 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved