Method Article
Sıçanlarda Subretinal İmplantlar için Cerrahi Bir Tekniğin Geliştirilmesi
Bu Makalede
Özet
Mevcut protokol, araştırmalarda retina hastalıklarının hayvan modellerinde uygulama için uygun bir cerrahi teknik olan subretinal cihaz implantasyonu için skleral yaklaşımı tanımlamaktadır.
Özet
Yaşa bağlı makula dejenerasyonu (AMD) gibi retina dejenerasyonu, dünya çapında körlüğün önde gelen nedenlerinden biridir. Kök hücre bazlı tedaviler de dahil olmak üzere AMD için rejeneratif tıp temelli tedaviler geliştirmek için sayısız yaklaşım benimsenmiştir. Retina dejenerasyonu için hayvan modelleri olarak kemirgenler, farklı aşamalarda retinal dejenerasyon hastalıkları geliştiren geniş suş spektrumu nedeniyle translasyonel araştırmalar için bir temel oluşturur. Bununla birlikte, kemirgenlerde subretinal implantların insan terapötik uygulamasını taklit etmek, lens boyutu ve vitreus hacmi gibi anatomik farklılıklar nedeniyle zordur. Bu cerrahi protokol, sıçanlarda implantların subretinal boşluğa nakli için rehberli bir yöntem sağlamayı amaçlamaktadır. Kritik adımların kullanıcı dostu kapsamlı bir açıklaması dahil edilmiştir. Bu protokol, sıçanlarda farklı preklinik çalışmalarda tekrarlanabilirlik için uygun maliyetli bir cerrahi prosedür olarak geliştirilmiştir. İmplantın boyutlarında ayarlamalar içeren cerrahi deneyi gerçekleştirmeden önce insan boyutunda bir implantın uygun şekilde minyatürleştirilmesi gerekir. İmplantı subretinal boşluğa iletmek için intravitreal bir prosedür yerine harici bir yaklaşım kullanılır. Küçük keskin bir iğne kullanılarak, temporal üst kadranda skleral bir insizyon yapılır, ardından göz içi basıncını azaltmak için parasentez yapılır, böylece cerrahi implantasyon sırasında direnci en aza indirir. Daha sonra, fokal retina dekolmanı (RD) elde etmek için insizyondan dengeli bir tuz çözeltisi (BSS) enjeksiyonu gerçekleştirilir. Son olarak, implantın subretinal boşluğa yerleştirilmesi ve görüntülenmesi gerçekleştirilir. İmplantın subretinal yerleşiminin ameliyat sonrası değerlendirilmesi, spektral domain optik koherens tomografi (SD-OCT) ile görüntülemeyi içerir. Görüntüleme takipleri, gözler alınmadan ve histolojik analiz için sabitlenmeden önce implantın subretinal stabilitesini tespit eder.
Giriş
Yaşa bağlı makula dejenerasyonu (AMD), dünya çapında körlüğün önde gelen bir nedenidir. 2020'de AMD'den etkilenen insan sayısının 196 milyon olduğu tahmin ediliyordu ve bunun 2040 yılına kadar yaklaşık 288 milyona çıkması bekleniyor1. Son on yılda, AMD'nin geç evreleri ile ilişkili görsel değişiklikleri hafifletmek için, esas olarak ıslak AMD'de gözlenen koroidal neovaskülarizasyonun gelişimini ve ilerlemesini tedavi etmek için çeşitli terapötikler geliştirilmiştir. Tersine, retina pigment epitel (RPE) hücresinin işlev bozukluğu ve kaybının RPE ve retinal atrofisine ilerlediği kuru YBMD tedavisinin, dünya çapında %0,44'lük bir prevalans ile AMD'nin %85 ila %90'ını oluşturduğu tahmin edilmektedir 1,2. AMD, hastalığın başlangıcına ve ilerlemesine katkıda bulunan yaş, genetik ve çevresel faktörlerle birlikte çok faktörlü bir hastalık olarak tanımlanmıştır; Bu hastalıkla ilişkili farklı patofizyolojik yolları ele almak için çeşitli tedaviler geliştirilmektedir3.
Kök hücre bazlı tedavi, kuru AMD4'te başarısız RPE'nin yerini almak için yeni bir terapötik seçenek olarak geliştirilmiştir. Pluripotent kök hücrelerin kullanımı hala erken klinik çalışmalarda olmasına rağmen, çeşitli klinik çalışmalarda güvenlik gösterilmiştir 5,6,7. Bugüne kadar, kök hücreleri subretinal boşluğa yerleştirmenin iki ana yolu vardır: biyouyumlu bir implant 8,9,10,11,12 üzerine ekilen tek katmanlı bir yamanın askıya alınması veya yerleştirilmesi. Klinik öncesi çalışmalarda kök hücre bazlı tedavileri kullanan yeni stratejiler, kök hücre bazlı terapötiklerin insanlarda amaçlandığı gibi aynı hedeflenen bölgeye verilebileceği hayvan modellerini gerektirir. Anatomideki farklılık, nihai insan ürünü ile kullanılanlara kıyasla prosedürlerde, cerrahi ekipmanda ve yaklaşımda küçük değişiklikler gerektirebilir13,14. Oküler cerrahi tekniklerin modifiye edilmesi, farklı hayvan modellerinde kullanım için başarılı bir yaklaşım olarak yaygın olarak tanımlanan gerekli değişikliklerden biridir 15,16,17.
Önceki yayınlar sıçanlarda subretinal implantlar için cerrahi tekniklerden bahsetmiş olsa da, araştırmacıların karşılaşabileceği teknik zorlukların üstesinden gelmek için bu tür tekniklerin kapsamlı bir açıklaması yoktur. Bu nedenle, cerrahi teknikleri ayrıntılı olarak tanımlamaya, kaçınılması gereken en iyi uygulamaları ve öğrenilen dersleri sağlamaya ve gerekirse prosedür boyunca kritik adımlar sırasında sorunları ele almaya ihtiyaç vardır. Bu makalenin amacı, sıçanlarda implantın subretinal boşluğa cerrahi implantasyonu için kapsamlı bir kılavuz sağlamaktır.
Protokol
Tüm deneyler Güney Kaliforniya Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylandı ve Ulusal Sağlık Enstitüleri (NIH) Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu ve Görme ve Oftalmoloji Araştırmaları Derneği (ARVO) Oftalmik ve Görme Araştırmalarında Hayvanların Kullanımı Beyanı'na göre gerçekleştirildi. Bu çalışmada toplam 12 adet Royal College of Surgeon (RCS) erkek sıçan kullanıldı. Hayvanlar hayvan tesisinde yetiştirildi ve doğumdan 1 gün sonra 28 ± 1 yaşına geldiklerinde çalışmaya dahil edildi. Göz anormalliklerinin olmadığını doğrulamak için tam bir göz muayenesi yapıldı. Parilen C'den yapılmış ve vitronektin ile kaplanmış ultra ince membranlar olan subretinal implantlar, belirli bir ticari organizasyon tarafından tasarlanmıştır (bkz. Bu membranlar, kalınlıkları ve geçirgenlikleri açısından insan boyutundaki membranları çoğaltır (ultra ince alanlarda 20 μm dairesel gözenekli 6.0 μm kalınlığında ağ çerçeve). İnsan boyutundaki zarlardan uzunluk ve genişliğin (1.0 mm × 0.4 mm) minyatürleştirilmesi, subretinal implantları kemirgen gözlerinin içine yerleştirmek için elde edildi18.
1. Hayvan bakımı ve cerrahi hazırlık
- Anestezi dozunu hesaplamak için hayvanı tartın ve adım 1.2'yi izleyerek anestezi uygulayın.
- Ketamin ve ksilazin karışımının (sırasıyla 35-50 mg / kg ve 5-10 mg / kg ; bkz. 1.0 mL şırınga ve 30 G iğne ile enjekte edin.
- İşlem sırasında uygun anestezi seviyesini korumak için anestezi karışımının (ketamin ve ksilazin) yarısı kadar başka bir 1.0 mL şırınga yükleyin.
- Pedal refleksi (sert ayak parmağı tutam) yokluğunda yeterli anesteziyi onaylayın.
- Vitreus boşluğunu ve retinayı düzgün bir şekilde görselleştirmek için, tedavi edilen göze %1 tropikamid ve %2.5 fenilefrin göz damlası damlatılarak göz bebeğini genişletin (Malzeme Tablosuna bakınız).
- 5 dakika sonra ikinci bir doz dilatasyon göz damlası uygulayın.
- Hayvan korneayı nemlendirmek için uyuşturulurken her 5-10 dakikada bir ameliyatsız göze suni gözyaşı veya oküler kayganlaştırıcı jel uygulayın.
- Isıtma yastığının üzerine steril bir örtü yerleştirin ( Malzeme Tablosuna bakın). Cerrahi tepsiyi kaplayan steril bir örtü yerleştirin.
- Cerrahi tepsiye aşağıdaki steril aletleri yerleştirerek steril cerrahi alanı hazırlayın: cerrahi eldivenler, subretinal implant ve cerrahi aletler: sivrisinek forseps (3), mikrocerrahi ince makas (1), iğne tutucu (1), dişli ince forseps (1), dişsiz ince düz forseps (2), mikrolitre şırınga (1), 32 G künt iğne (1), 27 G veya 30 G iğne (2), 4-0 ipek sütür (3), pamuklu çubuklar, dengeli tuz çözeltisi (BSS) ve bir lamel (bkz.
- Steril koşullar altında ve steril eldiven kullanarak, mikrolitre şırıngayı BSS ile doldurun ve 32 G künt iğneyi takın.
- İğnenin daha hassas bir şekilde manipüle edilmesi için bir tutamak oluşturmak üzere pamuğu 27 G veya 30 G iğne göbeğine yerleştirin.
- Prosedür boyunca steril koşulları korumak için, cerrahi mikroskop gibi steril olmayan aletler veya alanlar manipüle edilirse steril eldivenleri değiştirin.
2. Subretinal implantasyon için skleral yaklaşım: cerrahi teknik
- Aşağıdaki adımları izleyerek cerrahi alanı ortaya çıkarın.
- Hayvan anestezi altına alındıktan ve göz bebeği genişledikten sonra (adım 1.5), hayvanı karnı aşağı bakacak şekilde başı araştırmacıya doğru yerleştirin.
NOT: Tüm ameliyat boyunca ve hayvan tamamen iyileşene kadar fareyi steril bir örtü ile kaplı ısıtma yastığı üzerinde tutun. - Göze %5 povidon damlası (Malzeme Tablosuna bakınız) uygulayın ve göz yüzeyini ve göz kapaklarını pamuklu çubuklarla temizleyin.
- Cerrahi mikroskobu (Malzeme Tablosuna bakınız) cerrahi gözün üzerine yerleştirin ve ayarlayın.
NOT: Oküler yapıların daha keskin ve daha büyük bir görselleştirmesini elde etmek için tüm cerrahi prosedür boyunca cerrahi oftalmik mikroskop kullanılması önerilir. - Üst göz kapağını kaldırarak ve 4-0 emilmeyen dikişler kullanarak göz küresini dışarı çıkararak cerrahi alanın uygun şekilde pozlanmasını sağlayın.
- 4-0 ipek sütür kullanarak üstün göz kapağını yükseltin. Sütürü göz kapaklarının ön tarafına, meibomian bezleri hizasında yerleştirin. Sivrisinek forsepslerini cerrahi yüzeye sıkıştırarak traksiyonel sütürü sabitleyin.
NOT: Sütür, meibomian bezi seviyesinden daha yükseğe yerleştirilirse, göz kapağı yükselmesi yerine göz kapağının eversiyon meydana gelecektir. - Mikrocerrahi ince makas kullanarak temporal superior kadranın peritomisini gerçekleştirin.
- Göz küresinin dışarı çıkmasına ve öne doğru yer değiştirmesine izin vermek için iki traksiyonel sütür yerleştirin. Superior rektus kasının izolasyonunu gerçekleştirin.
- Limbusun üst tarafındaki ince diş forsepsleri (0.12 mm forseps) ile gözün nazikçe manipüle edilmesiyle, sklerayı ortaya çıkarmak için gözü aşağı doğru yuvarlayın.
- 4-0 ipek sütür süvürün süperior limbusun arkasına, superior ekstraoküler kasın yeri olan 1 mm'ye kadar yerleştirin. Sivrisinek forseps kullanarak sütürün her iki kuyruğunu da sıkıştırın.
- Temporal rektus kas izolasyonu gerçekleştirin. Temporal kadranda (temporal ekstraoküler kasın karşılık gelen bölgesinde) limbustan 1 mm'ye kadar ikinci bir sütür (4-0 ipek) yerleştirin. Sivrisinek forseps kullanarak sütürün her iki kuyruğunu da sıkıştırın.
- Her iki ekstraoküler kas sütürü de uygun şekilde yerleştirildikten ve klemplendikten sonra, skleranın temporal superior kadranını ortaya çıkarmak için dikişleri aşağı ve içe doğru çekin.
- 4-0 ipek sütür kullanarak üstün göz kapağını yükseltin. Sütürü göz kapaklarının ön tarafına, meibomian bezleri hizasında yerleştirin. Sivrisinek forsepslerini cerrahi yüzeye sıkıştırarak traksiyonel sütürü sabitleyin.
- Mikrocerrahi ince makasla peritomiyi gözün arkasına doğru uzatın.
- Pamuklu çubuklar kullanarak konjonktival kanamayı kontrol edin.
- Hayvan anestezi altına alındıktan ve göz bebeği genişledikten sonra (adım 1.5), hayvanı karnı aşağı bakacak şekilde başı araştırmacıya doğru yerleştirin.
- Aşağıdaki adımları izleyerek skleral insizyon, retina dekolmanı (RD) ve implant yerleştirme işlemlerini gerçekleştirin.
- 27 G veya 30 G iğne kullanarak skleral insizyon yapın. Kesi boyutunun ~ 1.2 mm olduğundan ve limbusun 1.5 mm arkasında olduğundan emin olun.
NOT: Gözü manipüle ederken ve implantı yerleştirirken göz içi yapıları stabilize etmek için tünel benzeri bir skleral insizyon konfigürasyonunun geliştirilmesi önerilir. Bu kesi şekli, göz içi basıncındaki ani dalgalanmaları önleyecektir. - Bazen, doğru yapılandırma pratik gerektirir. Bu nedenle, uygun konfigürasyon elde edilemezse, oküler yapıları vitreus boşluğunun içinde tutmayı kolaylaştırmak için ekstraoküler kas traksiyonel sütürlerinden bir miktar gerginliği serbest bırakın.
- Skleral insizyon için kullanılan aynı iğneyi (27 G veya 30 G) kullanarak, aynı kadranda periferik korneada parasentez yapın.
- Mikrolitrelik bir şırıngaya monte edilmiş 32 G künt iğneyi skleral insizyondan geçirin.
- Fokal bir RD oluşturmak için 100 μL BSS enjekte edin.
- Gözü normal pozisyona geri getirmek için ekstraoküler kas traksiyonel dikişlerini serbest bırakın.
- RD'nin doğrudan görselleştirilmesi için, oftalmik kayganlaştırıcı jel yüklü kapak mendilini dinlendirin ve kornea üzerine tutun.
- Retinaya odaklanmak için mikroskop objektifini ayarlayın.
- RD gözlenmezse veya çok küçükse (bir kadranın boyutundan daha küçükse), gözü aşağı ve içe doğru yuvarlayarak ve 2.2.4 ila 2.2.8 arasındaki adımları tekrarlayarak istenen RD boyutunu elde etmek için ikinci bir BSS enjeksiyonu gerçekleştirin.
- RD tamamlandıktan sonra, skleral uzunluğu (adım 2.2.1'de belirtildiği gibi) bir kumpas ile doğrulayın ( Malzeme Tablosuna bakınız).
- Koroid dokusunu ince mikrocerrahi makasla her iki yönde kesin.
- Tüm skleral ve koroid yapılarının diseke edildiğini doğrulamak için künt iğneyi skleral insizyon boyunca yanlamasına çalıştırın.
- İmplantı subretinal boşluğa yerleştirin.
- Forseps bağlamak gibi iki ince cerrahi forseps kullanarak (bkz . Malzeme Tablosu), implantın aktif kısmına zarar vermemek için implantı arkadan tutun.
- İmplantı insizyon düzlemine paralel olarak yerleştirin ve implantın içinde hafifçe kaydırın.
- İmplant subretinal boşluğa tamamen yerleştirildikten sonra, serbest bırakın ve forsepslerden birinin çenesini insizyona 1-1,5 mm sokarak implantı daha da içeri itin.
- Ekstraoküler kas traksiyonel sütürlerini serbest bırakın ve yukarıda açıklandığı gibi mikroskop ve lamel kullanarak implantın yerleşimini doğrulayın (adım 2.2.7 ve 2.2.8).
- 27 G veya 30 G iğne kullanarak skleral insizyon yapın. Kesi boyutunun ~ 1.2 mm olduğundan ve limbusun 1.5 mm arkasında olduğundan emin olun.
- Tüm dikişleri serbest bırakın ve çıkarın.
NOT: Cerrahi prosedür tamamlandıktan sonra, klinik bulguları doğrulamak için SD-OCT yapılır (adım 3). SD-OCT görüntüleme seansı ameliyattan hemen sonra yapılır. İmplant yerinin uygun şekilde görüntülenmesi elde edilemezse, SD-OCT'yi ameliyattan 7-10 gün sonra tekrar uygulayın.
3. SD-OCT görüntüleme
- Masaüstü ekranındaki Heidelberg Eye Explorer simgesine (bir görüntü yönetim yazılımı; Malzeme Tablosuna bakın) tıklayın.
- Ekranın üst kısmındaki Yeni Hasta simgesine tıklayın.
- Hayvan kimliğini oluşturmak için istenen tüm bilgileri doldurun ve Kabul Et'e tıklayın.
- Cihaz tipi için OCT görüntüleme sistemini (HRA + OCT; Malzeme Tablosuna bakın) seçin.
- Operatörü seçin ve Tamam'a basın.
- Doğru kornea eğriliği seçeneği için, varsayılan göz verilerini kabul etmek üzere OK düğmesine basın.
- SD-OCT alma penceresinin başlatıldığından ve SD-OCT için hazır olduğundan emin olun.
- Kameranın yanındaki dokunmatik ekranda bulunan sarı Başlat düğmesine basarak SD-OCT kamerayı açın.
- Hayvanı, SD-OCT koltuk başlığının üzerine uyarlanmış SD-OCT hayvan sahnesine yerleştirin.
NOT: Hayvan aşaması adaptasyonu, ısıtma yastığı da dahil olmak üzere hayvanı yerleştirmek için yeterince büyük olan SD-OCT kafa aşamasına sığacak şekilde bir parça polistiren köpük ( Malzeme Tablosuna bakınız) içerir. - Göz bebeğini SD-OCT lensin merkeziyle hizalamak için masa yüksekliğini ve hayvan konumunu ayarlayın.
NOT: Göz hizalandığında, ekranda kızılötesi (IR) canlı bir görüntü belirecektir. - Görüntü alımını başlatmak için dokunmatik ekrandaki IR + OCT düğmesine veya monitörün sağ alt kısmındaki OCT düğmesine basın.
- SD-OCT yayına girdiğinde, en yüksek sayıda (100) ART karesine sahip tek bir tarama modu seçin. 100 ART tarama modu varsayılan moddur.
- Kamera joystick'ini kullanarak, optik siniri IR görüntüsü üzerinde ortalayın.
- IR görüntüsü retinal görüntüyle eşit şekilde dolana kadar kamerayı ileri doğru itin.
NOT: Koyu köşeler, kameranın göze çok uzak veya yakın olduğunu gösterir. - İmplant retinanın temporal yönünde görüntülenene kadar kamerayı yana doğru hareket ettirin. Hareketleri yönlendirmek için IR görüntüsünü kullanın.
- İmplantı B taraması ile görselleştirmek için, SD-OCT B taraması ayarlama penceresini görüntülemek için CTRL + ALT + SHIFT + O tuşlarına aynı anda basın.
- Retina/implant SD-OCT görüntüsünde görüntülenene kadar "Referans Kolu" nu (pencerenin altında) ayarlayın.
NOT: SD-OCT görüntüsü mavi referans köşeleri içinde görüntülenmelidir. - Pencereyi kapatın.
- Joystick'i ve kamera kolunu kullanarak, daha iyi, daha düz ve daha keskin SD-OCT kalitesinde bir görüntü elde edilene kadar kamerayı her yöne kaydırın ve döndürün.
- IR görüntüsündeki mavi oku, implant boyunca yerleştirilene kadar sürükleyin.
- B-taramasının doygunluğu ve yerleşimi optimum olduğunda, dokunmatik ekranın altındaki siyah Kazanç Kontrolü düğmesine basarak "Otomatik Gerçek Zamanlı İzleme (ART)" özelliğini etkinleştirin.
- ART 100 kareye ulaştığında, dokunmatik ekranda Edin'e basın.
- Tüm görüntüler alındığında, pencerenin üst kısmındaki Görüntüleri Kaydet'e tıklayın ve ardından Çıkış'a tıklayın.
- Kayganlaştırıcı göz damlalarını sık sık (her 5 dakikada bir) uygulayarak tüm görüntüleme seansı boyunca korneayı nemli tutun.
4. Hayvanların geri kazanılması
- Görüntüleme seansının sonunda, oküler enfeksiyonu önlemek ve korneayı nemlendirmek için korneaya antibiyotikli merhem sürün.
- Hayvanı tamamen iyileşene kadar (~ 20-30 dakika) ve ayakta kalana kadar ısıtma yastığı üzerinde karnı üzerinde dinlendirin.
- Cerrahi işlemin sonunda sistemik analjezikler (1.0-1.2 mg / kg Buprenorfin SR bir kez subkutan; bkz . Malzeme Tablosu) verin.
- Yeterli bilinci yeniden kazanana kadar hayvanı gözetimsiz bırakmayın.
- Tamamen iyileşene kadar hayvanı diğer hayvanların şirketine iade etmeyin.
- Tamamen iyileştikten sonra, hayvanı yiyecek ve suya ad libitum erişimi olan barınma alanına geri koyun.
Sonuçlar
RCS sıçanlarında (N = 12) bir subretinal implantın implantasyonu, sıçanlarda subretinal doğum için cerrahi tekniğin fizibilitesini ve tekrarlanabilirliğini göstermiştir. Bu çalışmada, implant ile tedavi edilen göz (N = 12) sağ gözdü. İşlem sonunda cerrahi mikroskop kullanılarak yapılan klinik değerlendirmede, tedavi edilen 12 gözün dokuzunda (%75.00) implantın subretinal lokalizasyonu görüldüğü, iki gözde (%16.67) implantın intraretinal yerleşimi olarak tespit edildiği, bir gözde (%8.33) ise cerrahi alanda subretinal kanamanın neden olduğu medya opaklığı nedeniyle doğrudan görmenin mümkün olmadığı, hem implant hem de retina yapılarının sınırlı bir görünümü ile (Tablo 1). Cerrahi işlemden hemen sonra yapılan SD-OKT taramaları implantın subretinal veya intraretinal pozisyonunu gösterdi (sırasıyla 10 [%83.33] ve bir [%8.33]) (Şekil 1A). SD-OCT, 10 günlük bir takipten sonra bile, yukarıda açıklanan medya opaklığı ile (doğrudan görselleştirme mümkün değildir) aynı hayvanda (n = 1) implantın subretinal yerleşimini tam olarak tanımlayamadı. Şekil 1B,C, subretinal boşluğa düzgün bir şekilde yerleştirilmiş bir implantı olan iki farklı hayvanı göstermektedir. Cerrahi teknikle ilişkili başka bir cerrahi komplikasyon gelişmedi. Hematoksilen ve Eozin (H&E) boyaması ile implantın subretinal yerleşiminin doğrulanması gözlendi (Şekil 1D).
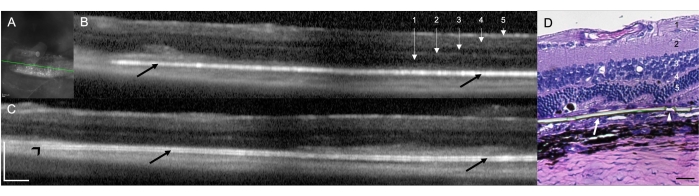
Şekil 1: Cerrahi implantasyondan 1 hafta sonra spektral domain optik koherens tomografi (SD-OCT) taramaları. (A) Subretinal implantın kızılötesi görüntüsü. Yeşil çizgi, (B)'de gösterilen kesiti sınırlar. Ölçek çubuğu: 200 μm. (B,C) Subretinal boşluğa düzgün bir şekilde yerleştirilmiş bir implanta sahip iki farklı hayvan (siyah oklar). İmplantın ucu optik sinire doğru işaret eder (siyah ok ucu). 1 = retina sinir lifi/ganglion hücre tabakası, 2 = iç pleksiform tabaka, 3 = iç dış tabaka, 4 = dış pleksiform tabaka ve 5 = dış nükleer tabaka. Ölçek çubuğu: 200 μm. (D) Parilen membranının subretinal implantasyonunu göstermek için H&E ile boyanmış histoloji kesiti (beyaz ok). Ok ucu, ultra ince alanlardaki mikro gözeneklerden birini gösterir. 1 = retina sinir lifi/ganglion hücre tabakası, 2 = iç pleksiform tabaka, 3 = iç dış tabaka, 4 = dış pleksiform tabaka ve 5 = dış nükleer tabaka. Ölçek çubuğu: 20 μm. Büyütme: 20x. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Klinik Değerlendirme | SD-OCT (Türkçe) | |||||
| Konu | SR | IR | Bilinmeyen | SR | IR | Bilinmeyen |
| 1 | X | X | ||||
| 2 | X | X | ||||
| 3 | X | X | ||||
| 4 | X | X | ||||
| 5 | X | X | ||||
| 6 | X | X | ||||
| 7 | X | X | ||||
| 8 | X | X | ||||
| 9 | X | X | ||||
| 10 | X | X | ||||
| 11 | X | X | ||||
| 12 | X | X | ||||
| 9 | 2 | 1 | 10 | 1 | 1 | |
| 75.00% | 16.67% | 8.33% | 83.33% | 8.33% | 8.33% | |
Tablo 1: Tüm hayvanlar arasında klinik değerlendirmeler ile SD-OCT görüntüleme arasındaki oküler bulguların karşılaştırılması. Kısaltmalar: SR = subretinal, IR = intraretinal ve SD-OCT = spektral domain optik koherens tomografi.
Tartışmalar
Prosedür daha önce küçük değişikliklerle tanımlanmış olsa da, bu makalenin kapsamı, tekniği öğrenirken izlenecek sıçanlarda subretinal implantlar için cerrahi prosedürün kapsamlı bir tanımını sağlamak ve araştırmacıların karşılaşabileceği cerrahi zorlukların ve potansiyel komplikasyonların üstesinden gelmektir. Burada özetlenen cerrahi protokol, laboratuvarımızda birkaç yıldır yaygın olarak kullanılan ultra ince parilen membranın kullanımını içerir 9,10,16,18. Bununla birlikte, farklı enjektörler ve subretinal boşluğa implante edilen materyaller kullanılarak tekniğin tekrarlanabilirliği gözlenmiştir18,19.
Subretinal cihaz implantasyonu için skleral bir yaklaşım, kök hücre bazlı tedavilerle sınırlı değildir; Küçük hayvan modellerinde retina nakli prosedürleri de tanımlanmıştır20,21. Retinal elektriksel stimülasyon alanında, sıçanlarda subretinal implantlar için bu cerrahi prosedür on yıldan fazla bir süredir kullanılmaktadır22. Daha yakın zamanlarda, Ho ve ark.23, sıçan retinasını uyarmak için bir dizi implante etti ve Thomas ve ark.24, kök hücre kaynağı olarak retina organoidlerini kullandı. Daha önce de belirtildiği gibi, kök hücre bazlı tedaviler, kök hücrelerle tohumlanmış biyouyumlu implantların cerrahi implantasyonu ile ilgili yayınlar da dahil olmak üzere iyi bir şekilde yayınlanmıştır4. Farklı yazarlar tarafından tanımlanan cerrahi yaklaşımlarda, bu yazıda açıklanan cerrahi teknikle tartışılacak ve karşılaştırılacak olan küçük farklılıklar vardır.
Skleral kapatma ve cerrahi enstrümantasyon ek tartışma gerektirir. Skleral insizyonu yönetmek için iki yaygın yaklaşım vardır: (1) dikişli kapatma ve (2) dikişsiz kapatma. Bazı yazarlar, normal prosedürlerinin bir parçası olarak skleral insizyonu bir sütürle kapatmak için 10-0 naylon kullanır 23,25,26,27. Bununla birlikte, diğer gruplar (bizimki dahil) 10-0 naylon sütürün gerekli olmadığını bulmuşlardır28. Dikişle kapatmayı destekleyenler, eğer dikiş yoksa subretinal protezin gözdeki kesiden kayarak dışarı çıkacağını savunurlar. Sonuçlar bölümünde açıklandığı gibi, mevcut çalışmada insizyon boyunca implantın veya göz içi dokusunun ekstrüzyonu bulunamamıştır. Dikişsiz bu cerrahi yaklaşım laboratuvarımızda rutin ve başarılı bir şekilde kullanılmaktadır 9,10,12,13,16. Dikişsiz bir yaklaşımın gerekçesi iki faktöre dayanır: Birincisi, insizyon yeri ve konfigürasyonunun bir kombinasyonu, kendi kendine kapanan bir insizyon oluşturmak için yeterli yapıyı sağlar. Skleral tünelin uygun şekilde yapılandırılmasının, araştırmacıların pratikle başaracakları bir adım olduğu unutulmamalıdır. İkincisi, traksiyon serbest bırakıldığında göz içi basıncı artar ve implantı yerinde tutar. Artan göz içi basıncı, retinanın insizyona doğru itilmesine, her iki skleral flebin birbirine yaklaşmasına ve kendi kendine kapanan bir kesi yapılmasına neden olur. Bu nedenle dikişe gerek yoktur. Unutulmamalıdır ki, kesi uzunluğu sadece 1,5 mm'ye kadardır. Cerrahi insizyonun daha büyük bir yara gerektirdiği veya uygun bir skleral tünel konfigürasyonunun elde edilemediği durumlarda, 10-0 naylon sütür makul bir çözümdür. Mevcut teknik, önerilen cerrahi enstrümantasyonla birlikte kullanıldığında oldukça güvenilirdir. Bazı yazarlar implantları için özelleştirilmiş enjektörler kullanmışlardır, bu da insizyon boyutunu değiştirir ve uygun kapatma için skleral sütür kullanma ihtiyacına neden olur25,29. Bununla birlikte, deneyimlerimize göre, farklı malzemeler ve enjektörler kullanmak, insizyon uzunluğunun artmasına (~0,5 mm) neden olmuştur18,19. Hala daha büyük bir skleral insizyonla ilişkili instabilite veya komplikasyon gözlemlemedik ve sütür gerekmedi. Bununla birlikte, prosedür sırasında bu kılavuzların dışında enstrümantasyon kullanılması bu tekniğin bir sınırlaması olarak kabul edilebilir.
Önceki yayınlarda nadiren atıfta bulunulan bir diğer kritik adım, fokal RD'yi oluşturmadan ve implantı subretinal boşluğa enjekte etmeden önce göz içi basıncını (GİB) azaltmak için parasentezdir 4,10,13,15. GİB'nin azaltılması, retinayı ayırırken göz içi yapıların daha iyi kontrol edilmesini sağlar ve göz içi içeriğinin ekstrüzyonunu önler, bu da başarısız bir işlemle sonuçlanır. Hipotonik bir gözle ilişkili bir diğer avantaj, implantın skleral insizyon yoluyla enjekte edilmesi sırasında direncin azalmasıdır, bu da implantın kendisine daha az zarar verir. Öte yandan, düşük GİB, cerrahi insizyonda oküler kanamanın artmasına eğilimlidir. Skleral insizyondaki büyük miktarda kan, görüşü gizler ve subretinal implantasyon sırasında kanın subretinal boşluğa taşınma riskini artırır. Bölgeyi temizlemek ve cerrahi komplikasyonlardan kaçınmak için kanamayı pamuk takasları ve BSS kullanarak kontrol etmenizi öneririz.
İmplantın subretinal boşluğa düzgün bir şekilde yerleştirilmesi için RD'nin boyutunun önemli olduğunu belirtmekte fayda var. Diğer hayvan modellerinden ve insanlardanfarklı olarak 5,14,30, bu skleral yaklaşım subretinal boşluğun doğrudan görüntülenmesini sağlamadığından, fokal bir RD oluşturmak daha zordur. İmplantın bu alanın dışına yerleştirilmeden subretinal boşluğa nazikçe yerleştirilmesi için yeterli alan sağlamak için 100 μLof BSS enjekte edilmesi önerilir. Bu öneri, retinanın en az bir kadranında bir RD oluşturulmasına dayanmaktadır. Retinanın en az bir kadranından daha küçük bir RD oluşturulursa, implant intravitreal, intraretinal veya suprakoroidal boşluğa yanlış bir şekilde enjekte edilecektir. Protokol boyunca açıklandığı gibi, küçük bir RD gözlenirse, istenen RD elde edilene kadar 2.2.4 ila 2.2.8 arasındaki adımların tekrarlanması önerilir.
Makalede tartışılan cerrahi komplikasyonların ve kritik adımların çoğu, öğrenme eğrisi sırasında ortaya çıkabilir ve bu da subretinal implantasyonun başarısını tehlikeye atabilir. Bu öğrenme eğrisi aynı zamanda hayvanların anestezi altında kaldığı süreyi ve dehidrasyon seviyesini de içerir. Daha uzun anestezi süresi, anestezikler ve dehidrasyon, kornea, lens ve skleral değişiklikler gibi kuru göz komplikasyonlarına yol açabilir31. Ek olarak, ketamin ve ksilazin gibi anestezikler, sulu mizah bileşimindeki değişikliklerle birlikte kornea ve lensteki ortam opaklığı ile ilişkilendirilmiştir32. Anestezi süresi boyunca cerrahi göze kayganlaştırıcı göz damlası (BSS) kullanmak bu komplikasyonları giderir. Özetle, bu yazıda açıklanan metodolojinin, sıçan gözlerinde subretinal terapötiklerin geliştirilmesinde cerrahi bir öneri olarak kullanılması amaçlanmıştır.
Açıklamalar
M.S.H., D.R.H. ve JL, Rejeneratif Yama Teknolojileri'nin (RPT) kurucu ortakları ve danışmanlarıdır. Diğer yazarlar, bu yazıda tartışılan konu veya materyallerle ilgili herhangi bir mali veya mali olmayan çıkarı olan herhangi bir kuruluş veya kuruluşla hiçbir bağlantıları veya katılımları olmadığını onaylarlar.
Teşekkürler
Bu çalışma CIRM DT3 (MSH) ve Körlüğü Önleme Araştırmaları (USC Roski Göz Enstitüsü) tarafından desteklenmiştir. Teknik yardımları için Fernando Gallardo ve Dr. Ying Liu'ya teşekkür etmek istiyoruz.
Sponsorun bu araştırmanın tasarımında veya yürütülmesinde hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | VWR | BD309659 | |
| 27 G needle 1/2'' | VWR | BD305109 | |
| 30 G needle 1/2'' | VWR | BD305106 | |
| 32 G Blunt needle - Small hub RN | Hamilton | 7803-04 | |
| 4-0 Perma Hand silk black 1X18" PC-5 | Ethicon | 1984G | |
| 6'' sterile cotton tips | VWR | 10805-154 | |
| Betadine 5% sterile ophthalmic prep solution | Alcon | 8007-1 | |
| BSS irrigating solution 15 mL | Accutome | Ax17362 | |
| Buprenorphine ER | ZooPharm | N/A | |
| Castroviejo Caliper | Storz | E2405 | |
| Castroviejo suturing forceps 0.12 mm | Storz | E1796 | |
| Clayman-Vannas scissors straight | Storz | E3383S | |
| Cover glass, square | WVR | 48366-227 | |
| EPS Polystyrene block | Silverlake LLC | CFB8x12x2 | |
| Gonak 15 mL | Accutome | Ax10968 | Eye lubricant |
| Halstead straight hemostatic mosquito forceps non-magnetic | Storz | E6772 | |
| Hamilton syringe 700 series 100 µL | Hamilton | 7638-01 | |
| HEYEX Software | Heidelberg | N/A | an image management software |
| Kelman-McPherson tying forceps angled | Storz | E1815 AKUS | |
| Ketamine (100 mg/mL) | MWI | 501072 | |
| Needle holder 9mm curved fine locking | Storz | 3-302 | |
| Neomycin/Polymyxin B sulfactes/Bacitracin zinc ointment 3.5 g | Accutome | Ax0720 | |
| Ophthalmic surgical microscope | Zeiss | SN: 233922 | |
| Phenylephrine 2.5% 15 mL | Accutome | Ax0310 | |
| Spectralis SD-OCT | Heidelberg | SPEC-CAM-011210s3600 | |
| Sterile Drape | VWR | 100229-300 | |
| Sterile surgical gloves | VWR | 89233-804 | |
| T-Pump heating system | Gaymar | TP650 | |
| Tropicamide 1% 15 mL | Accutome | Ax0330 | |
| Ultrathin membranes made from Parylene C and coated with vitronectin | Mini Pumps LLC, CA | specifically designed for this study | used as subretinal implants |
| Xylazine (100 mg/mL) | MWI | 510650 |
Referanslar
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Global Health. 2 (2), 106-116 (2014).
- Schultz, N. M., Bhardwaj, S., Barclay, C., Gaspar, L., Schwartz, J. Global burden of dry age-related macular degeneration: a targeted literature review. Clinical Therapeutics. 43 (10), 1792-1818 (2021).
- Deng, Y., et al. Age-related macular degeneration: Epidemiology, genetics, pathophysiology, diagnosis, and targeted therapy. Genes & Diseases. 9 (1), 62-79 (2021).
- Nazari, H., et al. Stem cell-based therapies for age-related macular degeneration: The promises and the challenges. Progress in Retinal and Eye Research. 48, 1-39 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- Kashani, A. H., et al. Survival of an HLA-mismatched, bioengineered RPE implant in dry age-related macular degeneration. Stem Cell Reports. 17 (3), 448-458 (2022).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Da Cruz, L., Chen, F. K., Ahmado, A., Greenwood, J., Coffey, P. RPE transplantation and its role in retinal disease. Progress in Retinal and Eye Research. 26 (6), 598-635 (2017).
- Hu, Y., et al. A novel approach for subretinal implantation of ultrathin substrates containing stem cell-derived retinal pigment epithelium monolayer. Ophthalmic Research. 48 (4), 186-191 (2012).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: improved survival when implanted as a monolayer. Investigative Ophthalmology & Visual Science. 54 (7), 5087-5096 (2013).
- Antognazza, M. R., et al. Characterization of a polymer-based, fully organic prosthesis for implantation into the subretinal space of the rat. Advanced Healthcare Materials. 5 (17), 2271-2282 (2016).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286 (2021).
- Thomas, B. B., et al. A new immunodeficient retinal dystrophic rat model for transplantation studies using human-derived cells. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (11), 2113-2125 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatán minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology. 254 (8), 1553-1565 (2016).
- Yu, W., et al. Biocompatibility of subretinal parylene-based Ti/Pt microelectrode array in rabbit for further artificial vision studies. Journal of Ocular Biology, Diseases, and Informatics. 2 (1), 33-36 (2009).
- Thomas, B. B., et al. Survival and functionality of hESC-derived retinal pigment epithelium cells cultured as a monolayer on polymer substrates transplanted in RCS rats. Investigative Ophthalmology & Visual Science. 57 (6), 2877-2887 (2016).
- Adekunle, A. N., et al. Integration of perforated subretinal prostheses with retinal tissue. Translational Vision Science & Technology. 4 (4), 5 (2015).
- Lu, B., et al. Semipermeable parylene membrane as an artificial Bruch's membrane. 2011 16th International Solid-State Sensors, Actuators and Microsystems Conference. IEEE. , 950-953 (2011).
- Hu, Y., et al. Subretinal implantation of gelatin films with stem cells derived RPE in rats. Investigative Ophthalmology & Visual Science. 54 (15), 1763 (2013).
- Aramant, R. B., Seiler, M. J. Retinal transplantation-advantages of intact fetal sheets. Progress in Retinal and Eye Research. 21 (1), 57-73 (2002).
- Peng, Q., et al. Structure and function of embryonic rat retinal sheet transplants. Current Eye Research. 32 (9), 781-789 (2007).
- Pardue, M. T., et al. Neuroprotective effect of subretinal implants in the RCS rat. Investigative Ophthalmology & Visual Science. 46 (2), 674-682 (2005).
- Ho, E., et al. Characteristics of prosthetic vision in rats with subretinal flat and pillar electrode arrays. Journal of Neural Engineering. 16 (6), 066027 (2019).
- Thomas, B. B., et al. Co-grafts of human embryonic stem cell derived retina organoids and retinal pigment epithelium for retinal reconstruction in immunodeficient retinal degenerate Royal College of Surgeons rats. Frontiers in Neuroscience. 15, 752958 (2021).
- Seiler, M. J., et al. Vision recovery and connectivity by fetal retinal sheet transplantation in an immunodeficient retinal degenerate rat model. Investigative Ophthalmology & Visual Science. 58 (1), 614-630 (2017).
- McLelland, B. T., et al. Transplanted hESC-derived retina organoid sheets differentiate, integrate, and improve visual function in retinal degenerate rats. Investigative Ophthalmology & Visual Science. 59 (6), 2586-2603 (2018).
- Lin, B., McLelland, B. T., Mathur, A., Aramant, R. B., Seiler, M. J. Sheets of human retinal progenitor transplants improve vision in rats with severe retinal degeneration. Experimental Eye Research. 174, 13-28 (2018).
- Matsuo, T., Hosoya, O., Tsutsui, K. M., Uchida, T. Behavior tests and immunohistochemical retinal response analyses in RCS rats with subretinal implantation of Okayama-University-type retinal prosthesis. Journal of Artificial Organs. 16 (3), 343-351 (2013).
- Seiler, M. J., et al. A new immunodeficient pigmented retinal degenerate rat strain to study transplantation of human cells without immunosuppression. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (7), 1079-1092 (2014).
- Stanzel, B. V. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Fabian, R. J., Bond, J. M., Drobeck, H. P. Induced corneal opacities in the rat. The British Journal of Ophthalmology. 51 (2), 124-129 (1976).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Experimental Eye Research. 42 (4), 331-337 (1986).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır