Method Article
Desenvolvimento de uma Técnica Cirúrgica para Implantes Sub-retinianos em Ratos
Neste Artigo
Resumo
O presente protocolo descreve a abordagem escleral para implante de dispositivo sub-retiniano, uma técnica cirúrgica viável para implementação em modelos animais de doenças retinianas em pesquisa.
Resumo
A degeneração da retina, como a degeneração macular relacionada à idade (DMRI), é uma das principais causas de cegueira em todo o mundo. Uma miríade de abordagens foi realizada para desenvolver terapias baseadas em medicina regenerativa para DMRI, incluindo terapias baseadas em células-tronco. Os roedores como modelos animais para degeneração retiniana são uma base para a pesquisa translacional, devido ao amplo espectro de cepas que desenvolvem doenças de degeneração retiniana em diferentes estágios. No entanto, imitar a entrega terapêutica humana de implantes sub-retinianos em roedores é um desafio, devido a diferenças anatômicas, como tamanho do cristalino e volume vítreo. Este protocolo cirúrgico visa fornecer um método guiado para o transplante de implantes para o espaço sub-retiniano em ratos. Uma descrição abrangente e amigável das etapas críticas foi incluída. Este protocolo foi desenvolvido como um procedimento cirúrgico econômico para reprodutibilidade em diferentes estudos pré-clínicos em ratos. A miniaturização adequada de um implante de tamanho humano é necessária antes da realização do experimento cirúrgico, que inclui ajustes nas dimensões do implante. Uma abordagem externa é usada em vez de um procedimento intravítreo para entregar o implante ao espaço sub-retiniano. Com uma agulha pequena e afiada, é realizada uma incisão escleral no quadrante temporal superior, seguida de paracentese para reduzir a pressão intraocular, minimizando assim a resistência durante o implante cirúrgico. Em seguida, uma injeção de solução salina balanceada (BSS) através da incisão é realizada para atingir o descolamento focal da retina (RD). Por fim, são realizadas a inserção e visualização do implante no espaço sub-retiniano. A avaliação pós-operatória da colocação sub-retiniana do implante inclui imagens por tomografia de coerência óptica de domínio espectral (SD-OCT). Os acompanhamentos de imagem verificam a estabilidade sub-retiniana do implante, antes que os olhos sejam colhidos e fixados para análise histológica.
Introdução
A degeneração macular relacionada à idade (DMRI) é uma das principais causas de cegueira em todo o mundo. O número de pessoas afetadas com DMRI em 2020 foi estimado em 196 milhões, e deve aumentar para cerca de 288 milhões até 20401. Na última década, várias terapêuticas foram desenvolvidas para mitigar as alterações visuais associadas aos estágios tardios da DMRI, principalmente para tratar o desenvolvimento e a progressão da neovascularização coroidal observada na DMRI úmida. Por outro lado, estima-se que o tratamento da DMRI seca, em que a disfunção e a perda das células do epitélio pigmentar da retina (EPR) progridem para EPR e atrofia retiniana, sejam responsáveis por 85% a 90% da DMRI, com prevalência de 0,44% em todo o mundo 1,2. A DMRI tem sido descrita como uma doença multifatorial com idade, fatores genéticos e ambientais que contribuem para o início e progressão da doença; Várias terapias estão em desenvolvimento para abordar as diferentes vias fisiopatológicas associadas a esta doença3.
A terapia baseada em células-tronco foi desenvolvida como uma nova opção terapêutica para substituir a falha do EPR na DMRIseca 4. Embora o uso de células-tronco pluripotentes ainda esteja em ensaios clínicos iniciais, a segurança foi demonstrada em vários ensaios clínicos 5,6,7. Até o momento, existem duas rotas principais para implantar células-tronco no espaço sub-retiniano: suspensão ou inserção de um adesivo monocamada semeado em um implante biocompatível 8,9,10,11,12. Novas estratégias usando terapias baseadas em células-tronco em estudos pré-clínicos exigem modelos animais em que a terapêutica baseada em células-tronco possa ser entregue no mesmo local-alvo pretendido em humanos. A diferença na anatomia pode exigir pequenas alterações nos procedimentos, equipamentos cirúrgicos e abordagem em comparação com aqueles usados com o produto humano final13,14. A modificação das técnicas cirúrgicas oculares é uma das mudanças necessárias que tem sido amplamente descrita como uma abordagem bem-sucedida para uso em diferentes modelos animais 15,16,17.
Embora publicações anteriores tenham mencionado técnicas cirúrgicas para implantes sub-retinianos em ratos, não há descrições abrangentes de tais técnicas para superar as dificuldades técnicas que os pesquisadores podem encontrar. Portanto, é necessário descrever adequadamente as técnicas cirúrgicas em detalhes, fornecer as melhores práticas e lições aprendidas a serem evitadas e, se necessário, resolver problemas durante as etapas críticas ao longo do procedimento. O objetivo deste manuscrito é fornecer uma diretriz abrangente para a implantação cirúrgica do implante no espaço sub-retiniano em ratos.
Protocolo
Todos os experimentos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade do Sul da Califórnia (IACUC) e foram realizados seguindo o Guia do National Institutes of Health (NIH) para o Cuidado e Uso de Animais de Laboratório e a Declaração da Associação para Pesquisa em Visão e Oftalmologia (ARVO) para o Uso de Animais em Pesquisa Oftálmica e Visual. Um total de 12 ratos machos do Royal College of Surgeon (RCS) foram usados no presente estudo. Os animais foram criados no biotério e incluídos no estudo assim que atingiram a idade de 28 ± 1 dia após o nascimento. Um exame oftalmológico completo foi realizado para verificar a ausência de anormalidades oculares. Os implantes sub-retinianos, membranas ultrafinas feitas de parileno C e revestidas com vitronectina, foram projetados por uma organização comercial específica (ver Tabela de Materiais). Essas membranas replicam membranas de tamanho humano em termos de espessura e permeabilidade (estrutura de malha de 6,0 μm de espessura com poros circulares de 20 μm nas áreas ultrafinas). A miniaturização do comprimento e da largura (1,0 mm × 0,4 mm) das membranas de tamanho humano foi alcançada para acomodar os implantes sub-retinianos dentro dos olhos dos roedores18.
1. Cuidados com os animais e preparação cirúrgica
- Pese o animal para calcular a dosagem de anestesia e anestesiar seguindo o passo 1.2.
- Anestesiar o animal por meio de injeção intraperitoneal de uma mistura de cetamina e xilazina (35-50 mg/kg e 5-10 mg/kg, respectivamente; ver Tabela de Materiais). Injete com uma seringa de 1,0 ml e uma agulha de 30 G.
- Carregue outra seringa de 1,0 mL com metade da quantidade da mistura da anestesia (cetamina e xilazina) para manter o nível adequado de anestesia durante o procedimento.
- Confirme a anestesia adequada pela ausência de reflexo pedal (pinça firme do dedo do pé).
- Para visualizar adequadamente a cavidade vítrea e a retina, dilate a pupila com a instilação de tropicamida a 1% e colírio de fenilefrina a 2,5% (consulte a Tabela de Materiais) no olho tratado.
- Aplique uma segunda dose de colírio de dilatação após 5 min.
- Aplique lágrimas artificiais ou gel lubrificante ocular no olho não cirúrgico a cada 5-10 minutos enquanto o animal está anestesiado para hidratar a córnea.
- Coloque uma cortina estéril sobre a almofada de aquecimento (consulte a Tabela de Materiais). Coloque uma cortina estéril cobrindo a bandeja cirúrgica.
- Prepare a área cirúrgica estéril colocando os seguintes instrumentos estéreis na bandeja cirúrgica: luvas cirúrgicas, implante sub-retiniano e ferramentas cirúrgicas: pinça mosquiteira (3), tesoura fina microcirúrgica (1), porta-agulha (1), pinça fina com dentes (1), pinça reta fina sem dentes (2), seringa de microlitro (1), agulha romba de 32 G (1), agulha de 27 G ou 30 G (2), Sutura de seda 4-0 (3), cotonetes, solução salina balanceada (BSS) e uma lamínula (ver Tabela de Materiais).
- Em condições estéreis e usando luvas estéreis, carregue a seringa de microlitro com o BSS e conecte a agulha romba de 32 G.
- Insira o comutador de algodão no cubo da agulha de 27 G ou 30 G para criar uma alça para uma manipulação mais sensível da agulha.
- Para manter as condições estéreis durante todo o procedimento, troque as luvas estéreis se instrumentos ou áreas não estéreis forem manipulados, como o microscópio cirúrgico.
2. Abordagem escleral para implante sub-retiniano: técnica cirúrgica
- Exponha a área cirúrgica seguindo os passos abaixo.
- Uma vez que o animal esteja sob anestesia e a pupila esteja dilatada (passo 1.5), coloque o animal de barriga para baixo com a cabeça voltada para o pesquisador.
NOTA: Mantenha o rato na almofada de aquecimento coberto com uma cortina estéril durante toda a cirurgia e até que o animal esteja totalmente recuperado. - Aplique gotas de povidona a 5% (consulte a Tabela de Materiais) no olho e limpe a superfície dos olhos e as pálpebras com cotonetes.
- Coloque e ajuste o microscópio cirúrgico (consulte a Tabela de Materiais) sobre o olho cirúrgico.
NOTA: Recomenda-se o uso de um microscópio oftalmológico cirúrgico durante todo o procedimento cirúrgico para obter uma visualização mais nítida e maior das estruturas oculares. - Garanta a exposição adequada da área cirúrgica levantando a pálpebra superior e projetando o globo ocular usando suturas inabsorvíveis 4-0.
- Eleve a pálpebra superior usando uma sutura de seda 4-0. Coloque a sutura no lado anterior das pálpebras ao nível das glândulas meibomianas. Prenda a sutura tracional prendendo a pinça de mosquito na superfície cirúrgica.
NOTA: Se a sutura for colocada acima do nível da glândula meibomiana, ocorrerá eversão da pálpebra em vez da elevação da pálpebra. - Realizar peritomia do quadrante temporal superior com tesoura microcirúrgica fina.
- Coloque duas suturas tracionais para permitir a protrusão e o deslocamento para a frente do globo ocular. Realize o isolamento do músculo reto superior.
- Através da manipulação suave do olho com pinças de dentes finos (pinças de 0,12 mm) na face superior do limbo, role o olho para baixo para expor a esclera.
- Coloque uma sutura de seda 4-0 atrás do limbo superior a até 1 mm de distância, que é a localização do músculo extraocular superior. Prenda ambas as caudas da sutura usando uma pinça de mosquito.
- Realize o isolamento do músculo reto temporal. Coloque uma segunda sutura (seda 4-0) a até 1 mm de distância do limbo no quadrante temporal (na área correspondente do músculo extraocular temporal). Prenda ambas as caudas da sutura usando uma pinça de mosquito.
- Uma vez que ambas as suturas do músculo extraocular estejam devidamente colocadas e presas, puxe as suturas para baixo e para dentro para expor o quadrante temporal superior da esclera.
- Eleve a pálpebra superior usando uma sutura de seda 4-0. Coloque a sutura no lado anterior das pálpebras ao nível das glândulas meibomianas. Prenda a sutura tracional prendendo a pinça de mosquito na superfície cirúrgica.
- Estenda a peritomia em direção à parte posterior do olho com uma tesoura microcirúrgica fina.
- Controle o sangramento conjuntival usando cotonetes.
- Uma vez que o animal esteja sob anestesia e a pupila esteja dilatada (passo 1.5), coloque o animal de barriga para baixo com a cabeça voltada para o pesquisador.
- Realize a incisão escleral, o descolamento de retina (RD) e a inserção do implante seguindo as etapas abaixo.
- Realize a incisão escleral usando uma agulha de 27 G ou 30 G. Certifique-se de que o tamanho da incisão seja ~ 1.2 mm e 1.5 mm posterior ao limbo.
NOTA: O desenvolvimento de uma configuração de incisão escleral em forma de túnel é recomendado para estabilizar as estruturas intraoculares durante a manipulação do olho e a introdução do implante. Esta forma de incisão evitará flutuações repentinas na pressão intraocular. - Às vezes, a configuração adequada requer prática. Portanto, se a configuração adequada não for alcançada, libere alguma tensão das suturas tracionais do músculo extraocular para facilitar a manutenção das estruturas oculares dentro da cavidade vítrea.
- Utilizando a mesma agulha utilizada para a incisão escleral (27 G ou 30 G), realizar paracentese na córnea periférica no mesmo quadrante.
- Insira a agulha romba de 32 G montada em uma seringa de microlitro através da incisão escleral.
- Injete 100 μL de BSS para criar um RD focal.
- Solte as suturas tracionais do músculo extraocular para colocar o olho de volta na posição normal.
- Para visualização direta do RD, coloque a lamínula, carregada com gel lubrificante oftálmico, na córnea.
- Ajuste a objetiva do microscópio para focar na retina.
- Se o RD não for observado ou for muito pequeno (menor que o tamanho de um quadrante), execute uma segunda injeção de BSS para atingir o tamanho desejado do RD rolando o olho para baixo e para dentro e repetindo as etapas 2.2.4 a 2.2.8.
- Uma vez concluído o RD, verifique o comprimento escleral (conforme mencionado na etapa 2.2.1) com um paquímetro (consulte a Tabela de Materiais).
- Corte o tecido coroidal em ambas as direções com uma tesoura microcirúrgica fina.
- Passe a agulha romba lateralmente ao longo da incisão escleral para verificar se todas as estruturas esclerais e coroidais foram dissecadas.
- Insira o implante no espaço sub-retiniano.
- Usando duas pinças cirúrgicas finas, como pinças de amarração (consulte a Tabela de Materiais), segure o implante por trás para não danificar a parte ativa do implante.
- Coloque o implante paralelo ao plano de incisão e deslize suavemente o implante.
- Assim que o implante estiver completamente introduzido no espaço sub-retiniano, solte-o e empurre o implante ainda mais, introduzindo as mandíbulas de uma das pinças de 1 a 1,5 mm na incisão.
- Solte as suturas tracionais do músculo extraocular e verifique a colocação do implante usando o microscópio e a lamínula conforme descrito acima (etapas 2.2.7 e 2.2.8).
- Realize a incisão escleral usando uma agulha de 27 G ou 30 G. Certifique-se de que o tamanho da incisão seja ~ 1.2 mm e 1.5 mm posterior ao limbo.
- Solte e remova todas as suturas.
NOTA: Após a conclusão do procedimento cirúrgico, é realizada a SD-OCT (etapa 3) para validar os achados clínicos. A sessão de imagem SD-OCT é realizada logo após a cirurgia. Se a visualização adequada da localização do implante não for obtida, realize o SD-OCT novamente 7 a 10 dias após a cirurgia.
3. Imagem SD-OCT
- Clique no ícone do Heidelberg Eye Explorer (um software de gerenciamento de imagens; consulte Tabela de materiais) na tela da área de trabalho.
- Clique no ícone Novo paciente na parte superior da tela.
- Preencha todas as informações solicitadas para gerar o ID do animal e clique em Aceitar.
- Selecione o sistema de imagem OCT (HRA + OCT; consulte Tabela de materiais) para o tipo de dispositivo.
- Selecione o operador e pressione OK.
- Para a opção de curvatura correta da córnea, pressione o botão OK para aceitar os dados padrão do olho.
- Certifique-se de que a janela de aquisição do SD-OCT esteja iniciada e pronta para o SD-OCT.
- Ligue a câmera SD-OCT pressionando o botão amarelo Iniciar localizado na tela sensível ao toque ao lado da câmera.
- Coloque o animal no estágio de animal SD-OCT que foi adaptado em cima do encosto de cabeça SD-OCT.
NOTA: A adaptação do estágio animal inclui um pedaço de espuma de poliestireno (consulte a Tabela de Materiais) para caber no estágio principal SD-OCT que seja grande o suficiente para colocar o animal, incluindo a almofada de aquecimento. - Ajuste a altura da mesa e a posição do animal para alinhar a pupila com o centro da lente SD-OCT.
NOTA: Assim que o olho estiver alinhado, uma imagem ao vivo infravermelha (IR) aparecerá na tela. - Pressione o botão IR + OCT na tela sensível ao toque ou o botão OCT no canto inferior direito do monitor para iniciar a aquisição da imagem.
- Assim que o SD-OCT for ativado, selecione um único modo de varredura com o maior número (100) de quadros ART. O modo de digitalização 100 ART é o modo padrão.
- Usando o joystick da câmera, centralize o nervo óptico na imagem IR.
- Empurre a câmera para frente até que a imagem IR seja preenchida uniformemente com a imagem da retina.
NOTA: Os cantos escuros indicam que a câmera está muito longe ou perto do olho. - Mova a câmera para o lado até que o implante seja visualizado no aspecto temporal da retina. Use a imagem IR para guiar os movimentos.
- Para visualizar o implante pelo B-scan, pressione CTRL + ALT + SHIFT + O simultaneamente para exibir a janela de ajuste do SD-OCT B-scan.
- Ajuste o "Braço de Referência" (na parte inferior da janela) até que a retina/implante seja visualizada na imagem SD-OCT.
NOTA: A imagem SD-OCT deve ser exibida nos cantos de referência azuis. - Feche a janela.
- Usando o joystick e a alça da câmera, deslize e gire a câmera em todas as direções até obter uma imagem de qualidade SD-OCT melhor, mais plana e mais nítida.
- Arraste a seta azul na imagem IR até que ela seja colocada ao longo do implante.
- Quando a saturação e o posicionamento do B-scan estiverem ideais, ative o "Rastreamento automático em tempo real (ART)" pressionando o botão preto de controle de ganho abaixo da tela sensível ao toque.
- Quando o ART atingir 100 quadros, pressione Adquirir na tela sensível ao toque.
- Quando todas as imagens tiverem sido adquiridas, clique em Salvar imagens na parte superior da janela e, em seguida, clique em Sair.
- Mantenha a córnea úmida durante toda a sessão de imagem aplicando colírios lubrificantes com frequência (a cada 5 minutos).
4. Recuperação de animais
- No final da sessão de imagem, aplique pomada antibiótica na córnea para prevenir infecções oculares e hidrate a córnea.
- Mantenha o animal descansando de barriga para baixo na almofada de aquecimento até que esteja totalmente recuperado (~ 20-30 min) e deambulando.
- Administre analgésicos sistêmicos (1,0-1,2 mg / kg de Buprenorfina SR uma vez por via subcutânea; ver Tabela de Materiais) no final do procedimento cirúrgico.
- Não deixe o animal sozinho até que ele tenha recuperado a consciência suficiente.
- Não devolva o animal à companhia de outros animais até que esteja totalmente recuperado.
- Depois de totalmente recuperado, coloque o animal de volta na área de alojamento com acesso a comida e água ad libitum.
Resultados
O implante de um implante sub-retiniano em ratos RCS (N = 12) demonstrou a viabilidade e reprodutibilidade da técnica cirúrgica para entrega sub-retiniana em ratos. Neste estudo, o olho direito foi o olho tratado (N = 12) com o implante. Na avaliação clínica realizada ao final do procedimento com o microscópio cirúrgico, nove dos 12 olhos tratados demonstraram localização sub-retiniana do implante (75,00%), dois olhos (16,67%) foram identificados como colocação intrarretiniana do implante e em um olho (8,33%) a visualização direta não foi possível devido à opacidade média causada por uma hemorragia sub-retiniana na área cirúrgica, com visão limitada tanto do implante quanto das estruturas retinianas (Tabela 1). Os exames de SD-OCT realizados imediatamente após o procedimento cirúrgico demonstraram a posição sub-retiniana ou intrarretiniana do implante (10 [83,33%] e um [8,33%], respectivamente) (Figura 1A). A SD-OCT não conseguiu identificar completamente a colocação do implante sub-retinalmente no mesmo animal (n = 1) com opacidade média descrita acima (visualização direta não possível), mesmo após 10 dias de acompanhamento. A Figura 1B, C mostra dois animais diferentes com um implante devidamente colocado no espaço sub-retiniano. Não houve outras complicações cirúrgicas associadas à técnica cirúrgica. Pela coloração de Hematoxilina e Eosina (H&E), observou-se a verificação da colocação sub-retiniana do implante (Figura 1D).
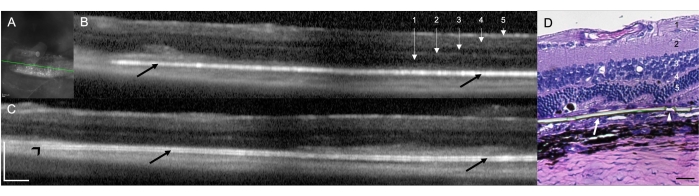
Figura 1: Tomografia de coerência óptica de domínio espectral (SD-OCT) em 1 semana após o implante cirúrgico. (A) Imagem infravermelha do implante sub-retiniano. A linha verde demarca a seção transversal mostrada em (B). Barra de escala: 200 μm. (B,C) Dois animais diferentes com um implante devidamente colocado no espaço sub-retiniano (setas pretas). A ponta do implante aponta para o nervo óptico (ponta de seta preta). 1 = Fibra nervosa da retina/camada de células ganglionares, 2 = Camada plexiforme interna, 3 = Camada externa interna, 4 = Camada plexiforme externa e 5 = Camada nuclear externa. Barra de escala: 200 μm. (D) Corte histológico corado com H&E para demonstrar a implantação sub-retiniana da membrana parileno (seta branca). A ponta da seta mostra um dos microporos nas áreas ultrafinas. 1 = Fibra nervosa da retina/camada de células ganglionares, 2 = Camada plexiforme interna, 3 = Camada externa interna, 4 = Camada plexiforme externa e 5 = Camada nuclear externa. Barra de escala: 20 μm. Ampliação: 20x. Clique aqui para ver uma versão maior desta figura.
| Avaliação Clínica | SD-OCT | |||||
| Assunto | SR | RI | Desconhecido | SR | RI | Desconhecido |
| 1 | X | X | ||||
| 2 | X | X | ||||
| 3 | X | X | ||||
| 4 | X | X | ||||
| 5 | X | X | ||||
| 6 | X | X | ||||
| 7 | X | X | ||||
| 8 | X | X | ||||
| 9 | X | X | ||||
| 10 | X | X | ||||
| 11 | X | X | ||||
| 12 | X | X | ||||
| 9 | 2 | 1 | 10 | 1 | 1 | |
| 75.00% | 16.67% | 8.33% | 83.33% | 8.33% | 8.33% | |
Tabela 1: Comparação dos achados oculares entre as avaliações clínicas e a SD-OCT entre todos os animais. Abreviaturas: SR = sub-retiniano, IR = intrarretiniano e SD-OCT = tomografia de coerência óptica de domínio espectral.
Discussão
Embora o procedimento tenha sido descrito anteriormente com pequenas variações, o escopo deste manuscrito é fornecer uma descrição abrangente de um procedimento cirúrgico para implantes sub-retinianos em ratos a ser seguido durante o aprendizado da técnica e para superar os desafios cirúrgicos e possíveis complicações que os investigadores podem encontrar. O protocolo cirúrgico descrito aqui inclui o uso da membrana de parileno ultrafina que tem sido amplamente utilizada em nosso laboratório há vários anos 9,10,16,18. No entanto, a reprodutibilidade da técnica com diferentes injetores e materiais implantados no espaço sub-retiniano tem sido observada 18,19.
Uma abordagem escleral para implantação de dispositivos sub-retinianos não se limita a terapias baseadas em células-tronco; Procedimentos de transplante de retina em modelos de pequenos animais também foram descritos20,21. No campo da estimulação elétrica retiniana, esse procedimento cirúrgico para implantes sub-retinianos em ratos é utilizado há mais de uma década22. Mais recentemente, Ho et al.23 implantaram um array para estimular a retina de ratos, e Thomas et al.24 usaram organoides de retina como fonte de células-tronco. Como mencionado anteriormente, as terapias baseadas em células-tronco foram bem publicadas, incluindo publicações sobre o implante cirúrgico de implantes biocompatíveis semeados com células-tronco4. Existem pequenas variações nas abordagens cirúrgicas descritas por diferentes autores, que serão discutidas e comparadas com a técnica cirúrgica descrita neste manuscrito.
O fechamento escleral e a instrumentação cirúrgica requerem discussão adicional. Existem duas abordagens comuns para o manejo da incisão escleral: (1) fechamento com sutura e (2) fechamento sem sutura. Vários autores usam náilon 10-0 para fechar a incisão escleral com uma sutura como parte de seu procedimento regular 23,25,26,27. No entanto, outros grupos (incluindo o nosso) descobriram que a sutura de náilon 10-0 não é necessária28. Aqueles que apóiam o fechamento com a sutura argumentam que o implante sub-retiniano deslizará para fora da incisão no olho se não houver sutura. Conforme descrito na seção de resultados, o presente estudo não encontrou extrusão do implante ou tecido intraocular ao longo da incisão. Essa abordagem cirúrgica sem sutura tem sido utilizada em nosso laboratório rotineiramente e com sucesso 9,10,12,13,16. A justificativa para uma abordagem sem sutura depende de dois fatores: primeiro, uma combinação do local da incisão e sua configuração fornece estrutura suficiente para gerar uma incisão autovedante. Deve-se ter em mente que a configuração adequada do túnel escleral é uma etapa que os investigadores alcançarão com a prática. Em segundo lugar, a pressão intraocular aumenta quando a tração é liberada, mantendo o implante no lugar. O aumento da pressão intraocular resulta na retina sendo empurrada contra a incisão, aproximando os dois retalhos esclerais e fazendo uma incisão autovedante. Portanto, uma sutura não é necessária. É importante notar que o comprimento da incisão é de apenas 1,5 mm. Nos casos em que a incisão cirúrgica requer uma ferida maior ou se uma configuração adequada do túnel escleral não for alcançada, uma sutura de náilon 10-0 é uma solução razoável. A técnica atual é altamente confiável se usada com a instrumentação cirúrgica recomendada. Alguns autores utilizaram injetores personalizados para seus implantes, o que modifica o tamanho da incisão e resulta na necessidade de uso de sutura escleral para fechamento adequado25,29. No entanto, em nossa experiência, o uso de diferentes materiais e injetores resultou em um aumento do comprimento da incisão (~0,5 mm)18,19. Ainda não observamos instabilidade ou complicações associadas a uma incisão escleral maior, e nenhuma sutura foi necessária. No entanto, o uso de instrumentação fora dessas diretrizes durante o procedimento pode ser considerado uma limitação dessa técnica.
Outra etapa crítica que raramente foi mencionada em publicações anteriores é a paracentese para reduzir a pressão intraocular (PIO) antes de criar o DR focal e injetar o implante no espaço sub-retiniano 4,10,13,15. A diminuição da PIO proporciona melhor controle das estruturas intraoculares ao mesmo tempo em que descola a retina e evita a extrusão do conteúdo intraocular, o que resulta em um procedimento malsucedido. Outra vantagem associada a um olho hipotônico é a redução da resistência ao injetar o implante através da incisão escleral, o que resulta em menos danos ao próprio implante. Por outro lado, a baixa PIO é propensa ao aumento do sangramento ocular na incisão cirúrgica. Grandes quantidades de sangue na incisão escleral obscurecem a visão e aumentam o risco de mover o sangue para o espaço sub-retiniano durante o implante sub-retiniano. Recomendamos controlar o sangramento usando trocas de algodão e BSS para limpar a área e evitar complicações cirúrgicas.
Vale ressaltar que o tamanho do RD é importante para a colocação adequada do implante no espaço sub-retiniano. Ao contrário de outros modelos animais e humanos 5,14,30, como essa abordagem escleral não fornece visualização direta do espaço sub-retiniano, é mais difícil gerar um DR focal. Para fornecer espaço suficiente para que o implante seja implantado suavemente no espaço sub-retiniano sem colocá-lo fora dessa área, a recomendação é injetar 100 μL de BSS. Essa recomendação é baseada na geração de um DR de pelo menos um quadrante da retina. Se um RD menor que pelo menos um quadrante da retina for criado, o implante será injetado incorretamente no espaço intravítreo, intrarretiniano ou supracoroidal. Conforme descrito em todo o protocolo, se um pequeno RD for observado, recomenda-se repetir as etapas 2.2.4 a 2.2.8 até que o RD desejado seja alcançado.
A maioria das complicações cirúrgicas e etapas críticas discutidas no manuscrito pode ocorrer durante a curva de aprendizado, o que pode comprometer o sucesso do implante sub-retiniano. Essa curva de aprendizado também inclui a quantidade de tempo que os animais permanecem sob anestesia e o nível de desidratação. Um maior tempo de anestesia, anestésicos e desidratação podem levar a complicações do olho seco, como alterações da córnea, do cristalino e escleral31. Além disso, anestésicos, como cetamina e xilazina, têm sido associados à opacidade da mídia na córnea e no cristalino, juntamente com alterações na composição do humor aquoso32. O uso de colírios lubrificantes (BSS) no olho cirúrgico durante todo o tempo anestésico aborda essas complicações. Em resumo, a metodologia descrita neste manuscrito deve ser usada como uma recomendação cirúrgica no desenvolvimento de terapêuticas sub-retinianas em olhos de ratos.
Divulgações
M.S.H., D.R.H. e J.L. são co-fundadores e consultores da Regenerative Patch Technologies (RPT). Os outros autores certificam que não têm afiliações ou envolvimento em qualquer organização ou entidade com qualquer interesse financeiro ou não financeiro no assunto ou materiais discutidos neste manuscrito.
Agradecimentos
Este estudo foi apoiado pelo CIRM DT3 (MSH) e Pesquisa para Prevenir a Cegueira (USC Roski Eye Institute). Queremos agradecer a Fernando Gallardo e ao Dr. Ying Liu por sua assistência técnica.
O patrocinador não teve nenhum papel no projeto ou na condução desta pesquisa.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | VWR | BD309659 | |
| 27 G needle 1/2'' | VWR | BD305109 | |
| 30 G needle 1/2'' | VWR | BD305106 | |
| 32 G Blunt needle - Small hub RN | Hamilton | 7803-04 | |
| 4-0 Perma Hand silk black 1X18" PC-5 | Ethicon | 1984G | |
| 6'' sterile cotton tips | VWR | 10805-154 | |
| Betadine 5% sterile ophthalmic prep solution | Alcon | 8007-1 | |
| BSS irrigating solution 15 mL | Accutome | Ax17362 | |
| Buprenorphine ER | ZooPharm | N/A | |
| Castroviejo Caliper | Storz | E2405 | |
| Castroviejo suturing forceps 0.12 mm | Storz | E1796 | |
| Clayman-Vannas scissors straight | Storz | E3383S | |
| Cover glass, square | WVR | 48366-227 | |
| EPS Polystyrene block | Silverlake LLC | CFB8x12x2 | |
| Gonak 15 mL | Accutome | Ax10968 | Eye lubricant |
| Halstead straight hemostatic mosquito forceps non-magnetic | Storz | E6772 | |
| Hamilton syringe 700 series 100 µL | Hamilton | 7638-01 | |
| HEYEX Software | Heidelberg | N/A | an image management software |
| Kelman-McPherson tying forceps angled | Storz | E1815 AKUS | |
| Ketamine (100 mg/mL) | MWI | 501072 | |
| Needle holder 9mm curved fine locking | Storz | 3-302 | |
| Neomycin/Polymyxin B sulfactes/Bacitracin zinc ointment 3.5 g | Accutome | Ax0720 | |
| Ophthalmic surgical microscope | Zeiss | SN: 233922 | |
| Phenylephrine 2.5% 15 mL | Accutome | Ax0310 | |
| Spectralis SD-OCT | Heidelberg | SPEC-CAM-011210s3600 | |
| Sterile Drape | VWR | 100229-300 | |
| Sterile surgical gloves | VWR | 89233-804 | |
| T-Pump heating system | Gaymar | TP650 | |
| Tropicamide 1% 15 mL | Accutome | Ax0330 | |
| Ultrathin membranes made from Parylene C and coated with vitronectin | Mini Pumps LLC, CA | specifically designed for this study | used as subretinal implants |
| Xylazine (100 mg/mL) | MWI | 510650 |
Referências
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Global Health. 2 (2), 106-116 (2014).
- Schultz, N. M., Bhardwaj, S., Barclay, C., Gaspar, L., Schwartz, J. Global burden of dry age-related macular degeneration: a targeted literature review. Clinical Therapeutics. 43 (10), 1792-1818 (2021).
- Deng, Y., et al. Age-related macular degeneration: Epidemiology, genetics, pathophysiology, diagnosis, and targeted therapy. Genes & Diseases. 9 (1), 62-79 (2021).
- Nazari, H., et al. Stem cell-based therapies for age-related macular degeneration: The promises and the challenges. Progress in Retinal and Eye Research. 48, 1-39 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- Kashani, A. H., et al. Survival of an HLA-mismatched, bioengineered RPE implant in dry age-related macular degeneration. Stem Cell Reports. 17 (3), 448-458 (2022).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Da Cruz, L., Chen, F. K., Ahmado, A., Greenwood, J., Coffey, P. RPE transplantation and its role in retinal disease. Progress in Retinal and Eye Research. 26 (6), 598-635 (2017).
- Hu, Y., et al. A novel approach for subretinal implantation of ultrathin substrates containing stem cell-derived retinal pigment epithelium monolayer. Ophthalmic Research. 48 (4), 186-191 (2012).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: improved survival when implanted as a monolayer. Investigative Ophthalmology & Visual Science. 54 (7), 5087-5096 (2013).
- Antognazza, M. R., et al. Characterization of a polymer-based, fully organic prosthesis for implantation into the subretinal space of the rat. Advanced Healthcare Materials. 5 (17), 2271-2282 (2016).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286 (2021).
- Thomas, B. B., et al. A new immunodeficient retinal dystrophic rat model for transplantation studies using human-derived cells. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (11), 2113-2125 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatán minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology. 254 (8), 1553-1565 (2016).
- Yu, W., et al. Biocompatibility of subretinal parylene-based Ti/Pt microelectrode array in rabbit for further artificial vision studies. Journal of Ocular Biology, Diseases, and Informatics. 2 (1), 33-36 (2009).
- Thomas, B. B., et al. Survival and functionality of hESC-derived retinal pigment epithelium cells cultured as a monolayer on polymer substrates transplanted in RCS rats. Investigative Ophthalmology & Visual Science. 57 (6), 2877-2887 (2016).
- Adekunle, A. N., et al. Integration of perforated subretinal prostheses with retinal tissue. Translational Vision Science & Technology. 4 (4), 5 (2015).
- Lu, B., et al. Semipermeable parylene membrane as an artificial Bruch's membrane. 2011 16th International Solid-State Sensors, Actuators and Microsystems Conference. IEEE. , 950-953 (2011).
- Hu, Y., et al. Subretinal implantation of gelatin films with stem cells derived RPE in rats. Investigative Ophthalmology & Visual Science. 54 (15), 1763 (2013).
- Aramant, R. B., Seiler, M. J. Retinal transplantation-advantages of intact fetal sheets. Progress in Retinal and Eye Research. 21 (1), 57-73 (2002).
- Peng, Q., et al. Structure and function of embryonic rat retinal sheet transplants. Current Eye Research. 32 (9), 781-789 (2007).
- Pardue, M. T., et al. Neuroprotective effect of subretinal implants in the RCS rat. Investigative Ophthalmology & Visual Science. 46 (2), 674-682 (2005).
- Ho, E., et al. Characteristics of prosthetic vision in rats with subretinal flat and pillar electrode arrays. Journal of Neural Engineering. 16 (6), 066027 (2019).
- Thomas, B. B., et al. Co-grafts of human embryonic stem cell derived retina organoids and retinal pigment epithelium for retinal reconstruction in immunodeficient retinal degenerate Royal College of Surgeons rats. Frontiers in Neuroscience. 15, 752958 (2021).
- Seiler, M. J., et al. Vision recovery and connectivity by fetal retinal sheet transplantation in an immunodeficient retinal degenerate rat model. Investigative Ophthalmology & Visual Science. 58 (1), 614-630 (2017).
- McLelland, B. T., et al. Transplanted hESC-derived retina organoid sheets differentiate, integrate, and improve visual function in retinal degenerate rats. Investigative Ophthalmology & Visual Science. 59 (6), 2586-2603 (2018).
- Lin, B., McLelland, B. T., Mathur, A., Aramant, R. B., Seiler, M. J. Sheets of human retinal progenitor transplants improve vision in rats with severe retinal degeneration. Experimental Eye Research. 174, 13-28 (2018).
- Matsuo, T., Hosoya, O., Tsutsui, K. M., Uchida, T. Behavior tests and immunohistochemical retinal response analyses in RCS rats with subretinal implantation of Okayama-University-type retinal prosthesis. Journal of Artificial Organs. 16 (3), 343-351 (2013).
- Seiler, M. J., et al. A new immunodeficient pigmented retinal degenerate rat strain to study transplantation of human cells without immunosuppression. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (7), 1079-1092 (2014).
- Stanzel, B. V. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Fabian, R. J., Bond, J. M., Drobeck, H. P. Induced corneal opacities in the rat. The British Journal of Ophthalmology. 51 (2), 124-129 (1976).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Experimental Eye Research. 42 (4), 331-337 (1986).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.