Method Article
Sviluppo di una tecnica chirurgica per impianti sottoretinici nei ratti
In questo articolo
Riepilogo
Il presente protocollo descrive l'approccio sclerale per l'impianto di dispositivi sottoretinici, una tecnica chirurgica fattibile per l'implementazione in modelli animali di malattie retiniche in ricerca.
Abstract
La degenerazione retinica, come la degenerazione maculare legata all'età (AMD), è una delle principali cause di cecità in tutto il mondo. Sono stati intrapresi una miriade di approcci per sviluppare terapie basate sulla medicina rigenerativa per l'AMD, comprese le terapie basate sulle cellule staminali. I roditori come modelli animali per la degenerazione retinica sono una base per la ricerca traslazionale, a causa dell'ampio spettro di ceppi che sviluppano malattie da degenerazione retinica in diversi stadi. Tuttavia, imitare la somministrazione terapeutica umana di impianti sottoretinici nei roditori è impegnativa, a causa di differenze anatomiche come le dimensioni della lente e il volume del vitreo. Questo protocollo chirurgico mira a fornire un metodo guidato per il trapianto di impianti nello spazio sottoretinico nei ratti. È stata inclusa una descrizione completa e di facile utilizzo dei passaggi critici. Questo protocollo è stato sviluppato come procedura chirurgica efficiente in termini di costi per la riproducibilità in diversi studi preclinici sui ratti. Prima di condurre l'esperimento chirurgico è necessaria un'adeguata miniaturizzazione di un impianto di dimensioni umane, che include la regolazione delle dimensioni dell'impianto. Viene utilizzato un approccio esterno invece di una procedura intravitreale per consegnare l'impianto nello spazio sottoretinico. Utilizzando un piccolo ago affilato, viene eseguita un'incisione sclerale nel quadrante temporale superiore, seguita da paracentesi per ridurre la pressione intraoculare, riducendo così al minimo la resistenza durante l'impianto chirurgico. Successivamente, viene eseguita un'iniezione di soluzione salina bilanciata (BSS) attraverso l'incisione per ottenere il distacco focale della retina (RD). Infine, vengono condotti l'inserimento e la visualizzazione dell'impianto nello spazio sottoretinico. La valutazione post-operatoria del posizionamento sottoretinico dell'impianto include l'imaging mediante tomografia a coerenza ottica del dominio spettrale (SD-OCT). I follow-up di imaging accertano la stabilità sottoretinica dell'impianto, prima che gli occhi vengano prelevati e fissati per l'analisi istologica.
Introduzione
La degenerazione maculare legata all'età (AMD) è una delle principali cause di cecità in tutto il mondo. Il numero di persone affette da AMD nel 2020 è stato stimato a 196 milioni e si prevede che aumenterà a circa 288 milioni entro il 20401. Nell'ultimo decennio, sono state sviluppate diverse terapie per mitigare i cambiamenti visivi associati agli stadi tardivi dell'AMD, principalmente per trattare lo sviluppo e la progressione della neovascolarizzazione coroideale osservata nell'AMD umida. Al contrario, si stima che il trattamento dell'AMD secca, in cui la disfunzione e la perdita delle cellule dell'epitelio pigmentato retinico (RPE) progrediscono verso l'RPE e l'atrofia retinica, rappresenti dall'85% al 90% dell'AMD, con una prevalenza dello 0,44% in tutto il mondo 1,2. L'AMD è stata descritta come una malattia multifattoriale con fattori di età, genetici e ambientali che contribuiscono all'insorgenza e alla progressione della malattia; Diverse terapie sono in fase di sviluppo per affrontare i diversi percorsi fisiopatologici associati a questa malattia3.
La terapia a base di cellule staminali è stata sviluppata come nuova opzione terapeutica per sostituire l'RPE fallimentare nell'AMD4 secca. Sebbene l'uso di cellule staminali pluripotenti sia ancora in fase di studi clinici iniziali, la sicurezza è stata dimostrata in diversi studi clinici 5,6,7. Ad oggi, ci sono due percorsi principali per distribuire le cellule staminali nello spazio sottoretinico: la sospensione o l'inserimento di un cerotto monostrato seminato su un impianto biocompatibile 8,9,10,11,12. Le nuove strategie che utilizzano terapie basate su cellule staminali negli studi preclinici richiedono modelli animali in cui le terapie basate su cellule staminali possono essere somministrate nello stesso sito mirato previsto negli esseri umani. La differenza di anatomia potrebbe richiedere piccole modifiche alle procedure, alle attrezzature chirurgiche e all'approccio rispetto a quelli utilizzati con il prodotto umano finale13,14. La modifica delle tecniche chirurgiche oculari è uno dei cambiamenti necessari che è stato ampiamente descritto come un approccio di successo per l'uso in diversi modelli animali 15,16,17.
Sebbene precedenti pubblicazioni abbiano menzionato tecniche chirurgiche per impianti sottoretinici nei ratti, non ci sono descrizioni complete di tali tecniche per superare le difficoltà tecniche che i ricercatori possono incontrare. Pertanto, è necessario descrivere adeguatamente le tecniche chirurgiche in dettaglio, fornire le migliori pratiche e le lezioni apprese per evitare e, se necessario, affrontare i problemi durante le fasi critiche della procedura. Lo scopo di questo manoscritto è quello di fornire una linea guida completa per l'impianto chirurgico dell'impianto nello spazio sottoretinico nei ratti.
Protocollo
Tutti gli esperimenti sono stati approvati dal Comitato Istituzionale per la Cura e l'Uso degli Animali (IACUC) della University of Southern California e sono stati eseguiti seguendo la Guida del National Institutes of Health (NIH) per la cura e l'uso degli animali da laboratorio e la Dichiarazione dell'Associazione per la ricerca sulla visione e l'oftalmologia (ARVO) per l'uso degli animali nella ricerca oftalmica e visiva. Nel presente studio sono stati utilizzati un totale di 12 ratti maschi del Royal College of Surgeon (RCS). Gli animali sono stati allevati nella struttura per animali e inclusi nello studio una volta raggiunta l'età di 28 anni ± 1 giorni dopo la nascita. È stato eseguito un esame oculistico completo per verificare l'assenza di anomalie oculari. Gli impianti sottoretinici, membrane ultrasottili realizzate in Parylene C e rivestite con vitronectina, sono state progettate da una specifica organizzazione commerciale (vedi Tabella dei Materiali). Queste membrane replicano membrane di dimensioni umane in termini di spessore e permeabilità (telaio a rete di 6,0 μm di spessore con pori circolari di 20 μm nelle aree ultrasottili). La miniaturizzazione della lunghezza e della larghezza (1,0 mm × 0,4 mm) delle membrane di dimensioni umane è stata ottenuta per accogliere gli impianti sottoretinici all'interno degli occhi dei roditori18.
1. Cura degli animali e preparazione chirurgica
- Pesare l'animale per calcolare il dosaggio di anestesia e anestetizzare seguendo il passaggio 1.2.
- Anestetizzare l'animale mediante iniezione intraperitoneale di una miscela di ketamina e xilazina (35-50 mg/kg e 5-10 mg/kg, rispettivamente; vedi Tabella dei materiali). Iniettare con una siringa da 1,0 ml e un ago da 30 G.
- Caricare un'altra siringa da 1,0 ml con metà della quantità della miscela di anestesia (ketamina e xilazina) per mantenere il corretto livello di anestesia durante la procedura.
- Confermare un'anestesia adeguata dall'assenza di un riflesso del pedale (pizzicamento deciso delle dita).
- Per visualizzare correttamente la cavità vitreale e la retina, dilatare la pupilla mediante l'instillazione di un collirio tropicammide all'1% e di fenilefrina al 2,5% (vedi Tabella dei materiali) nell'occhio trattato.
- Applicare una seconda dose di collirio dilatatore dopo 5 minuti.
- Applicare lacrime artificiali o gel lubrificante oculare nell'occhio non chirurgico ogni 5-10 minuti mentre l'animale è anestetizzato per idratare la cornea.
- Posizionare un telo sterile sul termoforo (vedi Tabella dei materiali). Posizionare un telo sterile che copra il vassoio chirurgico.
- Preparare l'area chirurgica sterile posizionando i seguenti strumenti sterili sul vassoio chirurgico: guanti chirurgici, impianto sottoretinico e strumenti chirurgici: pinza per zanzare (3), forbici fini microchirurgiche (1), portaaghi (1), pinza fine con denti (1), pinza fine dritta senza denti (2), siringa da microlitro (1), ago smussato da 32 G (1), ago da 27 G o 30 G (2), Sutura di seta 4-0 (3), tamponi di cotone, soluzione salina bilanciata (BSS) e vetrino coprioggetto (vedi Tabella dei materiali).
- In condizioni sterili e utilizzando guanti sterili, caricare la siringa da microlitri con il BSS e inserire l'ago smussato da 32 G.
- Inserisci il batuffolo di cotone nel mozzo dell'ago da 27 g o 30 g per creare un'impugnatura per una manipolazione più sensibile dell'ago.
- Per mantenere le condizioni di sterilità durante tutta la procedura, sostituire i guanti sterili se vengono manipolati strumenti o aree non sterili, come il microscopio operatorio.
2. Approccio sclerale per l'impianto sottoretinico: tecnica chirurgica
- Esporre l'area chirurgica seguendo i passaggi seguenti.
- Una volta che l'animale è sotto anestesia e la pupilla è dilatata (passaggio 1.5), posiziona l'animale a pancia in giù con la testa rivolta verso il ricercatore.
NOTA: Tenere il ratto sul termoforo coperto con un telo sterile durante l'intero intervento chirurgico e fino a quando l'animale non si è completamente ripreso. - Applicare gocce di povidone al 5% (vedi Tabella dei materiali) sull'occhio e pulire la superficie oculare e le palpebre con tamponi di cotone.
- Posizionare e regolare il microscopio operatorio (vedere la Tabella dei materiali) sull'occhio operatorio.
NOTA: Si consiglia di utilizzare un microscopio oftalmico chirurgico durante l'intera procedura chirurgica per ottenere una visualizzazione più nitida e più ampia delle strutture oculari. - Garantire una corretta esposizione dell'area chirurgica sollevando la palpebra superiore e sporgendo il bulbo oculare utilizzando suture 4-0 non assorbibili.
- Sollevare la palpebra superiore utilizzando una sutura di seta 4-0. Posizionare la sutura nella parte anteriore delle palpebre a livello delle ghiandole di Meibomio. Fissare la sutura trazionale bloccando le pinze antizanzare alla superficie chirurgica.
NOTA: Se la sutura è posizionata più in alto del livello della ghiandola di Meibomio, si verificherà l'eversione della palpebra invece dell'elevazione della palpebra. - Eseguire la peritomia del quadrante temporale superiore utilizzando le forbici fini microchirurgiche.
- Posizionare due suture di trazione per consentire la sporgenza e lo spostamento in avanti del bulbo oculare. Eseguire l'isolamento del muscolo retto superiore.
- Attraverso una delicata manipolazione dell'occhio con una pinza a denti sottili (pinza da 0,12 mm) nella parte superiore del limbus, ruotare l'occhio verso il basso per esporre la sclera.
- Posizionare una sutura di seta 4-0 dietro il limbus superiore fino a 1 mm di distanza, che è la posizione del muscolo extraoculare superiore. Bloccare entrambe le code della sutura utilizzando una pinza per zanzare.
- Eseguire l'isolamento del muscolo retto temporale. Posizionare una seconda sutura (seta 4-0) fino a 1 mm di distanza dal limbus nel quadrante temporale (nell'area corrispondente del muscolo extraoculare temporale). Bloccare entrambe le code della sutura utilizzando una pinza per zanzare.
- Una volta che entrambe le suture muscolari extraoculari sono posizionate e bloccate correttamente, tirare le suture verso il basso e verso l'interno per esporre il quadrante temporale superiore della sclera.
- Sollevare la palpebra superiore utilizzando una sutura di seta 4-0. Posizionare la sutura nella parte anteriore delle palpebre a livello delle ghiandole di Meibomio. Fissare la sutura trazionale bloccando le pinze antizanzare alla superficie chirurgica.
- Estendere la peritomia verso la parte posteriore dell'occhio con le forbici fini microchirurgiche.
- Controllare il sanguinamento congiuntivale utilizzando tamponi di cotone.
- Una volta che l'animale è sotto anestesia e la pupilla è dilatata (passaggio 1.5), posiziona l'animale a pancia in giù con la testa rivolta verso il ricercatore.
- Eseguire l'incisione sclerale, il distacco della retina (RD) e l'inserimento dell'impianto seguendo i passaggi seguenti.
- Eseguire l'incisione sclerale utilizzando un ago da 27 G o 30 G. Assicurarsi che la dimensione dell'incisione sia di ~1,2 mm e di 1,5 mm posteriormente al limbus.
NOTA: Si raccomanda lo sviluppo di una configurazione di incisione sclerale a tunnel per stabilizzare le strutture intraoculari durante la manipolazione dell'occhio e l'introduzione dell'impianto. Questa forma di incisione impedirà improvvise fluttuazioni della pressione intraoculare. - A volte, una corretta configurazione richiede pratica. Pertanto, se non si ottiene una configurazione corretta, rilasciare un po' di tensione dalle suture di trazione del muscolo extraoculare per facilitare il mantenimento delle strutture oculari all'interno della cavità vitreale.
- Utilizzando lo stesso ago utilizzato per l'incisione sclerale (27 G o 30 G), eseguire la paracentesi nella cornea periferica nello stesso quadrante.
- Inserire l'ago smussato da 32 G montato su una siringa da microlitri attraverso l'incisione sclerale.
- Iniettare 100 μL di BSS per creare una RD focale.
- Rilasciare le suture di trazione del muscolo extraoculare per riportare l'occhio nella posizione regolare.
- Per la visualizzazione diretta dell'RD, appoggiare e tenere premuto il vetrino coprioggetti, caricato con gel lubrificante oftalmico, sulla cornea.
- Regolare l'obiettivo del microscopio per mettere a fuoco la retina.
- Se la RD non viene osservata o è troppo piccola (più piccola della dimensione di un quadrante), eseguire una seconda iniezione di BSS per ottenere la dimensione RD desiderata ruotando l'occhio verso il basso e verso l'interno e ripetendo i passaggi da 2.2.4 a 2.2.8.
- Una volta completata la RD, verificare la lunghezza sclerale (come indicato al punto 2.2.1) con un calibro (vedi Tabella dei Materiali).
- Tagliare il tessuto coroideale in entrambe le direzioni con sottili forbici microchirurgiche.
- Far scorrere l'ago smussato lateralmente lungo l'incisione sclerale per verificare che tutte le strutture sclerali e coroideali siano state sezionate.
- Inserire l'impianto nello spazio sottoretinico.
- Utilizzando due pinze chirurgiche sottili, come le pinze da legatura (vedi Tabella dei materiali), afferrare l'impianto dalla parte posteriore in modo da non danneggiare la parte attiva dell'impianto.
- Posizionare l'impianto parallelamente al piano di incisione e farlo scorrere delicatamente nell'impianto.
- Una volta che l'impianto è stato completamente introdotto nello spazio sottoretinico, rilasciarlo e spingere ulteriormente l'impianto all'interno introducendo le mascelle di una delle pinze di 1-1,5 mm nell'incisione.
- Rilasciare le suture trazionali del muscolo extraoculare e verificare il posizionamento dell'impianto utilizzando il microscopio e il vetrino coprioggetti come descritto sopra (passaggi 2.2.7 e 2.2.8).
- Eseguire l'incisione sclerale utilizzando un ago da 27 G o 30 G. Assicurarsi che la dimensione dell'incisione sia di ~1,2 mm e di 1,5 mm posteriormente al limbus.
- Rilasciare e rimuovere tutti i punti di sutura.
NOTA: Dopo aver concluso la procedura chirurgica, viene eseguita la SD-OCT (fase 3) per convalidare i risultati clinici. La sessione di imaging SD-OCT viene condotta subito dopo l'intervento. Se non è stata ottenuta una corretta visualizzazione della posizione dell'impianto, eseguire nuovamente l'SD-OCT 7-10 giorni dopo l'intervento.
3. Imaging SD-OCT
- Fare clic sull'icona Heidelberg Eye Explorer (un software di gestione delle immagini; vedere Tabella dei materiali) sullo schermo del desktop.
- Fare clic sull'icona Nuovo paziente nella parte superiore dello schermo.
- Completa tutte le informazioni richieste per generare l'ID dell'animale e clicca su Accetta.
- Selezionare il sistema di imaging OCT (HRA + OCT; vedere Tabella dei materiali) per il tipo di dispositivo.
- Selezionare l'operatore e premere OK.
- Per l'opzione di curvatura della cornea corretta, premere il pulsante OK per accettare i dati oculari predefiniti.
- Assicurarsi che la finestra di acquisizione SD-OCT sia avviata e pronta per SD-OCT.
- Accendere la fotocamera SD-OCT premendo il pulsante Start giallo situato sul display touchscreen accanto alla fotocamera.
- Posizionare l'animale sul tavolino per animali SD-OCT che è stato adattato sopra il poggiatesta SD-OCT.
NOTA: L'adattamento del tavolino per animali include un pezzo di polistirene espanso (vedi Tabella dei materiali) per adattarsi all'interno del tavolino di testa SD-OCT che è abbastanza grande da poter posizionare l'animale, compreso il termoforo. - Regolare l'altezza del tavolo e la posizione dell'animale per allineare la pupilla con il centro della lente SD-OCT.
NOTA: Una volta che l'occhio è allineato, sullo schermo apparirà un'immagine dal vivo a infrarossi (IR). - Premere il pulsante IR + OCT sul touch screen o il pulsante OCT in basso a destra del monitor per avviare l'acquisizione dell'immagine.
- Una volta che l'SD-OCT è attivo, selezionare una modalità di scansione singola con il numero più alto (100) di fotogrammi ART. La modalità di scansione 100 ART è la modalità predefinita.
- Utilizzando il joystick della telecamera, centrare il nervo ottico sull'immagine IR.
- Spingere la fotocamera in avanti fino a quando l'immagine IR non è riempita uniformemente con l'immagine retinica.
NOTA: Gli angoli scuri indicano che la fotocamera è troppo lontana o vicina all'occhio. - Spostare la telecamera lateralmente fino a quando l'impianto non viene visualizzato nell'aspetto temporale della retina. Usa l'immagine IR per guidare i movimenti.
- Per visualizzare l'impianto tramite il B-scan, premere contemporaneamente CTRL + ALT + SHIFT + O per visualizzare la finestra di regolazione del B-scan SD-OCT.
- Regolare il "Braccio di riferimento" (nella parte inferiore della finestra) fino a quando la retina/impianto non viene visualizzato nell'immagine SD-OCT.
NOTA: L'immagine SD-OCT deve essere visualizzata all'interno degli angoli di riferimento blu. - Chiudi la finestra.
- Utilizzando il joystick e l'impugnatura della telecamera, far scorrere e ruotare la telecamera in tutte le direzioni fino a ottenere un'immagine di qualità SD-OCT migliore, più piatta e più nitida.
- Trascinare la freccia blu sull'immagine IR fino a posizionarla lungo l'impianto.
- Una volta che la saturazione e il posizionamento del B-scan sono ottimali, attivare l'"Automatic Real-time Tracking (ART)" premendo il pulsante nero Gain Control sotto il touch screen.
- Una volta che l'ART raggiunge i 100 fotogrammi, premere Acquisisci sul touch screen.
- Quando tutte le immagini sono state acquisite, fai clic su Salva immagini nella parte superiore della finestra e quindi fai clic su Esci.
- Mantenere la cornea umida durante l'intera sessione di imaging applicando frequentemente colliri lubrificanti (ogni 5 minuti).
4. Recupero degli animali
- Al termine della sessione di imaging, applicare un unguento antibiotico sulla cornea per prevenire l'infezione oculare e idratare la cornea.
- Tenere l'animale a riposo a pancia in giù sul termoforo fino a quando non si riprende completamente (~20-30 min) e ambulamenta.
- Somministrare analgesici sistemici (1,0-1,2 mg/kg di buprenorfina SR una volta sottocutaneo; vedere Tabella dei materiali) al termine della procedura chirurgica.
- Non lasciare l'animale incustodito fino a quando non ha ripreso sufficiente conoscenza.
- Non restituire l'animale alla compagnia di altri animali fino a quando non si è completamente ripreso.
- Una volta completamente recuperato, riposizionare l'animale nell'area di stabulazione con accesso a cibo e acqua ad libitum.
Risultati
L'impianto di un impianto sottoretinico in ratti RCS (N = 12) ha dimostrato la fattibilità e la riproducibilità della tecnica chirurgica per il rilascio sottoretinico nei ratti. In questo studio, l'occhio destro era l'occhio trattato (N = 12) con l'impianto. Nella valutazione clinica condotta al termine della procedura con il microscopio operatorio, nove dei 12 occhi trattati hanno dimostrato una localizzazione sottoretinica dell'impianto (75,00%), due occhi (16,67%) sono stati identificati come posizionamento intraretinico dell'impianto e in un occhio (8,33%) la visualizzazione diretta non è stata possibile a causa dell'opacità dei media causata da un'emorragia sottoretinica nell'area chirurgica, con una visione limitata sia dell'impianto che delle strutture retiniche (Tabella 1). Le scansioni SD-OCT eseguite immediatamente dopo la procedura chirurgica hanno dimostrato la posizione sottoretinica o intraretinica dell'impianto (rispettivamente 10 [83,33%] e uno [8,33%]) (Figura 1A). L'SD-OCT non è stato in grado di identificare completamente il posizionamento dell'impianto per via sottoretinica nello stesso animale (n = 1) con opacità del media sopra descritta (visualizzazione diretta non possibile), anche dopo un follow-up di 10 giorni. La Figura 1B, C mostra due diversi animali con un impianto posizionato correttamente nello spazio sottoretinico. Non ci sono state altre complicanze chirurgiche associate alla tecnica chirurgica. Mediante colorazione con ematossilina ed eosina (H&E), è stata osservata la verifica del posizionamento sottoretinico dell'impianto (Figura 1D).
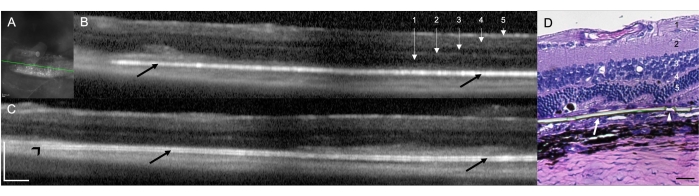
Figura 1: Scansioni di tomografia a coerenza ottica del dominio spettrale (SD-OCT) a 1 settimana dopo l'impianto chirurgico. (A) Immagine a infrarossi dell'impianto sottoretinico. La linea verde delimita la sezione trasversale mostrata in (B). Barra della scala: 200 μm. (B,C) Due animali diversi con un impianto posizionato correttamente nello spazio sottoretinico (frecce nere). La punta dell'impianto punta verso il nervo ottico (punta di freccia nera). 1 = fibra nervosa retinica/strato di cellule ganglionari, 2 = strato plessiforme interno, 3 = strato esterno interno, 4 = strato plessiforme esterno e 5 = strato nucleare esterno. Barra della scala: 200 μm. (D) Sezione istologica colorata con H&E per dimostrare l'impianto sottoretinico della membrana parilenica (freccia bianca). La punta della freccia mostra uno dei micropori nelle aree ultrasottili. 1 = fibra nervosa retinica/strato di cellule ganglionari, 2 = strato plessiforme interno, 3 = strato esterno interno, 4 = strato plessiforme esterno e 5 = strato nucleare esterno. Barra della scala: 20 μm. Ingrandimento: 20x. Clicca qui per visualizzare una versione più grande di questa figura.
| Valutazione clinica | SD-OCT | |||||
| Oggetto | SR | IR | Sconosciuto | SR | IR | Sconosciuto |
| 1 | X | X | ||||
| 2 | X | X | ||||
| 3 | X | X | ||||
| 4 | X | X | ||||
| 5 | X | X | ||||
| 6 | X | X | ||||
| 7 | X | X | ||||
| 8 | X | X | ||||
| 9 | X | X | ||||
| 10 | X | X | ||||
| 11 | X | X | ||||
| 12 | X | X | ||||
| 9 | 2 | 1 | 10 | 1 | 1 | |
| 75.00% | 16.67% | 8.33% | 83.33% | 8.33% | 8.33% | |
Tabella 1: Confronto dei risultati oculari tra le valutazioni cliniche e l'imaging SD-OCT tra tutti gli animali. Abbreviazioni: SR = sottoretinico, IR = intraretinico e SD-OCT = tomografia a coerenza ottica del dominio spettrale.
Discussione
Sebbene la procedura sia stata precedentemente descritta con lievi variazioni, lo scopo di questo manoscritto è quello di fornire una descrizione completa di una procedura chirurgica per impianti sottoretinici nei ratti da seguire durante l'apprendimento della tecnica e per superare le sfide chirurgiche e le potenziali complicanze che gli investigatori possono incontrare. Il protocollo chirurgico qui descritto include l'uso della membrana ultrasottile in parylene che è stata ampiamente utilizzata nel nostro laboratorio per diversi anni 9,10,16,18. Tuttavia, è stata osservata la riproducibilità della tecnica che utilizza diversi iniettori e materiali impiantati nello spazio sottoretinico18,19.
Un approccio sclerale per l'impianto di dispositivi sottoretinici non si limita alle terapie basate su cellule staminali; Sono state descritte anche procedure di trapianto di retina in piccoli modelli animali20,21. Nel campo della stimolazione elettrica retinica, questa procedura chirurgica per gli impianti sottoretinici nei ratti è stata utilizzata per più di un decennio22. Più recentemente, Ho et al.23 hanno impiantato un array per stimolare la retina del ratto e Thomas et al.24 hanno utilizzato organoidi della retina come fonte di cellule staminali. Come accennato in precedenza, le terapie basate sulle cellule staminali sono state ben pubblicate, comprese le pubblicazioni sull'impianto chirurgico di impianti biocompatibili seminati con cellule staminali4. Ci sono lievi variazioni negli approcci chirurgici descritti da diversi autori, che saranno discussi e confrontati con la tecnica chirurgica descritta in questo manoscritto.
La chiusura sclerale e la strumentazione chirurgica richiedono ulteriori discussioni. Esistono due approcci comuni alla gestione dell'incisione sclerale: (1) chiusura con una sutura e (2) chiusura senza sutura. Diversi autori usano il nylon 10-0 per chiudere l'incisione sclerale con una sutura come parte della loro procedura regolare 23,25,26,27. Tuttavia, altri gruppi (incluso il nostro) hanno scoperto che la sutura in nylon 10-0 non è necessaria28. Coloro che sostengono la chiusura con la sutura sostengono che l'impianto sottoretinico scivolerà fuori dall'incisione nell'occhio se non c'è sutura. Come descritto nella sezione dei risultati, lo studio attuale non ha riscontrato l'estrusione dell'impianto o del tessuto intraoculare in tutta l'incisione. Questo approccio chirurgico senza sutura è stato utilizzato nel nostro laboratorio di routine e con successo 9,10,12,13,16. La giustificazione per un approccio senza sutura si basa su due fattori: in primo luogo, una combinazione della posizione dell'incisione e della sua configurazione fornisce una struttura sufficiente per generare un'incisione autosigillante. Va tenuto presente che la corretta configurazione del tunnel sclerale è un passo che gli investigatori raggiungeranno con la pratica. In secondo luogo, la pressione intraoculare aumenta una volta rilasciata la trazione, mantenendo l'impianto in posizione. L'aumento della pressione intraoculare fa sì che la retina venga spinta contro l'incisione, avvicinando entrambi i lembi sclerali l'uno all'altro e praticando un'incisione autosigillante. Pertanto, non è necessaria una sutura. Da notare che la lunghezza dell'incisione è solo fino a 1,5 mm. Nei casi in cui l'incisione chirurgica richiede una ferita più grande o se non si ottiene una corretta configurazione del tunnel sclerale, una sutura in nylon 10-0 è una soluzione ragionevole. La tecnica attuale è altamente affidabile se utilizzata con la strumentazione chirurgica consigliata. Alcuni autori hanno utilizzato iniettori personalizzati per i loro impianti, il che modifica le dimensioni dell'incisione e comporta la necessità di utilizzare una sutura sclerale per una corretta chiusura 25,29. Tuttavia, in base alla nostra esperienza, l'utilizzo di materiali e iniettori diversi ha comportato un aumento della lunghezza dell'incisione (~0,5 mm)18,19. Non abbiamo ancora osservato instabilità o complicanze associate a un'incisione sclerale più grande e non è stata necessaria alcuna sutura. Tuttavia, l'utilizzo di strumentazione al di fuori di queste linee guida durante la procedura potrebbe essere considerato un limite di questa tecnica.
Un altro passaggio critico che è stato raramente citato nelle pubblicazioni precedenti è la paracentesi per ridurre la pressione intraoculare (IOP) prima di creare la RD focale e iniettare l'impianto nello spazio sottoretinico 4,10,13,15. La diminuzione della IOP fornisce un migliore controllo delle strutture intraoculari durante il distacco della retina ed evita l'estrusione del contenuto intraoculare, che si traduce in una procedura non riuscita. Un altro vantaggio associato a un occhio ipotonico è la riduzione della resistenza durante l'iniezione dell'impianto attraverso l'incisione sclerale, che si traduce in un minor danno all'impianto stesso. D'altra parte, una IOP bassa è soggetta ad un aumento del sanguinamento oculare all'incisione chirurgica. Grandi quantità di sangue nell'incisione sclerale oscurano la vista e aumentano il rischio di spostare il sangue nello spazio sottoretinico durante l'impianto sottoretinico. Si consiglia di controllare l'emorragia utilizzando batuffoli di cotone e BSS per pulire l'area ed evitare complicazioni chirurgiche.
Vale la pena ricordare che la dimensione della RD è importante per il corretto posizionamento dell'impianto nello spazio sottoretinico. A differenza di altri modelli animali e dell'uomo 5,14,30, poiché questo approccio sclerale non fornisce una visualizzazione diretta dello spazio sottoretinico, è più difficile generare una RD focale. Per fornire spazio sufficiente affinché l'impianto possa essere distribuito delicatamente nello spazio sottoretinico senza posizionarlo al di fuori di quest'area, si consiglia di iniettare 100 μL di BSS. Questa raccomandazione si basa sulla generazione di una RD di almeno un quadrante della retina. Se viene creata una RD più piccola di almeno un quadrante della retina, l'impianto verrà iniettato in modo errato nello spazio intravitreale, intraretinico o sopracoroideale. Come descritto in tutto il protocollo, se si osserva una RD piccola, si consiglia di ripetere i passaggi da 2.2.4 a 2.2.8 fino a raggiungere la RD desiderata.
La maggior parte delle complicanze chirurgiche e dei passaggi critici discussi nel manoscritto possono verificarsi durante la curva di apprendimento, il che potrebbe compromettere il successo dell'impianto sottoretinico. Questa curva di apprendimento include anche la quantità di tempo in cui gli animali rimangono sotto anestesia e il livello di disidratazione. Un tempo di anestesia più lungo, anestetici e disidratazione possono portare a complicazioni dell'occhio secco, come alterazioni corneali, del cristallino e sclerali31. Inoltre, gli anestetici, come la ketamina e la xilazina, sono stati associati all'opacità dei media nella cornea e nel cristallino insieme a cambiamenti nella composizione dell'umore acqueo32. L'uso di colliri lubrificanti (BSS) sull'occhio chirurgico per tutto il tempo di anestesia risolve queste complicanze. In sintesi, la metodologia descritta in questo manoscritto è destinata ad essere utilizzata come raccomandazione chirurgica nello sviluppo di terapie sottoretiniche negli occhi di ratto.
Divulgazioni
M.S.H., D.R.H. e J.L. sono co-fondatori e consulenti di Regenerative Patch Technologies (RPT). Gli altri autori certificano di non avere affiliazioni o coinvolgimento in alcuna organizzazione o entità con alcun interesse finanziario o non finanziario nell'argomento o nei materiali discussi in questo manoscritto.
Riconoscimenti
Questo studio è stato supportato da CIRM DT3 (MSH) e Research to Prevent Blindness (USC Roski Eye Institute). Ringraziamo Fernando Gallardo e il Dott. Ying Liu per l'assistenza tecnica.
Lo sponsor non ha avuto alcun ruolo nella progettazione o nella conduzione di questa ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | VWR | BD309659 | |
| 27 G needle 1/2'' | VWR | BD305109 | |
| 30 G needle 1/2'' | VWR | BD305106 | |
| 32 G Blunt needle - Small hub RN | Hamilton | 7803-04 | |
| 4-0 Perma Hand silk black 1X18" PC-5 | Ethicon | 1984G | |
| 6'' sterile cotton tips | VWR | 10805-154 | |
| Betadine 5% sterile ophthalmic prep solution | Alcon | 8007-1 | |
| BSS irrigating solution 15 mL | Accutome | Ax17362 | |
| Buprenorphine ER | ZooPharm | N/A | |
| Castroviejo Caliper | Storz | E2405 | |
| Castroviejo suturing forceps 0.12 mm | Storz | E1796 | |
| Clayman-Vannas scissors straight | Storz | E3383S | |
| Cover glass, square | WVR | 48366-227 | |
| EPS Polystyrene block | Silverlake LLC | CFB8x12x2 | |
| Gonak 15 mL | Accutome | Ax10968 | Eye lubricant |
| Halstead straight hemostatic mosquito forceps non-magnetic | Storz | E6772 | |
| Hamilton syringe 700 series 100 µL | Hamilton | 7638-01 | |
| HEYEX Software | Heidelberg | N/A | an image management software |
| Kelman-McPherson tying forceps angled | Storz | E1815 AKUS | |
| Ketamine (100 mg/mL) | MWI | 501072 | |
| Needle holder 9mm curved fine locking | Storz | 3-302 | |
| Neomycin/Polymyxin B sulfactes/Bacitracin zinc ointment 3.5 g | Accutome | Ax0720 | |
| Ophthalmic surgical microscope | Zeiss | SN: 233922 | |
| Phenylephrine 2.5% 15 mL | Accutome | Ax0310 | |
| Spectralis SD-OCT | Heidelberg | SPEC-CAM-011210s3600 | |
| Sterile Drape | VWR | 100229-300 | |
| Sterile surgical gloves | VWR | 89233-804 | |
| T-Pump heating system | Gaymar | TP650 | |
| Tropicamide 1% 15 mL | Accutome | Ax0330 | |
| Ultrathin membranes made from Parylene C and coated with vitronectin | Mini Pumps LLC, CA | specifically designed for this study | used as subretinal implants |
| Xylazine (100 mg/mL) | MWI | 510650 |
Riferimenti
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Global Health. 2 (2), 106-116 (2014).
- Schultz, N. M., Bhardwaj, S., Barclay, C., Gaspar, L., Schwartz, J. Global burden of dry age-related macular degeneration: a targeted literature review. Clinical Therapeutics. 43 (10), 1792-1818 (2021).
- Deng, Y., et al. Age-related macular degeneration: Epidemiology, genetics, pathophysiology, diagnosis, and targeted therapy. Genes & Diseases. 9 (1), 62-79 (2021).
- Nazari, H., et al. Stem cell-based therapies for age-related macular degeneration: The promises and the challenges. Progress in Retinal and Eye Research. 48, 1-39 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- Kashani, A. H., et al. Survival of an HLA-mismatched, bioengineered RPE implant in dry age-related macular degeneration. Stem Cell Reports. 17 (3), 448-458 (2022).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Da Cruz, L., Chen, F. K., Ahmado, A., Greenwood, J., Coffey, P. RPE transplantation and its role in retinal disease. Progress in Retinal and Eye Research. 26 (6), 598-635 (2017).
- Hu, Y., et al. A novel approach for subretinal implantation of ultrathin substrates containing stem cell-derived retinal pigment epithelium monolayer. Ophthalmic Research. 48 (4), 186-191 (2012).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: improved survival when implanted as a monolayer. Investigative Ophthalmology & Visual Science. 54 (7), 5087-5096 (2013).
- Antognazza, M. R., et al. Characterization of a polymer-based, fully organic prosthesis for implantation into the subretinal space of the rat. Advanced Healthcare Materials. 5 (17), 2271-2282 (2016).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286 (2021).
- Thomas, B. B., et al. A new immunodeficient retinal dystrophic rat model for transplantation studies using human-derived cells. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (11), 2113-2125 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatán minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology. 254 (8), 1553-1565 (2016).
- Yu, W., et al. Biocompatibility of subretinal parylene-based Ti/Pt microelectrode array in rabbit for further artificial vision studies. Journal of Ocular Biology, Diseases, and Informatics. 2 (1), 33-36 (2009).
- Thomas, B. B., et al. Survival and functionality of hESC-derived retinal pigment epithelium cells cultured as a monolayer on polymer substrates transplanted in RCS rats. Investigative Ophthalmology & Visual Science. 57 (6), 2877-2887 (2016).
- Adekunle, A. N., et al. Integration of perforated subretinal prostheses with retinal tissue. Translational Vision Science & Technology. 4 (4), 5 (2015).
- Lu, B., et al. Semipermeable parylene membrane as an artificial Bruch's membrane. 2011 16th International Solid-State Sensors, Actuators and Microsystems Conference. IEEE. , 950-953 (2011).
- Hu, Y., et al. Subretinal implantation of gelatin films with stem cells derived RPE in rats. Investigative Ophthalmology & Visual Science. 54 (15), 1763 (2013).
- Aramant, R. B., Seiler, M. J. Retinal transplantation-advantages of intact fetal sheets. Progress in Retinal and Eye Research. 21 (1), 57-73 (2002).
- Peng, Q., et al. Structure and function of embryonic rat retinal sheet transplants. Current Eye Research. 32 (9), 781-789 (2007).
- Pardue, M. T., et al. Neuroprotective effect of subretinal implants in the RCS rat. Investigative Ophthalmology & Visual Science. 46 (2), 674-682 (2005).
- Ho, E., et al. Characteristics of prosthetic vision in rats with subretinal flat and pillar electrode arrays. Journal of Neural Engineering. 16 (6), 066027 (2019).
- Thomas, B. B., et al. Co-grafts of human embryonic stem cell derived retina organoids and retinal pigment epithelium for retinal reconstruction in immunodeficient retinal degenerate Royal College of Surgeons rats. Frontiers in Neuroscience. 15, 752958 (2021).
- Seiler, M. J., et al. Vision recovery and connectivity by fetal retinal sheet transplantation in an immunodeficient retinal degenerate rat model. Investigative Ophthalmology & Visual Science. 58 (1), 614-630 (2017).
- McLelland, B. T., et al. Transplanted hESC-derived retina organoid sheets differentiate, integrate, and improve visual function in retinal degenerate rats. Investigative Ophthalmology & Visual Science. 59 (6), 2586-2603 (2018).
- Lin, B., McLelland, B. T., Mathur, A., Aramant, R. B., Seiler, M. J. Sheets of human retinal progenitor transplants improve vision in rats with severe retinal degeneration. Experimental Eye Research. 174, 13-28 (2018).
- Matsuo, T., Hosoya, O., Tsutsui, K. M., Uchida, T. Behavior tests and immunohistochemical retinal response analyses in RCS rats with subretinal implantation of Okayama-University-type retinal prosthesis. Journal of Artificial Organs. 16 (3), 343-351 (2013).
- Seiler, M. J., et al. A new immunodeficient pigmented retinal degenerate rat strain to study transplantation of human cells without immunosuppression. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (7), 1079-1092 (2014).
- Stanzel, B. V. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Fabian, R. J., Bond, J. M., Drobeck, H. P. Induced corneal opacities in the rat. The British Journal of Ophthalmology. 51 (2), 124-129 (1976).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Experimental Eye Research. 42 (4), 331-337 (1986).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon