Method Article
פיתוח טכניקה כירורגית לשתלים תת-רשתית בחולדות
In This Article
Summary
הפרוטוקול הנוכחי מתאר את הגישה הסקלרית להשתלת התקן תת-רשתית, טכניקה כירורגית אפשרית ליישום במודלים של מחלות רשתית בבעלי חיים במחקר.
Abstract
ניוון רשתית, כגון ניוון מקולרי הקשור לגיל (AMD), הוא גורם מוביל לעיוורון ברחבי העולם. מספר עצום של גישות ננקטו לפיתוח טיפולים מבוססי רפואה רגנרטיבית ל-AMD, כולל טיפולים מבוססי תאי גזע. מכרסמים כמודלים של בעלי חיים לניוון רשתית הם בסיס למחקר תרגומי, בשל הספקטרום הרחב של זנים המפתחים מחלות ניוון רשתית בשלבים שונים. עם זאת, חיקוי מתן טיפולי אנושי של שתלים תת-רשתית במכרסמים הוא מאתגר, בשל הבדלים אנטומיים כגון גודל העדשה ונפח הזגוגית. פרוטוקול כירורגי זה נועד לספק שיטה מונחית להשתלת שתלים בחלל התת-רשתית בחולדות. נכלל תיאור מקיף וידידותי למשתמש של השלבים הקריטיים. פרוטוקול זה פותח כהליך כירורגי חסכוני לשחזור במחקרים פרה-קליניים שונים בחולדות. נדרש מזעור נכון של שתל בגודל אנושי לפני ביצוע הניסוי הכירורגי, הכולל התאמות למידות השתל. נעשה שימוש בגישה חיצונית במקום הליך תוך-זגוגי כדי להעביר את השתל לחלל התת-רשתית. באמצעות מחט חדה קטנה מבוצע חתך סקלרלי ברביע העליון הטמפורלי, ואחריו פרצנטזיס להפחתת הלחץ התוך עיני, ובכך למזער את ההתנגדות במהלך ההשתלה הניתוחית. לאחר מכן, מתבצעת הזרקת תמיסת מלח מאוזנת (BSS) דרך החתך כדי להשיג היפרדות רשתית מוקדית (RD). לבסוף, מתבצעת החדרה והדמיה של השתל לחלל התת-רשתית. הערכה לאחר הניתוח של המיקום התת-רשתית של השתל כוללת הדמיה על ידי טומוגרפיה קוהרנטית אופטית בתחום הספקטרלי (SD-OCT). מעקבי הדמיה מוודאים את היציבות התת-רשתית של השתל, לפני שהעיניים נקצרות ומקובעות לניתוח היסטולוגי.
Introduction
ניוון מקולרי הקשור לגיל (AMD) הוא גורם מוביל לעיוורון ברחבי העולם. מספר האנשים שנפגעו מ-AMD בשנת 2020 נאמד ב-196 מיליון, וזה צפוי לגדול לכ-288 מיליון עד 20401. במהלך העשור האחרון, פותחו מספר טיפולים כדי להפחית את השינויים החזותיים הקשורים לשלבים המאוחרים של AMD, בעיקר כדי לטפל בהתפתחות והתקדמות הניאו-וסקולריזציה הכורואידית שנצפתה ב-AMD רטוב. לעומת זאת, הטיפול ב-AMD יבש, שבו תפקוד לקוי ואובדן של תאי אפיתל פיגמנט ברשתית (RPE) מתקדמים ל-RPE וניוון רשתית, הוערך כאחראי ל-85% עד 90% מ-AMD, עם שכיחות של 0.44% ברחבי העולם 1,2. AMD תוארה כמחלה רב-גורמית עם גורמי גיל, גנטיקה וסביבה התורמים להופעת המחלה והתקדמותה; מספר טיפולים נמצאים בפיתוח כדי לטפל במסלולים הפתופיזיולוגיים השונים הקשורים למחלה זו3.
טיפול מבוסס תאי גזע פותח כאופציה טיפולית חדשה להחלפת ה-RPE הכושל ב-AMD4 יבש. למרות שהשימוש בתאי גזע פלוריפוטנטיים עדיין נמצא בניסויים קליניים מוקדמים, הבטיחות הוכחה במספר ניסויים קליניים 5,6,7. נכון להיום, ישנם שני מסלולים עיקריים לפריסת תאי גזע בחלל התת-רשתית: השעיה או החדרת מדבקה חד-שכבתית שנזרעה על שתל תואם ביולוגית 8,9,10,11,12. אסטרטגיות חדשות המשתמשות בטיפולים מבוססי תאי גזע במחקרים פרה-קליניים דורשות מודלים של בעלי חיים שבהם ניתן להעביר את הטיפולים המבוססים על תאי גזע לאותו אתר ממוקד כפי שתוכנן בבני אדם. ההבדל באנטומיה עשוי לחייב שינויים קלים בהליכים, בציוד הכירורגי ובגישה בהשוואה לאלה ששימשו במוצר האנושי הסופי13,14. שינוי הטכניקות הכירורגיות של העיניים הוא אחד השינויים הנדרשים שתוארו באופן נרחב כגישה מוצלחת לשימוש במודלים שונים של בעלי חיים 15,16,17.
למרות שפרסומים קודמים הזכירו טכניקות כירורגיות לשתלים תת-רשתית בחולדות, אין תיאורים מקיפים של טכניקות כאלה כדי להתגבר על הקשיים הטכניים שחוקרים עלולים להיתקל בהם. לכן, יש צורך לתאר כראוי את הטכניקות הכירורגיות בפירוט, לספק שיטות עבודה מומלצות ולקחים שיש להימנע מהם, ובמידת הצורך לטפל בבעיות במהלך שלבים קריטיים לאורך ההליך. מטרת כתב יד זה היא לספק הנחיה מקיפה להשתלה כירורגית של השתל בחלל התת-רשתית בחולדות.
Protocol
כל הניסויים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת דרום קליפורניה (IACUC) ובוצעו בהתאם למדריך המכונים הלאומיים לבריאות (NIH) לטיפול ושימוש בחיות מעבדה והצהרת האגודה לחקר ראייה ורפואת עיניים (ARVO) לשימוש בבעלי חיים במחקר עיניים וראייה. בסך הכל נעשה שימוש ב-12 חולדות זכרות של הקולג' המלכותי לכירורגיה (RCS) במחקר הנוכחי. בעלי החיים גודלו במתקן בעלי החיים ונכללו במחקר לאחר שהגיעו לגיל 28 ± יום אחד לאחר הלידה. בוצעה בדיקת עיניים מלאה כדי לוודא את היעדר חריגות בעיניים. השתלים התת-רשתיים, ממברנות אולטרה-דקות העשויות מפארילן C ומצופות בוויטרונקטין, תוכננו על ידי ארגון מסחרי ספציפי (ראה טבלת חומרים). ממברנות אלו משכפלות ממברנות בגודל אנושי מבחינת העובי והחדירות שלהן (מסגרת רשת בעובי 6.0 מיקרומטר עם נקבוביות עגולות של 20 מיקרומטר באזורים האולטרה-דקים). מזעור האורך והרוחב (1.0 מ"מ × 0.4 מ"מ) מממברנות בגודל אנושי הושג כדי להתאים את השתלים התת-רשתית בתוך עיני המכרסמים18.
1. טיפול בבעלי חיים והכנה כירורגית
- שקלו את החיה כדי לחשב את מינון ההרדמה והרדימו לפי שלב 1.2.
- להרדים את בעל החיים באמצעות הזרקה תוך-צפקית של תערובת של קטמין וקסילזין (35-50 מ"ג/ק"ג ו-5-10 מ"ג/ק"ג, בהתאמה; ראה טבלת חומרים). יש להזריק עם מזרק של 1.0 מ"ל ומחט של 30 גרם.
- טען מזרק נוסף של 1.0 מ"ל עם מחצית מכמות תערובת ההרדמה (קטמין וקסילזין) כדי לשמור על רמת ההרדמה הנכונה במהלך ההליך.
- אשר הרדמה נאותה על ידי היעדר רפלקס דוושה (צביטת בוהן מוצקה).
- כדי לדמיין כראוי את חלל הזגוגית והרשתית, יש להרחיב את האישון על ידי החדרת טיפות עיניים של 1% טרופיקמיד ו-2.5% פנילפרין (ראה טבלת חומרים) בעין המטופלת.
- יש למרוח מנה שנייה של טיפות עיניים להרחבה לאחר 5 דקות.
- מרחו דמעות מלאכותיות או ג'ל סיכה לעיניים בעין הלא ניתוחית כל 5-10 דקות בזמן שהחיה מורדמת כדי להרטיב את הקרנית.
- הניחו וילון סטרילי מעל כרית החימום (ראו טבלת חומרים). הניחו וילון סטרילי המכסה את מגש הניתוח.
- הכן את אזור הניתוח הסטרילי על ידי הנחת המכשירים הסטריליים הבאים על מגש הניתוח: כפפות כירורגיות, שתל תת-רשתית וכלים כירורגיים: מלקחיים נגד יתושים (3), מספריים עדינים מיקרו-כירורגיים (1), מחזיק מחט (1), מלקחיים עדינים עם שיניים (1), מלקחיים ישרים עדינים ללא שיניים (2), מזרק מיקרוליטר (1), מחט קהה 32 גרם (1), מחט 27 גרם או 30 גרם (2), 4-0 תפר משי (3), צמר גפן, תמיסת מלח מאוזנת (BSS) והחלקת כיסוי (ראה טבלת חומרים).
- בתנאים סטריליים ובאמצעות כפפות סטריליות, טען את מזרק המיקרוליטר עם ה-BSS והצמד את המחט הקהה 32 G.
- הכנס את החלפת הכותנה לרכזת המחט של 27 גרם או 30 גרם כדי ליצור ידית למניפולציה רגישה יותר של המחט.
- כדי לשמור על תנאים סטריליים לאורך כל ההליך, החלף את הכפפות הסטריליות אם מבצעים מניפולציות על מכשירים או אזורים לא סטריליים, כגון המיקרוסקופ הכירורגי.
2. גישה סקלרלית להשתלה תת-רשתית: טכניקה כירורגית
- חשוף את אזור הניתוח לפי השלבים הבאים.
- ברגע שהחיה נמצאת תחת הרדמה והאישון מורחב (שלב 1.5), הניחו את בטן החיה כלפי מטה עם הראש לכיוון החוקר.
הערה: שמור את החולדה על כרית החימום מכוסה בווילון סטרילי במהלך כל הניתוח ועד שהחיה תתאושש לחלוטין. - יש למרוח טיפות 5% פובידון (ראו טבלת חומרים) על העין ולנקות את פני העין והעפעפיים בעזרת צמר גפן.
- הנח והתאם את המיקרוסקופ הכירורגי (ראה טבלת חומרים) מעל העין הניתוחית.
הערה: מומלץ להשתמש במיקרוסקופ עיניים כירורגי לאורך כל ההליך הכירורגי כדי לקבל הדמיה חדה וגדולה יותר של מבני העין. - הקפידו על חשיפה נכונה של אזור הניתוח על ידי הרמת העפעף העליון והבלטת גלגל העין באמצעות 4-0 תפרים שאינם נספגים.
- הרם את העפעף העליון באמצעות תפר משי 4-0. הנח את התפר בצד הקדמי של העפעפיים בגובה בלוטות המייבומיאן. אבטח את תפר המתיחה על ידי הידוק מלקחיים נגד יתושים למשטח הניתוח.
הערה: אם התפר ממוקם גבוה יותר ממפלס בלוטת המייבומיאן, תתרחש היפוך של העפעף במקום הרמת העפעפיים. - בצע פריטומיה של הרביע העליון הטמפורלי באמצעות מספריים עדינים מיקרו-כירורגיים.
- הנח שני תפרי מתיחה כדי לאפשר בליטה ותזוזה קדימה של גלגל העין. בצע בידוד של שריר פי הטבעת העליון.
- באמצעות מניפולציה עדינה של העין עם מלקחיים עדינים (מלקחיים של 0.12 מ"מ) בהיבט העליון של הלימבוס, גלגל את העין כלפי מטה כדי לחשוף את הסקלרה.
- הנח תפר משי 4-0 מאחורי הלימבוס העליון במרחק של עד 1 מ"מ, שהוא המיקום של השריר החוץ עיני העליון. מהדקים את שני זנבות התפר באמצעות מלקחיים נגד יתושים.
- בצע בידוד שרירי פי הטבעת הטמפורלי. הניחו תפר שני (4-0 משי) במרחק של עד 1 מ"מ מהלימבוס ברביע הטמפורלי (באזור המתאים של השריר החוץ-עיני הטמפורלי). מהדקים את שני זנבות התפר באמצעות מלקחיים נגד יתושים.
- לאחר ששני תפרי השרירים החוץ-עיניים ממוקמים כראוי ומהודקים, משוך את התפרים כלפי מטה ופנימה כדי לחשוף את הרביע העליון הטמפורלי של הסקלרה.
- הרם את העפעף העליון באמצעות תפר משי 4-0. הנח את התפר בצד הקדמי של העפעפיים בגובה בלוטות המייבומיאן. אבטח את תפר המתיחה על ידי הידוק מלקחיים נגד יתושים למשטח הניתוח.
- הרחב את הצפק לכיוון החלק האחורי של העין בעזרת מספריים עדינים מיקרו-כירורגיים.
- שלוט בדימום הלחמית באמצעות צמר גפן.
- ברגע שהחיה נמצאת תחת הרדמה והאישון מורחב (שלב 1.5), הניחו את בטן החיה כלפי מטה עם הראש לכיוון החוקר.
- בצע חתך סקלרלי, ניתוק רשתית (RD) והחדרת שתל לפי השלבים הבאים.
- בצע חתך סקלרלי באמצעות מחט של 27 גרם או 30 גרם. ודא שגודל החתך הוא ~1.2 מ"מ והוא 1.5 מ"מ אחורי הלימבוס.
הערה: מומלץ לפתח תצורת חתך סקלרלי דמוי מנהרה כדי לייצב מבנים תוך עיניים תוך מניפולציה של העין והחדרת השתל. צורת חתך זו תמנע תנודות פתאומיות בלחץ התוך עיני. - לפעמים, תצורה נכונה דורשת תרגול. לכן, אם לא מושגת תצורה נכונה, שחרר מתח מסוים מתפרי המתיחה של השרירים החוץ-עיניים כדי להקל על שמירת מבני העיניים בתוך חלל הזגוגית.
- על ידי שימוש באותה מחט המשמשת לחתך הסקלרי (27 גרם או 30 גרם), בצע פרצנטזיס בקרנית ההיקפית באותו רבע.
- הכנס את המחט הקהה 32 G המותקנת על מזרק מיקרוליטר דרך החתך הסקלרלי.
- הזרקת 100 מיקרוליטר של BSS ליצירת RD מוקדי.
- שחרר את תפרי המתיחה של השרירים החוץ-עיניים כדי להחזיר את העין למצב הרגיל.
- להדמיה ישירה של ה-RD, הניחו והחזיקו את החלקה של הכיסוי, עמוסה בג'ל סיכה עיניים, על הקרנית.
- כוונן את מטרת המיקרוסקופ כדי להתמקד ברשתית.
- אם ה-RD לא נצפה או שהוא קטן מדי (קטן מגודל של רבע אחד), בצע הזרקה שנייה של BSS כדי להשיג את גודל ה-RD הרצוי על ידי גלגול העין כלפי מטה ופנימה וחזרה על שלבים 2.2.4 עד 2.2.8.
- לאחר השלמת ה-RD, ודא את אורך הסקלר (כפי שהוזכר בשלב 2.2.1) עם קליפר (ראה טבלת חומרים).
- חותכים את הרקמה הכורואידית לשני הכיוונים בעזרת מספריים מיקרוכירורגיים עדינים.
- העבירו את המחט הקהה הצידה לאורך החתך הסקלרלי כדי לוודא שכל המבנים הסקלריים והכורואידליים נותחו.
- הכנס את השתל לחלל התת-רשתית.
- בעזרת שני מלקחיים כירורגיים עדינים, כגון קשירת מלקחיים (ראה טבלת חומרים), תפסו את השתל מאחור כדי לא לפגוע בחלק הפעיל של השתל.
- הנח את השתל במקביל למישור החתך והחלק בעדינות פנימה את השתל.
- לאחר שהשתל הוכנס במלואו לחלל התת-רשתית, שחרר אותו ודחף את השתל פנימה על ידי החדרת הלסתות של אחד המלקחיים 1-1.5 מ"מ לתוך החתך.
- שחרר את תפרי המתיחה של השריר החוץ-עיני וודא את מיקום השתל באמצעות המיקרוסקופ וכיסוי הכיסוי כמתואר לעיל (שלבים 2.2.7 ו-2.2.8).
- בצע חתך סקלרלי באמצעות מחט של 27 גרם או 30 גרם. ודא שגודל החתך הוא ~1.2 מ"מ והוא 1.5 מ"מ אחורי הלימבוס.
- שחרר והסר את כל התפרים.
הערה: לאחר סיום ההליך הכירורגי, מבוצע SD-OCT (שלב 3) כדי לאמת את הממצאים הקליניים. מפגש ההדמיה SD-OCT מתבצע מיד לאחר הניתוח. אם לא הושגה הדמיה נכונה של מיקום השתל, יש לבצע את ה-SD-OCT שוב 7-10 ימים לאחר הניתוח.
3. הדמיית SD-OCT
- לחץ על סמל Heidelberg Eye Explorer (תוכנה לניהול תמונות; ראה טבלת חומרים) במסך שולחן העבודה.
- לחץ על סמל המטופל החדש בחלק העליון של המסך.
- מלא את כל המידע המבוקש כדי להפיק את מזהה החיה ולחץ על קבל.
- בחר את מערכת ההדמיה OCT (HRA + OCT; ראה טבלת חומרים) עבור סוג המכשיר.
- בחר את המפעיל ולחץ על אישור.
- לאפשרות העקמומיות הנכונה של הקרנית, לחץ על כפתור אישור כדי לקבל נתוני עין המוגדרים כברירת מחדל.
- ודא שחלון הרכישה של SD-OCT מופעל ומוכן ל-SD-OCT.
- הפעל את מצלמת SD-OCT על ידי לחיצה על כפתור התחל הצהוב הממוקם בתצוגת מסך המגע לצד המצלמה.
- הנח את בעל החיים על במת בעלי החיים SD-OCT שהותאמה על גבי משענת הראש SD-OCT.
הערה: התאמת שלב בעלי החיים כוללת חתיכת קצף פוליסטירן (ראה טבלת חומרים) כדי להתאים לראש SD-OCT stage גדול מספיק כדי להניח עליו את החיה, כולל כרית החימום. - כוונן את גובה השולחן ואת מיקום החיה כדי ליישר את האישון עם מרכז עדשת SD-OCT.
הערה: לאחר יישור העין, תופיע תמונה חיה אינפרא אדום (IR) על המסך. - לחץ על כפתור IR + OCT במסך המגע או על כפתור OCT בפינה השמאלית התחתונה של הצג כדי להתחיל ברכישת התמונה.
- לאחר שה-SD-OCT עולה לאוויר, בחר מצב סריקה יחיד עם המספר הגבוה ביותר (100) של מסגרות ART. מצב הסריקה של 100 ART הוא מצב ברירת המחדל.
- באמצעות הג'ויסטיק של המצלמה, מרכז את עצב הראייה על תמונת ה-IR.
- דחוף את המצלמה קדימה עד שתמונת ה-IR תתמלא באופן שווה בתמונת הרשתית.
הערה: פינות כהות מצביעות על כך שהמצלמה רחוקה מדי או קרובה מדי לעין. - הזז את המצלמה הצידה עד שהשתל נראה בהיבט הטמפורלי של הרשתית. השתמש בתמונת ה-IR כדי להנחות את התנועות.
- כדי לדמיין את השתל על ידי סריקת B, לחץ על CTRL + ALT + SHIFT + O בו-זמנית כדי להציג את חלון התאמת סריקת B SD-OCT.
- כוונן את "זרוע הייחוס" (בתחתית החלון) עד שהרשתית/השתל יודגמו בתמונת SD-OCT.
הערה: יש להציג את תמונת SD-OCT בפינות הייחוס הכחולות. - סגור את החלון.
- באמצעות הג'ויסטיק וידית המצלמה, החלק וסובב את המצלמה לכל הכיוונים עד לקבלת תמונה טובה יותר, שטוחה וחדה יותר באיכות SD-OCT.
- גרור את החץ הכחול בתמונת ה-IR עד שהוא מונח לאורך השתל.
- לאחר שהרוויה והמיקום של סריקת B אופטימליים, הפעל את "מעקב אוטומטי בזמן אמת (ART)" על ידי לחיצה על כפתור בקרת הרווח השחור מתחת למסך המגע.
- ברגע שה-ART מגיע ל-100 פריימים, לחץ על Acquire במסך המגע.
- לאחר שכל התמונות נרכשו, לחץ על שמור תמונות בחלק העליון של החלון ולאחר מכן לחץ על יציאה.
- שמור על לחות הקרנית במהלך כל סשן ההדמיה על ידי מריחת טיפות עיניים סיכה לעתים קרובות (כל 5 דקות).
4. התאוששות בעלי חיים
- בתום מפגש ההדמיה יש למרוח משחה אנטיביוטית על הקרנית כדי למנוע זיהום בעיניים ולהרטיב את הקרנית.
- השאר את החיה מונחת על בטנה על כרית החימום עד להתאוששות מלאה (~20-30 דקות) ואמבולטורית.
- תן משככי כאבים סיסטמיים (1.0-1.2 מ"ג/ק"ג בופרנורפין SR לאחר תת עורית; ראה טבלת חומרים) בסוף ההליך הכירורגי.
- אל תשאיר את בעל החיים ללא השגחה עד שהוא חזר להכרה מספקת.
- אין להחזיר את החיה לחברת בעלי חיים אחרים עד להחלמה מלאה.
- לאחר התאוששות מלאה, החזירו את החיה לאזור המגורים עם גישה למזון ומים אד ליביטום.
תוצאות
השתלת שתל תת-רשתית בחולדות RCS (N = 12) הדגימה את ההיתכנות והשחזור של הטכניקה הכירורגית ללידה תת-רשתית בחולדות. במחקר זה, העין הימנית הייתה העין המטופלת (N = 12) עם השתל. בהערכה הקלינית שבוצעה בתום ההליך באמצעות המיקרוסקופ הכירורגי, תשע מתוך 12 העיניים שטופלו הדגימו לוקליזציה תת-רשתית של השתל (75.00%), שתי עיניים (16.67%) זוהו כמיקום תוך רשתית של השתל, ובעין אחת (8.33%) הדמיה ישירה לא התאפשרה עקב אטימות מדיה הנגרמת מדימום תת-רשתית באזור הניתוח, עם תצוגה מוגבלת של מבני השתל והרשתית (טבלה 1). סריקות SD-OCT שבוצעו מיד לאחר ההליך הכירורגי הדגימו את המיקום התת-רשתית או התוך-רשתית של השתל (10 [83.33%] ואחד [8.33%], בהתאמה) (איור 1A). SD-OCT לא הצליח לזהות לחלוטין את מיקום השתל תת-רשתית באותה חיה (n = 1) עם אטימות מדיה שתוארה לעיל (הדמיה ישירה אינה אפשרית), גם לאחר מעקב של 10 ימים. איור 1B,C מראה שתי חיות שונות עם שתל שממוקם כראוי בחלל התת-רשתית. לא היו סיבוכים כירורגיים אחרים הקשורים לטכניקה הניתוחית. על ידי צביעת המטוקסילין ואאוזין (H&E), נצפה אימות של המיקום התת-רשתית של השתל (איור 1D).
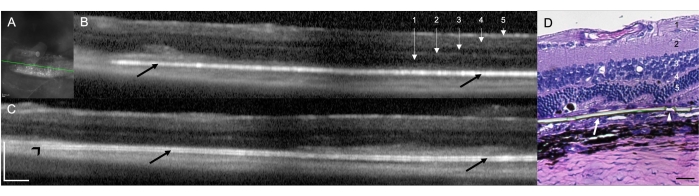
איור 1: סריקות טומוגרפיה קוהרנטיות אופטית בתחום ספקטרלי (SD-OCT) בשבוע לאחר ההשתלה לאחר הניתוח. (A) תמונת אינפרא אדום של השתל התת-רשתית. הקו הירוק תוחם את החתך המוצג ב-(B). סרגל קנה מידה: 200 מיקרומטר. (B,C) שני בעלי חיים שונים עם שתל הממוקם כראוי בחלל התת-רשתית (חיצים שחורים). קצה השתל מצביע לכיוון עצב הראייה (ראש חץ שחור). 1 = שכבת סיבי עצב רשתית/תאי גנגליון, 2 = שכבת פרספקס פנימית, 3 = שכבה חיצונית פנימית, 4 = שכבת פרספקס חיצונית ו-5 = שכבה גרעינית חיצונית. סרגל קנה מידה: 200 מיקרומטר. (D) חתך היסטולוגיה צבוע ב-H&E כדי להדגים את ההשתלה התת-רשתית של קרום הפארילן (חץ לבן). ראש החץ מראה את אחת המיקרו-נקבוביות באזורים האולטרה-דקים. 1 = שכבת סיבי עצב רשתית/תאי גנגליון, 2 = שכבת פרספקס פנימית, 3 = שכבה חיצונית פנימית, 4 = שכבת פרספקס חיצונית ו-5 = שכבה גרעינית חיצונית. סרגל קנה מידה: 20 מיקרומטר. הגדלה: פי 20. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| הערכה קלינית | SD-OCT | |||||
| נושא | SR | IR | ידוע | SR | IR | ידוע |
| 1 | X | X | ||||
| 2 | X | X | ||||
| 3 | X | X | ||||
| 4 | X | X | ||||
| 5 | X | X | ||||
| 6 | X | X | ||||
| 7 | X | X | ||||
| 8 | X | X | ||||
| 9 | X | X | ||||
| 10 | X | X | ||||
| 11 | X | X | ||||
| 12 | X | X | ||||
| 9 | 2 | 1 | 10 | 1 | 1 | |
| 75.00% | 16.67% | 8.33% | 83.33% | 8.33% | 8.33% | |
טבלה 1: השוואה של ממצאי העיניים בין הערכות קליניות להדמיית SD-OCT בקרב כל בעלי החיים. קיצורים: SR = תת-רשתית, IR = תוך-רשתית, ו-SD-OCT = טומוגרפיה קוהרנטית אופטית של תחום ספקטרלי.
Discussion
למרות שההליך תואר בעבר בשינויים קלים, היקף כתב היד הזה הוא לספק תיאור מקיף של הליך כירורגי לשתלים תת-רשתית בחולדות שיש לעקוב אחריו תוך כדי לימוד הטכניקה ולהתגבר על האתגרים הכירורגיים והסיבוכים הפוטנציאליים שהחוקרים עלולים להיתקל בהם. הפרוטוקול הכירורגי המתואר כאן כולל שימוש בקרום הפארילן האולטרה-דק שנמצא בשימוש נרחב במעבדה שלנו מזה מספר שנים 9,10,16,18. עם זאת, יכולת השחזור של הטכניקה באמצעות מזרקים וחומרים שונים המושתלים בחלל התת-רשתית נצפתה 18,19.
גישה סקלרלית להשתלת התקנים תת-רשתית אינה מוגבלת לטיפולים מבוססי תאי גזע; הליכי השתלת רשתית במודלים של בעלי חיים קטנים תוארו גםהם 20,21. בתחום הגירוי החשמלי ברשתית, הליך כירורגי זה לשתלים תת-רשתית בחולדות נמצא בשימוש כבר יותר מעשור22. לאחרונה, Ho et al.23 השתילו מערך לגירוי רשתית החולדה, ותומס ואחרים 24 השתמשו באורגנואידים ברשתית כמקור לתאי גזע. כפי שהוזכר קודם לכן, טיפולים מבוססי תאי גזע פורסמו היטב, כולל פרסומים על השתלה כירורגית של שתלים תואמים ביולוגית שנזרעו בתאי גזע4. ישנן וריאציות קלות בגישות הכירורגיות המתוארות על ידי מחברים שונים, אשר יידונו וישוו לטכניקה הכירורגית המתוארת בכתב יד זה.
סגירה סקלרלית ומכשור כירורגי דורשים דיון נוסף. ישנן שתי גישות נפוצות לניהול חתך סקלרלי: (1) סגירה עם תפר ו-(2) סגירה ללא תפר. מספר מחברים משתמשים בניילון 10-0 כדי לסגור את החתך הסקלרלי עם תפר כחלק מההליך הרגיל שלהם 23,25,26,27. עם זאת, קבוצות אחרות (כולל שלנו) מצאו שתפר ניילון 10-0 אינו נדרש28. אלה התומכים בסגירה עם התפר טוענים שהשתל התת-רשתית יחליק החוצה מהחתך בעין אם אין תפר. כפי שמתואר בסעיף התוצאות, המחקר הנוכחי לא מצא שחול של השתל או הרקמה התוך עינית לאורך כל החתך. גישה כירורגית זו ללא התפר שימשה במעבדה שלנו באופן שגרתי ומוצלח 9,10,12,13,16. ההצדקה לגישה ללא תפרים מסתמכת על שני גורמים: ראשית, שילוב של מיקום החתך ותצורתו מספק מספיק מבנה כדי ליצור חתך איטום עצמי. יש לזכור כי תצורה נכונה של מנהרת הסקלר היא צעד שהחוקרים ישיגו בתרגול. שנית, הלחץ התוך עיני עולה ברגע שהמתיחה משתחררת, ושומר על השתל במקומו. הלחץ התוך עיני המוגבר מביא לכך שהרשתית נדחפת כנגד החתך, מקרבת את שני הדשים הסקלריאליים זה לזה וגורמת לחתך אוטם את עצמו. לכן, אין צורך בתפר. יש לציין שאורך החתך הוא עד 1.5 מ"מ בלבד. במקרים בהם החתך הניתוחי דורש פצע גדול יותר או אם לא מושגת תצורת תעלה סקלרלית תקינה, תפר ניילון 10-0 הוא פתרון סביר. הטכניקה הנוכחית אמינה ביותר אם משתמשים בה עם המכשור הכירורגי המומלץ. חלק מהמחברים השתמשו במזרקים מותאמים אישית עבור השתלים שלהם, מה שמשנה את גודל החתך ומביא לצורך להשתמש בתפר סקלרלי לסגירה נכונה 25,29. עם זאת, מניסיוננו, שימוש בחומרים ומזרקים שונים הביא להגדלת אורך החתך (~0.5 מ"מ)18,19. עדיין לא ראינו חוסר יציבות או סיבוכים הקשורים לחתך סקלרלי גדול יותר, ולא היה צורך בתפר. עם זאת, שימוש במכשור מחוץ להנחיות אלה במהלך ההליך יכול להיחשב כמגבלה של טכניקה זו.
שלב קריטי נוסף שכמעט ולא הוזכר בפרסומים קודמים הוא הפרצנטזיס להפחתת הלחץ התוך עיני (IOP) לפני יצירת ה-RD המוקד והזרקת השתל לחלל התת-רשתית 4,10,13,15. הפחתת ה-IOP מספקת שליטה טובה יותר על המבנים התוך עיניים תוך ניתוק הרשתית ומונעת שחול של התוכן התוך עיני, מה שמוביל להליך לא מוצלח. יתרון נוסף הקשור לעין היפוטונית, הוא הפחתת ההתנגדות בעת הזרקת השתל דרך החתך הסקלרלי, מה שמביא לפחות נזק לשתל עצמו. מצד שני, IOP נמוך נוטה לדימום עיני מוגבר בחתך הניתוח. כמויות גדולות של דם בחתך הסקלרי מסתירות את הנוף ומגבירות את הסיכון להעברת דם לחלל התת-רשתית במהלך ההשתלה התת-רשתית. אנו ממליצים לשלוט בדימום באמצעות החלפות כותנה ו-BSS כדי לנקות את האזור ולמנוע סיבוכים כירורגיים.
ראוי להזכיר כי גודל ה-RD חשוב למיקום נכון של השתל בחלל התת-רשתית. בניגוד למודלים אחרים של בעלי חיים ובני אדם 5,14,30, מכיוון שגישה סקלרלית זו אינה מספקת הדמיה ישירה של המרחב התת-רשתית, קשה יותר ליצור RD מוקדי. כדי לספק מספיק מקום לפריסת השתל בעדינות לחלל התת-רשתית מבלי למקם מחוץ לאזור זה, ההמלצה היא להזריק 100 μLof BSS. המלצה זו מבוססת על יצירת RD של לפחות רבע אחד של הרשתית. אם נוצר RD קטן מרבע אחד לפחות של הרשתית, השתל יוזרק באופן שגוי לחלל התוך-זגוגי, התוך-רשתית או הסופרכורואידי. כפי שמתואר לאורך הפרוטוקול, אם נצפה RD קטן, מומלץ לחזור על שלבים 2.2.4 עד 2.2.8 עד להשגת ה-RD הרצוי.
רוב הסיבוכים הכירורגיים והשלבים הקריטיים שנדונו בכתב היד עלולים להתרחש במהלך עקומת הלמידה, מה שעלול לפגוע בהצלחת ההשתלה התת-רשתית. עקומת למידה זו כוללת גם את משך הזמן שבעלי החיים נשארים תחת הרדמה ואת רמת ההתייבשות. זמן הרדמה ארוך יותר, חומרי הרדמה והתייבשות עלולים להוביל לסיבוכים בעין יבשה, כגון שינויים בקרנית, בעדשה ובסקלרל31. בנוסף, חומרי הרדמה, כגון קטמין וקסילזין, נקשרו לאטימות מדיה בקרנית ובעדשה יחד עם שינויים בהרכב ההומור המימי32. שימוש בטיפות עיניים סיכה (BSS) על העין הניתוחית לאורך כל זמן ההרדמה מטפל בסיבוכים אלה. לסיכום, המתודולוגיה המתוארת בכתב יד זה נועדה לשמש כהמלצה כירורגית בפיתוח טיפולים תת-רשתית בעיני חולדות.
Disclosures
M.S.H., D.R.H. ו-J.L. הם מייסדים ויועצים שותפים ל-Regenerative Patch Technologies (RPT). המחברים האחרים מאשרים כי אין להם קשרים או מעורבות בארגון או ישות כלשהם בעלי אינטרס כספי או לא פיננסי כלשהו בנושא או בחומרים הנדונים בכתב יד זה.
Acknowledgements
מחקר זה נתמך על ידי CIRM DT3 (MSH) ומחקר למניעת עיוורון (מכון העיניים USC Roski). אנו רוצים להודות לפרננדו גלארדו ולד"ר יינג ליו על הסיוע הטכני שלהם.
לנותן החסות לא היה כל תפקיד בתכנון או בביצוע מחקר זה.
Materials
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | VWR | BD309659 | |
| 27 G needle 1/2'' | VWR | BD305109 | |
| 30 G needle 1/2'' | VWR | BD305106 | |
| 32 G Blunt needle - Small hub RN | Hamilton | 7803-04 | |
| 4-0 Perma Hand silk black 1X18" PC-5 | Ethicon | 1984G | |
| 6'' sterile cotton tips | VWR | 10805-154 | |
| Betadine 5% sterile ophthalmic prep solution | Alcon | 8007-1 | |
| BSS irrigating solution 15 mL | Accutome | Ax17362 | |
| Buprenorphine ER | ZooPharm | N/A | |
| Castroviejo Caliper | Storz | E2405 | |
| Castroviejo suturing forceps 0.12 mm | Storz | E1796 | |
| Clayman-Vannas scissors straight | Storz | E3383S | |
| Cover glass, square | WVR | 48366-227 | |
| EPS Polystyrene block | Silverlake LLC | CFB8x12x2 | |
| Gonak 15 mL | Accutome | Ax10968 | Eye lubricant |
| Halstead straight hemostatic mosquito forceps non-magnetic | Storz | E6772 | |
| Hamilton syringe 700 series 100 µL | Hamilton | 7638-01 | |
| HEYEX Software | Heidelberg | N/A | an image management software |
| Kelman-McPherson tying forceps angled | Storz | E1815 AKUS | |
| Ketamine (100 mg/mL) | MWI | 501072 | |
| Needle holder 9mm curved fine locking | Storz | 3-302 | |
| Neomycin/Polymyxin B sulfactes/Bacitracin zinc ointment 3.5 g | Accutome | Ax0720 | |
| Ophthalmic surgical microscope | Zeiss | SN: 233922 | |
| Phenylephrine 2.5% 15 mL | Accutome | Ax0310 | |
| Spectralis SD-OCT | Heidelberg | SPEC-CAM-011210s3600 | |
| Sterile Drape | VWR | 100229-300 | |
| Sterile surgical gloves | VWR | 89233-804 | |
| T-Pump heating system | Gaymar | TP650 | |
| Tropicamide 1% 15 mL | Accutome | Ax0330 | |
| Ultrathin membranes made from Parylene C and coated with vitronectin | Mini Pumps LLC, CA | specifically designed for this study | used as subretinal implants |
| Xylazine (100 mg/mL) | MWI | 510650 |
References
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Global Health. 2 (2), 106-116 (2014).
- Schultz, N. M., Bhardwaj, S., Barclay, C., Gaspar, L., Schwartz, J. Global burden of dry age-related macular degeneration: a targeted literature review. Clinical Therapeutics. 43 (10), 1792-1818 (2021).
- Deng, Y., et al. Age-related macular degeneration: Epidemiology, genetics, pathophysiology, diagnosis, and targeted therapy. Genes & Diseases. 9 (1), 62-79 (2021).
- Nazari, H., et al. Stem cell-based therapies for age-related macular degeneration: The promises and the challenges. Progress in Retinal and Eye Research. 48, 1-39 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- Kashani, A. H., et al. Survival of an HLA-mismatched, bioengineered RPE implant in dry age-related macular degeneration. Stem Cell Reports. 17 (3), 448-458 (2022).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Da Cruz, L., Chen, F. K., Ahmado, A., Greenwood, J., Coffey, P. RPE transplantation and its role in retinal disease. Progress in Retinal and Eye Research. 26 (6), 598-635 (2017).
- Hu, Y., et al. A novel approach for subretinal implantation of ultrathin substrates containing stem cell-derived retinal pigment epithelium monolayer. Ophthalmic Research. 48 (4), 186-191 (2012).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: improved survival when implanted as a monolayer. Investigative Ophthalmology & Visual Science. 54 (7), 5087-5096 (2013).
- Antognazza, M. R., et al. Characterization of a polymer-based, fully organic prosthesis for implantation into the subretinal space of the rat. Advanced Healthcare Materials. 5 (17), 2271-2282 (2016).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286 (2021).
- Thomas, B. B., et al. A new immunodeficient retinal dystrophic rat model for transplantation studies using human-derived cells. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (11), 2113-2125 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatán minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology. 254 (8), 1553-1565 (2016).
- Yu, W., et al. Biocompatibility of subretinal parylene-based Ti/Pt microelectrode array in rabbit for further artificial vision studies. Journal of Ocular Biology, Diseases, and Informatics. 2 (1), 33-36 (2009).
- Thomas, B. B., et al. Survival and functionality of hESC-derived retinal pigment epithelium cells cultured as a monolayer on polymer substrates transplanted in RCS rats. Investigative Ophthalmology & Visual Science. 57 (6), 2877-2887 (2016).
- Adekunle, A. N., et al. Integration of perforated subretinal prostheses with retinal tissue. Translational Vision Science & Technology. 4 (4), 5 (2015).
- Lu, B., et al. Semipermeable parylene membrane as an artificial Bruch's membrane. 2011 16th International Solid-State Sensors, Actuators and Microsystems Conference. IEEE. , 950-953 (2011).
- Hu, Y., et al. Subretinal implantation of gelatin films with stem cells derived RPE in rats. Investigative Ophthalmology & Visual Science. 54 (15), 1763 (2013).
- Aramant, R. B., Seiler, M. J. Retinal transplantation-advantages of intact fetal sheets. Progress in Retinal and Eye Research. 21 (1), 57-73 (2002).
- Peng, Q., et al. Structure and function of embryonic rat retinal sheet transplants. Current Eye Research. 32 (9), 781-789 (2007).
- Pardue, M. T., et al. Neuroprotective effect of subretinal implants in the RCS rat. Investigative Ophthalmology & Visual Science. 46 (2), 674-682 (2005).
- Ho, E., et al. Characteristics of prosthetic vision in rats with subretinal flat and pillar electrode arrays. Journal of Neural Engineering. 16 (6), 066027 (2019).
- Thomas, B. B., et al. Co-grafts of human embryonic stem cell derived retina organoids and retinal pigment epithelium for retinal reconstruction in immunodeficient retinal degenerate Royal College of Surgeons rats. Frontiers in Neuroscience. 15, 752958 (2021).
- Seiler, M. J., et al. Vision recovery and connectivity by fetal retinal sheet transplantation in an immunodeficient retinal degenerate rat model. Investigative Ophthalmology & Visual Science. 58 (1), 614-630 (2017).
- McLelland, B. T., et al. Transplanted hESC-derived retina organoid sheets differentiate, integrate, and improve visual function in retinal degenerate rats. Investigative Ophthalmology & Visual Science. 59 (6), 2586-2603 (2018).
- Lin, B., McLelland, B. T., Mathur, A., Aramant, R. B., Seiler, M. J. Sheets of human retinal progenitor transplants improve vision in rats with severe retinal degeneration. Experimental Eye Research. 174, 13-28 (2018).
- Matsuo, T., Hosoya, O., Tsutsui, K. M., Uchida, T. Behavior tests and immunohistochemical retinal response analyses in RCS rats with subretinal implantation of Okayama-University-type retinal prosthesis. Journal of Artificial Organs. 16 (3), 343-351 (2013).
- Seiler, M. J., et al. A new immunodeficient pigmented retinal degenerate rat strain to study transplantation of human cells without immunosuppression. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (7), 1079-1092 (2014).
- Stanzel, B. V. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Fabian, R. J., Bond, J. M., Drobeck, H. P. Induced corneal opacities in the rat. The British Journal of Ophthalmology. 51 (2), 124-129 (1976).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Experimental Eye Research. 42 (4), 331-337 (1986).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved