Method Article
ラットにおける網膜下インプラントの手術技術の開発
要約
現在のプロトコルは、網膜下デバイスの移植のための強膜アプローチ、研究中の網膜疾患の動物モデルでの実装のための実行可能な外科的技術について説明します。
要約
加齢黄斑変性症(AMD)などの網膜変性症は、世界中で失明の主な原因となっています。幹細胞ベースの治療を含む、AMDの再生医療ベースの治療法を開発するために、無数のアプローチが行われています。網膜変性の動物モデルとしてのげっ歯類は、さまざまな段階で網膜変性疾患を発症する幅広い株があるため、トランスレーショナルリサーチの基盤です。しかし、げっ歯類における網膜下インプラントのヒト治療送達を模倣することは、レンズサイズや硝子体容積などの解剖学的な違いにより困難です。この外科的プロトコルは、ラットの網膜下腔にインプラントを移植するためのガイド付き方法を提供することを目的としています。重要なステップのユーザーフレンドリーな包括的な説明が含まれています。このプロトコルは、ラットのさまざまな前臨床試験で再現性を高めるための費用対効果の高い外科的処置として開発されました。手術実験を行う前に、インプラントの寸法の調整など、人間サイズのインプラントの適切な小型化が必要です。硝子体内処置の代わりに外部アプローチを使用して、インプラントを網膜下腔に送達します。小さな鋭い針を使用して、側頭上象限で強膜切開を行い、続いて眼圧を下げるための穿刺を行い、それによって外科的移植中の抵抗を最小限に抑えます。次に、切開部からの平衡塩溶液(BSS)注入を行い、限局性網膜剥離(RD)を達成します。最後に、インプラントの網膜下腔への挿入と視覚化が行われます。インプラントの網膜下配置の術後評価には、スペクトル領域光干渉断層撮影法 (SD-OCT) によるイメージングが含まれます。イメージングのフォローアップでは、組織学的分析のために眼球を採取して固定する前に、インプラントの網膜下安定性を確認します。
概要
加齢性黄斑変性症(AMD)は、世界中で失明の主な原因です。2020年にAMDに罹患した人の数は1億9,600万人と推定され、これが2040年までに約2億8,800万人に増加すると予測されています1。過去 10 年間で、AMD の後期段階に関連する視覚変化を緩和するためのいくつかの治療法が開発されてきました。これは主に、滲出型 AMD で観察される脈絡膜新生血管の進行と進行を治療するためです。逆に、網膜色素上皮(RPE)細胞の機能不全と喪失がRPEと網膜萎縮に進行する乾性AMDの治療は、AMDの85%から90%を占めると推定されており、世界中での有病率は0.44%です1,2。AMDは、年齢、遺伝的、および環境的要因が疾患の発症と進行に寄与する多因子性疾患として説明されています。この疾患に関連するさまざまな病態生理学的経路に対処するために、いくつかの治療法が開発されています3。
幹細胞ベースの治療は、乾性AMD4のRPEの失敗を置き換える新しい治療オプションとして開発されました。多能性幹細胞の使用はまだ初期の臨床試験段階にありますが、安全性はいくつかの臨床試験で実証されています5,6,7。今日まで、幹細胞を網膜下腔に展開するための2つの主要な経路がある:懸濁液または生体適合性インプラント8,9,10,11,12に播種された単層パッチの挿入である。前臨床試験で幹細胞ベースの治療を使用する新しい戦略には、幹細胞ベースの治療薬をヒトで意図したのと同じ標的部位に送達できる動物モデルが必要です。解剖学的構造の違いは、最終的な人間の製品13,14で使用されるものと比較して、手順、手術器具、およびアプローチにわずかな変更を必要とするかもしれません。眼科手術技術の変更は、異なる動物モデル15,16,17で使用するための成功したアプローチとして広く説明されている必要な変更の1つである。
以前の出版物では、ラットの網膜下インプラントの外科的技術について言及されていますが、研究者が遭遇する可能性のある技術的困難を克服するためのそのような技術についての包括的な説明はありません。したがって、外科的技術を詳細に適切に説明し、回避するためのベストプラクティスと学んだ教訓を提供し、必要に応じて、手順全体の重要なステップ中の問題に対処する必要があります。この原稿の目的は、ラットの網膜下腔へのインプラントの外科的移植に関する包括的なガイドラインを提供することです。
プロトコル
すべての実験は、南カリフォルニア大学の動物管理・使用委員会(IACUC)によって承認され、国立衛生研究所(NIH)の実験動物の管理と使用に関するガイドおよび眼科および視覚研究における動物の使用に関するARVO(The Association for Research in Vision and Ophthalmology)の声明に従って実施されました。本研究では、合計12匹のRoyal College of Surgeon(RCS)雄ラットが使用されました。動物は動物施設で飼育され、生後1日±28歳に達すると研究に含まれました。眼科の完全検査を実施し、眼の異常がないことを確認しました。網膜下インプラントは、パリレンCから作られ、ビトロネクチンでコーティングされた極薄の膜で、特定の商業組織によって設計されました( 材料の表を参照)。これらの膜は、その厚さと透過性の点で人間サイズの膜を再現しています(厚さ6.0μmのメッシュフレームと極薄領域に20μmの円形の細孔)。ヒトサイズの膜からの長さと幅(1.0mm×0.4mm)の小型化は、げっ歯類の眼18内の網膜下インプラントを収容するために達成された。
1.動物の世話と手術の準備
- 動物の体重を量り、麻酔の投与量を計算し、ステップ1.2に従って麻酔をかけます。
- ケタミンとキシラジンの混合物(それぞれ35-50 mg / kgおよび5-10 mg / kg)の腹腔内注射により動物に麻酔をかけます。1.0mLのシリンジと30Gの針で注入します。
- 処置中に適切な麻酔レベルを維持するために、麻酔の混合物(ケタミンとキシラジン)の半分の量で別の1.0mLシリンジをロードします。.
- ペダル反射(つま先をしっかりとつまむ)がないことにより、適切な麻酔を確認します。
- 硝子体腔と網膜を適切に視覚化するには、治療した眼に1%トロピカミドと2.5%フェニレフリン点眼薬( 材料の表を参照)を点眼して ?? 孔を拡張します。.
- 5分後に2回目の拡張点眼薬を塗布します。
- 動物が角膜に潤いを与えるために麻酔をかけられている間、5〜10分ごとに非外科的眼に人工涙液または眼潤滑剤ジェルを塗布します。
- 加熱パッドの上に滅菌ドレープを置きます( 材料の表を参照)。手術用トレイを覆う滅菌ドレープを置きます。
- 手術用手袋、網膜下インプラント、手術器具:蚊鉗子(3)、顕微手術用ハサミ(1)、ニードルホルダー(1)、歯付き細い鉗子(1)、歯のない細いストレート鉗子(2)、マイクロリットル注射器(1)、32Gの鈍い針(1)、27Gまたは30Gの針(2)、 4-0シルク縫合糸(3)、綿棒、バランス塩溶液(BSS)、およびカバースリップ( 材料の表を参照)。
- 滅菌条件下で滅菌手袋を使用して、マイクロリットルシリンジにBSSをロードし、32Gの鈍針を取り付けます。
- コットンスワップを27Gまたは30Gのニードルハブに挿入して、針をより敏感に操作するためのハンドルを作成します。
- 手術中ずっと無菌状態を維持するために、手術用顕微鏡など、非滅菌器具や領域を操作する場合は、滅菌手袋を交換してください。
2. 網膜下移植のための強膜アプローチ:外科的手技
- 以下の手順に従って手術部位を露出させます。
- 動物が麻酔下に置かれ、瞳孔が拡張したら(ステップ1.5)、動物の腹を下にして、頭を研究者に向けて置きます。
注:手術全体を通して、動物が完全に回復するまで、ラットを加熱パッドに滅菌ドレープで覆ったままにしてください。 - 5%ポビドンドロップ( 材料の表を参照)を目に塗り、綿棒で目の表面とまぶたをきれいにします。.
- 手術用顕微鏡( 材料の表を参照)を手術用眼の上に置いて調整します。
注:眼の構造をより鮮明で大きく視覚化するために、外科的処置全体を通して外科用眼科用顕微鏡を使用することをお勧めします。 - 上まぶたを持ち上げ、4-0非吸収性縫合糸を使用して眼球を突き出すことにより、手術領域の適切な露出を確保します。
- 4-0シルク縫合糸を使用して上まぶたを持ち上げます。縫合糸をまぶたの前面のマイボーム腺のレベルに配置します。蚊の鉗子を手術面に固定して、牽引縫合糸を固定します。
注:縫合糸がマイボーム腺のレベルよりも高い位置に配置されると、まぶたの隆起ではなく、まぶたの外転が発生します。 - 顕微鏡手術用細いハサミを使用して、側頭上象限のペリトミーを行います。
- 眼球の突出と前方への変位を可能にするために、2つの牽引縫合糸を配置します。上直筋の分離を行います。
- リンバスの上面にある細い歯の鉗子(0.12mm鉗子)で目を優しく操作することにより、目を下に転がして強膜を露出させます。
- 上眼球筋の位置である上輪部の後ろに、最大1mm離れた場所に4-0シルク縫合糸を配置します。蚊の鉗子を使用して縫合糸の両側をクランプします。
- 側頭直筋の分離を行います。2番目の縫合糸(4-0シルク)を、側頭象限(側頭外眼筋の対応する領域)の輪部から最大1 mm離して配置します。蚊の鉗子を使用して縫合糸の両側をクランプします。
- 両方の外眼筋縫合糸が適切に配置され、固定されたら、縫合糸を内側に引き下げて、強膜の側頭上象限を露出させます。
- 4-0シルク縫合糸を使用して上まぶたを持ち上げます。縫合糸をまぶたの前面のマイボーム腺のレベルに配置します。蚊の鉗子を手術面に固定して、牽引縫合糸を固定します。
- マイクロサージェリーの細いハサミで眼の後ろに向かってペリトミーを伸ばします。
- 綿棒を使用して結膜出血を制御します。
- 動物が麻酔下に置かれ、瞳孔が拡張したら(ステップ1.5)、動物の腹を下にして、頭を研究者に向けて置きます。
- 以下の手順に従って、強膜切開、網膜剥離(RD)、およびインプラント挿入を行います。
- 27Gまたは30Gの針を使用して強膜切開を行います。切開部のサイズが ~1.2 mm で、辺縁部の後方 1.5 mm にあることを確認します。
注:眼を操作してインプラントを導入しながら眼内構造を安定させるために、トンネル状の強膜切開構成の開発が推奨されます。この切開形状により、眼圧の急激な変動を防ぐことができます。 - 適切な構成には練習が必要な場合があります。したがって、適切な構成が達成されない場合は、眼球構造を硝子体腔内に保持するのを容易にするために、外眼筋牽引縫合糸からいくらかの張力を解放します。
- 強膜切開に使用したのと同じ針(27Gまたは30G)を使用して、同じ象限の角膜末梢で穿刺を行います。
- マイクロリットルの注射器に取り付けられた32Gの鈍い針を強膜切開部に挿入します。
- 100 μL の BSS を注入して、フォーカル RD を作成します。
- 外眼筋牽引縫合糸を離して、目を通常の位置に戻します。
- RDを直接視覚化するには、眼科用潤滑剤ゲルを充填したカバースリップを角膜に載せて保持します。
- 顕微鏡の対物レンズを調整して、網膜に焦点を合わせます。
- RDが観察されないか、小さすぎる(1つの象限のサイズより小さい)場合は、BSSの2回目の注入を実行して、アイを内側に回転させ、手順2.2.4から2.2.8を繰り返すことにより、目的のRDサイズを達成します。
- RDが完了したら、キャリパー( 材料の表を参照)で強膜の長さ(ステップ2.2.1で説明したように)を確認します。
- 細い顕微手術用ハサミで脈絡膜組織を両方向に切断します。
- 鈍い針を強膜切開部に沿って横に走らせて、すべての強膜および脈絡膜の構造が解剖されたことを確認します。
- インプラントを網膜下腔に挿入します。
- 結束鉗子( 材料の表を参照)などの2つの細かい外科用鉗子を使用して、インプラントのアクティブ部分を損傷しないように、インプラントを背面からつかみます。
- インプラントを切開面と平行に置き、インプラントをそっとスライドさせます。
- インプラントが網膜下腔に完全に導入されたら、インプラントを解放し、鉗子の1つの顎を切開部に1〜1.5mm導入してインプラントをさらに押し込みます。
- 外眼筋牽引縫合糸をリリースし、上記のように顕微鏡とカバーガラスを使用してインプラントの配置を確認します(ステップ2.2.7および2.2.8)。
- 27Gまたは30Gの針を使用して強膜切開を行います。切開部のサイズが ~1.2 mm で、辺縁部の後方 1.5 mm にあることを確認します。
- すべての縫合糸を解放して取り外します。
注: 外科的処置の終了後、SD-OCT が実行され (ステップ 3)、臨床所見が検証されます。SD-OCTイメージングセッションは、手術直後に行われます。インプラントの位置を適切に視覚化できなかった場合は、手術後7〜10日後に再度SD-OCTを実施します。
3. SD-OCTイメージング
- デスクトップ画面の Heidelberg Eye Explorer アイコン(画像管理ソフトウェア、 資料表を参照)をクリックします。
- 画面上部の 「新規患者 」アイコンをクリックします。
- 動物IDを生成するために要求されたすべての情報を入力し、[同意する]をクリックします。
- デバイスタイプとして、OCTイメージングシステム(HRA + OCT、 材料表を参照)を選択します。
- オペレーターを選択し、[ OK]を押します。
- 角膜の湾曲を正しいオプションにするには、 OK ボタンを押してデフォルトの目のデータを受け入れます。
- SD-OCT 取得ウィンドウが起動し、SD-OCT の準備ができていることを確認します。
- カメラの横にあるタッチスクリーンディスプレイにある黄色の スタート ボタンを押して、SD-OCTカメラの電源を入れます。
- SD-OCTヘッドレストの上に装着されたSD-OCTアニマルステージに動物を置きます。
注:動物ステージの適応には、加熱パッドを含む動物を置くのに十分な大きさのSD-OCTヘッドステージ内に収まる発泡スチロール( 材料の表を参照)が含まれています。 - テーブルの高さと動物の位置を調整して、瞳孔をSD-OCTレンズの中心に合わせます。
注意: 目の位置が揃うと、赤外線(IR)ライブ画像が画面に表示されます。 - タッチスクリーンの IR + OCT ボタンまたはモニターの右下にある OCT ボタンを押して、画像取得を開始します。
- SD-OCT がライブになったら、ART フレームの数が最も多い 100 の 1 つのスキャン モードを選択します。100 ARTスキャンモードがデフォルトのモードです。
- カメラのジョイスティックを使用して、視神経をIR画像の中央に配置します。
- IR画像が網膜画像で均一に満たされるまで、カメラを前方に押します。
注意: 暗いコーナーは、カメラが遠すぎるか、目に近すぎることを示しています。 - インプラントが網膜の時間的側面で視覚化されるまで、カメラを横に動かします。IR画像を使用して動きをガイドします。
- B-スキャンでインプラントを視覚化するには、 CTRL + ALT + SHIFT + O を同時に押して、SD-OCT B-スキャン調整ウィンドウを表示します。
- SD-OCT画像に網膜/インプラントが視覚化されるまで、「リファレンスアーム」(ウィンドウ下部)を調整します。
メモ: SD-OCT 画像は、青色の参照コーナー内に表示する必要があります。 - ウィンドウを閉じます。
- ジョイスティックとカメラハンドルを使用して、カメラをあらゆる方向にスライドさせて回転させ、より良く、より平らで、より鮮明なSD-OCT品質の画像が得られます。
- IR画像の青い矢印をドラッグして、インプラントに沿って配置します。
- B-スキャンの彩度と配置が最適になったら、タッチスクリーンの下にある黒い ゲインコントロール ボタンを押して、「自動リアルタイムトラッキング(ART)」をアクティブにします。
- ARTが100フレームに達したら、タッチスクリーンの Acquire を押します。
- すべての画像を取得したら、ウィンドウ上部の[ 画像を保存 ]をクリックし、[ 終了]をクリックします。
- イメージングセッション全体を通して、潤滑剤の点眼薬を頻繁に(5分ごとに)塗布することにより、角膜を湿らせておきます。
4. 動物の回復
- イメージングセッションの最後に、角膜に抗生物質軟膏を塗布して、眼の感染を防ぎ、角膜に潤いを与えます。
- 動物を完全に回復するまで(~20-30分)、歩行できるようになるまで、動物を温熱パッドの上で腹ばいにしてください。
- 外科的処置の最後に全身性鎮痛薬(1.0-1.2 mg / kgブプレノルフィンSRを皮下投与; 材料の表を参照)を投与します。.
- 動物が十分な意識を取り戻すまで、動物を放置しないでください。
- 完全に回復するまで、動物を他の動物と一緒に戻さないでください。
- 完全に回復したら、動物を住宅エリアに戻し、自由に餌 と水を手に入れることができます。
結果
RCSラット(N = 12)における網膜下インプラントの移植は、ラットにおける網膜下送達のための外科的技術の実現可能性および再現性を実証した。この研究では、右目をインプラントで治療した目(N = 12)でした。手術用顕微鏡を使用した処置の最後に実施された臨床評価では、治療された 12 個の眼のうち 9 個がインプラントの網膜下局在を示し (75.00%)、2 つの眼 (16.67%) がインプラントの網膜内配置として特定され、片方の眼 (8.33%) では、手術領域での網膜下出血による培地の不透明度により、直接視覚化できませんでした。 インプラントと網膜の両方の構造が限られた視野で観察できます(表1)。外科的処置の直後に実施されたSD-OCTスキャンは、インプラントの網膜下または網膜内の位置を示しました(それぞれ10 [83.33%]と1 [8.33%])(図1A)。SD-OCT は、10 日間のフォローアップ後でも、上記の培地の不透明度 (直接視覚化できない) で、同じ動物 (n = 1) でのインプラントの網膜下配置を完全に特定できませんでした。 図1B、C は、インプラントが網膜下腔に適切に留置された2つの異なる動物を示しています。この手術技術に関連する他の外科的合併症はありませんでした。ヘマトキシリンとエオシン(H&E)染色により、インプラントの網膜下配置の検証が観察されました(図1D)。
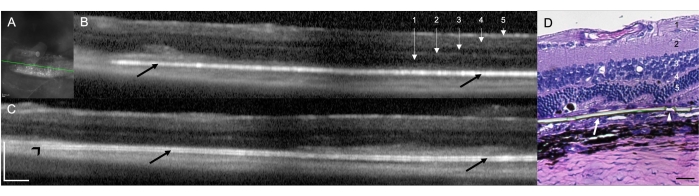
図1:術後1週間の移植時のスペクトル領域光干渉断層撮影法(SD-OCT)スキャン(A)網膜下インプラントの赤外線画像。緑色の線は、(B)に示す断面を区切るものです。スケールバー:200μm.(B,C) 網膜下腔にインプラントを適切に配置した2種類の動物(黒矢印)。インプラントの先端は視神経(黒の矢印)を指しています。1 =網膜神経線維/神経節細胞層、2 =内側の神経叢層、3 =内側の外層、4 =外側の神経叢層、および5 =外側の核層。スケールバー:200 μm. (D) パリレン膜の網膜下移植を実証するためにH&Eで染色した組織学切片(白矢印)。矢印は、極薄領域の微細孔の1つを示しています。1 =網膜神経線維/神経節細胞層、2 =内側の神経叢層、3 =内側の外層、4 =外側の神経叢層、および5 =外側の核層。スケールバー:20μm.倍率:20倍。この図の拡大版を見るには、ここをクリックしてください。
| 臨床評価 | SD-OCTの | |||||
| 件名 | SRの | IR関連 | 不明 | SRの | IR関連 | 不明 |
| 1 | X | X | ||||
| 2 | X | X | ||||
| 3 | X | X | ||||
| 4 | X | X | ||||
| 5 | X | X | ||||
| 6 | X | X | ||||
| 7 | X | X | ||||
| 8 | X | X | ||||
| 9 | X | X | ||||
| 10 | X | X | ||||
| 11 | X | X | ||||
| 12 | X | X | ||||
| 9 | 2 | 1 | 10 | 1 | 1 | |
| 75.00% | 16.67% | 8.33% | 83.33% | 8.33% | 8.33% | |
表1:すべての動物間での臨床評価とSD-OCTイメージングの間の眼所見の比較。略語:SR =網膜下、IR =網膜内、およびSD-OCT =スペクトル領域光コヒーレンストモグラフィー。
ディスカッション
この手順は以前にわずかなバリエーションで説明されていましたが、この原稿の範囲は、技術を学びながら追跡するラットの網膜下インプラントの外科的手順の包括的な説明を提供し、研究者が遭遇する可能性のある外科的課題と潜在的な合併症を克服することです。ここで概説する外科的プロトコルには、数年前から私たちの研究室で広く利用されてきた極薄のパリレン膜の使用が含まれています9,10,16,18。しかし、網膜下腔に埋め込まれた異なるインジェクターおよび材料を用いた技術の再現性が観察されている18,19。
網膜下デバイス移植のための強膜アプローチは、幹細胞ベースの治療に限定されません。小動物モデルにおける網膜移植手順も記載されている20,21。網膜電気刺激の分野では、ラットの網膜下インプラントに対するこの外科的処置は、10年以上にわたって使用されてきました22。最近では、Hoら23はラットの網膜を刺激するアレイを移植し、Thomasら24は幹細胞の供給源として網膜オルガノイドを使用しました。前述のように、幹細胞ベースの治療法は、幹細胞を播種した生体適合性インプラントの外科的移植に関する出版物など、よく発表されています4。さまざまな著者によって記述されている外科的アプローチにはわずかな違いがあり、これについて議論し、この原稿で説明されている外科的技術と比較します。
強膜閉鎖と手術器具には追加の議論が必要です。強膜切開の管理には、(1)縫合糸による閉鎖と(2)縫合糸なしの閉鎖という2つの一般的なアプローチがあります。何人かの著者は、通常の手順23,25,26,27の一部として、縫合糸で強膜切開を閉じるために10-0ナイロンを使用しています。しかし、他のグループ(私たちを含む)は、10-0ナイロン縫合糸は必要ないことを発見しました28。縫合糸による閉鎖を支持する人々は、縫合糸がない場合、網膜下インプラントが目の切開部から滑り落ちると主張しています。結果のセクションで説明されているように、現在の研究では、切開全体でインプラントまたは眼内組織の押し出しは見つかりませんでした。縫合糸を使用しないこの外科的アプローチは、私たちの研究室で日常的に使用され、成功しています 9,10,12,13,16。縫合なしのアプローチの正当性は、2つの要因に依存しています:まず、切開位置とその構成の組み合わせは、セルフシール切開を生成するのに十分な構造を提供します。強膜トンネルの適切な構成は、研究者が実践して達成するステップであることに留意する必要があります。次に、牽引力が解放されると眼圧が上昇し、インプラントが所定の位置に保たれます。眼圧が上昇すると、網膜が切開部に押し付けられ、両方の強膜フラップが互いに接近し、セルフシール切開が行われます。したがって、縫合糸は必要ありません。注目すべきは、切開長さが最大1.5mmであることです。外科的切開でより大きな創傷が必要な場合、または適切な強膜トンネル構成が達成されない場合は、10-0ナイロン縫合糸が合理的な解決策です。現在の技術は、推奨される手術器具と併用すると非常に信頼性があります。一部の著者は、インプラント用にカスタマイズされたインジェクターを使用しており、これにより切開サイズが変更され、適切な閉鎖のために強膜縫合糸を使用する必要が生じています25,29。しかし、私たちの経験では、異なる材料とインジェクターを使用すると、切開長が増加しました(~0.5 mm)18,19。より大きな強膜切開に伴う不安定性や合併症はまだ観察されず、縫合糸の必要もありませんでした。ただし、手順中にこれらのガイドライン以外の機器を使用することは、この手法の制限と見なすことができます。
以前の出版物でめったに言及されていない別の重要なステップは、焦点RDを作成し、インプラントを網膜下腔に注入する前に、眼圧(IOP)を下げるための穿刺です4,10,13,15。IOPを減少させると、網膜を剥離しながら眼内構造をより適切に制御でき、眼内内容物の押し出しが回避されます。これにより、手順が失敗します。低張眼に関連する別の利点は、強膜切開部を通じてインプラントを注入する際の抵抗の減少であり、これによりインプラント自体への損傷が少なくなります。一方、眼圧が低いと、外科的切開部での眼の出血が増加する傾向があります。強膜切開部に大量の血液が付着すると視界が遮られ、網膜下移植中に血液が網膜下腔に移動するリスクが高まります。コットンスワップとBSSを使用して出血を制御し、その領域をきれいにし、外科的合併症を回避することをお勧めします。
RDのサイズは、インプラントを網膜下腔に適切に配置するために重要であることに言及する価値があります。他の動物モデルやヒト5,14,30とは異なり、この強膜アプローチは網膜下空間の直接的な視覚化を提供しないため、焦点RDを生成することはより困難である。インプラントが網膜下腔の外側に置かずに網膜下腔に穏やかに展開されるのに十分なスペースを確保するために、100μLof BSSを注入することをお勧めします。この推奨事項は、網膜の少なくとも 1 つの象限の RD の生成に基づいています。網膜の少なくとも 1 つの象限よりも小さい RD が作成されると、インプラントは硝子体内、網膜内、または脈絡膜上腔に誤って注入されます。プロトコル全体で説明されているように、小さなRDが観察された場合は、目的のRDが達成されるまで、ステップ2.2.4〜2.2.8を繰り返すことをお勧めします。
原稿で議論されている外科的合併症と重要なステップのほとんどは、学習曲線中に発生する可能性があり、網膜下移植の成功を損なう可能性があります。この学習曲線には、動物が麻酔下にある時間や脱水症状のレベルも含まれます。麻酔時間が長くなり、麻酔薬がかかり、脱水症状になると、角膜、水晶体、強膜の変化などのドライアイの合併症を引き起こす可能性があります31。さらに、ケタミンやキシラジンなどの麻酔薬は、房水組成の変化とともに角膜および水晶体の媒体混濁と関連している32。麻酔時間中、手術用眼に潤滑剤点眼薬(BSS)を使用すると、これらの合併症に対処します。要約すると、この原稿に記載されている方法論は、ラットの眼で網膜下治療薬を開発する際の外科的推奨として使用することを目的としています。
開示事項
M.S.H.、D.R.H.、J.L.は、Regenerative Patch Technologies(RPT)の共同設立者であり、コンサルタントです。他の著者は、この原稿で議論されている主題または資料に金銭的または非金銭的な利益を持つ組織または団体と提携または関与していないことを証明します。
謝辞
この研究は、CIRM DT3(MSH)およびResearch to Prevent Blindness(USC Roski Eye Institute)の支援を受けました。Fernando Gallardo氏とYing Liu博士の技術支援に感謝します。
スポンサーは、この研究の設計や実施に何の役割も果たしていませんでした。
資料
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | VWR | BD309659 | |
| 27 G needle 1/2'' | VWR | BD305109 | |
| 30 G needle 1/2'' | VWR | BD305106 | |
| 32 G Blunt needle - Small hub RN | Hamilton | 7803-04 | |
| 4-0 Perma Hand silk black 1X18" PC-5 | Ethicon | 1984G | |
| 6'' sterile cotton tips | VWR | 10805-154 | |
| Betadine 5% sterile ophthalmic prep solution | Alcon | 8007-1 | |
| BSS irrigating solution 15 mL | Accutome | Ax17362 | |
| Buprenorphine ER | ZooPharm | N/A | |
| Castroviejo Caliper | Storz | E2405 | |
| Castroviejo suturing forceps 0.12 mm | Storz | E1796 | |
| Clayman-Vannas scissors straight | Storz | E3383S | |
| Cover glass, square | WVR | 48366-227 | |
| EPS Polystyrene block | Silverlake LLC | CFB8x12x2 | |
| Gonak 15 mL | Accutome | Ax10968 | Eye lubricant |
| Halstead straight hemostatic mosquito forceps non-magnetic | Storz | E6772 | |
| Hamilton syringe 700 series 100 µL | Hamilton | 7638-01 | |
| HEYEX Software | Heidelberg | N/A | an image management software |
| Kelman-McPherson tying forceps angled | Storz | E1815 AKUS | |
| Ketamine (100 mg/mL) | MWI | 501072 | |
| Needle holder 9mm curved fine locking | Storz | 3-302 | |
| Neomycin/Polymyxin B sulfactes/Bacitracin zinc ointment 3.5 g | Accutome | Ax0720 | |
| Ophthalmic surgical microscope | Zeiss | SN: 233922 | |
| Phenylephrine 2.5% 15 mL | Accutome | Ax0310 | |
| Spectralis SD-OCT | Heidelberg | SPEC-CAM-011210s3600 | |
| Sterile Drape | VWR | 100229-300 | |
| Sterile surgical gloves | VWR | 89233-804 | |
| T-Pump heating system | Gaymar | TP650 | |
| Tropicamide 1% 15 mL | Accutome | Ax0330 | |
| Ultrathin membranes made from Parylene C and coated with vitronectin | Mini Pumps LLC, CA | specifically designed for this study | used as subretinal implants |
| Xylazine (100 mg/mL) | MWI | 510650 |
参考文献
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Global Health. 2 (2), 106-116 (2014).
- Schultz, N. M., Bhardwaj, S., Barclay, C., Gaspar, L., Schwartz, J. Global burden of dry age-related macular degeneration: a targeted literature review. Clinical Therapeutics. 43 (10), 1792-1818 (2021).
- Deng, Y., et al. Age-related macular degeneration: Epidemiology, genetics, pathophysiology, diagnosis, and targeted therapy. Genes & Diseases. 9 (1), 62-79 (2021).
- Nazari, H., et al. Stem cell-based therapies for age-related macular degeneration: The promises and the challenges. Progress in Retinal and Eye Research. 48, 1-39 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- Kashani, A. H., et al. Survival of an HLA-mismatched, bioengineered RPE implant in dry age-related macular degeneration. Stem Cell Reports. 17 (3), 448-458 (2022).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Da Cruz, L., Chen, F. K., Ahmado, A., Greenwood, J., Coffey, P. RPE transplantation and its role in retinal disease. Progress in Retinal and Eye Research. 26 (6), 598-635 (2017).
- Hu, Y., et al. A novel approach for subretinal implantation of ultrathin substrates containing stem cell-derived retinal pigment epithelium monolayer. Ophthalmic Research. 48 (4), 186-191 (2012).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: improved survival when implanted as a monolayer. Investigative Ophthalmology & Visual Science. 54 (7), 5087-5096 (2013).
- Antognazza, M. R., et al. Characterization of a polymer-based, fully organic prosthesis for implantation into the subretinal space of the rat. Advanced Healthcare Materials. 5 (17), 2271-2282 (2016).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286(2021).
- Thomas, B. B., et al. A new immunodeficient retinal dystrophic rat model for transplantation studies using human-derived cells. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (11), 2113-2125 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatán minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology. 254 (8), 1553-1565 (2016).
- Yu, W., et al. Biocompatibility of subretinal parylene-based Ti/Pt microelectrode array in rabbit for further artificial vision studies. Journal of Ocular Biology, Diseases, and Informatics. 2 (1), 33-36 (2009).
- Thomas, B. B., et al. Survival and functionality of hESC-derived retinal pigment epithelium cells cultured as a monolayer on polymer substrates transplanted in RCS rats. Investigative Ophthalmology & Visual Science. 57 (6), 2877-2887 (2016).
- Adekunle, A. N., et al. Integration of perforated subretinal prostheses with retinal tissue. Translational Vision Science & Technology. 4 (4), 5(2015).
- Lu, B., et al. Semipermeable parylene membrane as an artificial Bruch's membrane. 2011 16th International Solid-State Sensors, Actuators and Microsystems Conference. IEEE. , 950-953 (2011).
- Hu, Y., et al. Subretinal implantation of gelatin films with stem cells derived RPE in rats. Investigative Ophthalmology & Visual Science. 54 (15), 1763(2013).
- Aramant, R. B., Seiler, M. J. Retinal transplantation-advantages of intact fetal sheets. Progress in Retinal and Eye Research. 21 (1), 57-73 (2002).
- Peng, Q., et al. Structure and function of embryonic rat retinal sheet transplants. Current Eye Research. 32 (9), 781-789 (2007).
- Pardue, M. T., et al. Neuroprotective effect of subretinal implants in the RCS rat. Investigative Ophthalmology & Visual Science. 46 (2), 674-682 (2005).
- Ho, E., et al. Characteristics of prosthetic vision in rats with subretinal flat and pillar electrode arrays. Journal of Neural Engineering. 16 (6), 066027(2019).
- Thomas, B. B., et al. Co-grafts of human embryonic stem cell derived retina organoids and retinal pigment epithelium for retinal reconstruction in immunodeficient retinal degenerate Royal College of Surgeons rats. Frontiers in Neuroscience. 15, 752958(2021).
- Seiler, M. J., et al. Vision recovery and connectivity by fetal retinal sheet transplantation in an immunodeficient retinal degenerate rat model. Investigative Ophthalmology & Visual Science. 58 (1), 614-630 (2017).
- McLelland, B. T., et al. Transplanted hESC-derived retina organoid sheets differentiate, integrate, and improve visual function in retinal degenerate rats. Investigative Ophthalmology & Visual Science. 59 (6), 2586-2603 (2018).
- Lin, B., McLelland, B. T., Mathur, A., Aramant, R. B., Seiler, M. J. Sheets of human retinal progenitor transplants improve vision in rats with severe retinal degeneration. Experimental Eye Research. 174, 13-28 (2018).
- Matsuo, T., Hosoya, O., Tsutsui, K. M., Uchida, T. Behavior tests and immunohistochemical retinal response analyses in RCS rats with subretinal implantation of Okayama-University-type retinal prosthesis. Journal of Artificial Organs. 16 (3), 343-351 (2013).
- Seiler, M. J., et al. A new immunodeficient pigmented retinal degenerate rat strain to study transplantation of human cells without immunosuppression. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (7), 1079-1092 (2014).
- Stanzel, B. V. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Fabian, R. J., Bond, J. M., Drobeck, H. P. Induced corneal opacities in the rat. The British Journal of Ophthalmology. 51 (2), 124-129 (1976).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Experimental Eye Research. 42 (4), 331-337 (1986).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved