Method Article
تطوير تقنية جراحية لزراعة تحت الشبكية في الفئران
In This Article
Summary
يصف البروتوكول الحالي نهج الصلبة لزرع الجهاز تحت الشبكية ، وهي تقنية جراحية مجدية للتنفيذ في النماذج الحيوانية لأمراض الشبكية في البحث.
Abstract
يعد تنكس الشبكية ، مثل التنكس البقعي المرتبط بالعمر (AMD) ، سببا رئيسيا للعمى في جميع أنحاء العالم. تم اتباع عدد لا يحصى من الأساليب لتطوير علاجات قائمة على الطب التجديدي ل AMD ، بما في ذلك العلاجات القائمة على الخلايا الجذعية. تعتبر القوارض كنماذج حيوانية لتنكس الشبكية أساسا للأبحاث الانتقالية ، نظرا لمجموعة واسعة من السلالات التي تطور أمراض تنكس الشبكية في مراحل مختلفة. ومع ذلك ، فإن تقليد التوصيل العلاجي البشري للغرسات تحت الشبكية في القوارض يمثل تحديا ، بسبب الاختلافات التشريحية مثل حجم العدسة وحجم الجسم الزجاجي. يهدف هذا البروتوكول الجراحي إلى توفير طريقة موجهة لزرع الغرسات في الفضاء تحت الشبكية في الفئران. تم تضمين وصف شامل سهل الاستخدام للخطوات الحاسمة. تم تطوير هذا البروتوكول كإجراء جراحي فعال من حيث التكلفة للتكاثر عبر الدراسات قبل السريرية المختلفة في الفئران. مطلوب التصغير المناسب للغرسة بحجم الإنسان قبل إجراء التجربة الجراحية ، والتي تتضمن تعديلات على أبعاد الزرع. يتم استخدام نهج خارجي بدلا من الإجراء داخل الجسم الزجاجي لتوصيل الغرسة إلى الفضاء تحت الشبكية. باستخدام إبرة حادة صغيرة ، يتم إجراء شق صلبي في الربع العلوي الصدغي ، يليه بزل للنظر لتقليل ضغط العين ، وبالتالي تقليل المقاومة أثناء الزرع الجراحي. بعد ذلك ، يتم إجراء حقن محلول ملح متوازن (BSS) من خلال الشق لتحقيق انفصال الشبكية البؤري (RD). أخيرا ، يتم إدخال وتصور الغرسة في الفضاء تحت الشبكية. يشمل التقييم بعد الجراحة لموضع الغرسة تحت الشبكية التصوير عن طريق التصوير المقطعي البصري للمجال الطيفي (SD-OCT). تتأكد المتابعة التصويرية من استقرار تحت الشبكية للغرسة ، قبل حصاد العينين وتثبيتها للتحليل النسيجي.
Introduction
يعد التنكس البقعي المرتبط بالعمر (AMD) سببا رئيسيا للعمى في جميع أنحاء العالم. قدر عدد الأشخاص المصابين ب AMD في عام 2020 ب 196 مليون ، ومن المتوقع أن يرتفع هذا إلى حوالي 288 مليونا بحلول عام 20401. على مدى العقد الماضي ، تم تطوير العديد من العلاجات للتخفيف من التغيرات البصرية المرتبطة بالمراحل المتأخرة من AMD ، بشكل أساسي لعلاج تطور وتطور الأوعية الدموية المشيمية الجديدة التي لوحظت في AMD الرطب. على العكس من ذلك ، فإن علاج AMD الجاف ، حيث يتطور الخلل الوظيفي وفقدان خلايا ظهارة صبغة الشبكية (RPE) إلى RPE وضمور الشبكية ، يمثل 85٪ إلى 90٪ من AMD ، مع انتشار 0.44٪ في جميع أنحاء العالم1،2. تم وصف AMD بأنه مرض متعدد العوامل مع العمر والعوامل الوراثية والبيئية التي تساهم في ظهور المرض وتطوره. هناك العديد من العلاجات قيد التطوير لمعالجة المسارات الفيزيولوجية المرضية المختلفة المرتبطة بهذاالمرض 3.
تم تطوير العلاج القائم على الخلايا الجذعية كخيار علاجي جديد لاستبدال RPE الفاشل في AMD4 الجاف. على الرغم من أن استخدام الخلايا الجذعية متعددة القدرات لا يزال في التجارب السريرية المبكرة ، فقد تم إثبات السلامة في العديد من التجارب السريرية5،6،7. حتى الآن ، هناك طريقان رئيسيان لنشر الخلايا الجذعية في الفضاء تحت الشبكية: تعليق أو إدخال رقعة أحادية الطبقة مصنفة على غرسة متوافقةحيويا 8،9،10،11،12. تتطلب الاستراتيجيات الجديدة التي تستخدم العلاجات القائمة على الخلايا الجذعية في الدراسات قبل السريرية نماذج حيوانية حيث يمكن توصيل العلاجات القائمة على الخلايا الجذعية إلى نفس الموقع المستهدف كما هو مقصود في البشر. قد يتطلب الاختلاف في علم التشريح تغييرات طفيفة في الإجراءات والمعدات الجراحية والنهج مقارنة بتلك المستخدمة مع المنتج البشري النهائي13،14. يعد تعديل تقنيات جراحة العين أحد التغييرات المطلوبة التي تم وصفها على نطاق واسع بأنها نهج ناجح للاستخدام عبر نماذج حيوانية مختلفة15،16،17.
على الرغم من أن المنشورات السابقة قد ذكرت التقنيات الجراحية لزراعة تحت الشبكية في الفئران ، إلا أنه لا توجد أوصاف شاملة لمثل هذه التقنيات للتغلب على الصعوبات التقنية التي قد يواجهها الباحثون. لذلك ، هناك حاجة لوصف التقنيات الجراحية بشكل صحيح بالتفصيل ، وتقديم أفضل الممارسات والدروس المستفادة لتجنب المشكلات ، وإذا لزم الأمر ، معالجة المشكلات أثناء الخطوات الحرجة طوال الإجراء. الغرض من هذه المخطوطة هو توفير إرشادات شاملة للزرع الجراحي للغرسة في الفضاء تحت الشبكية في الفئران.
Protocol
تمت الموافقة على جميع التجارب من قبل اللجنة المؤسسية لرعاية واستخدام بجامعة جنوب كاليفورنيا (IACUC) وتم إجراؤها وفقا لدليل المعاهد الوطنية للصحة (NIH) لرعاية واستخدام المختبر وبيان جمعية البحوث في الرؤية وطب العيون (ARVO) لاستخدام في أبحاث طب العيون والرؤية. تم استخدام ما مجموعه 12 من ذكور الجرذان من الكلية الملكية للجراحين (RCS) في هذه الدراسة. تم تربية في منشأة وتم تضمينها في الدراسة بمجرد بلوغها سن 28 ± 1 يوم بعد الولادة. تم إجراء فحص كامل للعين للتحقق من عدم وجود تشوهات في العين. تم تصميم الغرسات تحت الشبكية ، وهي أغشية رقيقة للغاية مصنوعة من الباريلين C ومغلفة بفيتامين برونكتين ، من قبل منظمة تجارية محددة (انظر جدول المواد). تكرر هذه الأغشية أغشية بحجم الإنسان من حيث سمكها ونفاذيتها (إطار شبكي بسمك 6.0 ميكرومتر مع مسام دائرية 20 ميكرومتر في المناطق فائقة النحافة). تم تصغير الطول والعرض (1.0 مم × 0.4 مم) من أغشية بحجم الإنسان لاستيعاب الغرسات تحت الشبكية داخل عيون القوارض18.
1. رعاية والتحضير الجراحي
- قم بوزن لحساب جرعة التخدير والتخدير باتباع الخطوة 1.2.
- تخدير عن طريق الحقن داخل الصفاق لخليط من الكيتامين والزيلازين (35-50 مجم / كجم و 5-10 مجم / كجم ، على التوالي ؛ انظر جدول المواد). حقن بحقنة 1.0 مل وإبرة 30 جرام.
- قم بتحميل حقنة أخرى سعة 1.0 مل بنصف كمية خليط التخدير (الكيتامين والزيلازين) للحفاظ على المستوى المناسب من التخدير أثناء العملية.
- تأكد من التخدير الكافي من خلال عدم وجود منعكس دواسة (قرصة إصبع القدم الصلبة).
- لتصور التجويف الزجاجي وشبكية العين بشكل صحيح ، قم بتوسيع حدقة العين عن طريق تقطير قطرات العين 1٪ تروبيكاميد و 2.5٪ من قطرات العين فينيليفرين (انظر جدول المواد) في العين المعالجة.
- ضع جرعة ثانية من قطرات العين التمدد بعد 5 دقائق.
- ضع الدموع الاصطناعية أو جل زيوت التشحيم العينية في العين غير الجراحية كل 5-10 دقائق أثناء تخدير لترطيب القرنية.
- ضع ستارة معقمة فوق وسادة التدفئة (انظر جدول المواد). ضع ستارة معقمة تغطي صينية الجراحة.
- جهز المنطقة الجراحية المعقمة عن طريق وضع الأدوات المعقمة التالية على الدرج الجراحي: القفازات الجراحية ، وزرع تحت الشبكية ، والأدوات الجراحية: ملقط البعوض (3) ، مقص دقيق للجراحة المجهرية (1) ، حامل الإبرة (1) ، ملقط دقيق بأسنان (1) ، ملقط مستقيم ناعم بدون أسنان (2) ، حقنة ميكرولتر (1) ، إبرة حادة 32 جم (1) ، إبرة 27 جم أو 30 جم (2) ، 4-0 خياطة حريرية (3) ، مسحات قطنية ، محلول ملح متوازن (BSS) ، وزلة غطاء (انظر جدول المواد).
- في ظل ظروف معقمة وباستخدام قفازات معقمة ، قم بتحميل حقنة الميكرولتر ب BSS وقم بتوصيل الإبرة الحادة 32 G.
- أدخل مقايضة القطن في محور الإبرة 27 جم أو 30 جم لإنشاء مقبض لمعالجة الإبرة بشكل أكثر حساسية.
- للحفاظ على ظروف معقمة طوال الإجراء، قم بتغيير القفازات المعقمة إذا تم التلاعب بالأدوات أو المناطق غير المعقمة، مثل المجهر الجراحي.
2. نهج الصلبة لزرع تحت الشبكية: تقنية جراحية
- كشف المنطقة الجراحية باتباع الخطوات أدناه.
- بمجرد أن يخضع للتخدير ويتوسع حدقة العين (الخطوة 1.5) ، ضع جانب بطن لأسفل مع وضع الرأس باتجاه الباحث.
ملاحظة: احتفظ بالجرذ على وسادة التدفئة مغطاة بستارة معقمة أثناء الجراحة بأكملها وحتى يتعافى تماما. - ضعي قطرات بوفيدون بنسبة 5٪ (انظر جدول المواد) على العين ونظفي سطح العين والجفون بمسحات قطنية.
- ضع المجهر الجراحي واضبطه (انظر جدول المواد) فوق العين الجراحية.
ملاحظة: يوصى باستخدام مجهر العين الجراحي طوال العملية الجراحية بأكملها للحصول على تصور أكثر وضوحا وأكبر لهياكل العين. - تأكد من التعرض المناسب لمنطقة الجراحة عن طريق رفع الجفن العلوي وبرز مقلة العين باستخدام 4-0 خيوط غير قابلة للامتصاص.
- ارفع الجفن العلوي باستخدام خياطة حريرية 4-0. ضع الخيط في الجانب الأمامي من الجفون على مستوى غدد ميبوميان. قم بتأمين خياطة الجر عن طريق تثبيت ملقط البعوض على سطح الجراحة.
ملاحظة: إذا تم وضع الخيط أعلى من مستوى غدة ميبوميان ، فسيحدث انعكاس للجفن بدلا من رفع الجفن. - قم بإجراء استئصال الصفاق من الربع العلوي الصدغي باستخدام مقص دقيق جراحي مجهري.
- ضع خيوط جر للسماح بالنتوء والإزاحة الأمامية لمقلة العين. أداء عزل العضلة المستقيمة العليا.
- من خلال التلاعب اللطيف بالعين باستخدام ملقط الأسنان الدقيقة (ملقط 0.12 مم) في الجانب العلوي من الأطراف ، قم بلف العين لأسفل لفضح الصلبة.
- ضع خياطة حريرية 4-0 خلف الطرف العلوي على بعد 1 مم ، وهو موقع العضلة خارج العين العلوية. قم بتثبيت ذيل الخيط باستخدام ملقط البعوض.
- أداء عزل العضلات المستقيم الصدغي. ضع خياطة ثانية (4-0 حرير) على بعد 1 مم من الأطراف في الربع الصدغي (في المنطقة المقابلة من العضلة الصدغية خارج العين). قم بتثبيت ذيل الخيط باستخدام ملقط البعوض.
- بمجرد وضع خيوط العضلات خارج العين وتثبيتها بشكل صحيح ، اسحب الغرز لأسفل وإلى الداخل لفضح الربع العلوي الصدغي من الصلبة.
- ارفع الجفن العلوي باستخدام خياطة حريرية 4-0. ضع الخيط في الجانب الأمامي من الجفون على مستوى غدد ميبوميان. قم بتأمين خياطة الجر عن طريق تثبيت ملقط البعوض على سطح الجراحة.
- قم بتمديد الصفاق باتجاه الجزء الخلفي من العين باستخدام مقص دقيق جراحي مجهري.
- السيطرة على نزيف الملتحمة باستخدام مسحات القطن.
- بمجرد أن يخضع للتخدير ويتوسع حدقة العين (الخطوة 1.5) ، ضع جانب بطن لأسفل مع وضع الرأس باتجاه الباحث.
- قم بإجراء شق الصلبة وانفصال الشبكية (RD) وإدخال الغرسة باتباع الخطوات التالية.
- قم بإجراء شق الصلبة باستخدام إبرة 27 جم أو 30 جم. تأكد من أن حجم الشق ~ 1.2 مم وأنه 1.5 مم خلف الطياف.
ملاحظة: يوصى بتطوير تكوين شق صلبي يشبه النفق لتحقيق الاستقرار في الهياكل داخل العين أثناء التلاعب بالعين وإدخال الغرسة. سيمنع شكل الشق هذا التقلبات المفاجئة في ضغط العين. - في بعض الأحيان ، يتطلب التكوين الصحيح ممارسة. لذلك ، إذا لم يتم تحقيق التكوين الصحيح ، فقم بتحرير بعض التوتر من خيوط الجر العضلية خارج العين لتسهيل الحفاظ على هياكل العين داخل التجويف الزجاجي.
- باستخدام نفس الإبرة المستخدمة في شق الصلبة (27 جم أو 30 جم) ، قم بإجراء بزل في القرنية الطرفية في نفس الربع.
- أدخل الإبرة الحادة 32 جيجا المثبتة على حقنة ميكرولتر من خلال شق الصلبة.
- حقن 100 ميكرولتر من BSS لإنشاء RD بؤري.
- حرر خيوط الجر العضلية خارج العين لإعادة العين إلى وضعها المعتاد.
- للتصور المباشر ل RD ، استرح مع الاحتفاظ بقلة الغطاء ، المحملة بجل زيوت التشحيم للعيون ، على القرنية.
- اضبط هدف المجهر للتركيز على شبكية العين.
- إذا لم يتم ملاحظة RD أو كان صغيرا جدا (أصغر من حجم ربع واحد) ، فقم بإجراء حقنة ثانية من BSS لتحقيق حجم RD المطلوب عن طريق دحرجة العين لأسفل وإلى الداخل وتكرار الخطوات من 2.2.4 إلى 2.2.8.
- بمجرد اكتمال RD ، تحقق من طول الصلبة (كما هو مذكور في الخطوة 2.2.1) باستخدام الفرجار (انظر جدول المواد).
- قطع الأنسجة المشيمية في كلا الاتجاهين بمقص جراحي مجهري ناعم.
- مرر الإبرة الحادة جانبيا على طول الشق الصلبي للتحقق من تشريح جميع الهياكل الصلبة والمشيمية.
- أدخل الغرسة في الفراغ تحت الشبكية.
- باستخدام ملقطين جراحيين دقيقين ، مثل ملقط الربط (انظر جدول المواد) ، أمسك الغرسة من الخلف حتى لا تتلف الجزء النشط من الغرسة.
- ضع الغرسة بالتوازي مع مستوى الشق وانزلق برفق في الغرسة.
- بمجرد إدخال الغرسة بالكامل في الفضاء تحت الشبكية ، حررها ، وادفع الغرسة إلى الداخل عن طريق إدخال فكي أحد الملقط 1-1.5 مم في الشق.
- حرر خيوط الجر العضلية خارج العين وتحقق من وضع الغرسة باستخدام المجهر والغطاء كما هو موضح أعلاه (الخطوتان 2.2.7 و 2.2.8).
- قم بإجراء شق الصلبة باستخدام إبرة 27 جم أو 30 جم. تأكد من أن حجم الشق ~ 1.2 مم وأنه 1.5 مم خلف الطياف.
- حرر وقم بإزالة جميع الغرز.
ملاحظة: بعد الانتهاء من الإجراء الجراحي ، يتم إجراء SD-OCT (الخطوة 3) للتحقق من صحة النتائج السريرية. يتم إجراء جلسة التصوير SD-OCT مباشرة بعد الجراحة. إذا لم يتم الحصول على التصور المناسب لموقع الزرع ، فقم بإجراء SD-OCT مرة أخرى بعد 7-10 أيام من الجراحة.
3. تصوير SD-OCT
- انقر فوق أيقونة مستكشف العيون في هايدلبرغ (برنامج لإدارة الصور ؛ انظر جدول المواد) على شاشة سطح المكتب.
- انقر فوق أيقونة مريض جديد في الجزء العلوي من الشاشة.
- أكمل جميع المعلومات المطلوبة لإنشاء معرف وانقر فوق قبول.
- حدد نظام التصوير OCT (HRA + OCT؛ انظر جدول المواد) لنوع الجهاز.
- حدد عامل التشغيل واضغط على موافق.
- للحصول على خيار انحناء القرنية الصحيح، اضغط على الزر موافق لقبول بيانات العين الافتراضية.
- تأكد من تشغيل نافذة الاستحواذ SD-OCT وجاهزة ل SD-OCT.
- قم بتشغيل كاميرا SD-OCT بالضغط على زر البدء الأصفر الموجود على شاشة اللمس بجوار الكاميرا.
- ضع على مرحلة SD-OCT التي تم تكييفها فوق مسند الرأس SD-OCT.
ملاحظة: يتضمن تكييف المرحلة الحيوانية قطعة من رغوة البوليسترين (انظر جدول المواد) لتلائم مرحلة رأس SD-OCT الكبيرة بما يكفي لوضع عليها ، بما في ذلك وسادة التدفئة. - اضبط ارتفاع الطاولة وموضع لمحاذاة التلميذ مع مركز عدسة SD-OCT.
ملاحظة: بمجرد محاذاة العين ، ستظهر صورة حية بالأشعة تحت الحمراء (IR) على الشاشة. - اضغط إما على زر IR + OCT على شاشة اللمس أو زر OCT في أسفل يمين الشاشة لبدء الحصول على الصورة.
- بمجرد بدء تشغيل SD-OCT، حدد وضع مسح ضوئي واحد بأعلى عدد (100) من إطارات ART. وضع المسح الضوئي 100 ART هو الوضع الافتراضي.
- باستخدام عصا التحكم في الكاميرا ، قم بتوسيط العصب البصري على صورة الأشعة تحت الحمراء.
- ادفع الكاميرا للأمام حتى تمتلئ صورة الأشعة تحت الحمراء بالتساوي بصورة الشبكية.
ملاحظة: تشير الزوايا الداكنة إلى أن الكاميرا إما بعيدة جدا أو قريبة من العين. - حرك الكاميرا جانبا حتى يتم تصور الغرسة في الجانب الزمني لشبكية العين. استخدم صورة الأشعة تحت الحمراء لتوجيه الحركات.
- لتصور الغرسة بواسطة المسح B، اضغط على CTRL + ALT + SHIFT + O في نفس الوقت لعرض نافذة ضبط SD-OCT B-scan
- اضبط "الذراع المرجعي" (في الجزء السفلي من النافذة) حتى يتم تصور شبكية العين / الغرسة في صورة SD-OCT.
ملاحظة: يجب عرض صورة SD-OCT داخل الزوايا المرجعية الزرقاء. - أغلق النافذة.
- باستخدام عصا التحكم ومقبض الكاميرا ، قم بتحريك الكاميرا وتدويرها في جميع الاتجاهات حتى يتم الحصول على صورة أفضل وأكثر وضوحا بجودة SD-OCT.
- اسحب السهم الأزرق على صورة الأشعة تحت الحمراء حتى يتم وضعه على طول الغرسة.
- بمجرد أن يصبح تشبع المسح B وموضعه مثاليا ، قم بتنشيط "التتبع التلقائي في الوقت الفعلي (ART)" بالضغط على زر التحكم في الكسب الأسود أسفل شاشة اللمس.
- بمجرد أن يصل ART إلى 100 إطار، اضغط على Acquire على شاشة اللمس.
- عند الحصول على جميع الصور ، انقر فوق حفظ الصور في الجزء العلوي من النافذة ثم انقر فوق خروج.
- حافظ على رطوبة القرنية خلال جلسة التصوير بأكملها عن طريق وضع قطرات العين المزلقة بشكل متكرر (كل 5 دقائق).
4. استعادة
- في نهاية جلسة التصوير ، ضع مرهم مضاد حيوي على القرنية لمنع عدوى العين وترطيب القرنية.
- احتفظ بالحيوان مستريحا على بطنه على وسادة التدفئة حتى يتعافى تماما (~ 20-30 دقيقة) ومتنقل.
- إعطاء المسكنات الجهازية (1.0-1.2 مجم / كجم بوبرينورفين SR مرة واحدة تحت الجلد ؛ انظر جدول المواد) في نهاية العملية الجراحية.
- لا تترك دون رقابة حتى يستعيد وعيه الكافي.
- لا تعيد إلى صحبة الأخرى حتى يتعافى تماما.
- بمجرد التعافي التام ، ضع مرة أخرى في منطقة السكن مع إمكانية الوصول إلى الطعام والماء بشكل خاص.
النتائج
أظهر زرع غرسة تحت الشبكية في فئران RCS (N = 12) جدوى وقابلية استنساخ التقنية الجراحية للولادة تحت الشبكية في الفئران. في هذه الدراسة ، كانت العين اليمنى هي العين المعالجة (N = 12) مع الزرع. في التقييم السريري الذي تم إجراؤه في نهاية الإجراء باستخدام المجهر الجراحي ، أظهرت تسعة من العيون ال 12 المعالجة توطين تحت الشبكية للزرع (75.00٪) ، وتم تحديد عينين (16.67٪) على أنهما وضعان داخل الشبكية للزرع ، وفي عين واحدة (8.33٪) لم يكن التصور المباشر ممكنا بسبب عتامة الوسائط الناجمة عن نزيف تحت الشبكية في المنطقة الجراحية ، مع رؤية محدودة لكل من الزرع وهياكل الشبكية (الجدول 1). أظهرت فحوصات SD-OCT التي تم إجراؤها مباشرة بعد الإجراء الجراحي وضع تحت الشبكية أو داخل الشبكية للغرسة (10 [83.33٪] وواحد [8.33٪] ، على التوالي) (الشكل 1 أ). لم يتمكن SD-OCT من تحديد موضع الغرسة بشكل كامل تحت الشبكية في نفس (ن = 1) مع عتامة الوسائط الموضحة أعلاه (التصور المباشر غير ممكن) ، حتى بعد متابعة لمدة 10 أيام. يوضح الشكل 1 ب ، ج حيوانين مختلفين مع غرسة موضوعة بشكل صحيح في الفضاء تحت الشبكية. لم تكن هناك مضاعفات جراحية أخرى مرتبطة بالتقنية الجراحية. من خلال تلطيخ الهيماتوكسيلين والإيوسين (H & E) ، لوحظ التحقق من وضع الشبكية تحت القناة للغرسة (الشكل 1 د).
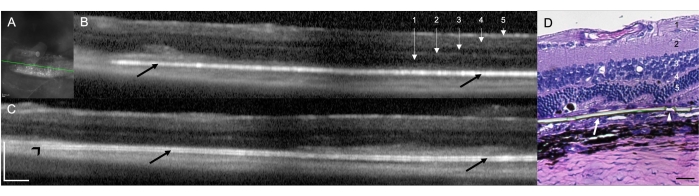
الشكل 1: التصوير المقطعي البصري للمجال الطيفي (SD-OCT) في أسبوع واحد بعد الزرع الجراحة. (أ) صورة الأشعة تحت الحمراء للغرسة تحت الشبكية. يحدد الخط الأخضر المقطع العرضي الموضح في (ب). شريط المقياس: 200 ميكرومتر (B ، C) حيوانان مختلفان مع غرسة موضوعة بشكل صحيح في الفضاء تحت الشبكية (أسهم سوداء). يشير طرف الغرسة نحو العصب البصري (رأس السهم الأسود). 1 = الألياف العصبية الشبكية / طبقة الخلايا العقدية ، 2 = طبقة الضفيرة الداخلية ، 3 = الطبقة الخارجية الداخلية ، 4 = طبقة الضفيرة الخارجية ، و 5 = الطبقة النووية الخارجية. شريط المقياس: 200 ميكرومتر (د) قسم الأنسجة ملطخ ب H & E لإثبات الزرع تحت الشبكية لغشاء الباريلين (السهم الأبيض). يظهر رأس السهم أحد المسام الدقيقة في المناطق فائقة النحافة. 1 = الألياف العصبية الشبكية / طبقة الخلايا العقدية ، 2 = طبقة الضفيرة الداخلية ، 3 = الطبقة الخارجية الداخلية ، 4 = طبقة الضفيرة الخارجية ، و 5 = الطبقة النووية الخارجية. شريط المقياس: 20 ميكرومتر. التكبير: 20x. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
| التقييم السريري | SD-أكتوبر | |||||
| موضوع | ريال | الاشعه تحت الحمراء | مجهول | ريال | الاشعه تحت الحمراء | مجهول |
| 1 | X | X | ||||
| 2 | X | X | ||||
| 3 | X | X | ||||
| 4 | X | X | ||||
| 5 | X | X | ||||
| 6 | X | X | ||||
| 7 | X | X | ||||
| 8 | X | X | ||||
| 9 | X | X | ||||
| 10 | X | X | ||||
| 11 | X | X | ||||
| 12 | X | X | ||||
| 9 | 2 | 1 | 10 | 1 | 1 | |
| 75.00% | 16.67% | 8.33% | 83.33% | 8.33% | 8.33% | |
الجدول 1: مقارنة النتائج العينية بين التقييمات السريرية وتصوير SD-OCT بين جميع. الاختصارات: SR = تحت الشبكية ، IR = داخل الشبكية ، و SD-OCT = التصوير المقطعي البصري للتماسك البصري في المجال الطيفي.
Discussion
على الرغم من أن الإجراء قد تم وصفه سابقا باختلافات طفيفة ، إلا أن نطاق هذه المخطوطة هو تقديم وصف شامل للإجراء الجراحي لزراعة تحت الشبكية في الفئران التي يجب اتباعها أثناء تعلم التقنية والتغلب على التحديات الجراحية والمضاعفات المحتملة التي قد يواجهها الباحثون. يتضمن البروتوكول الجراحي الموضح هنا استخدام غشاء الباريلين الرقيق للغاية الذي تم استخدامه على نطاق واسع في مختبرنا لعدة سنوات9،10،16،18. ومع ذلك ، فقد لوحظت قابلية تكرار التقنية باستخدام حاقنات ومواد مختلفة مزروعة في الفضاء تحت الشبكية18،19.
لا يقتصر نهج الصلبة لزرع الجهاز تحت الشبكية على العلاجات القائمة على الخلايا الجذعية. كما تم وصف إجراءات زرع الشبكية في نماذج الصغيرة20،21. في مجال التحفيز الكهربائي للشبكية ، تم استخدام هذا الإجراء الجراحي لزراعة تحت الشبكية في الفئران لأكثر من عقدمن الزمان 22. في الآونة الأخيرة ، قام Ho et al.23 بزرع مجموعة لتحفيز شبكية العين ، واستخدم Thomas et al.24 عضيات شبكية العين كمصدر للخلايا الجذعية. كما ذكرنا سابقا ، تم نشر العلاجات القائمة على الخلايا الجذعية بشكل جيد ، بما في ذلك المنشورات حول الزرع الجراحي للغرسات المتوافقة حيويا المصنفة بالخلايا الجذعية4. هناك اختلافات طفيفة في الأساليب الجراحية التي وصفها مؤلفون مختلفون ، والتي سيتم مناقشتها ومقارنتها بالتقنية الجراحية الموضحة في هذه المخطوطة.
يتطلب إغلاق الصلبة والأجهزة الجراحية مناقشات إضافية. هناك طريقتان شائعتان لإدارة شق الصلبة: (1) الإغلاق بخياطة و (2) الإغلاق بدون خياطة. يستخدم العديد من المؤلفين 10-0 نايلون لإغلاق شق الصلبة بخياطة كجزء من إجراءاتهم المعتادة23،25،26،27. ومع ذلك ، وجدت مجموعات أخرى (بما في ذلك مجموعتنا) أن خياطة النايلون 10-0 ليستمطلوبة 28. يجادل أولئك الذين يدعمون الإغلاق بالخياطة بأن الغرسة تحت الشبكية ستنزلق من شق العين إذا لم يكن هناك خياطة. كما هو موضح في قسم النتائج ، لم تجد الدراسة الحالية بثق الغرسة أو الأنسجة داخل العين في جميع أنحاء الشق. تم استخدام هذا النهج الجراحي بدون خياطة في مختبرنا بشكل روتيني وناجح9،10،12،13،16. يعتمد تبرير نهج عدم الخياطة على عاملين: أولا ، يوفر الجمع بين موقع الشق وتكوينه بنية كافية لإنشاء شق ذاتي الإغلاق. يجب أن يؤخذ في الاعتبار أن التكوين الصحيح للنفق الصلبي هو خطوة سيحققها المحققون من خلال الممارسة. ثانيا ، يزداد ضغط العين بمجرد تحرير الجر ، مما يحافظ على الغرسة في مكانها. يؤدي الضغط المتزايد داخل العين إلى دفع شبكية العين ضد الشق ، مما يجعل كلا اللوحات الصلبية قريبة من بعضها البعض وعمل شق ذاتي الإغلاق. لذلك ، ليست هناك حاجة إلى خياطة. وتجدر الإشارة إلى أن طول الشق يصل إلى 1.5 مم فقط. في الحالات التي يتطلب فيها الشق الجراحي جرحا أكبر أو إذا لم يتم تحقيق تكوين نفق صلبي مناسب ، فإن خياطة النايلون 10-0 هي حل معقول. التقنية الحالية موثوقة للغاية إذا تم استخدامها مع الأجهزة الجراحية الموصى بها. استخدم بعض المؤلفين عن طريق الحقن المخصصة لغرساتهم ، مما يعدل حجم الشق ويؤدي إلى الحاجة إلى استخدام خياطة صلبية للإغلاق المناسب25،29. ومع ذلك ، من خلال تجربتنا ، أدى استخدام مواد وحاقن مختلفة إلى زيادة طول الشق (~ 0.5 مم) 18،19. ما زلنا لم نلاحظ عدم الاستقرار أو المضاعفات المرتبطة بشق صلبي أكبر ، ولم تكن هناك حاجة إلى خياطة. ومع ذلك، يمكن اعتبار استخدام الأجهزة خارج هذه الإرشادات أثناء الإجراء قيدا لهذه التقنية.
خطوة أخرى حاسمة نادرا ما تمت الإشارة إليها في المنشورات السابقة هي بزل الرحمن لتقليل ضغط العين (IOP) قبل إنشاء RD البؤري وحقن الغرسة في الفضاء تحت الشبكية4،10،13،15. يوفر تقليل IOP تحكما أفضل في الهياكل داخل العين أثناء فصل الشبكية ويتجنب بثق المحتوى داخل العين ، مما يؤدي إلى إجراء غير ناجح. ميزة أخرى مرتبطة بالعين منخفضة التوتر هي تقليل المقاومة أثناء حقن الغرسة من خلال شق الصلبة ، مما يؤدي إلى تقليل الضرر للغرسة نفسها. من ناحية أخرى ، فإن انخفاض IOP عرضة لزيادة نزيف العين عند الشق الجراحي. تحجب كميات كبيرة من الدم عند شق الصلبة الرؤية وتزيد من خطر نقل الدم إلى الحيز تحت الشبكية أثناء الانغراس تحت الشبكية. نوصي بالسيطرة على النزيف باستخدام مقايضات القطن و BSS لتنظيف المنطقة وتجنب المضاعفات الجراحية.
من الجدير بالذكر أن حجم RD مهم لوضع الغرسة بشكل صحيح في الفضاء تحت الشبكية. على عكس النماذج الحيوانية الأخرى والبشر5،14،30 ، نظرا لأن هذا النهج الصلبي لا يوفر تصورا مباشرا للمساحة تحت الشبكية ، فمن الصعب إنشاء RD بؤري. لتوفير مساحة كافية لنشر الغرسة برفق في الفضاء تحت الشبكية دون وضعها خارج هذه المنطقة ، فإن التوصية هي حقن 100 ميكرولتر من BSS. تستند هذه التوصية إلى توليد RD من ربع واحد على الأقل من شبكية العين. إذا تم إنشاء RD أصغر من ربع واحد على الأقل من شبكية العين ، حقن الغرسة بشكل غير صحيح في الفضاء داخل الجسم الزجاجي أو داخل الشبكية أو فوق الشبكية. كما هو موضح في جميع أنحاء البروتوكول ، إذا لوحظ RD صغير ، يوصى بتكرار الخطوات 2.2.4 إلى 2.2.8 حتى يتم تحقيق RD المطلوب.
قد تحدث معظم المضاعفات الجراحية والخطوات الحرجة التي تمت مناقشتها في المخطوطة أثناء منحنى التعلم ، مما قد يضر بنجاح عملية زرع تحت الشبكية. يتضمن منحنى التعلم هذا أيضا مقدار الوقت الذي تبقى فيه تحت التخدير ومستوى الجفاف. يمكن أن يؤدي وقت التخدير الأطول والتخدير والجفاف إلى مضاعفات جفاف العين ، مثل تغيرات القرنية والعدسة والصلبة31. بالإضافة إلى ذلك ، ارتبطت التخدير ، مثل الكيتامين والزيلازين ، بعتامة الوسائط في القرنية والعدسة جنبا إلى جنب مع التغييرات في تكوين الفكاهة المائية32. يعالج استخدام قطرات العين المزلقة (BSS) على العين الجراحية طوال فترة التخدير هذه المضاعفات. باختصار ، من المفترض أن تستخدم المنهجية الموضحة في هذه المخطوطة كتوصية جراحية في تطوير العلاجات تحت الشبكية في عيون الفئران.
Disclosures
M.S.H. و D.R.H. و JL هم مؤسسون مشاركون ومستشارون لشركة Regenerative Patch Technologies (RPT). يشهد المؤلفون الآخرون بأنه ليس لديهم أي انتماءات أو مشاركة في أي منظمة أو كيان له أي مصلحة مالية أو غير مالية في الموضوع أو المواد التي تمت مناقشتها في هذه المخطوطة.
Acknowledgements
تم دعم هذه الدراسة من قبل CIRM DT3 (MSH) والبحث لمنع العمى (معهد USC Roski Eye Institute). نود أن نشكر فرناندو غالاردو والدكتور يينغ ليو على مساعدتهما الفنية.
لم يكن للراعي أي دور في تصميم أو إجراء هذا البحث.
Materials
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | VWR | BD309659 | |
| 27 G needle 1/2'' | VWR | BD305109 | |
| 30 G needle 1/2'' | VWR | BD305106 | |
| 32 G Blunt needle - Small hub RN | Hamilton | 7803-04 | |
| 4-0 Perma Hand silk black 1X18" PC-5 | Ethicon | 1984G | |
| 6'' sterile cotton tips | VWR | 10805-154 | |
| Betadine 5% sterile ophthalmic prep solution | Alcon | 8007-1 | |
| BSS irrigating solution 15 mL | Accutome | Ax17362 | |
| Buprenorphine ER | ZooPharm | N/A | |
| Castroviejo Caliper | Storz | E2405 | |
| Castroviejo suturing forceps 0.12 mm | Storz | E1796 | |
| Clayman-Vannas scissors straight | Storz | E3383S | |
| Cover glass, square | WVR | 48366-227 | |
| EPS Polystyrene block | Silverlake LLC | CFB8x12x2 | |
| Gonak 15 mL | Accutome | Ax10968 | Eye lubricant |
| Halstead straight hemostatic mosquito forceps non-magnetic | Storz | E6772 | |
| Hamilton syringe 700 series 100 µL | Hamilton | 7638-01 | |
| HEYEX Software | Heidelberg | N/A | an image management software |
| Kelman-McPherson tying forceps angled | Storz | E1815 AKUS | |
| Ketamine (100 mg/mL) | MWI | 501072 | |
| Needle holder 9mm curved fine locking | Storz | 3-302 | |
| Neomycin/Polymyxin B sulfactes/Bacitracin zinc ointment 3.5 g | Accutome | Ax0720 | |
| Ophthalmic surgical microscope | Zeiss | SN: 233922 | |
| Phenylephrine 2.5% 15 mL | Accutome | Ax0310 | |
| Spectralis SD-OCT | Heidelberg | SPEC-CAM-011210s3600 | |
| Sterile Drape | VWR | 100229-300 | |
| Sterile surgical gloves | VWR | 89233-804 | |
| T-Pump heating system | Gaymar | TP650 | |
| Tropicamide 1% 15 mL | Accutome | Ax0330 | |
| Ultrathin membranes made from Parylene C and coated with vitronectin | Mini Pumps LLC, CA | specifically designed for this study | used as subretinal implants |
| Xylazine (100 mg/mL) | MWI | 510650 |
References
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Global Health. 2 (2), 106-116 (2014).
- Schultz, N. M., Bhardwaj, S., Barclay, C., Gaspar, L., Schwartz, J. Global burden of dry age-related macular degeneration: a targeted literature review. Clinical Therapeutics. 43 (10), 1792-1818 (2021).
- Deng, Y., et al. Age-related macular degeneration: Epidemiology, genetics, pathophysiology, diagnosis, and targeted therapy. Genes & Diseases. 9 (1), 62-79 (2021).
- Nazari, H., et al. Stem cell-based therapies for age-related macular degeneration: The promises and the challenges. Progress in Retinal and Eye Research. 48, 1-39 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- Kashani, A. H., et al. Survival of an HLA-mismatched, bioengineered RPE implant in dry age-related macular degeneration. Stem Cell Reports. 17 (3), 448-458 (2022).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Da Cruz, L., Chen, F. K., Ahmado, A., Greenwood, J., Coffey, P. RPE transplantation and its role in retinal disease. Progress in Retinal and Eye Research. 26 (6), 598-635 (2017).
- Hu, Y., et al. A novel approach for subretinal implantation of ultrathin substrates containing stem cell-derived retinal pigment epithelium monolayer. Ophthalmic Research. 48 (4), 186-191 (2012).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: improved survival when implanted as a monolayer. Investigative Ophthalmology & Visual Science. 54 (7), 5087-5096 (2013).
- Antognazza, M. R., et al. Characterization of a polymer-based, fully organic prosthesis for implantation into the subretinal space of the rat. Advanced Healthcare Materials. 5 (17), 2271-2282 (2016).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286 (2021).
- Thomas, B. B., et al. A new immunodeficient retinal dystrophic rat model for transplantation studies using human-derived cells. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (11), 2113-2125 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatán minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology. 254 (8), 1553-1565 (2016).
- Yu, W., et al. Biocompatibility of subretinal parylene-based Ti/Pt microelectrode array in rabbit for further artificial vision studies. Journal of Ocular Biology, Diseases, and Informatics. 2 (1), 33-36 (2009).
- Thomas, B. B., et al. Survival and functionality of hESC-derived retinal pigment epithelium cells cultured as a monolayer on polymer substrates transplanted in RCS rats. Investigative Ophthalmology & Visual Science. 57 (6), 2877-2887 (2016).
- Adekunle, A. N., et al. Integration of perforated subretinal prostheses with retinal tissue. Translational Vision Science & Technology. 4 (4), 5 (2015).
- Lu, B., et al. Semipermeable parylene membrane as an artificial Bruch's membrane. 2011 16th International Solid-State Sensors, Actuators and Microsystems Conference. IEEE. , 950-953 (2011).
- Hu, Y., et al. Subretinal implantation of gelatin films with stem cells derived RPE in rats. Investigative Ophthalmology & Visual Science. 54 (15), 1763 (2013).
- Aramant, R. B., Seiler, M. J. Retinal transplantation-advantages of intact fetal sheets. Progress in Retinal and Eye Research. 21 (1), 57-73 (2002).
- Peng, Q., et al. Structure and function of embryonic rat retinal sheet transplants. Current Eye Research. 32 (9), 781-789 (2007).
- Pardue, M. T., et al. Neuroprotective effect of subretinal implants in the RCS rat. Investigative Ophthalmology & Visual Science. 46 (2), 674-682 (2005).
- Ho, E., et al. Characteristics of prosthetic vision in rats with subretinal flat and pillar electrode arrays. Journal of Neural Engineering. 16 (6), 066027 (2019).
- Thomas, B. B., et al. Co-grafts of human embryonic stem cell derived retina organoids and retinal pigment epithelium for retinal reconstruction in immunodeficient retinal degenerate Royal College of Surgeons rats. Frontiers in Neuroscience. 15, 752958 (2021).
- Seiler, M. J., et al. Vision recovery and connectivity by fetal retinal sheet transplantation in an immunodeficient retinal degenerate rat model. Investigative Ophthalmology & Visual Science. 58 (1), 614-630 (2017).
- McLelland, B. T., et al. Transplanted hESC-derived retina organoid sheets differentiate, integrate, and improve visual function in retinal degenerate rats. Investigative Ophthalmology & Visual Science. 59 (6), 2586-2603 (2018).
- Lin, B., McLelland, B. T., Mathur, A., Aramant, R. B., Seiler, M. J. Sheets of human retinal progenitor transplants improve vision in rats with severe retinal degeneration. Experimental Eye Research. 174, 13-28 (2018).
- Matsuo, T., Hosoya, O., Tsutsui, K. M., Uchida, T. Behavior tests and immunohistochemical retinal response analyses in RCS rats with subretinal implantation of Okayama-University-type retinal prosthesis. Journal of Artificial Organs. 16 (3), 343-351 (2013).
- Seiler, M. J., et al. A new immunodeficient pigmented retinal degenerate rat strain to study transplantation of human cells without immunosuppression. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (7), 1079-1092 (2014).
- Stanzel, B. V. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Fabian, R. J., Bond, J. M., Drobeck, H. P. Induced corneal opacities in the rat. The British Journal of Ophthalmology. 51 (2), 124-129 (1976).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Experimental Eye Research. 42 (4), 331-337 (1986).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved