Method Article
쥐의 망막하 임플란트를 위한 수술 기법 개발
요약
본 프로토콜은 연구에서 망막 질환의 동물 모델에서 구현하기 위한 실현 가능한 수술 기술인 망막하 장치 이식을 위한 공막 접근법을 설명합니다.
초록
노화 관련 황반변성(AMD)과 같은 망막 변성은 전 세계적으로 실명의 주요 원인입니다. 줄기세포 기반 치료법을 포함하여 AMD를 위한 재생 의학 기반 치료법을 개발하기 위해 수많은 접근 방식이 수행되었습니다. 망막 변성에 대한 동물 모델로서의 설치류는 다양한 단계에서 망막 변성 질환을 발병시키는 광범위한 균주로 인해 중개 연구의 기초가 됩니다. 그러나 설치류에서 망막하 보형물의 인간 치료 전달을 모방하는 것은 수정체 크기 및 유리체 부피와 같은 해부학적 차이로 인해 어렵습니다. 이 수술 프로토콜은 쥐의 망막하 공간에 임플란트를 이식하기 위한 안내 방법을 제공하는 것을 목표로 합니다. 중요한 단계에 대한 사용자 친화적이고 포괄적인 설명이 포함되어 있습니다. 이 프로토콜은 쥐를 대상으로 한 다양한 전임상 연구에서 재현성을 위한 비용 효율적인 수술 절차로 개발되었습니다. 수술 실험을 수행하기 전에 인간 크기의 임플란트를 적절하게 소형화해야 하며, 여기에는 임플란트의 치수 조정이 포함됩니다. 임플란트를 망막하 공간으로 전달하기 위해 유리체강내 절차 대신 외부 접근법이 사용됩니다. 작고 날카로운 바늘을 사용하여 측두상사분면(측두상사분면)에서 공막 절개를 시행한 후 주위천자를 실시하여 안압을 낮추어 외과적 이식 중 저항을 최소화합니다. 다음으로, 국소 망막 박리(RD)를 달성하기 위해 절개 부위를 통한 균형 잡힌 염 용액(BSS) 주입을 수행합니다. 마지막으로, 임플란트를 망막하 공간에 삽입하고 시각화합니다. 임플란트의 망막하 배치에 대한 수술 후 평가에는 스펙트럼 영역 광간섭 단층촬영(SD-OCT)에 의한 이미징이 포함됩니다. 영상 후속 조치는 조직학적 분석을 위해 눈을 적출하고 고정하기 전에 임플란트의 망막하 안정성을 확인합니다.
서문
노화 관련 황반변성(AMD)은 전 세계적으로 실명의 주요 원인입니다. 2020년 AMD에 감염된 사람의 수는 1억 9,600만 명으로 추산되었으며, 2040년에는 약 2억 8,800만 명으로 증가할 것으로 예상됩니다1. 지난 10년 동안 AMD의 말기와 관련된 시각적 변화를 완화하기 위해 여러 치료법이 개발되었으며, 주로 습성 AMD에서 관찰되는 맥락막 신생혈관의 발달 및 진행을 치료하기 위해 개발되었습니다. 반대로, 기능 장애 및 망막 색소 상피(RPE) 세포의 손실이 RPE 및 망막 위축으로 진행되는 건성 AMD의 치료는 AMD의 85%에서 90%를 차지하는 것으로 추정되며, 전 세계적으로 0.44%의 유병률을 보이고 있습니다 1,2. AMD는 질병의 발병과 진행에 기여하는 연령, 유전적 및 환경적 요인이 있는 다인성 질환으로 설명되었습니다. 이 질병과 관련된 다양한 병태생리학적 경로를 해결하기 위해 여러 치료법이 개발 중에 있습니다3.
줄기세포 기반 치료법은 건성 AMD4에서 실패한 RPE를 대체할 수 있는 새로운 치료 옵션으로 개발되었습니다. 만능 줄기세포의 사용은 아직 초기 임상 시험에 있지만 여러 임상 시험에서 안전성이 입증되었습니다 5,6,7. 현재까지 줄기세포를 망막하 공간으로 배치하는 두 가지 주요 경로가 있습니다: 현탁액 또는 생체적합성 임플란트에 파종된 단층 패치 삽입 8,9,10,11,12. 전임상 연구에서 줄기세포 기반 치료법을 사용하는 새로운 전략은 줄기세포 기반 치료법이 인간에서 의도한 것과 동일한 표적 부위에 전달될 수 있는 동물 모델을 필요로 합니다. 해부학적 구조상의 차이로 인해 최종 인체 산물에 사용된 것과 비교하여 절차, 수술 장비 및 접근 방식에 약간의 변경이 필요할 수 있습니다13,14. 안구 수술 기법을 수정하는 것은 필요한 변화 중 하나이며, 다양한 동물 모델에서 사용하기 위한 성공적인 접근법으로 널리 설명되어 왔다 15,16,17.
이전 간행물에서는 쥐의 망막하 임플란트에 대한 수술 기법을 언급했지만, 연구자들이 직면할 수 있는 기술적 어려움을 극복하기 위한 이러한 기술에 대한 포괄적인 설명은 없습니다. 따라서 수술 기법을 자세히 적절하게 설명하고, 피해야 할 모범 사례와 교훈을 제공하고, 필요한 경우 시술 전반에 걸쳐 중요한 단계에서 문제를 해결해야 합니다. 이 원고의 목적은 쥐의 망막하 공간에 임플란트를 외과적으로 이식하기 위한 포괄적인 지침을 제공하는 것입니다.
프로토콜
모든 실험은 서던캘리포니아대학교 기관 동물 관리 및 사용 위원회(IACUC)의 승인을 받았으며 미국 국립보건원(NIH)의 실험실 동물 관리 및 사용 가이드와 시력 및 안과 연구 협회(ARVO)의 안과 및 시력 연구에서의 동물 사용에 대한 성명에 따라 수행되었습니다. 본 연구에는 총 12마리의 RCS(Royal College of Surgeon) 수컷 쥐가 사용되었습니다. 동물은 동물 시설에서 사육되었으며 출생 후 1일 ± 28세가 되면 연구에 포함되었습니다. 눈의 이상이 없는지 확인하기 위해 완전한 시력 검사를 수행했습니다. Parylene C로 만들고 vitronectin으로 코팅된 초박막인 망막하 임플란트는 특정 상업 조직에 의해 설계되었습니다( 재료 표 참조). 이 멤브레인은 두께와 투과성 측면에서 인간 크기의 멤브레인을 복제합니다(초박형 영역에 20μm 원형 기공이 있는 6.0μm 두께의 메쉬 프레임). 설치류 눈 내부의 망막하 임플란트를 수용하기 위해 인간 크기의 막으로부터 길이와 너비(1.0mm× 0.4mm)를 소형화하는 것이 달성되었다18.
1. 동물 관리 및 수술 준비
- 마취 용량을 계산하기 위해 동물의 무게를 측정하고 1.2 단계에 따라 마취합니다.
- 케타민과 자일라진(각각 35-50mg/kg 및 5-10mg/kg)의 혼합물을 복강내 주사하여 동물을 마취 합니다. 1.0mL 주사기와 30G 바늘로 주사합니다.
- 시술 중 적절한 마취 수준을 유지하기 위해 마취제(케타민 및 자일라진) 혼합물의 절반을 1.0mL 주사기에 더 로드합니다.
- 페달 반사(단단한 발가락 꼬집음)가 없는 경우 적절한 마취를 확인하십시오.
- 유리강과 망막을 적절하게 시각화하려면 처리된 눈에 1%의 트로피카마이드와 2.5%의 페닐에프린 점안액( 재료 표 참조)을 점안하여 동공을 확장시킵니다.
- 5분 후에 확장 점안액을 두 번째 바르십시오.
- 각막에 수분을 공급하기 위해 동물이 마취되는 동안 5-10분마다 비수술적 눈에 인공 눈물 또는 안구 윤활제 젤을 바르십시오.
- 가열 패드 위에 멸균 드레이프를 놓습니다( 재료 표 참조). 수술 트레이를 덮는 멸균 드레이프를 놓습니다.
- 수술 트레이에 다음 멸균 기구를 놓아 멸균 부위를 준비합니다: 수술용 장갑, 망막하 임플란트 및 수술 도구: 모기 집게(3), 미세 수술용 미세 가위(1), 바늘 홀더(1), 이빨이 있는 가는 집게(1), 이빨이 없는 가는 직선 집게(2), 마이크로리터 주사기(1), 32G 무딘 바늘(1), 27G 또는 30G 바늘(2), 4-0 실크 봉합사(3), 면봉, 균형 잡힌 소금 용액(BSS) 및 커버 슬립( 재료표 참조).
- 멸균 상태에서 멸균 장갑을 사용하여 마이크로리터 주사기에 BSS를 넣고 32G의 뭉툭한 바늘을 부착합니다.
- 면 스왑을 27G 또는 30G 바늘 허브에 삽입하여 바늘을 보다 민감하게 조작할 수 있는 손잡이를 만듭니다.
- 시술 내내 멸균 상태를 유지하려면 비멸균 기구 또는 수술용 현미경과 같은 영역을 조작하는 경우 멸균 장갑을 교체하십시오.
2. 망막하 이식을 위한 공막 접근법: 수술 기법
- 아래 단계에 따라 수술 부위를 노출시킵니다.
- 동물이 마취되고 동공이 확장되면(1.5단계) 동물의 배가 아래로 향하게 하고 머리가 연구원을 향하도록 놓습니다.
알림: 전체 수술 동안 그리고 동물이 완전히 회복될 때까지 멸균 드레이프로 덮인 가열 패드에 쥐를 보관하십시오. - 포비돈 5방울( 재료 표 참조)을 눈에 바르고 면봉으로 눈 표면과 눈꺼풀을 닦습니다.
- 수술용 현미경( 재료 표 참조)을 수술용 눈 위에 놓고 조정합니다.
참고: 안구 구조를 더 선명하고 크게 시각화하기 위해 전체 수술 과정에서 외과용 안과 현미경을 사용하는 것이 좋습니다. - 4-0 비흡수성 봉합사를 사용하여 상안꺼풀을 들어 올리고 안구를 돌출시켜 수술 부위가 적절하게 노출되도록 합니다.
- 4-0 실크 봉합사를 사용하여 우수한 눈꺼풀을 들어 올립니다. 눈꺼풀의 앞쪽에 마이봄샘 수준의 눈꺼풀 앞쪽에 봉합사를 놓습니다. 모기 집게를 수술 표면에 고정하여 견인 봉합사를 고정합니다.
참고: 봉합사를 마이봄샘 수준보다 높게 배치하면 눈꺼풀 높이 대신 눈꺼풀의 외전이 발생합니다. - 미세수술용 가위를 사용하여 측두상사분면의 복막절개술을 수행합니다.
- 안구의 돌출과 전방 변위를 허용하기 위해 두 개의 견인 봉합사를 배치합니다. 상직근을 분리합니다.
- 윤부의 상부에 있는 미세한 이빨 집게(0.12mm 집게)로 눈을 부드럽게 조작하여 눈을 아래로 굴려 공막을 노출시킵니다.
- 상안구 근육의 위치인 상변림 뒤에 최대 1mm 떨어진 곳에 4-0 실크 봉합사를 놓습니다. 모기 집게를 사용하여 봉합사의 양쪽 꼬리를 고정합니다.
- 측두직근 격리를 수행합니다. 측두사분면(측두엽 안구 근육의 해당 영역)의 변연계에서 최대 1mm 떨어진 곳에 두 번째 봉합사(4-0 실크)를 배치합니다. 모기 집게를 사용하여 봉합사의 양쪽 꼬리를 고정합니다.
- 두 안구 외 근육 봉합사가 적절하게 배치되고 고정되면 봉합사를 아래와 안쪽으로 당겨 공막의 측두부 상사분면을 노출시킵니다.
- 4-0 실크 봉합사를 사용하여 우수한 눈꺼풀을 들어 올립니다. 눈꺼풀의 앞쪽에 마이봄샘 수준의 눈꺼풀 앞쪽에 봉합사를 놓습니다. 모기 집게를 수술 표면에 고정하여 견인 봉합사를 고정합니다.
- 미세수술용 가위로 주위(peritomy)를 눈 뒤쪽으로 연장합니다.
- 면봉을 사용하여 결막 출혈을 조절합니다.
- 동물이 마취되고 동공이 확장되면(1.5단계) 동물의 배가 아래로 향하게 하고 머리가 연구원을 향하도록 놓습니다.
- 아래 단계에 따라 공막 절개, 망막 박리(RD) 및 임플란트 삽입을 수행합니다.
- 27G 또는 30G 바늘을 사용하여 공막 절개를 수행합니다. 절개 부위의 크기가 ~1.2mm이고 변연 뒤쪽 1.5mm인지 확인합니다.
참고: 터널과 같은 공막 절개 구성의 개발은 눈을 조작하고 임플란트를 삽입하는 동안 안구 구조를 안정화하기 위해 권장됩니다. 이 절개 모양은 안압의 급격한 변동을 방지합니다. - 때로는 적절한 구성을 위해 연습이 필요합니다. 따라서 적절한 구성이 이루어지지 않으면 안구 외 근육 견인 봉합사에서 약간의 긴장을 풀어 안구 구조를 유리체 강 내부에 유지하는 데 도움이 됩니다.
- 공막 절개에 사용된 것과 동일한 바늘(27G 또는 30G)을 사용하여 같은 사분면의 말초 각막에서 천자를 수행합니다.
- 마이크로리터 주사기에 장착된 32G의 뭉툭한 바늘을 공막 절개 부위를 통해 삽입합니다.
- 100μL의 BSS를 주입하여 초점 RD를 생성합니다.
- 안구 외 근육 견인 봉합사를 풀어 눈을 정상적인 위치로 되돌립니다.
- RD를 직접 시각화하려면 안과용 윤활제 젤이 로드된 커버 슬립을 각막에 놓고 고정합니다.
- 현미경 대물렌즈를 조정하여 망막에 초점을 맞춥니다.
- RD가 관찰되지 않거나 너무 작으면(한 사분면의 크기보다 작음) 눈을 아래와 안쪽으로 굴리고 2.2.4에서 2.2.8 단계를 반복하여 원하는 RD 크기를 얻기 위해 BSS를 두 번째 주입합니다.
- RD가 완료되면 캘리퍼로 공막 길이(2.2.1단계에서 언급)를 확인합니다( 재료 표 참조).
- 미세한 미세 수술 용 가위로 맥락막 조직을 양방향으로 자릅니다.
- 공막 절개 부위를 따라 뭉툭한 바늘을 옆으로 움직여 모든 공막 및 맥락막 구조가 절개되었는지 확인합니다.
- 임플란트를 망막하 공간에 삽입합니다.
- 겸자를 묶는 것과 같은 두 개의 미세한 수술용 겸자( 재료 표 참조)를 사용하여 임플란트의 활성 부분이 손상되지 않도록 뒤쪽에서 임플란트를 잡습니다.
- 임플란트를 절개면과 평행하게 놓고 임플란트를 부드럽게 밀어 넣습니다.
- 임플란트가 망막하 공간에 완전히 삽입되면 임플란트를 풀고 집게 중 하나의 턱을 절개 부위에 1-1.5mm 삽입하여 임플란트를 더 밀어 넣습니다.
- 안구 외 근육 견인 봉합사를 풀고 위에서 설명한 대로 현미경과 커버슬립을 사용하여 임플란트의 위치를 확인합니다(2.2.7 및 2.2.8 단계).
- 27G 또는 30G 바늘을 사용하여 공막 절개를 수행합니다. 절개 부위의 크기가 ~1.2mm이고 변연 뒤쪽 1.5mm인지 확인합니다.
- 모든 봉합사를 풀고 제거합니다.
참고: 수술 절차를 마친 후 임상 소견을 검증하기 위해 SD-OCT를 수행합니다(3단계). SD-OCT 이미징 세션은 수술 직후에 진행됩니다. 임플란트 위치에 대한 적절한 시각화를 얻지 못한 경우 수술 후 7-10일 후에 SD-OCT를 다시 실시하십시오.
3. SD-OCT 이미징
- 바탕 화면에서 Heidelberg Eye Explorer 아이콘(이미지 관리 소프트웨어, 재료 표 참조)을 클릭합니다.
- 화면 상단에 있는 New Patient(새 환자 ) 아이콘을 클릭합니다.
- 동물 ID를 생성하는 데 요청된 모든 정보를 입력하고 수락을 클릭합니다.
- 장치 유형에 대한 OCT 이미징 시스템(HRA + OCT, 재료 표 참조)을 선택합니다.
- 연산자를 선택하고 OK를 누릅니다.
- 올바른 각막 곡률 옵션을 위해 OK 버튼을 눌러 기본 눈 데이터를 수락합니다.
- SD-OCT 획득 창이 시작되고 SD-OCT를 수행할 준비가 되었는지 확인합니다.
- 카메라 옆의 터치스크린 디스플레이에 있는 노란색 시작 버튼을 눌러 SD-OCT 카메라를 켭니다.
- SD-OCT 머리 받침 위에 개조된 SD-OCT 동물 스테이지에 동물을 놓습니다.
참고: 동물 단계 적응에는 발열 패드를 포함하여 동물을 놓을 수 있을 만큼 충분히 큰 SD-OCT 헤드 스테이지에 맞는 폴리스티렌 폼 조각( 재료 표 참조)이 포함됩니다. - 테이블 높이와 동물의 위치를 조정하여 동공을 SD-OCT 렌즈의 중앙에 정렬합니다.
알림: 눈이 정렬되면 적외선(IR) 라이브 이미지가 화면에 나타납니다. - 터치 스크린의 IR + OCT 버튼 또는 모니터 오른쪽 하단의 OCT 버튼을 눌러 이미지 획득을 시작합니다.
- SD-OCT가 가동되면 ART 프레임 수(100)가 가장 높은 단일 스캔 모드를 선택합니다. 100 ART 스캔 모드가 기본 모드입니다.
- 카메라 조이스틱을 사용하여 시신경을 IR 이미지의 중앙에 놓습니다.
- IR 이미지가 망막 이미지로 균일하게 채워질 때까지 카메라를 앞으로 밉니다.
참고: 어두운 모서리는 카메라가 눈에 너무 멀거나 가깝다는 것을 나타냅니다. - 임플란트가 망막의 시간적 측면에서 시각화될 때까지 카메라를 옆으로 움직입니다. IR 이미지를 사용하여 움직임을 안내합니다.
- B-스캔으로 임플란트를 시각화하려면 CTRL + ALT + SHIFT + O 를 동시에 눌러 SD-OCT B-스캔 조정 창을 표시합니다.
- 망막/임플란트가 SD-OCT 이미지에서 시각화될 때까지 "Reference Arm"(창 하단)을 조정합니다.
참고: SD-OCT 이미지는 파란색 참조 모서리 내에 표시되어야 합니다. - 창을 닫습니다.
- 조이스틱과 카메라 핸들을 사용하여 더 좋고 평평하며 선명한 SD-OCT 품질의 이미지를 얻을 때까지 카메라를 모든 방향으로 밀고 회전합니다.
- IR 이미지가 임플란트를 따라 배치될 때까지 IR 이미지의 파란색 화살표를 드래그합니다.
- B-스캔의 채도와 위치가 최적화되면 터치 스크린 아래의 검은색 게인 제어 버튼을 눌러 "자동 실시간 추적(ART)"을 활성화합니다.
- ART가 100프레임에 도달하면 터치 스크린에서 Acquire 를 누릅니다.
- 모든 이미지를 획득했으면 창 상단의 Save Images(이미지 저장 )를 클릭한 다음 Exit(종료)를 클릭합니다.
- 전체 이미징 세션 동안 윤활제 점안액을 자주(5분마다) 적용하여 각막을 촉촉하게 유지하십시오.
4. 동물 회복
- 영상 촬영이 끝나면 각막에 항생제 연고를 발라 안구 감염을 예방하고 각막에 수분을 공급합니다.
- 완전히 회복되고(~20-30분) 보행할 수 있을 때까지 동물을 가열 패드에 엎드려 쉬게 합니다.
- 수술 절차가 끝날 때 전신 진통제(피하 시 1.0-1.2mg/kg 부프레노르핀 SR, 재료표 참조)를 투여합니다.
- 동물이 충분한 의식을 회복할 때까지 동물을 방치하지 마십시오.
- 완전히 회복될 때까지 동물을 다른 동물과 함께 반납하지 마십시오.
- 완전히 회복되면 동물을 먹이 와 물을 자유롭게 이용할 수 있는 수용 구역으로 다시 눕힙니다.
결과
RCS 쥐(N=12)에 대한 망막하 임플란트 이식은 쥐의 망막하 전달을 위한 수술 기술의 타당성과 재현성을 입증했습니다. 이 연구에서 오른쪽 눈은 임플란트로 치료된 눈(N = 12)이었습니다. 수술 현미경을 사용하여 시술 종료 후 실시한 임상 평가에서 치료된 12개의 눈 중 9개의 눈에서 임플란트의 망막하 국소화가 확인되었고(75.00%), 2개의 눈(16.67%)이 임플란트의 망막 내 배치로 확인되었으며, 한쪽 눈(8.33%)에서는 수술 부위의 망막하 출혈로 인한 매체 혼탁으로 인해 직접 시각화가 불가능했습니다. 임플란트와 망막 구조 모두에 대한 제한된 견해를 가지고 있습니다(표 1). 수술 직후 수행된 SD-OCT 스캔은 임플란트의 망막하 또는 망막내 위치를 보여주었습니다(각각 10개[83.33%] 및 1개[8.33%)(그림 1A). SD-OCT는 10일의 추적 관찰 후에도 위에서 설명한 매체 불투명도(직접 시각화 불가능)로 동일한 동물(n = 1)에서 임플란트의 망막하 배치를 완전히 식별할 수 없었습니다. 그림 1B,C는 망막하 공간에 적절하게 배치된 임플란트를 가진 두 개의 다른 동물을 보여줍니다. 수술 기법과 관련된 다른 수술 합병증은 없었다. Hematoxylin 및 Eosin(H&E) 염색을 통해 임플란트의 망막하 배치에 대한 검증이 관찰되었습니다(그림 1D).
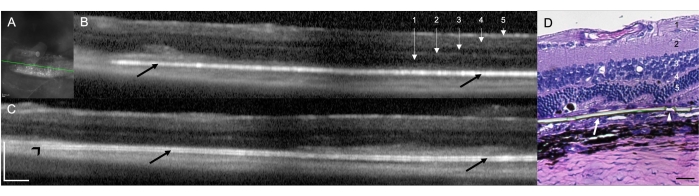
그림 1: 수술 후 1주일 후 스펙트럼 영역 광간섭 단층촬영(SD-OCT) 스캔.(A) 망막하 임플란트의 적외선 이미지. 녹색 선은 (B)에 표시된 단면을 구분합니다. 눈금자: 200 μm. (B,C) 망막하 공간(검은색 화살표)에 임플란트가 적절하게 배치된 두 마리의 다른 동물. 임플란트의 끝은 시신경(검은색 화살촉)을 가리킵니다. 1 = 망막 신경 섬유/신경절 세포층, 2 = 내망상층, 3 = 내외층, 4 = 외망상층, 5 = 외핵층. 스케일 바: 200μm. (D) 파릴렌 막의 망막하 이식을 보여주기 위해 H&E로 염색된 조직학 섹션(흰색 화살표). 화살촉은 초박형 영역의 미세 기공 중 하나를 보여줍니다. 1 = 망막 신경 섬유/신경절 세포층, 2 = 내망상층, 3 = 내외층, 4 = 외망상층, 5 = 외핵층. 눈금 막대 : 20 μm. 배율 : 20x. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 임상 평가 | SD-10월 | |||||
| 제목 | 시리얼 | 적외선(IR | 알려지지 않은 | 시리얼 | 적외선(IR | 알려지지 않은 |
| 1 | X | X | ||||
| 2 | X | X | ||||
| 3 | X | X | ||||
| 4 | X | X | ||||
| 5 | X | X | ||||
| 6 | X | X | ||||
| 7 | X | X | ||||
| 8 | X | X | ||||
| 9 | X | X | ||||
| 10 | X | X | ||||
| 11 | X | X | ||||
| 12 | X | X | ||||
| 9 | 2 | 1 | 10 | 1 | 1 | |
| 75.00% | 16.67% | 8.33% | 83.33% | 8.33% | 8.33% | |
표 1: 모든 동물을 대상으로 한 임상 평가와 SD-OCT 영상 간의 안구 소견 비교. 약어: SR = 망막하, IR = 망막내, SD-OCT = 스펙트럼 도메인 광간섭 단층 촬영.
토론
이 절차는 이전에 약간의 변형이 있었지만 이 원고의 범위는 기술을 배우는 동안 따라야 할 쥐의 망막하 임플란트에 대한 수술 절차에 대한 포괄적인 설명을 제공하고 연구자가 직면할 수 있는 수술적 어려움과 잠재적 합병증을 극복하는 것입니다. 여기에 설명된 수술 프로토콜에는 수년 동안 우리 실험실에서 널리 사용되어 온 초박형 파릴렌 멤브레인의 사용이 포함됩니다 9,10,16,18. 그러나, 망막하 공간에 이식된 다른 주사기와 재료를 사용하는 기술의 재현성이 관찰되었습니다18,19.
망막하 장치 이식을 위한 공막 접근법은 줄기 세포 기반 치료법에만 국한되지 않습니다. 소동물 모델에서의 망막 이식 절차도 기술되어 있다20,21. 망막 전기 자극 분야에서, 쥐의 망막하 임플란트를 위한 이 수술 절차는 10년 이상 사용되어 왔다22. 보다 최근에는 Ho 등[23]이 쥐의 망막을 자극하기 위해 어레이를 이식했고, Thomas 등[24]은 망막 오가노이드를 줄기세포의 공급원으로 사용했습니다. 앞서 언급한 바와 같이, 줄기세포 기반 치료법은 줄기세포가 파종된 생체적합성 임플란트의 외과적 이식에 관한 논문을 포함하여 잘 발표되어 왔다4. 다른 저자가 설명한 수술 방법에는 약간의 차이가 있으며, 이는 이 원고에 설명된 수술 기술과 논의되고 비교될 것입니다.
공막 봉합 및 수술 기구에 대해서는 추가적인 논의가 필요합니다. 공막 절개를 관리하는 데는 두 가지 일반적인 방법이 있습니다: (1) 봉합사를 이용한 봉합과 (2) 봉합사 없이 봉합하는 것입니다. 몇몇 저자는 일반 절차의 일환으로 10-0 나일론을 사용하여 공막 절개 부위를 봉합사로 봉합합니다 23,25,26,27. 그러나 다른 그룹(우리 그룹 포함)은 10-0 나일론 봉합사가 필요하지 않다는 것을 발견했습니다28. 봉합사로 봉합하는 것을 지지하는 사람들은 봉합사가 없으면 망막하 임플란트가 눈의 절개 부위에서 미끄러져 나올 것이라고 주장합니다. 결과 섹션에서 설명한 바와 같이, 본 연구에서는 절개 부위 전체에 걸쳐 임플란트 또는 안구 내 조직의 돌출을 발견하지 못했습니다. 봉합사를 사용하지 않는 이 수술 방법은 우리 실험실에서 일상적이고 성공적으로 사용되었습니다 9,10,12,13,16. 무봉합사 접근법의 정당성은 두 가지 요인에 의존합니다: 첫째, 절개 위치와 그 구성의 조합은 자체 밀봉 절개를 생성하기에 충분한 구조를 제공합니다. 공막 터널의 적절한 구성은 연구자가 연습을 통해 달성할 수 있는 단계라는 점을 명심해야 합니다. 둘째, 견인이 해제되면 안압이 증가하여 임플란트가 제자리에 유지됩니다. 안압이 증가하면 망막이 절개 부위에 밀려 양쪽 공막 피판이 서로 가까워지고 자체 밀봉 절개가 이루어집니다. 따라서 봉합사가 필요하지 않습니다. 참고로, 절개 길이는 최대 1.5mm에 불과합니다. 외과적 절개 시 더 큰 상처가 필요하거나 적절한 공막 터널 구성이 이루어지지 않은 경우 10-0 나일론 봉합사가 합리적인 해결책입니다. 현재 기술은 권장되는 수술 기구와 함께 사용할 경우 매우 신뢰할 수 있습니다. 일부 저자는 임플란트에 맞춤형 주사기를 사용했는데, 이는 절개 크기를 수정하고 적절한 봉합을 위해 공막 봉합사를 사용해야 하는 결과를 낳았습니다25,29. 그러나 경험에 따르면 다른 재료와 주사기를 사용하면 절개 길이(~0.5mm)가 증가했습니다18,19. 우리는 여전히 더 큰 공막 절개와 관련된 불안정성이나 합병증을 관찰하지 못했으며, 봉합사가 필요하지 않았다. 그러나 절차 중에 이러한 지침을 벗어나는 계측을 사용하는 것은 이 기술의 제한 사항으로 간주될 수 있습니다.
이전 간행물에서 거의 언급되지 않은 또 다른 중요한 단계는 초점 RD를 생성하고 임플란트를 망막하 공간에 주입하기 전에 안압(IOP)을 낮추기 위한 천자입니다 4,10,13,15. 안압을 낮추면 망막을 분리하는 동안 안구 내 구조를 더 잘 제어할 수 있으며 시술이 실패하는 결과를 초래하는 안구 내 내용물의 압출을 방지할 수 있습니다. 긴장성 안구와 관련된 또 다른 장점은 공막 절개를 통해 임플란트를 주입하는 동안 저항이 감소하여 임플란트 자체의 손상이 적다는 것입니다. 반면에, 낮은 안압은 외과적 절개 부위에서 안구 출혈이 증가하기 쉽습니다. 공막 절개 부위에 많은 양의 혈액이 있으면 시야가 가려지고 망막하 이식 중에 혈액이 망막하 공간으로 이동할 위험이 높아집니다. 코튼 스왑과 BSS를 사용하여 출혈을 조절하여 해당 부위를 청소하고 수술 합병증을 피하는 것이 좋습니다.
RD의 크기는 망막하 공간에 임플란트를 적절하게 배치하는 데 중요하다는 점을 언급할 가치가 있습니다. 다른 동물 모델 및 인간과 달리5,14,30, 이 공막 접근법은 망막하 공간의 직접적인 시각화를 제공하지 않기 때문에 초점 RD를 생성하는 것이 더 어렵습니다. 임플란트가 이 영역 밖에 배치되지 않고 망막하 공간에 부드럽게 배치될 수 있는 충분한 공간을 제공하려면 100μL의 BSS를 주입하는 것이 좋습니다. 이 권장 사항은 망막의 하나 이상의 사분면에 대한 RD 생성을 기반으로 합니다. 망막의 적어도 한 사분면보다 작은 RD가 생성되면 임플란트가 유리체강내, 망막내 또는 극상부 공간에 잘못 주입됩니다. 프로토콜 전체에서 설명한 바와 같이, 작은 RD가 관찰되는 경우 원하는 RD가 달성될 때까지 2.2.4 - 2.2.8 단계를 반복하는 것이 좋습니다.
원고에서 논의된 대부분의 수술 합병증과 중요한 단계는 학습 곡선 중에 발생할 수 있으며, 이는 망막하 이식의 성공을 저해할 수 있습니다. 이 학습 곡선에는 동물이 마취 상태를 유지하는 시간과 탈수 수준도 포함됩니다. 마취 시간이 길어지고, 마취제를 투여하고, 탈수가 발생하면 각막, 수정체, 공막 변화와 같은 안구 건조 합병증이 발생할 수 있다31. 또한, 케타민(ketamine) 및 자일라진(xylazine)과 같은 마취제는 수액 조성의 변화와 함께 각막 및 수정체의 매체 불투명도와 관련이 있다32. 마취 기간 내내 수술 눈에 윤활제 점안액(BSS)을 사용하면 이러한 합병증을 해결할 수 있습니다. 요약하면, 이 원고에 기술된 방법론은 쥐의 눈에서 망막하 치료제를 개발하기 위한 외과적 권고안으로 사용되기 위한 것입니다.
공개
M.S.H., D.R.H. 및 J.L.은 재생 패치 기술(RPT)의 공동 창립자이자 컨설턴트입니다. 다른 저자는 이 원고에서 논의된 주제 또는 자료에 대해 재정적 또는 비재무적 이해관계를 가진 조직 또는 단체와 제휴 관계가 없거나 관여하지 않았음을 증명합니다.
감사의 말
이 연구는 CIRM DT3(MSH) 및 실명 예방 연구(USC Roski Eye Institute)의 지원을 받았습니다. 기술 지원에 대해 Fernando Gallardo와 Dr. Ying Liu에게 감사드립니다.
의뢰자는 이 연구의 설계나 수행에 아무런 역할도 하지 않았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | VWR | BD309659 | |
| 27 G needle 1/2'' | VWR | BD305109 | |
| 30 G needle 1/2'' | VWR | BD305106 | |
| 32 G Blunt needle - Small hub RN | Hamilton | 7803-04 | |
| 4-0 Perma Hand silk black 1X18" PC-5 | Ethicon | 1984G | |
| 6'' sterile cotton tips | VWR | 10805-154 | |
| Betadine 5% sterile ophthalmic prep solution | Alcon | 8007-1 | |
| BSS irrigating solution 15 mL | Accutome | Ax17362 | |
| Buprenorphine ER | ZooPharm | N/A | |
| Castroviejo Caliper | Storz | E2405 | |
| Castroviejo suturing forceps 0.12 mm | Storz | E1796 | |
| Clayman-Vannas scissors straight | Storz | E3383S | |
| Cover glass, square | WVR | 48366-227 | |
| EPS Polystyrene block | Silverlake LLC | CFB8x12x2 | |
| Gonak 15 mL | Accutome | Ax10968 | Eye lubricant |
| Halstead straight hemostatic mosquito forceps non-magnetic | Storz | E6772 | |
| Hamilton syringe 700 series 100 µL | Hamilton | 7638-01 | |
| HEYEX Software | Heidelberg | N/A | an image management software |
| Kelman-McPherson tying forceps angled | Storz | E1815 AKUS | |
| Ketamine (100 mg/mL) | MWI | 501072 | |
| Needle holder 9mm curved fine locking | Storz | 3-302 | |
| Neomycin/Polymyxin B sulfactes/Bacitracin zinc ointment 3.5 g | Accutome | Ax0720 | |
| Ophthalmic surgical microscope | Zeiss | SN: 233922 | |
| Phenylephrine 2.5% 15 mL | Accutome | Ax0310 | |
| Spectralis SD-OCT | Heidelberg | SPEC-CAM-011210s3600 | |
| Sterile Drape | VWR | 100229-300 | |
| Sterile surgical gloves | VWR | 89233-804 | |
| T-Pump heating system | Gaymar | TP650 | |
| Tropicamide 1% 15 mL | Accutome | Ax0330 | |
| Ultrathin membranes made from Parylene C and coated with vitronectin | Mini Pumps LLC, CA | specifically designed for this study | used as subretinal implants |
| Xylazine (100 mg/mL) | MWI | 510650 |
참고문헌
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Global Health. 2 (2), 106-116 (2014).
- Schultz, N. M., Bhardwaj, S., Barclay, C., Gaspar, L., Schwartz, J. Global burden of dry age-related macular degeneration: a targeted literature review. Clinical Therapeutics. 43 (10), 1792-1818 (2021).
- Deng, Y., et al. Age-related macular degeneration: Epidemiology, genetics, pathophysiology, diagnosis, and targeted therapy. Genes & Diseases. 9 (1), 62-79 (2021).
- Nazari, H., et al. Stem cell-based therapies for age-related macular degeneration: The promises and the challenges. Progress in Retinal and Eye Research. 48, 1-39 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- Kashani, A. H., et al. Survival of an HLA-mismatched, bioengineered RPE implant in dry age-related macular degeneration. Stem Cell Reports. 17 (3), 448-458 (2022).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Da Cruz, L., Chen, F. K., Ahmado, A., Greenwood, J., Coffey, P. RPE transplantation and its role in retinal disease. Progress in Retinal and Eye Research. 26 (6), 598-635 (2017).
- Hu, Y., et al. A novel approach for subretinal implantation of ultrathin substrates containing stem cell-derived retinal pigment epithelium monolayer. Ophthalmic Research. 48 (4), 186-191 (2012).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: improved survival when implanted as a monolayer. Investigative Ophthalmology & Visual Science. 54 (7), 5087-5096 (2013).
- Antognazza, M. R., et al. Characterization of a polymer-based, fully organic prosthesis for implantation into the subretinal space of the rat. Advanced Healthcare Materials. 5 (17), 2271-2282 (2016).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286 (2021).
- Thomas, B. B., et al. A new immunodeficient retinal dystrophic rat model for transplantation studies using human-derived cells. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (11), 2113-2125 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatán minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology. 254 (8), 1553-1565 (2016).
- Yu, W., et al. Biocompatibility of subretinal parylene-based Ti/Pt microelectrode array in rabbit for further artificial vision studies. Journal of Ocular Biology, Diseases, and Informatics. 2 (1), 33-36 (2009).
- Thomas, B. B., et al. Survival and functionality of hESC-derived retinal pigment epithelium cells cultured as a monolayer on polymer substrates transplanted in RCS rats. Investigative Ophthalmology & Visual Science. 57 (6), 2877-2887 (2016).
- Adekunle, A. N., et al. Integration of perforated subretinal prostheses with retinal tissue. Translational Vision Science & Technology. 4 (4), 5 (2015).
- Lu, B., et al. Semipermeable parylene membrane as an artificial Bruch's membrane. 2011 16th International Solid-State Sensors, Actuators and Microsystems Conference. IEEE. , 950-953 (2011).
- Hu, Y., et al. Subretinal implantation of gelatin films with stem cells derived RPE in rats. Investigative Ophthalmology & Visual Science. 54 (15), 1763 (2013).
- Aramant, R. B., Seiler, M. J. Retinal transplantation-advantages of intact fetal sheets. Progress in Retinal and Eye Research. 21 (1), 57-73 (2002).
- Peng, Q., et al. Structure and function of embryonic rat retinal sheet transplants. Current Eye Research. 32 (9), 781-789 (2007).
- Pardue, M. T., et al. Neuroprotective effect of subretinal implants in the RCS rat. Investigative Ophthalmology & Visual Science. 46 (2), 674-682 (2005).
- Ho, E., et al. Characteristics of prosthetic vision in rats with subretinal flat and pillar electrode arrays. Journal of Neural Engineering. 16 (6), 066027 (2019).
- Thomas, B. B., et al. Co-grafts of human embryonic stem cell derived retina organoids and retinal pigment epithelium for retinal reconstruction in immunodeficient retinal degenerate Royal College of Surgeons rats. Frontiers in Neuroscience. 15, 752958 (2021).
- Seiler, M. J., et al. Vision recovery and connectivity by fetal retinal sheet transplantation in an immunodeficient retinal degenerate rat model. Investigative Ophthalmology & Visual Science. 58 (1), 614-630 (2017).
- McLelland, B. T., et al. Transplanted hESC-derived retina organoid sheets differentiate, integrate, and improve visual function in retinal degenerate rats. Investigative Ophthalmology & Visual Science. 59 (6), 2586-2603 (2018).
- Lin, B., McLelland, B. T., Mathur, A., Aramant, R. B., Seiler, M. J. Sheets of human retinal progenitor transplants improve vision in rats with severe retinal degeneration. Experimental Eye Research. 174, 13-28 (2018).
- Matsuo, T., Hosoya, O., Tsutsui, K. M., Uchida, T. Behavior tests and immunohistochemical retinal response analyses in RCS rats with subretinal implantation of Okayama-University-type retinal prosthesis. Journal of Artificial Organs. 16 (3), 343-351 (2013).
- Seiler, M. J., et al. A new immunodeficient pigmented retinal degenerate rat strain to study transplantation of human cells without immunosuppression. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (7), 1079-1092 (2014).
- Stanzel, B. V. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Fabian, R. J., Bond, J. M., Drobeck, H. P. Induced corneal opacities in the rat. The British Journal of Ophthalmology. 51 (2), 124-129 (1976).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Experimental Eye Research. 42 (4), 331-337 (1986).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유
당사 웹 사이트에서는 사용자의 경험을 향상시키기 위해 쿠키를 사용합니다.
당사 웹 사이트를 계속 사용하거나 '계속'을 클릭하는 것은 당사 쿠키 수락에 동의하는 것을 의미합니다.