Method Article
大鼠视网膜下植入物手术技术的开发
摘要
本方案描述了视网膜下装置植入的巩膜入路,这是一种在研究中视网膜疾病动物模型中实施的可行手术技术。
摘要
视网膜变性,如年龄相关性黄斑变性 (AMD),是全球失明的主要原因。已经采取了无数方法来开发基于再生医学的 AMD 疗法,包括基于干细胞的疗法。啮齿动物作为视网膜变性的动物模型是转化研究的基础,因为在不同阶段发展视网膜变性疾病的菌株范围很广。然而,由于晶状体尺寸和玻璃体体积等解剖学差异,模拟啮齿动物视网膜下植入物的人类治疗递送具有挑战性。该手术方案旨在提供一种将植入物移植到大鼠视网膜下间隙的指导方法。包括对关键步骤的用户友好型全面描述。该方案已被开发为一种具有成本效益的外科手术,可在大鼠的不同临床前研究中具有可重复性。在进行手术实验之前,需要对人类大小的植入物进行适当的小型化,其中包括调整植入物的尺寸。使用外部方法代替玻璃体内手术将植入物输送到视网膜下间隙。使用一根小而锋利的针头,在颞上象限进行巩膜切口,然后进行穿刺术以降低眼压,从而最大限度地减少手术植入过程中的阻力。接下来,通过切口进行平衡盐溶液 (BSS) 注射以实现局灶性视网膜脱离 (RD)。最后,将植入物插入视网膜下间隙并进行可视化。植入物视网膜下放置的术后评估包括通过光谱域光学相干断层扫描 (SD-OCT) 进行成像。影像学随访确定植入物的视网膜下稳定性,然后采集和固定眼睛进行组织学分析。
引言
年龄相关性黄斑变性 (AMD) 是全球失明的主要原因。据估计,2020 年受 AMD 影响的人数为 1.96 亿,预计到 2040 年将增加到约 2.88 亿1。在过去的十年中,已经开发了几种治疗方法来减轻与 AMD 晚期相关的视觉变化,主要用于治疗在湿性 AMD 中观察到的脉络膜新生血管形成的发展和进展。相反,干性 AMD 的治疗,即视网膜色素上皮 (RPE) 细胞功能障碍和丢失进展为 RPE 和视网膜萎缩,估计占 AMD 的 85%-90%,全球患病率为 0.44% 1,2。AMD 被描述为一种多因素疾病,年龄、遗传和环境因素导致疾病的发生和进展;几种疗法正在开发中,以解决与这种疾病相关的不同病理生理途径3。
基于干细胞的疗法已被开发为一种新的治疗选择,以替代干性 AMD4 中失败的 RPE。尽管多能干细胞的使用仍处于早期临床试验中,但已在多项临床试验中证明了安全性 5,6,7。迄今为止,将干细胞部署到视网膜下空间有两种主要途径:悬浮或插入接种在生物相容性植入物上的单层贴片 8,9,10,11,12。在临床前研究中使用基于干细胞的疗法的新策略需要动物模型,其中基于干细胞的疗法可以被递送到与人类预期的相同的目标部位。与最终人体产品相比,解剖结构的差异可能要求对手术、手术设备和方法进行微小的更改13,14。修改眼部手术技术是所需的更改之一,已被广泛描述为用于不同动物模型的成功方法 15,16,17。
尽管以前的出版物提到了大鼠视网膜下植入物的手术技术,但没有对此类技术进行全面描述,以克服研究人员可能遇到的技术困难。因此,需要正确详细地描述手术技术,提供需要避免的最佳实践和经验教训,并在需要时解决整个手术过程中关键步骤中的问题。本手稿的目的是为大鼠将植入物手术植入视网膜下间隙提供全面的指南。
研究方案
所有实验均已获得南加州大学机构动物护理和使用委员会 (IACUC) 的批准,并按照美国国立卫生研究院 (NIH) 实验动物护理和使用指南和视觉与眼科研究协会 (ARVO) 关于动物在眼科和视觉研究中使用的声明进行。本研究共使用了 12 只皇家外科医学院 (RCS) 雄性大鼠。动物在动物设施中饲养,并在出生后 28 岁± 1 天后被纳入研究。进行了全面的眼科检查以验证没有眼部异常。视网膜下植入物是由聚对二甲苯 C 制成并涂有玻连蛋白的超薄膜,由特定的商业组织设计(参见 材料表)。这些膜在厚度和渗透性方面复制了人类大小的膜(6.0 μm 厚的网状框架,超薄区域有 20 μm 的圆形孔)。实现了人类尺寸膜的长度和宽度(1.0 毫米× 0.4 毫米)的小型化,以容纳啮齿动物眼睛内的视网膜下植入物18。
1. 动物护理和手术准备
- 称量动物以计算麻醉剂量并按照步骤 1.2 麻醉。
- 通过腹膜内注射氯胺酮和甲苯噻嗪的混合物(分别为 35-50 mg/kg 和 5-10 mg/kg;见 材料表)麻醉动物。用 1.0 mL 注射器和 30 G 针头注射。
- 在另一个 1.0 mL 注射器中加入一半量的麻醉混合物(氯胺酮和甲苯噻嗪),以在手术过程中保持适当的麻醉水平。
- 通过没有踏板反射(用力捏住脚趾)来确认充分麻醉。
- 为了正确观察玻璃体腔和视网膜,通过在治疗眼中滴注 1% 托吡卡胺和 2.5% 去氧肾上腺素滴眼液(见 材料表)来扩张瞳孔。
- 5 分钟后涂抹第二剂散瞳滴眼液。
- 在麻醉动物以滋润角膜的同时,每 5-10 分钟在非手术眼中涂抹人工泪液或眼部润滑凝胶。
- 在加热垫上放置无菌窗帘(参见 材料表)。放置覆盖手术托盘的无菌窗帘。
- 将以下无菌器械放在手术托盘上,准备无菌手术区域:手术手套、视网膜下植入物和手术工具:蚊子镊子 (3)、显微外科细剪刀 (1)、持针器 (1)、带齿细镊子 (1)、无齿细直镊子 (2)、微升注射器 (1)、32 G 钝针 (1)、27 G 或 30 G 针头 (2), 4-0 丝缝合线 (3)、棉签、平衡盐溶液 (BSS) 和盖玻片(见 材料表)。
- 在无菌条件下,使用无菌手套,将 BSS 装入微升注射器并连接 32 G 钝针。
- 将棉交换插入 27 G 或 30 G 针座,形成一个手柄,以便更灵敏地作针头。
- 为了在整个手术过程中保持无菌条件,如果作非无菌器械或区域,例如手术显微镜,请更换无菌手套。
2. 视网膜下植入术的巩膜入路:手术技术
- 按照以下步骤暴露手术区域。
- 一旦动物处于麻醉状态并且瞳孔放大(步骤 1.5),将动物腹部朝下,头部朝向研究人员。
注意:在整个手术过程中,将大鼠放在加热垫上,并用无菌窗帘覆盖,直到动物完全康复。 - 将 5% 聚维酮滴剂(见 材料表)涂抹在眼睛上,并用棉签清洁眼表和眼睑。
- 将手术显微镜(见 材料表)放在手术眼上并进行调整。
注意:建议在整个手术过程中使用外科眼科显微镜,以获得更清晰、更大的眼部结构可视化。 - 通过使用 4-0 不可吸收缝合线抬起上眼睑并突出眼球,确保手术区域适当暴露。
- 使用 4-0 丝缝合线提升上眼睑。将缝合线放在眼睑前侧的睑板腺水平。通过将蚊子镊子夹在手术表面来固定牵引缝合线。
注意:如果缝合线的位置高于睑板腺的水平,则会发生眼睑外翻而不是眼睑抬高。 - 使用显微外科细剪刀进行颞上象限的腹膜切开术。
- 放置两根牵引缝合线,以允许眼球突出和向前移动。进行上直肌的隔离。
- 通过在角膜缘的上部用细齿镊子(0.12 毫米镊子)轻轻作眼睛,向下滚动眼睛以露出巩膜。
- 将 4-0 丝缝线放在上角膜缘后面,最远 1 毫米,这是上眼外肌的位置。用蚊子镊子夹住缝合线的两尾。
- 进行颞直肌分离术。在颞象限(在颞外肌的相应区域)距离角膜缘最远 1 毫米处放置第二根缝合线(4-0 丝)。用蚊子镊子夹住缝合线的两尾。
- 正确放置和夹紧两根眼外肌缝合线后,向下和向内拉缝合线以露出巩膜的颞上象限。
- 使用 4-0 丝缝合线提升上眼睑。将缝合线放在眼睑前侧的睑板腺水平。通过将蚊子镊子夹在手术表面来固定牵引缝合线。
- 用显微外科细剪刀将腹膜向眼睛后部延伸。
- 使用棉签控制结膜出血。
- 一旦动物处于麻醉状态并且瞳孔放大(步骤 1.5),将动物腹部朝下,头部朝向研究人员。
- 按照以下步骤进行巩膜切口、视网膜脱离 (RD) 和植入物植入。
- 使用 27 G 或 30 G 针头进行巩膜切口。确保切口的大小为 ~1.2 毫米,并且在角膜缘后方 1.5 毫米。
注意:建议开发隧道状巩膜切口配置,以在纵眼睛和引入植入物时稳定眼内结构。这种切口形状将防止眼压的突然波动。 - 有时,正确的配置需要练习。因此,如果未达到适当的配置,请释放眼外肌牵引缝合线的一些张力,以促进将眼部结构保持在玻璃体腔内。
- 使用与巩膜切口相同的针头(27 G 或 30 G),在同一象限的外周角膜中进行穿刺术。
- 将安装在微升注射器上的 32 G 钝针穿过巩膜切口。
- 注入 100 μL BSS 以创建局灶性 RD。
- 松开眼外肌牵引缝合线,使眼睛恢复到正常位置。
- 为了直接观察 RD,请将装有眼用润滑凝胶的盖玻片放在角膜上。
- 调整显微镜物镜以聚焦在视网膜上。
- 如果未观察到 RD 或太小(小于一个象限的大小),请通过向下和向内滚动眼睛并重复步骤 2.2.4 至 2.2.8 来执行第二次 BSS 注射以达到所需的 RD 大小。
- RD 完成后,用卡尺验证巩膜长度(如步骤 2.2.1 中所述)(参见 材料表)。
- 用细显微外科剪刀在两个方向上剪断脉络膜组织。
- 将钝针沿巩膜切口侧向延伸,以验证所有巩膜和脉络膜结构都已被解剖。
- 将植入物插入视网膜下间隙。
- 使用两个精细的手术钳,例如打结镊子(见 材料表),从后面抓住植入物,以免损坏植入物的活动部分。
- 将植入物平行于切口平面放置,然后轻轻滑入植入物。
- 一旦植入物完全引入视网膜下间隙,将其松开,并通过将其中一把镊子的钳口引入切口 1-1.5 毫米,将植入物进一步推入。
- 如上所述(步骤 2.2.7 和 2.2.8),松开眼外肌牵引缝合线,并使用显微镜和盖玻片验证植入物的位置。
- 使用 27 G 或 30 G 针头进行巩膜切口。确保切口的大小为 ~1.2 毫米,并且在角膜缘后方 1.5 毫米。
- 松开并移除所有缝合线。
注意:手术结束后,执行 SD-OCT(步骤 3)以验证临床发现。SD-OCT 成像会话在手术后立即进行。如果未获得植入物位置的适当可视化,则在手术后 7-10 天再次进行 SD-OCT。
3. SD-OCT 成像
- 单击桌面屏幕上的 Heidelberg Eye Explorer 图标(图像管理软件;请参阅 材料表)。
- 单击屏幕顶部的 New Patient 图标。
- 填写生成动物 ID 所需的所有信息,然后单击 Accept(接受)。
- 选择 OCT 成像系统(HRA + OCT;参见 材料表)作为设备类型。
- 选择运算符,然后按 OK。
- 对于正确的角膜曲率选项,请按 OK(确定 )按钮接受默认的眼睛数据。
- 确保 SD-OCT 采集窗口已启动并准备好进行 SD-OCT。
- 按下摄像机旁边触摸屏显示屏上的黄色 开始 按钮,打开 SD-OCT 摄像机。
- 将动物放在 SD-OCT 头枕顶部的 SD-OCT 动物舞台上。
注意:动物载物台适配包括一块聚苯乙烯泡沫(参见 材料表),以安装在 SD-OCT 头部载物台中,该泡沫足够大,可以将动物放在上面,包括加热垫。 - 调整桌子高度和动物位置,使瞳孔与 SD-OCT 镜头的中心对齐。
注意:眼睛对齐后,屏幕上将出现红外 (IR) 实时图像。 - 按下触摸屏上的 IR + OCT 按钮或显示器右下角的 OCT 按钮开始图像采集。
- SD-OCT 上线后,选择具有最大 ART 帧数 (100) 的单个扫描模式。100 ART 扫描模式是默认模式。
- 使用相机纵杆,将视神经置于 IR 图像的中心。
- 向前推动相机,直到 IR 图像均匀地充满视网膜图像。
注意: 暗角表示相机离眼睛太远或太近。 - 将相机向侧面移动,直到在视网膜的颞侧看到植入物。使用 IR 图像引导移动。
- 要通过 B 扫描使植入物可视化,请同时按下 CTRL + ALT + SHIFT + O 以显示 SD-OCT B 扫描调整窗口。
- 调整“参考臂”(位于窗口底部),直到视网膜/植入物在 SD-OCT 图像中可视化。
注意:SD-OCT 图像必须显示在蓝色参考角内。 - 关闭窗口。
- 通过使用纵杆和相机手柄,向各个方向滑动和旋转相机,直到获得更好、更平坦、更清晰的 SD-OCT 质量图像。
- 拖动 IR 图像上的蓝色箭头,直到它沿着植入物放置。
- 一旦 B 扫描的饱和度和位置达到最佳状态,按下触摸屏下方的黑色 增益控制 按钮即可激活“自动实时跟踪 (ART)”。
- ART 达到 100 帧后,按触摸屏上的 Acquire 。
- 获取所有图像后,单击窗口顶部的 Save Images ,然后单击 Exit 。
- 通过频繁(每 5 分钟)涂抹润滑滴眼液,在整个成像过程中保持角膜湿润。
4. 动物恢复
- 在成像疗程结束时,在角膜上涂抹抗生素软膏以防止眼部感染并滋润角膜。
- 让动物趴在加热垫上,直到完全恢复(~20-30 分钟)并可以走动。
- 在手术结束时给予全身镇痛药(1.0-1.2 mg/kg 丁丙诺啡 SR 皮下注射;见 材料表)。
- 在动物恢复足够的意识之前,不要让它无人看管。
- 在完全康复之前,请勿将动物送回其他动物的陪伴处。
- 完全康复后,将动物放回饲养区,并 随意提供食物和水。
结果
在 RCS 大鼠 (N = 12) 中植入视网膜下植入物证明了大鼠视网膜下分娩手术技术的可行性和可重复性。在这项研究中,右眼是接受治疗的植入物眼 (N = 12)。在手术结束时使用手术显微镜进行的临床评估中,12 只接受治疗的眼睛中有 9 只表现出植入物的视网膜下定位 (75.00%),两只眼睛 (16.67%) 被确定为植入物的视网膜内放置,一只眼睛 (8.33%) 由于手术区域视网膜下出血引起的介质混浊,无法直接观察, 植入物和视网膜结构的视野有限(表 1)。手术后立即进行的 SD-OCT 扫描显示植入物的视网膜下或视网膜内位置(分别为 10 个 [83.33%] 和 1 个 [8.33%])(图 1A)。SD-OCT 无法完全识别植入物在具有上述介质混浊的同一只动物 (n = 1) 中的视网膜下位置(无法直接观察),即使在 10 天的随访后也是如此。图 1B,C 显示了两种不同的动物,植入物正确放置在视网膜下间隙。没有与手术技术相关的其他手术并发症。通过苏木精和伊红 (H&E) 染色,观察到植入物视网膜下位置的验证(图 1D)。
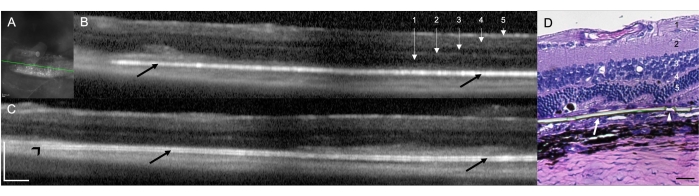
图 1:植入后 1 周的光谱域光学相干断层扫描 (SD-OCT) 扫描。(A) 视网膜下植入物的红外图像。绿线划定了 (B) 中所示的截面。比例尺:200 μm。(B,C) 两种不同的动物,植入物正确放置在视网膜下间隙(黑色箭头)。植入物的尖端指向视神经(黑色箭头)。1 = 视网膜神经纤维/神经节细胞层,2 = 内丛状层,3 = 内外层,4 = 外丛状层,5 = 外核层。比例尺:200 μm。(D) 用 H&E 染色的组织学切片,以显示斜对二甲苯膜的视网膜下植入(白色箭头)。箭头显示了超薄区域中的一个微孔。1 = 视网膜神经纤维/神经节细胞层,2 = 内丛状层,3 = 内外层,4 = 外丛状层,5 = 外核层。比例尺:20 μm。放大倍率:20 倍。请点击此处查看此图的较大版本。
| 临床评估 | SD-OCT | |||||
| 主题 | 锶 | 红外 | 未知 | 锶 | 红外 | 未知 |
| 1 | X | X | ||||
| 2 | X | X | ||||
| 3 | X | X | ||||
| 4 | X | X | ||||
| 5 | X | X | ||||
| 6 | X | X | ||||
| 7 | X | X | ||||
| 8 | X | X | ||||
| 9 | X | X | ||||
| 10 | X | X | ||||
| 11 | X | X | ||||
| 12 | X | X | ||||
| 9 | 2 | 1 | 10 | 1 | 1 | |
| 75.00% | 16.67% | 8.33% | 83.33% | 8.33% | 8.33% | |
表 1:所有动物临床评估和 SD-OCT 成像之间的眼部发现比较。缩写:SR = 视网膜下,IR = 视网膜内,SD-OCT = 光谱域光学相干断层扫描。
讨论
尽管之前对该程序的描述略有不同,但本手稿的范围是全面描述在学习该技术的同时要遵循的大鼠视网膜下植入物的外科手术,并克服研究人员可能遇到的手术挑战和潜在并发症。此处概述的手术方案包括使用超薄聚对二甲苯膜,该膜已在我们的实验室中广泛使用数年 9,10,16,18。然而,已经观察到该技术使用植入视网膜下间隙的不同注射器和材料的可重复性18,19。
视网膜下装置植入的巩膜入路不仅限于基于干细胞的疗法;小动物模型中的视网膜移植手术也有报道20,21。在视网膜电刺激领域,这种用于大鼠视网膜下植入物的外科手术已经使用了十多年22。最近,Ho 等人23 植入了一个阵列来刺激大鼠视网膜,Thomas 等人24 使用视网膜类器官作为干细胞的来源。如前所述,基于干细胞的疗法已经发表了大量文章,包括关于手术植入干细胞种子的生物相容性植入物的出版物4。不同作者描述的手术方法略有不同,将与本手稿中描述的手术技术进行讨论和比较。
巩膜缝合和手术器械需要进一步讨论。有两种常见的方法来处理巩膜切口:(1) 用缝合闭合和 (2) 不用缝合闭合。几位作者使用 10-0 尼龙用缝合线闭合巩膜切口,作为他们常规手术的一部分 23,25,26,27。然而,其他小组(包括我们)发现不需要 10-0 尼龙缝合线 28。那些支持用缝合线闭合的人认为,如果没有缝合,视网膜下植入物会从眼睛的切口中滑出。如结果部分所述,目前的研究没有发现植入物或眼内组织在整个切口中挤压。这种没有缝合的手术方法已在我们的实验室中常规使用并成功 9,10,12,13,16。无缝合方法的合理性取决于两个因素:首先,切口位置及其配置的组合提供了足够的结构来生成自密封切口。应该记住,巩膜隧道的正确配置是研究人员将通过实践实现的一个步骤。其次,一旦牵引力释放,眼压就会增加,从而将植入物保持在原位。眼压升高导致视网膜被推向切口,使两个巩膜瓣彼此靠近并形成自密封切口。因此,不需要缝合。值得注意的是,切口长度只有 1.5 毫米。在手术切口需要更大伤口或未实现适当的巩膜隧道配置的情况下,10-0 尼龙缝合线是合理的解决方案。如果与推荐的手术器械一起使用,目前的技术是高度可靠的。一些作者为他们的植入物使用了定制的注射器,这改变了切口的大小,导致需要使用巩膜缝合线来正确闭合25,29。然而,根据我们的经验,使用不同的材料和注射器会导致切口长度增加 (~0.5 mm)18,19。我们仍然没有观察到与较大巩膜切口相关的不稳定或并发症,并且不需要缝合。然而,在手术过程中使用这些指南之外的器械可被视为该技术的局限性。
在以前的出版物中很少提及的另一个关键步骤是穿刺术,以降低眼压 (IOP),然后再创建局灶性 RD 并将植入物注射到视网膜下空间 4,10,13,15。降低眼压可以更好地控制眼内结构,同时分离视网膜并避免眼内内容物挤压,这会导致手术不成功。与低渗眼相关的另一个优点是通过巩膜切口注射植入物时阻力降低,从而减少对植入物本身的损害。另一方面,低眼压容易导致手术切口处的眼出血增加。巩膜切口处的大量血液会遮挡视线,并增加在视网膜下植入过程中将血液移入视网膜下间隙的风险。我们建议使用棉签和 BSS 来控制出血,以清洁该区域并避免手术并发症。
值得一提的是,RD 的大小对于将植入物正确放置在视网膜下间隙很重要。与其他动物模型和人类 5,14,30 不同,由于这种巩膜入路不提供视网膜下间隙的直接可视化,因此更难产生局灶性 RD。为了提供足够的空间让植入物轻轻地部署到视网膜下空间而不放置在该区域之外,建议注射 100 μLof BSS。该建议基于视网膜至少一个象限的 RD 生成。如果产生的 RD 小于视网膜的至少一个象限,则植入物将被错误地注射到玻璃体内、视网膜内或脉络膜上间隙。如整个方案所述,如果观察到较小的 RD,建议重复步骤 2.2.4 至 2.2.8,直到达到所需的 RD。
手稿中讨论的大多数手术并发症和关键步骤可能发生在学习曲线期间,这可能会影响视网膜下植入的成功。该学习曲线还包括动物在麻醉下保持的时间和脱水程度。较长的麻醉时间、麻醉剂和脱水会导致干眼症并发症,例如角膜、晶状体和巩膜变化31。此外,麻醉剂,如氯胺酮和甲苯噻嗪,与角膜和晶状体中的介质混浊以及房水组成的变化有关32。在整个麻醉时间内在手术眼上使用润滑滴眼液 (BSS) 可以解决这些并发症。总之,本手稿中描述的方法旨在用作开发大鼠眼视网膜下治疗药物的手术建议。
披露声明
M.S.H.、D.R.H. 和 J.L. 是 Regenerative Patch Technologies (RPT) 的联合创始人和顾问。其他作者证明,他们与任何组织或实体没有任何隶属关系或参与,与本手稿中讨论的主题或材料有任何财务或非财务利益。
致谢
这项研究得到了 CIRM DT3 (MSH) 和预防失明研究 (USC Roski Eye Institute) 的支持。我们要感谢 Fernando Gallardo 和 Ying Liu 博士提供的技术帮助。
申办者在这项研究的设计或实施中没有作用。
材料
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | VWR | BD309659 | |
| 27 G needle 1/2'' | VWR | BD305109 | |
| 30 G needle 1/2'' | VWR | BD305106 | |
| 32 G Blunt needle - Small hub RN | Hamilton | 7803-04 | |
| 4-0 Perma Hand silk black 1X18" PC-5 | Ethicon | 1984G | |
| 6'' sterile cotton tips | VWR | 10805-154 | |
| Betadine 5% sterile ophthalmic prep solution | Alcon | 8007-1 | |
| BSS irrigating solution 15 mL | Accutome | Ax17362 | |
| Buprenorphine ER | ZooPharm | N/A | |
| Castroviejo Caliper | Storz | E2405 | |
| Castroviejo suturing forceps 0.12 mm | Storz | E1796 | |
| Clayman-Vannas scissors straight | Storz | E3383S | |
| Cover glass, square | WVR | 48366-227 | |
| EPS Polystyrene block | Silverlake LLC | CFB8x12x2 | |
| Gonak 15 mL | Accutome | Ax10968 | Eye lubricant |
| Halstead straight hemostatic mosquito forceps non-magnetic | Storz | E6772 | |
| Hamilton syringe 700 series 100 µL | Hamilton | 7638-01 | |
| HEYEX Software | Heidelberg | N/A | an image management software |
| Kelman-McPherson tying forceps angled | Storz | E1815 AKUS | |
| Ketamine (100 mg/mL) | MWI | 501072 | |
| Needle holder 9mm curved fine locking | Storz | 3-302 | |
| Neomycin/Polymyxin B sulfactes/Bacitracin zinc ointment 3.5 g | Accutome | Ax0720 | |
| Ophthalmic surgical microscope | Zeiss | SN: 233922 | |
| Phenylephrine 2.5% 15 mL | Accutome | Ax0310 | |
| Spectralis SD-OCT | Heidelberg | SPEC-CAM-011210s3600 | |
| Sterile Drape | VWR | 100229-300 | |
| Sterile surgical gloves | VWR | 89233-804 | |
| T-Pump heating system | Gaymar | TP650 | |
| Tropicamide 1% 15 mL | Accutome | Ax0330 | |
| Ultrathin membranes made from Parylene C and coated with vitronectin | Mini Pumps LLC, CA | specifically designed for this study | used as subretinal implants |
| Xylazine (100 mg/mL) | MWI | 510650 |
参考文献
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Global Health. 2 (2), 106-116 (2014).
- Schultz, N. M., Bhardwaj, S., Barclay, C., Gaspar, L., Schwartz, J. Global burden of dry age-related macular degeneration: a targeted literature review. Clinical Therapeutics. 43 (10), 1792-1818 (2021).
- Deng, Y., et al. Age-related macular degeneration: Epidemiology, genetics, pathophysiology, diagnosis, and targeted therapy. Genes & Diseases. 9 (1), 62-79 (2021).
- Nazari, H., et al. Stem cell-based therapies for age-related macular degeneration: The promises and the challenges. Progress in Retinal and Eye Research. 48, 1-39 (2015).
- Kashani, A. H., et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration. Science Translational Medicine. 10 (435), (2018).
- Kashani, A. H., et al. Survival of an HLA-mismatched, bioengineered RPE implant in dry age-related macular degeneration. Stem Cell Reports. 17 (3), 448-458 (2022).
- da Cruz, L., et al. Phase 1 clinical study of an embryonic stem cell-derived retinal pigment epithelium patch in age-related macular degeneration. Nature Biotechnology. 36 (4), 328-337 (2018).
- Da Cruz, L., Chen, F. K., Ahmado, A., Greenwood, J., Coffey, P. RPE transplantation and its role in retinal disease. Progress in Retinal and Eye Research. 26 (6), 598-635 (2017).
- Hu, Y., et al. A novel approach for subretinal implantation of ultrathin substrates containing stem cell-derived retinal pigment epithelium monolayer. Ophthalmic Research. 48 (4), 186-191 (2012).
- Diniz, B., et al. Subretinal implantation of retinal pigment epithelial cells derived from human embryonic stem cells: improved survival when implanted as a monolayer. Investigative Ophthalmology & Visual Science. 54 (7), 5087-5096 (2013).
- Antognazza, M. R., et al. Characterization of a polymer-based, fully organic prosthesis for implantation into the subretinal space of the rat. Advanced Healthcare Materials. 5 (17), 2271-2282 (2016).
- Pennington, B. O., et al. Xeno-free cryopreservation of adherent retinal pigmented epithelium yields viable and functional cells in vitro and in vivo. Scientific Reports. 11 (1), 6286 (2021).
- Thomas, B. B., et al. A new immunodeficient retinal dystrophic rat model for transplantation studies using human-derived cells. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (11), 2113-2125 (2018).
- Koss, M. J., et al. Subretinal implantation of a monolayer of human embryonic stem cell-derived retinal pigment epithelium: a feasibility and safety study in Yucatán minipigs. Graefe's Archive for Clinical and Experimental Ophthalmology. 254 (8), 1553-1565 (2016).
- Yu, W., et al. Biocompatibility of subretinal parylene-based Ti/Pt microelectrode array in rabbit for further artificial vision studies. Journal of Ocular Biology, Diseases, and Informatics. 2 (1), 33-36 (2009).
- Thomas, B. B., et al. Survival and functionality of hESC-derived retinal pigment epithelium cells cultured as a monolayer on polymer substrates transplanted in RCS rats. Investigative Ophthalmology & Visual Science. 57 (6), 2877-2887 (2016).
- Adekunle, A. N., et al. Integration of perforated subretinal prostheses with retinal tissue. Translational Vision Science & Technology. 4 (4), 5 (2015).
- Lu, B., et al. Semipermeable parylene membrane as an artificial Bruch's membrane. 2011 16th International Solid-State Sensors, Actuators and Microsystems Conference. IEEE. , 950-953 (2011).
- Hu, Y., et al. Subretinal implantation of gelatin films with stem cells derived RPE in rats. Investigative Ophthalmology & Visual Science. 54 (15), 1763 (2013).
- Aramant, R. B., Seiler, M. J. Retinal transplantation-advantages of intact fetal sheets. Progress in Retinal and Eye Research. 21 (1), 57-73 (2002).
- Peng, Q., et al. Structure and function of embryonic rat retinal sheet transplants. Current Eye Research. 32 (9), 781-789 (2007).
- Pardue, M. T., et al. Neuroprotective effect of subretinal implants in the RCS rat. Investigative Ophthalmology & Visual Science. 46 (2), 674-682 (2005).
- Ho, E., et al. Characteristics of prosthetic vision in rats with subretinal flat and pillar electrode arrays. Journal of Neural Engineering. 16 (6), 066027 (2019).
- Thomas, B. B., et al. Co-grafts of human embryonic stem cell derived retina organoids and retinal pigment epithelium for retinal reconstruction in immunodeficient retinal degenerate Royal College of Surgeons rats. Frontiers in Neuroscience. 15, 752958 (2021).
- Seiler, M. J., et al. Vision recovery and connectivity by fetal retinal sheet transplantation in an immunodeficient retinal degenerate rat model. Investigative Ophthalmology & Visual Science. 58 (1), 614-630 (2017).
- McLelland, B. T., et al. Transplanted hESC-derived retina organoid sheets differentiate, integrate, and improve visual function in retinal degenerate rats. Investigative Ophthalmology & Visual Science. 59 (6), 2586-2603 (2018).
- Lin, B., McLelland, B. T., Mathur, A., Aramant, R. B., Seiler, M. J. Sheets of human retinal progenitor transplants improve vision in rats with severe retinal degeneration. Experimental Eye Research. 174, 13-28 (2018).
- Matsuo, T., Hosoya, O., Tsutsui, K. M., Uchida, T. Behavior tests and immunohistochemical retinal response analyses in RCS rats with subretinal implantation of Okayama-University-type retinal prosthesis. Journal of Artificial Organs. 16 (3), 343-351 (2013).
- Seiler, M. J., et al. A new immunodeficient pigmented retinal degenerate rat strain to study transplantation of human cells without immunosuppression. Graefe's Archive for Clinical and Experimental Ophthalmology. 252 (7), 1079-1092 (2014).
- Stanzel, B. V. Subretinal delivery of ultrathin rigid-elastic cell carriers using a metallic shooter instrument and biodegradable hydrogel encapsulation. Investigative Ophthalmology & Visual Science. 53 (1), 490-500 (2012).
- Fabian, R. J., Bond, J. M., Drobeck, H. P. Induced corneal opacities in the rat. The British Journal of Ophthalmology. 51 (2), 124-129 (1976).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Experimental Eye Research. 42 (4), 331-337 (1986).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
我们使用 cookie 来增强您在我们网站上的体验。
继续使用我们的网站或单击“继续”,即表示您同意接受我们的 cookie。