Method Article
Uzun Süreli ve Kısa Süreli Hematopoetik Kök Hücreler için İzolasyon Yöntemi
Bu Makalede
Özet
Hoxb5 muhabir sistemini kullanarak uzun süreli hematopoetik kök hücrelerin (LT-HSC'ler) ve kısa süreli HSC'lerin (ST-HSC'ler) izolasyonu için adım adım bir protokol sunuyoruz.
Özet
Kendini yenileme kapasitesi ve çok soylu farklılaşma potansiyeli genellikle hematopoetik kök hücrelerin (HSC) tanımlayıcı özellikleri olarak kabul edilir. Bununla birlikte, çok sayıda çalışma, HSC kompartmanında fonksiyonel heterojenitenin var olduğunu ileri sürmüştür. Son zamanlarda yapılan tek hücreli analizler, HSC bölmesinde farklı hücre kaderlerine sahip HSC klonlarını bildirmiştir ve bunlar önyargılı HSC klonları olarak adlandırılmaktadır. Heterojen veya kötü tekrarlanabilir sonuçların altında yatan mekanizmalar, özellikle saflaştırılmış HSC fraksiyonları konvansiyonel immün boyama ile nakledildiğinde kendini yenilemenin uzunluğu ile ilgili olarak çok az anlaşılmıştır. Bu nedenle, uzun vadeli HSC'ler (LT-HSC'ler) ve kısa vadeli HSC'ler (ST-HSC'ler) için, kendilerini yenileme süreleri ile tanımlanan tekrarlanabilir bir izolasyon yöntemi oluşturmak, bu sorunun üstesinden gelmek için çok önemlidir. Tarafsız çok adımlı tarama kullanarak, fare hematopoetik sistemindeki LT-HSC'lerin özel bir belirteci olabilecek bir transkripsiyon faktörü olan Hoxb5'i tanımladık. Bu bulguya dayanarak, bir Hoxb5 muhabir fare hattı oluşturduk ve LT-HSC'leri ve ST-HSC'leri başarıyla izole ettik. Burada, Hoxb5 muhabir sistemini kullanarak LT-HSC'lerin ve ST-HSC'lerin izolasyonu için ayrıntılı bir protokol açıklıyoruz. Bu izolasyon yöntemi, araştırmacıların kendini yenileme mekanizmalarını ve HSC bölmesindeki bu heterojenliğin biyolojik temelini daha iyi anlamalarına yardımcı olacaktır.
Giriş
Kendini yenileme kapasitesine ve multipotensine sahip hematopoetik kök hücreler (HSC'ler), hematopoetik hiyerarşi 1,2'nin zirvesinde yer almaktadır. 1988'de Weissman ve meslektaşları ilk kez fare HSC'lerinin izolasyonunun akış sitometrisi3 kullanılarak sağlanabileceğini gösterdi. Daha sonra, hücre yüzey belirteçlerinin bir kombinasyonu ile tanımlanan bir fraksiyonun, Lineage-c-Kit + Sca-1 + CD150 + CD34 − / loFlk2 −, farelerde tüm HSC'leri içerdiği bildirildi 4,5,6,7,8.
İmmünofenotipik olarak tanımlanmış (Lineage-c-Kit+Sca-1+CD150+CD34−/loFlk2−) HSC'ler (bundan böyle pHSC'ler) daha önce fonksiyonel olarak homojen olarak kabul edildi. Bununla birlikte, son zamanlarda yapılan tek hücreli analizler, pHSC'lerin hala kendini yenileme kapasiteleri9,10 ve multipotens11,12 açısından heterojenlik sergilediklerini ortaya koymuştur. Spesifik olarak, pHSC fraksiyonunda kendini yenileme kapasiteleri açısından iki popülasyon var gibi görünmektedir: sürekli kendini yenileme kapasitesine sahip uzun süreli hematopoetik kök hücreler (LT-HSC'ler) ve geçici kendini yenileme kapasitesine sahip kısa süreli hematopoetik kök hücreler (ST-HSC'ler) 9,10.
Bugüne kadar, LT-HSC'leri ve ST-HSC'leri birbirinden ayıran kendini yenileme kapasitesinin moleküler mekanizmaları tam olarak anlaşılamamıştır. Her iki hücre popülasyonunu da kendini yenileme kapasitelerine göre izole etmek ve altta yatan moleküler mekanizmaları keşfetmek çok önemlidir. LT-HSC'leri saflaştırmak için çeşitli muhabir sistemleri de tanıtılmıştır13,14,15; Bununla birlikte, her bir muhabir sistemi tarafından tanımlanan LT-HSC saflığı değişkendir ve bugüne kadar özel LT-HSC saflaştırması sağlanamamıştır.
Bu nedenle, LT-HSC'ler ve ST-HSC'ler için bir izolasyon sistemi geliştirmek, pHSC fraksiyonunda kendini yenileme kapasitesi ile ilgili araştırmaları hızlandıracaktır. LT-HSC'lerin ve ST-HSC'lerin izolasyonunda, çok adımlı, tarafsız tarama kullanan bir çalışma, pHSC fraksiyonu16'da heterojen olarak ifade edilen tek bir gen, Hoxb5'i tanımladı. Ek olarak, Hoxb5 muhabir farelerinin kemik iliği analizi, pHSC fraksiyonunun yaklaşık% 20-25'inin Hoxb5 pos hücrelerinden oluştuğunu ortaya koymuştur. Hoxb5pos pHSC'ler ve Hoxb5neg pHSC'ler kullanılarak yapılan rekabetçi bir transplantasyon testi, sadece Hoxb5 pos pHSC'lerin uzun vadeli kendini yenileme kapasitesine sahip olduğunu, Hoxb5neg pHSC'lerin ise kısa bir süre içinde kendini yenileme kapasitelerini kaybettiğini ortaya koymuştur ve bu da Hoxb5'in pHSC fraksiyonu16'da LT-HSC'leri tanımladığını göstermektedir.
Burada, Hoxb5 muhabir sistemini kullanarak LT-HSC'leri ve ST-HSC'leri izole etmek için adım adım bir protokol gösteriyoruz. Ek olarak, Hoxb5pos/neg pHSC'lerin kendini yenileme kapasitesini değerlendirmek için rekabetçi bir transplantasyon testi sunuyoruz (Şekil 1). Bu Hoxb5 raporlayıcı sistemi, LT-HSC'leri ve ST-HSC'leri ileriye dönük olarak izole etmemizi sağlar ve LT-HSC'ye özgü özelliklerin anlaşılmasına katkıda bulunur.
Protokol
Açıklanan tüm hayvan deneyleri RIKEN Biyosistem Dinamiği Araştırma Merkezi tarafından onaylanmıştır.
1. Alıcı farelerin ön koşullandırması
- 8-10 haftalık erkek C57BL/6 konjenik fareleri alıcı fareler olarak hazırlayın. Alıcı farelerin sayısı deneysel protokole bağlıdır. Genellikle her durum için 10-20 fare hazırlarız.
- Fareleri enrofloksasin (170 mg / L) ile desteklenmiş sterilize edilmiş suyla besleyin. Işınlanmış alıcı fareler enfeksiyona karşı oldukça hassas olduklarından, kafesleri mümkün olduğunca temiz tutun.
NOT: Antibiyotiklerle takviye, ışınlamadan 24 saat önce başlar ve enfeksiyonları önlemek için transplantasyondan sonra 3 hafta boyunca devam eder.
- Fareleri enrofloksasin (170 mg / L) ile desteklenmiş sterilize edilmiş suyla besleyin. Işınlanmış alıcı fareler enfeksiyona karşı oldukça hassas olduklarından, kafesleri mümkün olduğunca temiz tutun.
- Toplam vücut ışınlaması
- Total vücut ışınlaması, donör hücrelerin engraftasyonunu sağlamak için alıcı kemik iliği hücrelerini yok eder. Alıcı fareleri bir ışınlama kafesine aktarın. Transplantasyondan önce alıcı fareleri 12-16 saatte tek bir doz 8.7 Gy ile lethally ışınlayın.
NOT: Radyasyon dozu ve süresi ekipmana bağlı olarak değişebilir. Ölümcül radyasyon dozu, araştırmacının ışınlayıcısı ve fare suşu ile doğrulanmalıdır. - Tüm vücut ışınlamasından sonra onları kafeslerine geri getirin.
- Total vücut ışınlaması, donör hücrelerin engraftasyonunu sağlamak için alıcı kemik iliği hücrelerini yok eder. Alıcı fareleri bir ışınlama kafesine aktarın. Transplantasyondan önce alıcı fareleri 12-16 saatte tek bir doz 8.7 Gy ile lethally ışınlayın.
2. Donör kemik iliği hücrelerinin toplanması
- 12 haftalık bir erkek Hoxb5-tri-mCherry faresi hazırlayın ve fareyi CO2'ye maruz kalmanın ardından servikal çıkık veya yerel hayvan etik komitesi tarafından onaylanan yöntemleri kullanarak ötenazi yapın.
NOT: Fare başına reaktif hacmi aşağıdaki adımlarda açıklanmıştır. - Steril koşullar altında, cildi çıkarın ve kemikleri (femur, tibia, pelvis, humerus) açığa çıkarın. Ana kasları kesin ve kemikleri (femur, tibia, pelvis, humerus) fareden alın. Onları Ca 2+ - ve Mg2 + içermeyen, buz gibi soğuk PBS içeren steril hücre kültürü kaplarına yerleştirin.
- Kirlenmeyi önlemek için cımbız, küçük makas ve mendil kullanarak kasları ve fibröz dokuları kemiklerden kesin. Bu adımda kemikleri kırmamaya dikkat edin. Kısırlığı korumak için kırık kemikleri atın.
- Bir harç ve havaneyi% 70 etanol (EtOH) ile sterilize edin ve tamamen kurumasını bekleyin. Hücre boyama tamponu ile dengeleyin (% 2 ısı ile inaktive FBS, 2 mM EDTA, 100 U / mL penisilin ve 100 μg / mL streptomisin ile desteklenmiş Ca2 + - ve Mg2 + içermeyen PBS).
- Kemikleri harç içine koyun ve 3 mL hücre boyama tamponu ekleyin. Kemikleri havaneyle açık olarak ezin. Hücre kümelerini nazik pipetleme ile ayrıştırın ve hücre süspansiyonunu 100 μm'lik bir hücre süzgecinden 50 mL'lik bir tüpe aktarın.
- Çözüm netleşene kadar adım 2.5'i tekrarlayın. Genellikle üç kez yeterlidir.
3. C-kit + hücrelerinin manyetik sıralama ile ayrılması
- Manyetik ayıklama için antikor boyama
- Numuneleri 400 x g ve 4 °C'de 5 dakika boyunca santrifüj edin. Süpernatanı aspire edin ve peletleri 1 mL hücre boyama tamponunda yeniden askıya alın. Spesifik olmayan antikor bağlanmasını azaltmak için 10 μL sıçan-IgG (5 mg/mL) ekleyin ve bir P1.000 pipet kullanarak hafifçe yukarı ve aşağı pipet uygulayın. 15 dakika boyunca buz üzerinde inkübe edin.
- c-Kit antikorunu (klon 2B8) 4 μg/mL konsantrasyonda ekleyin ve P1.000 pipetle karıştırın. 15 dakika boyunca buz üzerinde inkübe edin.
- 5 mL hücre boyama tamponu ekleyin ve iyice karıştırın. Numuneleri 400 x g, 4 °C, 5 dk'da santrifüj edin. Süpernatanı aspire edin ve peleti 500 μL hücre boyama tamponunda yeniden askıya alın.
- c-Kit+ hücrelerini zenginleştirmek için 35 μL anti-APC mikroboncuk ekleyin ve bir P1.000 pipetle karıştırın. 15 dakika boyunca buz üzerinde inkübe edin.
- 4-5 mL hücre boyama tamponu ekleyin. Numuneleri 400 x g ve 4 °C'de 5 dakika boyunca santrifüj edin. Süpernatanı aspire edin ve peletleri 1 mL hücre boyama tamponunda yeniden askıya alın.
- c-Kit+ hücrelerinin manyetik olarak sıralanması
- Hücreleri sıralamak için üreticinin yönergelerini izleyin. Kısacası, 3 mL hücre boyama tamponuna sahip manyetik bir sıralama sütunu alayın. Numuneyi (1 mL) 40 μm'lik bir hücre süzgecinden geçirin ve numuneyi manyetik sıralama sütununa yükleyin.
- Üç kez 3 mL hücre boyama tamponu ekleyerek yıkayın. Hücre boyama arabelleğini yalnızca sütun haznesi boşken ekleyin.
- Manyetik sıralama sütununu buz gibi soğuk 15 mL'lik bir tüpün üzerine koyun ve 5 mL hücre boyama tamponu ekleyin. Pistonu kolonun içine sıkıca iterek hücreleri yıkayın. Akışı buz üzerinde tutun.
NOT: Kazara numune kaybı durumunda, akışı deneyin sonuna kadar tutarız.
4. Hematopoetik kök hücre boyama
- Adım 3.2.3'te hazırlanan numuneyi 400 x g ve 4 °C'de 5 dakika boyunca santrifüj edin. Süpernatanı aspire et.
- CD34 antikorunu (klon RAM34) peletin üzerine 50 μg / mL konsantrasyonda ekleyin ve 60 dakika boyunca buz üzerinde inkübe edin.
NOT: İşlem süresini kısaltmak için CD34 ile inkübasyonun ilk saatinde destekleyici hücrelerin hazırlanması önerilir. - Antikor ana karışımını Tablo 1'e göre hazırlayın. Numuneye 100 μL ana karışım ekleyin ve buz üzerinde 30 dakika boyunca inkübe edin. CD34 antijeni için antikor (klon; RAM34) yeterli boyama için 90 dakika gerektirir.
- 4-5 mL hücre boyama tamponu ekleyin. Numuneyi 400 x g ve 4 °C'de 5 dakika boyunca santrifüj edin. Süpernatanı aspire et. Peletin üzerine 3 μg/mL konsantrasyonda streptavidin-BUV737 ekleyin ve buz üzerinde 30 dakika inkübe edin.
- 4-5 mL hücre boyama tamponu ekleyin. Numuneyi 400 x g ve 4 °C'de 5 dakika boyunca santrifüj edin. Süpernatanı aspire edin ve peleti 400 μL hücre boyama tamponunda yeniden askıya alın. Numuneyi buz üzerinde tutun.
5. Destekleyici hücre hazırlığı
- 12 haftalık bir CD45.1+ CD45.2+ konjenik fare hazırlayın; İdeal olarak, bu donör fare ile aynı yaşta olmalıdır. Fareyi CO2 maruziyeti, ardından servikal çıkık veya yerel hayvan etik komitesi tarafından onaylanan yöntemleri kullanarak ötenazi yapın.
NOT: Verilen örnekte, CD45.1+ CD45.2+ konjenik fareler B6'yı geçerek şirket içinde yetiştirilmiştir. CD45.1 C57BL/6J fareler ile konjenik fareler16. - Steril koşullar altında, hem femurları hem de tibiaları alın ve bunları Ca 2 + - ve Mg2 + içermeyen, buz gibi soğuk PBS içeren steril hücre kültürü kaplarına yerleştirin. Cımbız ve küçük makas kullanarak kasları ve fibröz dokuları kemiklerden kesin.
- Kemiklerin her iki ucunu keskin, steril makasla kesin. Kemik iliğini hücre süspansiyon tamponlu steril bir hücre kültürü kabına yıkamak için 23 G iğne ve buz gibi soğuk hücre süspansiyon tamponu (% 2 ısı ile inaktive FBS, 100 U / mL penisilin ve 100 μg / mL streptomisin ile desteklenmiş Ca2 + - ve Mg2 + içermeyen PBS) ile doldurulmuş 5 mL'lik bir şırınga kullanın. Hücre kümelerini nazik pipetleme ile ayrıştırın.
- Hücre süspansiyonunu P1.000 pipet kullanarak 40 μm hücre süzgecinden geçirin. Bir hemositometre kullanarak hücre süspansiyonunun hücre sayısını sayın ve 1 x 106 hücre / mL içeren bir kemik iliği hücre süspansiyonu hazırlayın.
- Kemik iliği hücre süspansiyonunun 200 μL'sini (2 x 105 hücre) 96 kuyulu, yuvarlak tabanlı bir plakaya aktarın. Kullanana kadar buz üzerinde tutun.
NOT: Kolay hücre toplanması için yuvarlak tabanlı plakalar önerilir.
6. Hoxb5pos veya Hoxb5neg pHSC sıralama
- Geçit kurulumu
- Adım 4.5'te hazırlanan numunenin 400 μL'sini, 35 μm hücre süzgeci çıtçıtlı kapağı olan yuvarlak tabanlı bir polistiren test tüpüne aktarın. Ölü hücre boyama reaktifi hazırlayın ve üreticinin talimatlarına göre analizden önce numuneye ekleyin.
- Bir akış sitometresi açın ve analiz yazılımını üreticinin talimatlarına göre başlatın. Ardından, Yükle'ye basın ve verileri alın.
NOT: Sıralanan hücrelerin saflığını arttırmak için beş lazer ve 70 μm nozul ile donatılmış bir akış sitometresi önerilir. - Çiftleri, ölü hücreleri ve soy-pozitif hücreleri hariç tuttuktan sonra, Soy-c-Kit + Sca-1 + fraksiyonunu açın. Ardından, Flk2+ fraksiyonunu dışarı çıkarın. Daha sonra, CD150 + CD34 − / düşük fraksiyondaki kapı Hoxb5pos veya Hoxb5neg pHSC'ler (Şekil 2). İlk deneyde spektral örtüşme için telafi gerçekleştirin.
NOT: Hoxb5 pozitif hücrelerin Soy-c-Kit+Sca-1+CD150+CD34−/düşükFlk2− fraksiyonunun %20-%25'ini temsil etmesi beklenir.
- Hoxb5pos veya Hoxb5neg pHSC sıralama
- % 10 ısı ile inaktive FBS ile desteklenmiş 600 μL Ca 2 + - ve Mg2 + içermeyen PBS içeren 1.5 mL düşük proteinli bir bağlama tüpü hazırlayın.
- 1,5 mL düşük proteinli bağlanma tüpünü bir sıralama toplama cihazına yerleştirin ve adım 6.1.3'te belirlenen geçit stratejisini kullanarak Hoxb5pos veya Hoxb5neg pHSC'leri 1,5 mL tüpe sıralayın. İlk sıralamada, sıralama hassasiyeti modundaki verimi kullanın.
- 96 delikli plakayı, otomatik hücre biriktirme birimi (ACDU) aşamasında adım 5.5'te hazırlanan destekleyici hücrelerle ayarlayın. Adım 6.2.2'de hazırlanan 1,5 mL düşük proteinli bağlayıcı tüpü bir akış sitometresinin yükleme portuna ayarlayın.
- Adım 6.1.3'te belirlenen geçit stratejisini kullanarak Hoxb5pos veya Hoxb5neg pHSC'leri, destekleyici hücrelerle birlikte 96 delikli bir plakaya sıralayın. Kendi kendini yenileme kapasitelerini test etmek için 10 Hoxb5pos veya Hoxb5neg pHSC'yi sıralayın.
NOT: Saflığı artırmak için çift sıralama önerilir. İkinci sıralamada, önerilen sıralama hassasiyeti modu olarak saflığı kullanın. - Tipik olarak, 500-1.000 Hoxb5pos pHSC ve 1.500-4.000 Hoxb5neg pHSC, çift sıralamadan sonra hasat edilir. Hücre canlılığını arttırmak için HSC sıralamasından sonra mümkün olan en kısa sürede transplantasyon prosedürlerine devam edin (ideal olarak 1-2 saat içinde).
7. Transplantasyon
- Adım 6.2.4'te hazırlanan HSC sıralı, 96 delikli plakayı buzun üzerine yerleştirin. HSC sıralı, 96 delikli plakayı steril koşullarda, ideal olarak bir hücre davlumbazında tutun.
- Bir alıcı fareyi gaz anestezi indüksiyon odasında% 2 izofluran ile uyuşturun. Hayvan tamamen uyuşturulduktan sonra, çıkarın ve yanına yerleştirin. Yeterli anesteziyi sağlamak için, zararlı bir uyarana yanıt olarak hiçbir hareketi onaylayın.
- Uygun anestezinin onaylanmasından sonra, farenin bilincini yeniden kazanmasını önlemek için mümkün olan en kısa sürede retro-orbital enjeksiyon yapın. Retro-orbital enjeksiyon 30 saniyeden az sürer.
NOT: Enjeksiyon süresi kısa olduğu için gözlere oftalmik merhem sürmeden işlemi bitiriyoruz. Bununla birlikte, prosedür daha uzun sürerse, oftalmik merhem kullanılmasını öneririz. - HSC'de sıralanmış 96 delikli plakadaki hücreleri karıştırmak için nazikçe pipetleyin. Donör hücreleri 30 G insülin şırıngası kullanarak sıralama plakasında toplayın ve bunları alıcı farelerin retro-orbital venöz pleksusuna enjekte edin. Önerilen enjekte edilebilir hacim ≤200 μL'dir.
- Fareler bilinçli olana ve temiz bir kafeste hareket edene kadar gözlemleyin. İyileşmelerini onayladıktan sonra onları kafeslerine geri getirin.
8. Periferik kan analizi
- Kuyruk damarından 50 μL periferik kan toplayın ve 2 mM EDTA ile 100 μL Ca2 + - ve Mg2 + içermeyen PBS ile yeniden askıya alın. Tüm numuneleri 96 delikli bir plakaya aktarın. 400 x g ve 4 °C'de 5 dakika boyunca santrifüj yapın ve süpernatanı atın.
- 200 μL kırmızı kan hücresi lizis tamponu ekleyin ve 3 dakika boyunca buz üzerinde inkübe edin. Numuneleri 400 x g ve 4 °C'de 5 dakika boyunca santrifüj edin ve süpernatanı atın. Bir kez daha tekrarlayın.
- 200 μL hücre boyama tamponu ekleyin. Numuneleri 400 x g ve 4 °C'de 5 dakika boyunca santrifüj edin ve süpernatanı atın.
- Antikor ana karışımını Tablo 2'ye göre hazırlayın. 50 μL antikor ana karışımı ekleyin ve 30 dakika boyunca buz üzerinde inkübe edin.
- 150 μL hücre boyama tamponu ekleyin. Numuneleri 400 x g ve 4 °C'de 5 dakika boyunca santrifüj edin ve süpernatanı atın.
- 200 μL hücre boyama tamponu ekleyin. Numuneleri 400 x g ve 4 °C'de 5 dakika boyunca santrifüj edin ve süpernatanı atın. 200 μL hücre boyama tamponunda tekrar askıya alın ve üreticinin talimatlarına göre analizden önce ölü hücre boyama reaktifi ekleyin.
- Daha önce tarif edildiği gibi bir akış sitometresi kullanarak periferik kan kimerizmini analiz edin16. Çok soylu sulandırmayı takip etmek için transplantasyondan 4 hafta, 8 hafta, 12 hafta ve 16 hafta sonra kan toplayın. Temsili akım sitometri grafikleri Şekil 3'te verilmiştir.
Sonuçlar
Önceden, kendini yenileme kapasitesi, donör HSC'lerin kendilerini yenileme kapasitelerini ancak alıcı periferik kandaki çok soylu donör hücreleri gözlenirse korudukları düşünülen rekabetçi transplantasyon testleri kullanılarak ölçülmüştür17. Ek olarak, birkaç rapor LT-HSC'leri ikinci kemik iliği transplantasyonundan birkaç ay sonra periferik kan hücreleri üretmeye devam eden hücreler olarak tanımlamaktadır10,18. Bu nedenle, kendilerini yenileme yeteneklerini karşılaştırmak için, Hoxb5 muhabir farelerinden izole edilen 10 Hoxb5pos veya Hoxb5 neg pHSC, 2 x 105 tam kemik iliği hücresi ile lethally ışınlanmış birincil alıcı farelere nakledildi. Daha sonra, primer transplantasyondan 16 hafta sonra, primer alıcı farelerden izole edilen 1 x 107 kemik iliği hücresi, uzun süreli kendini yenileme kapasitesini değerlendirmek için lethally ışınlanmış sekonder alıcı farelere nakledildi (Şekil 1). Şekil 2, Hoxb5-tri-mCherry farelerinin kemik iliği analizinin temsili akış sitometri grafiklerini göstermektedir. Lineage-c-Kit+Sca-1+CD150+CD34−/loFlk2− tarafından tanımlanan pHSC fraksiyonundaki hücrelerin yaklaşık %20-%25'i, fare kemik iliğinin sadece %0.001-%0.00125'ini oluşturan Hoxb5pos pHSC'lerdi. Şekil 3, alıcı farelerde periferik kan analizinin temsili akış sitometri grafiklerini göstermektedir. CD45.2 donör fareleri (Hoxb5-tri-mCherry fareleri), CD45.1 / CD45.2 destekleyici hücreler ve CD45.1 alıcı fareler, sırasıyla donör, destekleyici ve alıcı hücreleri ayrı ayrı analiz etmek için hazırlanmıştır.
Şekil 4, donör kimerizmini doğrulamak için transplantasyondan 4 hafta, 8 hafta, 12 hafta ve 16 hafta sonra alıcı farelerde periferik kan analizlerini göstermektedir. Bu analizler, Hoxb5 pos ve Hoxb5neg pHSC'lerin transplantasyondan 4 hafta sonra benzer donör kimerizmi göstermesine rağmen, sadece Hoxb5pos pHSC alıcılarında sürekli hematopoez gözlendiğini ortaya koymuştur (Şekil 4A, B). Hoxb5negatif HSC'ler ise transplantasyondan 8 hafta sonra hematopoetik hücre üretme yeteneğini kaybetmeye başlamıştır (Şekil 4A,B). Sekonder transplantasyon analizinde sadece Hoxb5pos pHSC alıcılarında sağlam hematopoez saptandı (Şekil 5A,B). Buna karşılık, Hoxb5 neg pHSC alıcı farelerde donör hücreler neredeyse hiç gözlenmemiştir, bu da Hoxb5neg pHSC'lerin birincil alıcı farelerde transplantasyondan sonraki 16 hafta içinde kendini yenileme yeteneklerini kaybettiğini düşündürmektedir. Bu veriler, Hoxb5 ifadesinin LT-HSC'ler için belirli bir işaretleyici olarak kullanılabileceğini göstermektedir.

Şekil 1: Uzun süreli hematopoetik sulandırma testleri için deneysel şematik. Alıcı fareler lethally ışınlandı ve 10 HSC ve 2 x 105 tam kemik iliği hücresi (destekleyici hücreler) ile rekabetçi bir şekilde nakledildi. Sekonder nakiller için, birincil alıcı farelerden 1 x 107 tam kemik iliği hücresi transfer edildi. Kısaltmalar: PB = periferik kan; WBM = tüm kemik iliği. Bu rakam Chen ve ark.16'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
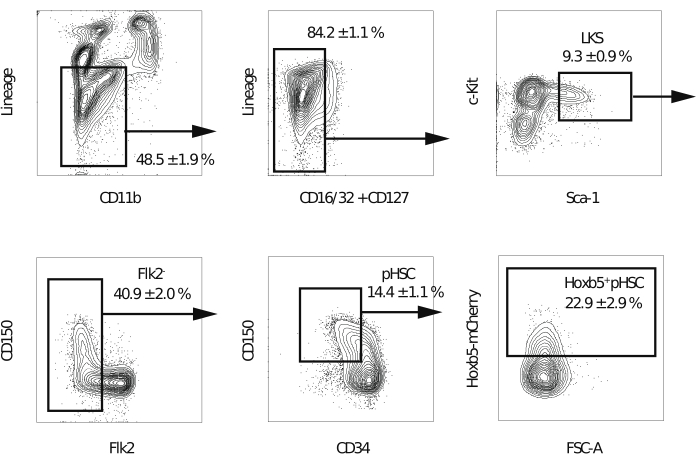
Şekil 2: Hoxb5pos ve Hoxb5neg pHSC'leri sıralamak için geçiş stratejisi. Çiftlerin ve ölü hücrelerin dışlanmasından sonra LKS, Flk2−, pHSC, Hoxb5pos ve Hoxb5neg pHSC'leri izole etmek için temsili akış sitometrisi geçişi. Değerler, s.d. ± her kesirin yüzdesini gösterir (n = 3). Soylar arasında B220, CD3ε, CD4, CD8a, Gr-1 ve Ter-119 bulunur. Bu rakam Chen ve ark.16'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
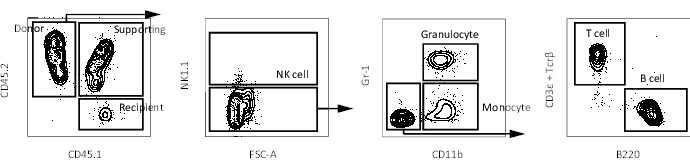
Şekil 3: Bir alıcı faredeki periferik kanın temsili FACS grafikleri. Çiftlerin ve ölü hücrelerin dışlanmasından sonra alıcı bir farede periferik kan hücrelerini (NK hücresi, granülosit, monosit, T hücresi ve B hücresi) tanımlamak için geçit şeması. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 4: Primer transplantasyon sonrası alıcı farelerde kimerizm. (A) 10 Hoxb5neg (n = 9), Hoxb5lo (n = 13) veya Hoxb5hi (n = 18) pHSC alan birincil alıcılarda 4 hafta, 8 hafta, 12 hafta ve 16 haftada yüzde kimerizm. Her sütun ayrı bir fareyi temsil eder. Hoxb5hi fraksiyonu, Hoxb5 ekspresyonunun en üst% 5'i ve diğerleri Hoxb5lo fraksiyonu olarak tanımlandı. (B) 10 hücreli primer nakillerde ortalama donör soy katkısı. Hata çubukları s.d.'yi gösterir. Bu rakam Chen ve ark.16'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 5: Sekonder transplantasyondan sonra alıcı farelerde kimerizm. (A) Tüm kemik iliği sekonder transplantasyonunu takiben 4 hafta, 8 hafta, 12 hafta ve 16 haftada yüzde kimerizm. (B) Tüm kemik iliği sekonder alıcılarında soya göre bireysel donör kimerizmi. Her satır ayrı bir fareyi temsil eder. Bu rakam Chen ve ark.16'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Antikor | Klon | Konsantrasyon | Florokromlar |
| FLK-2 | A2-F10 | 4 μg/mL | PerCP/eFlour710 |
| CD150 | TC15-12F12.2 | 4 μg/mL | BV421 |
| CD11b | M1/70 | 4 μg/mL | BV711 |
| SCA-1 | D7 | 4 μg/mL | BUV395 |
| CD16/32 | 93 | 4 μg/mL | A-700 |
| CD127 | A7R34 | 4 μg/mL | A-700 |
| CD3ε | 145-2C11 | 10 μg/mL | Biotin |
| CD4 | GK1.5 | 10 μg/mL | Biotin |
| CD8a | 53-6.7 | 10 μg/mL | Biotin |
| Gr-1 | RB6-8C5 | 10 μg/mL | Biotin |
| B220 | RA3-6B2 | 10 μg/mL | Biotin |
| Ter119 | TER119 | 10 μg/mL | Biotin |
Tablo 1: Hematopoetik kök hücre boyama için antikor master karışımı.
| Antikor | Klon | Konsantrasyon | Florokromlar |
| CD45.1 | A20 | 1 μg/mL | FITC |
| CD45.2 | 104 | 1 μg/mL | PE |
| Gr-1 | RB6-8C5 | 2,5 μg/mL | A700 |
| NK1.1 | PK136 | 1 μg/mL | PerCP-Siyanin5.5 |
| CD11b | M1/70 | 1 μg/mL | BUV395 |
| CD3ε | 145-2C11 | 1 μg/mL | BV421 |
| TCRβ | H57-597 | 1 μg/mL | BV421 |
| B220 | RA3-6B2 | 1 μg/mL | BV786 |
Tablo 2: Periferik kan hücresi boyama için antikor ana karışımı.
Tartışmalar
Geleneksel olarak, hücre yüzey belirteci tanımlı HSC'ler, HSC'lerin kendini yenileme kapasitesi ve çoklu potens 19,20,21 gibi işlevlerini incelemek için hazırlanmıştır. Bununla birlikte, immünofenotipik olarak tanımlanan (Soy-c-Kit + Sca-1 + CD150 + CD34 − / loFlk2 −) HSC fraksiyonu iki ayrı HSC popülasyonu içerir: LT-HSC'ler ve ST-HSC'ler 9,10. Bu nedenle, iyi niyetli HSC'lerin, LT-HSC'lerin spesifik analizi henüz elde edilmemiştir. Buna göre, Hoxb5 raporlayıcı sistemini kullanan LT-HSC'ler için bir izolasyon yöntemi, kendini yenileme kapasitesinin moleküler mekanizmalarının araştırılmasına önemli ölçüde fayda sağlayacaktır.
Burada, bu protokoldeki kritik adımları tartışacağız. İlk olarak, adım 1'den adım 7'ye kadar olan adımların kesintisiz olarak tamamlanması gerekir. Bu adımlar genellikle 9-12 saat sürer ve numune canlılığını korumak için numuneleri bu prosedürler boyunca mümkün olduğunca 4 ° C'de tutmak önemlidir. Daha sonra, bir fareden yaklaşık 1 x 108 kemik iliği hücresi toplanır. Bu nedenle, boyama performansını yeniden üretmek için yeterli miktarda antikor kullanmamız gerekir. Ek olarak, CD34 antijeni için antikor (klon; RAM34) yeterli boyama için 90 dakika gerektirirken, diğer antikorlar için 30 dakika yeterlidir. İkincisi, ışınlama genellikle alıcı farelerde pansitopeniye neden olur. Alıcı kaynaklı nötrofiller birçok alıcı farede devam ederse, bu radyasyon dozunun yetersiz olduğunu gösterir. Böyle bir durumda, radyasyon dozunun optimizasyonu önerilir. Üçüncüsü, farelerin çoğu transplantasyondan kısa bir süre sonra ölürse, iki olası açıklama vardır: yetersiz sayıda destekleyici hücre veya başarısız retro-orbital enjeksiyon.
On yıllardır, iyi niyetli HSC fraksiyonunun homojen mi yoksa heterojen mi olduğu tartışmalıdır22,23,24. Bu çalışmada, Hoxb5pos pHSC transplantasyonu alan alıcı fareler, bu fraksiyonun heterojen olabileceğini gösteren farklı donör kimeraları ve farklılaşma paternleri sunmuştur (Şekil 4A). Bununla birlikte, bu dalgalanmalara hem saflaştırılmamış kemik iliği hücrelerinin destekleyici hücreler olarak kullanılması hem de bireysel farelerin farklı radyo duyarlılıkları neden olabilir25.
Özetle, Hoxb5 muhabir sistemini kullanarak LT-HSC'lerin ve ST-HSC'lerin izolasyonu için adım adım bir protokol gösterdik. Bugüne kadar, LT-HSC'lerin tespiti, 8 aydan fazla süren rekabetçi transplantasyon testine bağlıydı. Buna karşılık, Hoxb5 raporlayıcı sistemi hem LT-HSC'leri hem de ST-HSC'leri ileriye dönük olarak tanımlamamızı ve bunları çeşitli fonksiyonel analizler için kullanmamızı sağlar. Şekil 4 ve Şekil 5 ayrıca Hoxb5 ekspresyon seviyesinin, ikinci alıcı farelerdeki donör kimerizminin derecesi ile ilişkili olduğunu göstermektedir. Ek olarak, Hoxb5 muhabir sisteminden yararlanarak, LT-HSC'lerin ve ST-HSC'lerin hematopoetik kök hücre nakli sonrası sürekli hematopoetik sulandırma için tamamlayıcı bir şekilde çalıştıklarını daha önce ortaya koymuştuk26. Dahası, eksojen Hoxb5 ekspresyonunun, ST-HSC'lerin hücre kaderini LT-HSC'lerinkine kısmen tersine çevirebileceğini gösterdik, bu da Hoxb5'in varlığının veya yokluğunun, hücre yüzey belirteci tanımlı HSC fraksiyonu27'deki kendini yenileme yeteneğinin heterojenliğini açıkladığını gösterdi.
Bu bulgulara ek olarak, LT-HSC'lerin prospektif izolasyonu, LT-HSC'leri yaşlanma, inflamasyon ve benzeri gibi çeşitli fizyolojik koşullar altında analiz etmemizi sağlar. Bu analizler, LT-HSC'lerin işlevlerinin anlaşılmasını büyük ölçüde kolaylaştıracaktır.
Açıklamalar
Yazarlar bu çalışma ile ilişkili herhangi bir çıkar çatışması olmadığını beyan etmişlerdir.
Teşekkürler
Hiroshi Kiyonari'ye hayvan bakımı ve RIKEN BDR'de alıcı fareler sağladığı için ve ayrıca Kobe Üniversitesi'nde laboratuvar yönetimi için Hitomi Oga, Kayoko Nagasaka ve Masaki Miyahashi'ye minnettarız. Yazarlar ayrıca bu çalışma için devam eden desteği de büyük ölçüde takdir ediyorlar. Masanori Miyanishi, Japonya Bilimi Geliştirme Derneği (JSPS) KAKENHI Hibe Numaraları JP17K07407 ve JP20H03268, Mochida Memorial Tıbbi ve Farmasötik Araştırma Vakfı, Japonya Yaşam Bilimleri Vakfı, Takeda Bilim Vakfı, Astellas Metabolik Bozukluklar Araştırma Vakfı ve AMED-PRIME, AMED tarafından JP18gm6110020 Hibe Numarası altında desteklenmiştir. Taro Sakamaki, JSPS KAKENHI Hibe Numaraları JP21K20669 ve JP22K16334 tarafından desteklenmektedir ve JSPS Çekirdekten Çekirdeğe Programı ve RIKEN Junior Araştırma Önlisans Programı. Katsuyuki Nishi, JSPS Hibe Numarası KAKENHI JP18J13408 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.2 mL Strip of 8 Tubes, Dome Cap | SSIbio | 3230-00 | |
| 0.5M EDTA pH 8.0 | Iinvtrogen | AM9260G | |
| 100 µm Cell Strainer | Falcon | 352360 | |
| 30G insulin syringe | BD | 326668 | |
| 40 µm Cell Strainer | Falcon | 352340 | |
| 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer Snap Cap | FALCON | 352235 | |
| 7-AAD Viability Staining Solution | BioLegend | 420404 | |
| 96 well U-Bottom | FALCON | 351177 | |
| Anti-APC-MicroBeads | Milteny biotec | 130-090-855 | |
| Aspirator with trap flask | Biosan | FTA-1 | |
| B220-Alexa Fluor 700 (RA3-6B2) | BioLegend | 103232 | |
| B220-Biotin (RA3-6B2) | BioLegend | 103204 | |
| B220-BV786 (RA3-6B2) | BD Biosciences | 563894 | |
| B6.CD45.1 congenic mice | Sankyo Labo Service | N/A | |
| Baytril 10% | BAYER | 341106546 | |
| BD FACS Aria II special order system | BD | N/A | |
| Brilliant stain buffer | BD | 566349 | |
| CD11b-Alexa Fluor 700 (M1/70) | BioLegend | 101222 | |
| CD11b-Biotin (M1/70) | BioLegend | 101204 | |
| CD11b-BUV395 (M1/70) | BD Biosciences | 563553 | |
| CD11b-BV711 (M1/70) | BD Biosciences | 563168 | |
| CD127-Alexa Fluor 700 (A7R34) | Invitrogen | 56-1271-82 | |
| CD150-BV421 (TC15-12F12.2) | BioLegend | 115943 | |
| CD16/CD32-Alexa Fluor 700 (93) | Invitrogen | 56-0161-82 | |
| CD34-Alexa Fluor 647 (RAM34) | BD Biosciences | 560230 | |
| CD34-FITC (RAM34) | Invitrogen | 11034185 | |
| CD3-Alexa Fluor 700 (17A2) | BioLegend | 100216 | |
| CD3ε -Biotin (145-2C11) | BioLegend | 100304 | |
| CD3ε -BV421 (145-2C11) | BioLegend | 100341 | |
| CD45.1/CD45.2 congenic mice | N/A | N/A | Bred in our Laboratory |
| CD45.1-FITC (A20) | BD Biosciences | 553775 | |
| CD45.2-PE (104) | BD Biosciences | 560695 | |
| CD4-Alexa Fluor 700 (GK1.5) | BioLegend | 100430 | |
| CD4-Biotin (GK1.5) | BioLegend | 100404 | |
| CD8a-Alexa Fluor 700 (53-6.7) | BioLegend | 100730 | |
| CD8a-Biotin (53-6.7) | BioLegend | 100704 | |
| Centrifuge Tube 15ml | NICHIRYO | 00-ETS-CT-15 | |
| Centrifuge Tube 50ml | NICHIRYO | 00-ETS-CT-50 | |
| c-Kit-APC-eFluor780 (2B8) | Invitrogen | 47117182 | |
| D-PBS (-) without Ca and Mg, liquid | Nacalai | 14249-24 | |
| Fetal Bovine Serum | Thermo Fisher | 10270106 | |
| Flk2-PerCP-eFluor710 (A2F10) | eBioscience | 46135182 | |
| FlowJo version 10 | BD Biosciences | https://www.flowjo.com/solutions/flowjo | |
| Gmmacell 40 Exactor | Best theratronics | N/A | |
| Gr-1-Alexa Fluor 700 (RB6-8C5) | BioLegend | 108422 | |
| Gr-1-Biotin (RB6-8C5) | BioLegend | 108404 | |
| Hoxb5-tri-mCherry mice (C57BL/6J background) | N/A | N/A | Bred in our Laboratory |
| IgG from rat serum, technical grade, >=80% (SDS-PAGE), buffered aqueous solution | Sigma-Aldrich | I8015-100MG | |
| isoflurane | Pfizer | 4987-114-13340-3 | |
| Kimwipes S200 | NIPPON PAPER CRECIA | 6-6689-01 | |
| LS Columns | Milteny biotec | 130-042-401 | |
| Lysis buffer | BD | 555899 | |
| MACS MultiStand | Milteny biotec | 130-042-303 | |
| Microplate for Tissue Culture (For Adhesion Cell) 6Well | IWAKI | 3810-006 | |
| MidiMACS Separator | Milteny biotec | 130-042-302 | |
| Mouse Pie Cages | Natsume Seisakusho | KN-331 | |
| Multipurpose refrigerated Centrifuge | TOMY | EX-125 | |
| NARCOBIT-E (II) | Natsume Seisakusho | KN-1071-I | |
| NK-1.1-PerCP-Cy5.5 (PK136) | BioLegend | 108728 | |
| Penicillin-Streptomycin Mixed Solution | nacalai | 26253-84 | |
| Porcelain Mortar φ120mm with Pestle | Asone | 6-549-03 | |
| Protein LoBind Tube 1.5 mL | Eppendorf | 22431081 | |
| Sca-I-BUV395 (D7) | BD Biosciences | 563990 | |
| Stainless steel scalpel blade | FastGene | FG-B2010 | |
| Streptavidin-BUV737 | BD Biosciences | 612775 | |
| SYTOX-red | Invitrogen | S34859 | |
| Tailveiner Restrainer for Mice standard | Braintree | TV-150 STD | |
| TCRb-BV421 (H57-597) | BioLegend | 109230 | |
| Ter-119-Alexa Fluor 700 (TER-119) | BioLegend | 116220 | |
| Ter-119-Biotin (TER-119) | BioLegend | 116204 | |
| Terumo 5ml Concentric Luer-Slip Syringe | TERUMO | SS-05LZ | |
| Terumo Hypodermic Needle 23G x 1 | TERUMO | NN-2325-R |
Referanslar
- Weissman, I. L., Shizuru, J. A. The origins of the identification and isolation of hematopoietic stem cells, and their capability to induce donor-specific transplantation tolerance and treat autoimmune diseases. Blood. 112 (9), 3543-3553 (2008).
- Majeti, R., Park, C. Y., Weissman, I. L. Identification of a hierarchy of multipotent hematopoietic progenitors in human cord blood. Cell Stem Cell. 1 (6), 635-645 (2007).
- Spangrude, G. J., Heimfeld, S., Weissman, I. L. Purification and characterization of mouse hematopoietic stem cells. Science. 241 (4861), 58-62 (1988).
- Ogawa, M., et al. Expression and function of c-kit in hemopoietic progenitor cells. Journal of Experimental Medicine. 174 (1), 63-71 (1991).
- Ikuta, K., Weissman, I. L. Evidence that hematopoietic stem cells express mouse c-kit but do not depend on steel factor for their generation. Proceedings of the National Academy of Sciences of the United States of America. 89 (4), 1502-1506 (1992).
- Osawa, M., Hanada, K., Hamada, H., Nakauchi, H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 273 (5272), 242-245 (1996).
- Christensen, J. L., Weissman, I. L. Flk-2 is a marker in hematopoietic stem cell differentiation: A simple method to isolate long-term stem cells. Proceedings of the National Academy of Sciences of the United States of America. 98 (25), 14541-14546 (2001).
- Kiel, M. J., et al. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121 (7), 1109-1121 (2005).
- Morrison, S. J., Weissman, I. L. The long-term repopulating subset of hematopoietic stem cells is deterministic and isolatable by phenotype. Immunity. 1 (8), 661-673 (1994).
- Spangrude, G. J., Brooks, D. M., Tumas, D. B. Long-term repopulation of irradiated mice with limiting numbers of purified hematopoietic stem cells: In vivo expansion of stem cell phenotype but not function. Blood. 85 (4), 1006-1016 (1995).
- Dykstra, B., Olthof, S., Schreuder, J., Ritsema, M., de Haan, G. Clonal analysis reveals multiple functional defects of aged murine hematopoietic stem cells. Journal of Experimental Medicine. 208 (13), 2691-2703 (2011).
- Grover, A., et al. Single-cell RNA sequencing reveals molecular and functional platelet bias of aged haematopoietic stem cells. Nature Communications. 7, 11075 (2016).
- Kataoka, K., et al. Evi1 is essential for hematopoietic stem cell self-renewal, and its expression marks hematopoietic cells with long-term multilineage repopulating activity. Journal of Experimental Medicine. 208 (12), 2403-2416 (2011).
- Gazit, R., et al. Fgd5 identifies hematopoietic stem cells in the murine bone marrow. Journal of Experimental Medicine. 211 (7), 1315-1331 (2014).
- Acar, M., et al. Deep imaging of bone marrow shows non-dividing stem cells are mainly perisinusoidal. Nature. 526 (7571), 126-130 (2015).
- Chen, J. Y., et al. Hoxb5 marks long-term haematopoietic stem cells and reveals a homogenous perivascular niche. Nature. 530 (7589), 223-227 (2016).
- Ema, H., et al. Quantification of self-renewal capacity in single hematopoietic stem cells from normal and Lnk-deficient mice. Developmental Cell. 8 (6), 907-914 (2005).
- Morita, Y., Ema, H., Nakauchi, H. Heterogeneity and hierarchy within the most primitive hematopoietic stem cell compartment. Journal of Experimental Medicine. 207 (6), 1173-1182 (2010).
- Yamamoto, R., et al. Clonal analysis unveils self-renewing lineage-restricted progenitors generated directly from hematopoietic stem cells. Cell. 154 (5), 1112-1126 (2013).
- Fathman, J. W., et al. Upregulation of CD11A on hematopoietic stem cells denotes the loss of long-term reconstitution potential. Stem Cell Reports. 3 (5), 707-715 (2014).
- Oguro, H., Ding, L., Morrison, S. J. SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell. 13 (1), 102-116 (2013).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Schroeder, T. Hematopoietic stem cell heterogeneity: Subtypes, not unpredictable behavior. Cell Stem Cell. 6 (3), 203-207 (2010).
- Muller-Sieburg, C. E., Sieburg, H. B., Bernitz, J. M., Cattarossi, G. Stem cell heterogeneity: Implications for aging and regenerative medicine. Blood. 119 (17), 3900-3907 (2012).
- Duran-Struuck, R., Dysko, R. C. Principles of bone marrow transplantation (BMT): Providing optimal veterinary and husbandry care to irradiated mice in BMT studies. Journal of the American Association for Laboratory Animal Science. 48 (1), 11-22 (2009).
- Nishi, K., et al. Identification of the minimum requirements for successful haematopoietic stem cell transplantation. British Journal of Haematology. 196 (3), 711-723 (2022).
- Sakamaki, T., et al. Hoxb5 defines the heterogeneity of self-renewal capacity in the hematopoietic stem cell compartment. Biochemical and Biophysical Research Communications. 539, 34-41 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır